一种截短侧耳素类化合物及其制备方法和应用与流程
本发明属于药物合成领域,具体涉及一种截短侧耳素类化合物及其制备方法和应用。
背景技术
截短侧耳素(pleuromutilin)是由高等真菌产生的一种具有抗菌活性的二萜类化合物。对革兰氏阳性菌和支原体有强抗菌活性,其抗菌机理是通过与细菌核糖体50s亚基的位点结合,抑制肽基转移,阻断核糖体50s亚基的合成。截短侧耳素类化合物具有异于临床常见抗菌药母核结构,与其它结构类抗菌药之间不易产生交叉耐药性,泰妙菌素和沃尼妙林是该类化合物作为动物专用抗菌药开发获得成功的典型事例。截短侧耳素类药物具有独特的结构与抗菌机制,使其能相对较慢的产生耐药性,使截短侧耳素进入了研究人员的视野从而备受关注重。
葛兰素史克(glaxosmithkline)公司开发了瑞他妙林(retapamulin)于2007年在美国和欧洲获批上市。瑞他妙林是截短侧耳素类的第一个人用药。其主要用于局部外用。瑞他妙林对金黄色葡萄球菌、酿脓链球菌、凝固酶葡萄球菌等革兰氏阳性或阴性菌均有较好的抑制作用。主要用于治疗皮肤感染和软组织感染。瑞他妙林对多种耐药菌均具有良好的抗菌活性,可以治疗耐苯唑西林、红霉素、莫匹罗星等药物的细菌感染疾病。与已用抗生素对比,瑞他妙林更不易引起金黄色葡萄球菌的耐药性。
截短侧耳素类衍生物拥有独特的抗菌机制及耐药性产生缓慢等特点,该类化合物可作为新型动物专用抗菌药物研发的主要研究对象。因为截短侧耳素类衍生物普遍有着较差的水溶性,从导致吸收困难,半衰期短,利用率低,难以在临床和兽用生产上投入使用。到目前为止,已通过对截短侧耳素母核结构修饰得到了超过1000余种的衍生物,但有效的、能够成为候选药物或兽用药物仍较少。因此,针对传统制备方法的不足,提供了一种截短侧耳素类化合物的优化制备方法显得十分必要。
技术实现要素:
为了克服现有技术的不足和缺点,本发明的首要目的在于提供一种截短侧耳素类化合物,该化合物具有新颖的结构和较强的抗菌活性。
本发明的另一目的在于提供上述截短侧耳素类化合物的制备方法,该方法是以截短侧耳素为原料,经过8位侧链末端羟基甲磺酰化、亲核取代,再与二氨基苯硫醇侧链的巯基发生反应,最终与邻甲基苯甲酸或邻甲基苯甲酰氯的羰基缩合,合成得到截短侧耳素类化合物。该方法精简合成路线,具有生产周期短,生产成本低,操作简便,产品收率较高、纯度高,合成路线简单等优点。
本发明的再一目的在于提供上述截短侧耳素类化合物的应用。
本发明的第四个目的在于提供一种含有上述截短侧耳素类化合物的药物。
本发明的目的通过下述技术方案来实现:
一种截短侧耳素类化合物,其结构如式ⅰ所示:
所述的截短侧耳素类化合物的制备方法,包含如下步骤:
以截短侧耳素为原料,经过8位侧链末端羟基甲磺酰化、亲核取代,再与二氨基苯硫醇侧链的巯基发生反应,最终与邻甲基苯甲酸或邻甲基苯甲酰氯的羰基缩合,合成得到截短侧耳素类化合物;
所述的截短侧耳素类化合物的制备方法,优选包含如下步骤:
(1)将截短侧耳素溶于有机溶剂,得到截短侧耳素溶液,然后加入对甲苯磺酰氯,得到混合液;冰浴条件下,在混合液中滴加碱溶液至体系ph为12~13,然后20~30℃反应;反应完全后,氯仿分出油相,洗涤、干燥,旋转蒸干,加入异丙醇加热溶解,冷却后抽滤,得到对甲苯磺酰化截短侧耳素;
(2)在保护气氛下,将步骤(1)制得的对甲苯磺酰化截短侧耳素溶于有机溶剂中,加入冷却的碱溶液和二氨基苯硫醇的混合液,20~30℃反应2~4h;
(3)在步骤(2)制得的溶液中加入苄基三乙基氯化铵(tebac)催化剂,75~85℃加热回流反应,反应结束后用溶剂萃取分出油相,经洗涤、干燥、旋转蒸发后,得中间体(i)粗品;将中间体(i)粗品除杂,得到中间体(i);
(4)在有或无保护气氛下,将邻甲基苯甲酸溶于有机溶剂,加入缩合剂、有机碱和催化剂或不加催化剂,20~30℃反应,然后加入步骤(3)中制备的中间体(i),20~30℃反应;或将步骤(3)中制备的中间体(i)溶于有机溶剂,加入有机碱和邻甲基苯甲酰氯,20~30℃反应;反应结束后用溶剂萃取分出油相,经洗涤、干燥、旋转蒸发后,得到截短侧耳素类化合物粗品;将截短侧耳素类化合物粗品除杂,得到截短侧耳素类化合物纯品;
步骤(1)中所述的有机溶剂优选为二氯甲烷、氯仿、乙酸乙酯、四氯化碳和苯中的至少一种;
步骤(1)中所述的对甲苯磺酰氯和截短侧耳素的摩尔比优选为(1~1.3):1;
步骤(1)中所述的碱溶液优选为氢氧化钠溶液、氢氧化钾溶液、氢氧化铯溶液和碳酸钠溶液中的至少一种;
步骤(1)中所述的碱溶液的浓度优选为20~30mol/l;
步骤(1)中所述的反应的时间优选为2~3h;
步骤(2)中所述的保护气氛优选为氮气、氦气、氖气或氩气;
步骤(2)中所述的有机溶剂和对甲苯磺酰氯化截短侧耳素的摩尔比优选为(100~103):1;
步骤(2)中所述的有机溶剂优选为乙酸乙酯、二氯甲烷、乙腈和四氢呋喃中的至少一种;
步骤(2)中所述的碱溶液优选冷却至0℃;
步骤(2)中所述的碱溶液优选为氢氧化钠溶液、氢氧化钾溶液、氢氧化铯溶液和碳酸钠溶液中的至少一种;所述的碱溶液的浓度优选为9~11wt%;
步骤(2)中所述的碱溶液和二氨基苯硫醇的体积比优选为1:(0.021~0.027);
步骤(2)中所述的二氨基苯硫醇和对甲苯磺酰化截短侧耳素的摩尔比优选为(1~1.3):1;
步骤(3)中所述的苄基三乙基氯化铵和对甲苯磺酰化截短侧耳素的摩尔比优选为(0.1~0.2):1;
步骤(3)中所述的加热回流的时间优选为2~3h;
步骤(3)中所述的除杂的具体操作优选为:中间体(i)粗品用二氯甲烷或乙酸乙酯溶解后加入硅胶粉混合,自然干燥后用柱层析提纯;
所述的硅胶粉的目数优选为100~200目;所述的柱层析的流动相为石油醚和乙酸乙酯,其体积比(1~3):1;
步骤(4)中所述的保护气氛为氮气、氦气、氖气或氩气;
步骤(4)中所述的有机溶剂为二氯甲烷或n,n-二甲基甲酰胺中的至少一种;
步骤(4)中所述的缩合剂为1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、1-羟基苯并三唑和2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯中的至少一种;
步骤(4)中所述的有机碱为n,n-二异丙基乙胺或三乙胺;
步骤(4)中所述的催化剂为4-二甲氨基吡啶;
步骤(4)中所述的缩合剂和中间体(i)的摩尔比为(1~2.6):1;所述的有机碱和中间体(i)的摩尔比为(1.5~3):1;所述的催化剂和中间体(i)的摩尔比为(0.1~0.2):1;所述的邻甲基苯甲酸或邻甲基苯甲酰氯和中间体(i)的摩尔比为(1~1.5):1;
步骤(4)中所述的20~30℃反应的时间为5~7h;
步骤(4)中所述的萃取的溶剂优选为乙醚、乙酸乙酯、石油醚、二氯甲烷、三氯甲烷或四氯甲烷;
步骤(4)中所述的洗涤的溶液依次为饱和食盐水和水;
步骤(4)中所述的干燥的干燥剂为无水氯化钙、无水硫酸钠、无水硫酸钙、无水碳酸钾和五氧化二磷中的至少一种;
步骤(4)中所述的除杂的具体操作优选为:将截短侧耳素类化合物粗品用有机溶剂溶解后加入硅胶粉混合,自然干燥后用柱层析提纯;
所述的有机溶剂为甲醇、乙酸乙酯、乙醇、二氯甲烷和三氯甲烷中的至少一种;所述的硅胶粉的粒径为200~300目;所述的柱层析中的流动相为石油醚和乙酸乙酯,其体积比为(1~3):1;
所述的截短侧耳素类化合物在制备治疗人或动物经支原体、耐药金黄色葡萄球菌或多药耐药菌感染引起的感染性疾病的药物中的应用;
所述的药物含有上述截短侧耳素类化合物或其药用盐或溶剂化物中的至少一种;公知的,化合物的溶剂化形式与盐通常并不影响化合物自身的生物学活性;
所述化合物的药用盐优选包括这些化合物的盐酸盐、硫酸盐、磷酸盐、硝酸盐、氢溴酸盐、草酸盐、马来酸盐、柠檬酸盐、乙酸盐、乳酸盐、磺酸盐、对甲苯磺酸盐、甲磺酸盐、酒石酸盐和琥珀酸盐等。
所述的药物可含有一种或多种药学上可接受的载体、赋形剂或稀释剂;
所述的药物的制剂包括多种临床药物剂型,如片剂、注射液、脂质体纳米粒、控释剂等;
一种抗生素药物,含有有效量的上述截短侧耳素类化合物,余量为药用辅料或其它可配伍的药物;
所述药用辅料是指常规的药用赋形剂,如溶剂、崩解剂、矫味剂、防腐剂、着色剂和粘合剂等;
所述其它可配伍的药物,指的是以有效剂量的截短侧耳素类化合物为药物原料,再配伍其它天然药物或化学药品;
本发明相对于现有技术具有如下的优点及效果:
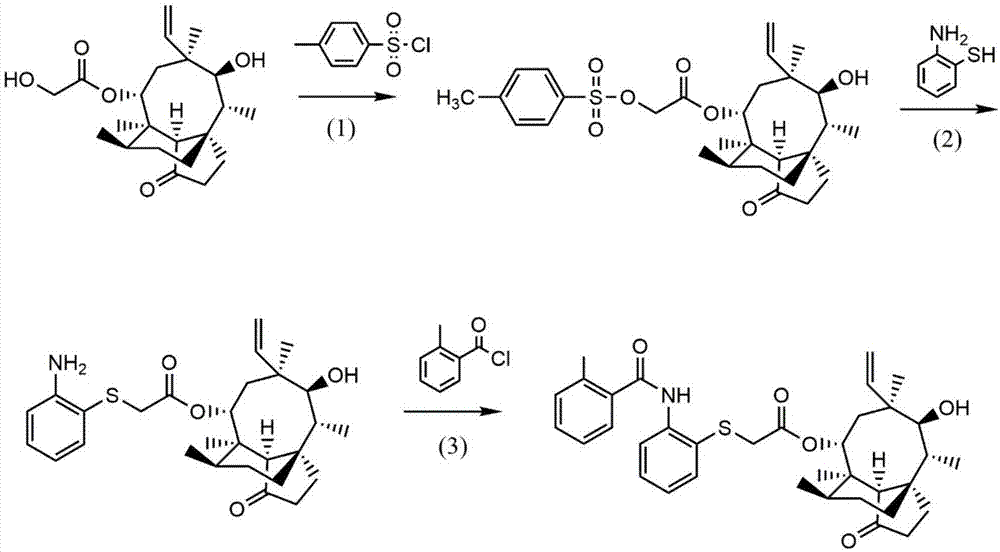
(1)本发明以截短侧耳素为原料,经过8位侧链末端羟基甲磺酰化、亲核取代,再与二氨基苯硫醇侧链的巯基发生反应,最终与邻甲基苯甲酸或邻甲基苯甲酰氯的羰基缩合,合成得到截短侧耳素类化合物(图1、图4)。本发明的合成工艺简洁,所用反应物对设备腐蚀作用小,能够延长设备的使用寿命,减少成本,方法反应条件温和,对设备要求不高;合成路线所涉及的溶剂均能回收利用,整条合成工艺能做到环境友好,低碳环保。
(2)本发明方法制备的截短侧耳素类化合物产率较高,可达到79%以上,比现有的产率(10%~50%)高出30~70%,该截短侧耳素类化合物具有新颖的结构和较强的抗菌活性,经mic检测,其mic值为0.25。
(3)本发明所需原料总体价格便宜,能够降低生产成本,具有很大的经济效益和社会效益,符合绿色生态和可持续发展的要求。
附图说明
图1是截短侧耳素类化合物的合成路线图。
图2是瑞他妙林的结构式示意图。
图3是中间体(i)的结构式示意图
图4是截短侧耳素类化合物的结构式示意图。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
图1为截短侧耳素类化合物的合成路线图,实施例3~10与对比实施例1~9中采用实施例1制备的对甲苯磺酰化截短侧耳素,实施例2制备的中间体(i),实施例3~10与对比实施例1~9主要从溶剂的选择、反应物用量的参考、有机碱碱性强度、催化剂活性的调整从而对实验方法、技术进行优化,下面结合图1和实施例3~10与对比实施例1~9说明其具体的合成过程。
实施例1对甲苯磺酰化截短侧耳素的制备
(1)将截短侧耳素(10g,26.46mmol)溶于20ml乙酸乙酯,得到截短侧耳素溶液,然后加入对甲苯磺酰氯(5.5g,28.94mmol),得到混合液;冰浴条件下,在混合液中滴加浓度为20mol/l的氢氧化钠溶液至体系ph为12.5,然后撤冰浴,25℃条件下,反应3h,反应完全;
(2)将反应液倒入分液漏斗,先加50ml氯仿分层,除去水相,最后用水100ml洗涤有机相2次并用无水硫酸钠干燥;
(3)旋转蒸发干有机相,往残余固体中加入10ml异丙醇并加热溶解,冷却后析出大量白色粉末,减压抽滤,滤出物用异丙醇洗涤,自然挥发至干燥,得对甲苯磺酰化截短侧耳素,产率为91.84%。
实施例2中间体(i)的制备
(1)在氮气保护下,在装有温度计和搅拌器的三口瓶中加入实施例1制得的对甲苯磺酰化截短侧耳素(1g,1.88mmol)和乙酸乙酯(18.3ml,188mmol),常温溶解完全;
(2)向冷却至0℃的10ml10wt%氢氧化钠溶液中加入二氨基苯硫醇(0.31g,2.44mmol),得到碱溶液和二氨基苯硫醇的混合液;然后将混合液滴加至步骤(1)中的反应瓶中,26℃反应3h;最后加入tebac(0.09g,0.376mmol),75℃加热回流反应3h;
(3)反应结束后用二氯甲烷萃取分出油相,依次用氯仿、饱和食盐水、水洗涤有机相,无水硫酸钠干燥后蒸干乙酸乙酯,得到中间体(i)粗品;
(4)将上述中间体(i)粗品用有机溶剂二氯甲烷溶解后加入硅胶粉(100~200目)混合,自然干燥后,用柱层析过柱提纯(石油醚:乙酸乙酯(v:v)=2:1为流动相),得到如图3所示结构的产物中间体(i)的纯品,产率79.68%。
实施例3截短侧耳素类化合物的制备
(1)在装有温度计和搅拌器的三口瓶中加入邻甲基苯甲酸(0.34g,2.47mmol)和二氯甲烷(12.0ml,188mmol),常温溶解完全;
(2)取1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(0.47g,2.47mmol)、1-羟基苯并三唑(0.33g,2.47mmol)、三乙胺(0.86ml,6.19mmol)加入反应瓶,25℃反应5h;取实施例2中制备的中间体(i)(1g,2.06mmol)加入反应瓶,25℃反应5h;
(3)反应结束后用二氯甲烷分出油相,饱和食盐水、水洗涤油相,五氧化二磷干燥后蒸干油相,得截短侧耳素类化合物粗品;
(4)将上述截短侧耳素类化合物粗品用甲醇溶解后加入硅胶粉(200~300目)混合,自然干燥后用柱层析过柱提纯(石油醚:乙酸乙酯(v:v)=2:1为流动相),得到截短侧耳素类化合物纯品,如图4所示结构,产率为10.98%。
实施例4截短侧耳素类化合物的制备
(1)在装有温度计和搅拌器的三口瓶中加入邻甲基苯甲酸(0.34g,2.47mmol)和二氯甲烷(12.0ml,188mmol),常温溶解完全;
(2)取1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(0.47g,2.47mmol)、1-羟基苯并三唑(0.33g,2.47mmol)、n,n-二异丙基乙胺(1.02ml,6.19mmol)加入反应瓶,20℃反应7h;取实施例2中制备的中间体(i)(1g,2.06mmol)加入反应瓶,20℃反应7h;
(3)反应结束后用乙酸乙酯分出油相,饱和食盐水、水洗涤油相,无水碳酸钾干燥后蒸干油相,得到截短侧耳素类化合物粗品;
(4)将上述截短侧耳素类化合物粗品用乙醇溶解后加入硅胶粉(200~300目)混合,自然干燥后用柱层析过柱提纯(石油醚:乙酸乙酯(v:v)=2:1为流动相),得到截短侧耳素类化合物纯品,如图4所示结构,产率为14.85%。
实施例5截短侧耳素类化合物的制备
(1)在装有温度计和搅拌器的三口瓶中加入邻甲基苯甲酸(0.34g,2.47mmol)和n,n-二甲基甲酰胺(12.0ml,155mmol),常温溶解完全;
(2)取1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(0.47g,2.47mmol)、1-羟基苯并三唑(0.33g,2.47mmol)、n,n-二异丙基乙胺(1.02ml,6.19mmol)加入反应瓶,30℃反应7h;取实施例2中制备的中间体(i)(1g,2.06mmol)加入反应瓶,30℃反应7h;
(3)反应结束后用三氯甲烷分出油相,饱和食盐水、水洗涤油相,五氧化二磷干燥后蒸干油相,得到截短侧耳素类化合物粗品。
(4)将上述截短侧耳素类化合物粗品用乙酸乙酯溶解后加入硅胶粉(200~300目)混合,自然干燥后用柱层析过柱提纯(石油醚:乙酸乙酯(v:v)=2:1为流动相),得到截短侧耳素类化合物纯品,如图4所示结构,产率为28.78%。
实施例6截短侧耳素类化合物的制备
(1)在装有温度计和搅拌器的三口瓶中加入邻甲基苯甲酸(0.34g,2.47mmol)和n,n-二甲基甲酰胺(12.0ml,155mmol),常温溶解完全;
(2)取1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(0.47g,2.47mmol)、1-羟基苯并三唑(0.33g,2.47mmol)、n,n-二异丙基乙胺(1.02ml,6.19mmol)、4-二甲氨基吡啶(0.025g,0.2mmol)加入反应瓶,20℃反应5h;取实施例2中制备的中间体(i)(1g,2.06mmol)加入反应瓶,20℃反应5h;
(3)反应结束后用四氯甲烷分出油相,饱和食盐水、水洗涤油相,无水硫酸钠干燥后蒸干油相,得到截短侧耳素类化合物粗品;
(4)将上述截短侧耳素类化合物粗品用二氯甲烷溶解后加入硅胶粉(200~300目)混合,自然干燥后用柱层析过柱提纯(石油醚:乙酸乙酯(v:v)=2:1为流动相),得到截短侧耳素类化合物纯品,如图4所示结构,产率为48.23%。
实施例7截短侧耳素类化合物的制备
(1)在氦气保护下,在装有温度计和搅拌器的三口瓶中加入邻甲基苯甲酸(0.34g,2.47mmol)和n,n-二甲基甲酰胺(12.0ml,155mmol),常温溶解完全。
(2)取1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(0.47g,2.47mmol)、1-羟基苯并三唑(0.33g,2.47mmol)、n,n-二异丙基乙胺(1.02ml,6.19mmol)、4-二甲氨基吡啶(0.025g,0.2mmol)加入反应瓶,25℃反应5.5h;取实施例2中制备的中间体(i)(1g,2.06mmol)加入反应瓶,25℃反应5.5h;
(3)反应结束后用乙酸乙酯分出油相,饱和食盐水、水洗涤油相,无水碳酸钾干燥后蒸干油相,得到截短侧耳素类化合物粗品;
(4)将上述截短侧耳素类化合物粗品用三氯甲烷溶解后加入硅胶粉(200~300目)混合,自然干燥后用柱层析过柱提纯(石油醚:乙酸乙酯(v:v)=1:1为流动相),得到截短侧耳素类化合物纯品,如图4所示结构,产率为57.22%。
实施例8截短侧耳素类化合物的制备
(1)在氩气保护下,在装有温度计和搅拌器的三口瓶中加入邻甲基苯甲酸(0.34g,2.47mmol)和n,n-二甲基甲酰胺(12.0ml,155mmol),常温溶解完全。
(2)取2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.94g,2.47mmol)、n,n-二异丙基乙胺(1.02ml,6.19mmol)、4-二甲氨基吡啶(0.025g,0.2mmol)加入反应瓶,27℃反应6h;取实施例2中制备的中间体(i)(1g,2.06mmol)加入反应瓶,27℃反应6h;
(3)反应结束用乙酸乙酯分出油相,饱和食盐水、水洗涤油相,五氧化二磷干燥后蒸干油相,得到截短侧耳素类化合物粗品;
(4)将上述截短侧耳素类化合物粗品用甲醇溶解后加入硅胶粉(200~300目)混合,自然干燥后用柱层析过柱提纯(石油醚:乙酸乙酯(v:v)=3:1为流动相),得到截短侧耳素类化合物纯品,如图4所示结构,产率为59.37%。
实施例9截短侧耳素类化合物的制备
(1)在氮气保护下,在装有温度计和搅拌器的三口瓶中加入实施例2中制备的中间体(i)(1g,2.06mmol)和n,n-二甲基甲酰胺(12.0ml,155mmol),常温溶解完全;
(2)取n,n-二异丙基乙胺(0.51ml,3.09mmol)、邻甲基苯甲酰氯(0.4ml,3.09mmol)加入反应瓶,28℃反应7h;
(3)反应结束用四氯甲烷分出油相,饱和食盐水、水洗涤油相,无水硫酸钠干燥后蒸干油相,得到截短侧耳素类化合物粗品;
(4)将上述截短侧耳素类化合物粗品用乙醇溶解后加入硅胶粉(200~300目)混合,自然干燥后用柱层析过柱提纯(石油醚:乙酸乙酯(v:v)=2:1为流动相),得到截短侧耳素类化合物纯品,如图4所示结构,产率为79.83%。
实施例10截短侧耳素类化合物的制备
(1)在氮气保护下,在装有温度计和搅拌器的三口瓶中加入实施例2中制备的中间体(i)(1g,2.06mmol)和二氯甲烷(12.0ml,188mmol),常温溶解完全。
(2)取n,n-二异丙基乙胺(0.51ml,3.09mmol)、邻甲基苯甲酰氯(0.4ml,3.09mmol)加入反应瓶,22℃反应6h;
(3)反应结束用三氯甲烷分出油相,饱和食盐水、水洗涤油相,无水硫酸钠干燥后蒸干油相,得截短侧耳素类化合物粗品;
(4)将上述粗产物-硅胶粉混合物用柱层析过柱提纯(200~300目硅胶粉为固定相,石油醚:乙酸乙酯=2:1为流动相),得到截短侧耳素类化合物纯品,如图4所示结构,产率为78.69%。
对比实施例1
(1)在装有温度计和搅拌器的三口瓶中加入邻甲基苯甲酸(0.34g,2.47mmol)和乙腈(10ml,188mmol),常温溶解完全;
(2)取1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(0.47g,2.47mmol)、1-羟基苯并三唑(0.33g,2.47mmol)、三乙胺(0.86ml,6.19mmol)加入反应瓶,25℃反应6h;取实施例2中制备的中间体(i)(1g,2.06mmol)加入反应瓶,25℃反应6h;无截短侧耳素类化合物产物生成。
对比实施例2
(1)在装有温度计和搅拌器的三口瓶中加入邻甲基苯甲酸(0.34g,2.47mmol)和乙腈(10ml,188mmol),常温溶解完全;
(2)取1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(0.47g,2.47mmol)、1-羟基苯并三唑(0.33g,2.47mmol)、n,n-二异丙基乙胺(1.02ml,6.19mmol)加入反应瓶,22℃反应6h;取实施例2中制备的中间体(i)(1g,2.06mmol)加入反应瓶,22℃反应6h;无截短侧耳素类化合物产物生成。
对比实施例3
(1)在装有温度计和搅拌器的三口瓶中加入邻甲基苯甲酸(0.34g,2.47mmol)和二氯甲烷(12ml,188mmol),常温溶解完全;
(2)取2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(0.94g,2.47mmol)、n-甲基吗啉(0.68ml,6.19mmol)加入反应瓶,20℃反应5h;取实施例2中制备的中间体(i)(1g,2.06mmol)加入反应瓶,20℃反应5h;无截短侧耳素类化合物产物生成。
对比实施例4
(1)在装有温度计和搅拌器的三口瓶中加入邻甲基苯甲酸(0.34g,2.47mmol)和二氯甲烷(12ml,188mmol),常温溶解完全。
(2)取o-苯并三氮唑-四甲基脲六氟磷酸酯(0.94g,2.47mmol)、n,n-二异丙基乙胺(1.02ml,6.19mmol)加入反应瓶,30℃反应7h;取实施例2中制备的中间体(i)(1g,2.06mmol)、4-二甲氨基吡啶(0.025g,0.2mmol)加入反应瓶,30℃反应7h;无截短侧耳素类化合物产物生成。
对比实施例5
(1)在装有温度计和搅拌器的三口瓶中加入邻甲基苯甲酸(0.34g,2.47mmol)和四氢呋喃(15.2ml,188mmol),常温溶解完全;
(2)取o-苯并三氮唑-四甲基脲六氟磷酸酯(0.94g,2.47mmol)、n,n-二异丙基乙胺(1.02ml,6.19mmol)、4-二甲氨基吡啶(0.025g,0.2mmol)加入反应瓶,27℃反应5.5h;取实施例2中制备的中间体(i)(1g,2.06mmol)加入反应瓶,27℃反应5.5h;无截短侧耳素类化合物产物生成。
对比实施例6
(1)在氮气保护下,在装有温度计和搅拌器的三口瓶中加入邻甲基苯甲酸(0.34g,2.47mmol)和四氢呋喃(15.2ml,188mmol),常温溶解完全;
(2)取1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(0.47g,2.47mmol)、1-羟基苯并三唑(0.33g,2.47mmol)、n,n-二异丙基乙胺(1.02ml,6.19mmol)、吡啶(0.016ml,0.2mmol)加入反应瓶,28℃反应6.5h;取实施例2中制备的中间体(i)(1g,2.06mmol)加入反应瓶,28℃反应6.5h。无截短侧耳素类化合物产物生成。
对比实施例7
(1)在氦气保护下,在装有温度计和搅拌器的三口瓶中加入邻甲基苯甲酸(0.34g,2.47mmol)和乙酸乙酯(18.3ml,188mmol),常温溶解完全。
(2)取1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(0.47g,2.47mmol)、1-羟基苯并三唑(0.33g,2.47mmol)、n,n-二异丙基乙胺(1.02ml,6.19mmol)、吡啶(0.016ml,0.2mmol)加入反应瓶,21℃反应6h;取实施例2中制备的中间体(i)(1g,2.06mmol)加入反应瓶,21℃反应6h。无截短侧耳素类化合物产物生成。
对比实施例8
(1)在氩气保护下,在装有温度计和搅拌器的三口瓶中加入实施例2中制备的中间体(i)(1g,2.06mmol)和乙腈(10ml,188mmol),常温溶解完全;
(2)取n,n-二异丙基乙胺(0.51ml,3.09mmol)、邻甲基苯甲酰氯(0.4ml,3.09mmol)加入反应瓶,24℃反应7h;
(3)反应结束后用二氯甲烷分出油相,饱和食盐水、水洗涤油相,无水硫酸钙干燥后蒸干油相,得到反应产物粗品。
(4)将上述粗产物-硅胶粉混合物用柱层析过柱提纯(200~300目硅胶粉为固定相,石油醚:乙酸乙酯=1:1为流动相),经高分辨率质谱仪检测得到的产物不为图4所示结构的产物。
对比实施例9
(1)在氮气保护下,在装有温度计和搅拌器的三口瓶中加入实施例2中制备的中间体(i)(1g,2.06mmol)和四氢呋喃(15.2ml,188mmol),常温溶解完全。
(2)取n,n-二异丙基乙胺(0.51ml,3.09mmol)、邻甲基苯甲酰氯(0.4ml,3.09mmol)加入反应瓶,30℃反应5h。
(3)反应结束后用乙酸乙酯分出油相,饱和食盐水、水洗涤油相,无水硫酸钠干燥后蒸干油相,得到反应产物粗品。
(4)将上述粗产物-硅胶粉混合物用柱层析过柱提纯(200~300目硅胶粉为固定相,石油醚:乙酸乙酯=3:1为流动相),经高分辨率质谱仪检测得到的产物不为图4所示结构的产物。
对比实施例1~9主要是针对有机溶剂的选择、有机碱的选择、催化剂活性的调整进行探究。所述有机碱更为优选为n,n-二异丙基乙胺或三乙胺;所述有机溶液更为优选为为乙酸乙酯、二氯甲烷或n,n-二甲基甲酰胺;所述反应温度优选为室温;所述氢氧化钠溶液滴加的方式优选为在冰浴的条件下;所述二氨基苯硫醇和对甲苯磺酰氯化截短侧耳素的摩尔比为1~1.3:1;所述苄基三乙基氯化铵和对甲苯磺酰化截短侧耳素的摩尔比为0.1~0.2:1;所述缩合剂和中间体(i)的摩尔比为1~1.3:1;所述催化剂和中间体(i)的摩尔比为0.1~0.2:1;所述有机碱和中间体(i)的摩尔比为1.5~3:1;所述邻甲基苯甲酸或邻甲基苯甲酰氯和中间体(i)的摩尔比为1~1.3:1。
效果实施例
采用琼脂二倍稀释法测定实施例9制得的截短侧耳素类化合物的最小抑菌浓度(mic),实验对照药物选用沃尼妙林,沃尼妙林为截短侧耳素类抗生素,是该类抗生素中目前应用广泛的兽用抗生素。使用多点接种器将菌液接种在含不同浓度药物的培养皿中,接种菌量为106cfu/ml。37℃孵育24h后观察结果,以不长菌的培养皿中的化合物浓度作为该化合物的最小抑菌浓度(mic)。
实验中所用的菌株为大肠杆菌atcc25922、金黄色葡萄球菌atcc29213和耐甲氧西林金黄色葡萄球菌atcc43300。
精密称取25.6mg所合成的目标化合物,置于10ml的容量瓶中,先用少量n,n-二甲基甲酰胺溶解后,再用n,n-二甲基甲酰胺定容至10ml,配成2560μg/ml的储备液。另分别精密称取25.6mg截短侧耳素、泰妙菌素、沃尼妙林和瑞他妙林(结构式见图2),置于10ml容量瓶中,n,n-二甲基甲酰胺稀释并定容至10ml,配成2560μg/ml的对照储备液。
将储备液以倍比稀释法稀释在培养皿中,每个培养皿含药液1ml,以融化的mh琼脂稀释至20ml,使系列培养皿中受试化合物的终浓度分别为64,32,16,8,4,2,1,0.5,0.25,0.125,0.0625μg/ml。
表1为实施例9制得的截短侧耳素类化合物的体外抑菌数据。其中,e.coli代表大肠杆菌、s.aureus代表金黄色葡萄球菌、mrsa代表耐甲氧西林金黄色葡萄球菌。从表1中可知,经最低抑菌浓度(mic)检测,此截短侧耳素类化合物针对上述三种菌的mic值均为0.25,实验中主要择取金黄色葡萄球菌、耐甲氧西林金黄色葡萄球菌的mic值,从表中可得知,说明此截短侧耳素类化合物有较强的抗菌活性。
表1截短侧耳素类化合物的体外抑菌数据
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!