来源于茶叶的与茶黄素生成相关的过氧化物酶POD1及其应用的制作方法
本发明涉及茶叶加工
技术领域:
,具体涉及一种来源于茶叶的与茶黄素生成相关的过氧化物酶pod1及其应用。
背景技术:
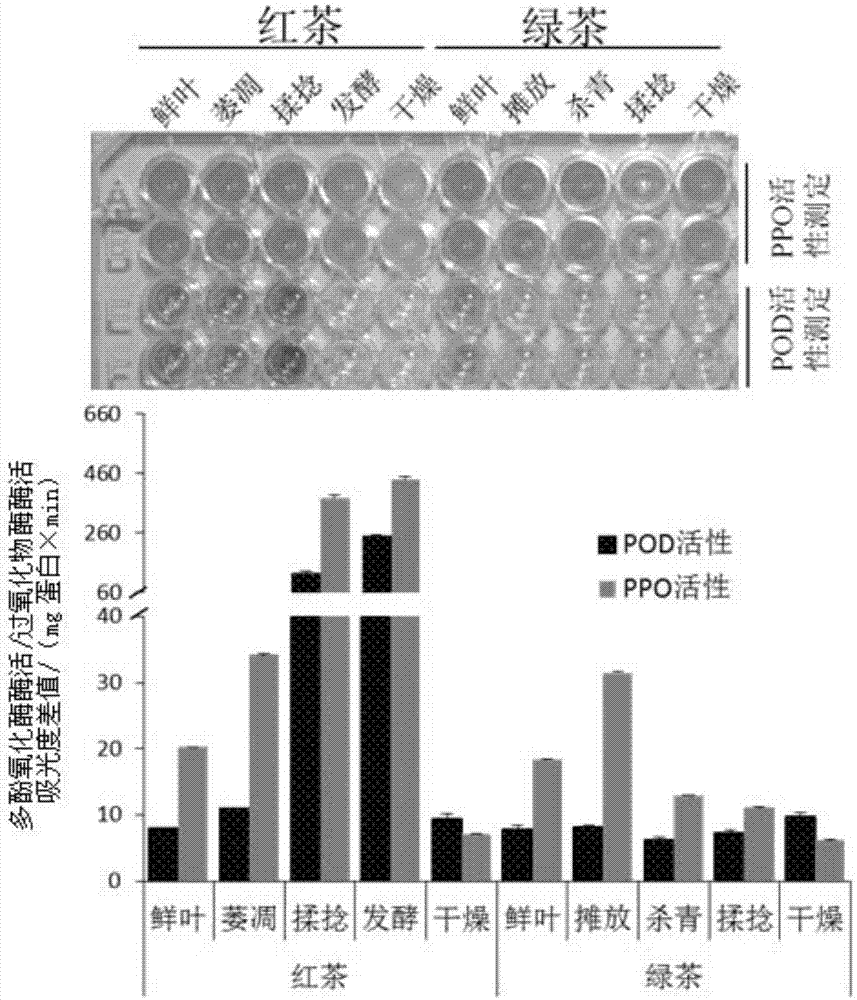
绿茶加工过程中为了确保酯型儿茶素(egc、egcg、ecg及cg)及非酯型儿茶素(ec和c)不被氧化降解,常常采用杀青来灭活茶叶体内的氧化酶(主要为过氧化物酶和多酚氧化酶)。由于人们对茶叶内这些氧化酶的催化活性缺乏足够的了解,而且杀青的温度和时间因不同茶树品种而异,因此绿茶加工自动化和标准化过程受到影响和限制。红茶加工过程中产生茶黄素类化合物,其含量一般占茶叶干重的0.3%-1.5%,4种主要的茶黄素类化合物为:tf、tf2a、tf2b和tf3。茶黄素类化合物是由儿茶素类化合物在茶叶内的氧化酶的作用下以不同组合氧化缩合而来。同样由于人们对茶叶内这些氧化酶的催化活性缺乏足够了解,而利用茶叶自身的氧化酶来进行红茶加工发酵的温度,湿度,和时间等条件也因不同茶树品种而异,生产者大多依据自己的经验来控制红茶加工过程。这使得红茶的加工自动化和产品标准化程度受到极大的限制。茶黄素类化合物具有调节血脂和预防心血管疾病的功效,且无毒副作用,在某些方面甚至优于儿茶素。茶黄素对红茶的汤色和滋味起着重要的作用。因此茶黄素含量的高低决定了红茶的销售价格,也是决定茶叶饮料品质好坏的关键因子之一。以茶黄素为原料的天然药物及功能性食品的研究开发前景广阔。筛选特异的过氧化物酶和多酚氧化酶酶源,利用酶促氧化合成茶黄素类化合物,研究茶黄素类化合物合成机理,具有重要的理论与实际意义。虽然过氧化物酶(pod)和多酚氧化酶(ppo)在红茶加工过程中非常重要,但对其基因和遗传了解缺乏。解析茶叶中主要负责红茶发酵氧化儿茶素而合成茶黄素的蛋白的编码基因可以帮助茶树分子育种,培育低表达过氧化物酶和多酚氧化酶品种便于专门制作绿茶,培育高表达过氧化物酶和多酚氧化酶品种可便于制作红茶,便于控制绿茶或红茶茶叶加工过程中的稳定控制,便于标准化自动化茶叶生产。氧化酶(主要为过氧化物酶和多酚氧化酶)催化氧化儿茶素类化合物生成邻醌类物质,邻醌类物质再进一步聚合生成连苯酚醌类,后者进一步氧化可以生成茶黄素类的单体,单体在经过偶联氧化生成茶黄素类化合物。研究证明茶黄素均是由儿茶素及相关的没食子酸经过氧化聚合形成的二聚体化合物,四种主要茶黄素的形成机制为:(l)-egc+(l)-ec→tf:茶黄素;(l)-egcg+(l)-ec→tf2a;(l)-ecg+(l)-egc→tf2b;(l)-egcg+(l)-ecg→tf3。egc全称为表没食子儿茶素。egcg全称为表没食子儿茶素没食子酸酯。ecg全称为表儿茶素没食子酸酯。cg全称为儿茶素没食子酸酯。ec全称为表儿茶素。c全称为儿茶素。tf全称为茶黄素。tf2a全称为茶黄素-3-没食子酸酯。tf2b全称为茶黄素-3’没食子酸酯。tf3全称为茶黄素双没食子酸酯。gc全称为没食子儿茶素。gcg全称为没食子儿茶素没食子酸酯。技术实现要素:本发明的目的是提供一种来源于茶叶的与茶黄素生成相关的过氧化物酶pod1及其应用。本发明提供了一种蛋白质,命名为pod1蛋白,是如下(a1)至(a8)中的任意一种:(a1)由序列表中序列1所示的氨基酸序列组成的蛋白质;(a2)含有(a1)的融合蛋白;(a3)在(a1)的末端连接含有标签的短肽得到的融合蛋白;(a4)在(a1)的末端连接标签得到的融合蛋白;(a5)由序列表中序列3所示的氨基酸序列组成的蛋白质;(a6)将(a1)或(a2)或(a3)或(a4)或(a5)经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有氧化酶功能的由其衍生的蛋白质;(a7)获自茶叶的与(a1)具有98%以上同源性且具有氧化酶功能的由其衍生的蛋白质;(a8)获自舒茶早的与(a1)具有98%以上同源性具有氧化酶功能的由其衍生的蛋白质。所述氧化酶为过氧化物酶和/或多酚氧化酶。标签具体如表1所示。表1标签的序列标签残基序列poly-arg5-6(通常为5个)rrrrrpoly-his2-10(通常为6个)hhhhhhflag8dykddddkstrep-tagii8wshpqfekc-myc10eqkliseedlha9ypydvpdya蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。pod1蛋白的编码基因(pod1基因)也属于本发明的保护范围。所述pod1基因为如下(b1)至(b5)中任一所述的dna分子:(b1)编码区如序列表中序列2所示的dna分子;(b2)编码区如序列表中序列4所示的dna分子;(b3)在严格条件下与(b1)或(b2)限定的dna序列杂交且编码氧化酶的dna分子;(b4)来源于茶叶的与(b1)限定的dna序列具有90%以上或95%以上或98%以上或99%以上同源性且编码氧化酶的dna分子;(b5)来源于舒茶早的与(b1)限定的dna序列具有90%以上或95%以上或98%以上或99%以上同源性且编码氧化酶的dna分子。所述氧化酶为过氧化物酶和/或多酚氧化酶。上述严格条件可为用0.1×sspe(或0.1×ssc),0.1%sds的溶液,在dna或者rna杂交实验中65℃下杂交并洗膜。本发明还保护pod1蛋白的应用,为如下(c1)至(c16)中的至少一种:(c1)作为氧化酶;(c2)制备氧化酶;(c3)作为过氧化物酶;(c4)制备过氧化物酶;(c5)作为多酚氧化酶;(c6)制备多酚氧化酶;(c7)制备茶黄素类化合物;(c8)以儿茶素类化合物为底物制备茶黄素类化合物;(c9)制备茶黄素;(c10)以儿茶素类化合物为底物制备茶黄素;(c11)以表没食子儿茶素和表儿茶素为底物制备茶黄素;(c12)促进茶叶中儿茶素类化合物降解;(c13)降低茶叶中儿茶素类化合物的水平;(c14)提高茶叶中茶黄素水平;(c15)作为标志物筛选适合制作绿茶的茶树品种和/或适合制作红茶的茶树品种;(c16)作为考察指标对红茶加工工艺进行控制。本发明还保护pod1基因在茶树育种中的应用;所述茶树育种为培育适合制作绿茶的茶树品种或培育适合制作红茶的茶树品种。本发明还保护用于抑制pod1基因表达的物质在制备茶黄素水平降低的转基因植物或转基因植物组织中的应用。所述植物为茶树。用于抑制pod1基因表达的物质具体可为后述的特异dna分子或者具有所述特异dna分子的重组表达载体。本发明还保护用于降低pod1蛋白活性和/或水平的物质在培育茶黄素水平降低的植物中的应用。所述植物为茶树。本发明还保护用于检测pod1基因表达水平的物质的应用,为如下(d1)至(d5)中的至少一种:(d1)评价待测茶树品种或个体适合制作绿茶还是红茶;(d2)评价待测茶树品种或个体生产茶黄素的能力;(d3)评价待测茶树品种或个体的抗病性;(d4)筛选适合制作绿茶的茶树品种或个体;(d5)筛选适合制作红茶的茶树品种或个体。用于检测pod1基因表达水平的物质具体可以为后述的特异引物对。本发明还保护用于检测pod1蛋白水平的物质的应用,为如下(d1)至(d5)中的至少一种:(d1)评价待测茶树品种或个体适合制作绿茶还是红茶;(d2)评价待测茶树品种或个体生产茶黄素的能力;(d3)评价待测茶树品种或个体的抗病性;(d4)筛选适合制作绿茶的茶树品种或个体;(d5)筛选适合制作红茶的茶树品种或个体。本发明还保护一种特异引物对,由序列表的序列5所示的单链dna分子和序列表的序列6所示的单链dna分子组成。本发明还保护一种特异dna分子,为序列表的序列7所示的单链dna分子。本发明的发明人通过茶树的转录组数据分析,结合原核表达和功能验证,从舒茶早中发现了能够催化儿茶素类化合物合成茶黄素的氧化酶,兼具过氧化物酶和多酚氧化酶的活性。目前红茶加工发酵过程参数(时间长短、温度、湿度等)的确定多数依赖专业制茶师的评判,局限于专业制茶人的感觉(如视觉、触觉等)对茶叶发酵性的判断。这种因人而异和不准确的感觉经验极大地限制了茶叶加工的标准化和机械化,造成茶叶质量变化很大,批次间的重复性一致性极差,因而无法大规模生产,造成我国茶叶生产质量和稳定性、均一性方面无法和国际上著名的品牌相比。将pod1蛋白水平作为指标,可以通过客观数据设置红茶发酵参数(茶叶加工过程中的温度、湿度、ph、时间等),得到具有预期茶黄素含量的红茶,从而有效推进茶叶加工的标准化、自动化和机械化。本发明可用于茶树育种。培育低表达pod1基因的茶树品种,便于制作绿茶。培育高表达pod1基因的茶树品种,便于制作红茶。木本植物茶树的常规育种周期长(一般需要10-20年的杂种优势选择),分子育种可以极大地缩短育种时间,减少大规模筛选的人力和时间。本发明可用于筛选适于制作红茶的茶树品种和适于制作绿茶的茶树品种。具体来说,是通过检测pod1基因的表达水平来实现的,如果pod1基因表达水平高、该茶树品种适于制作红茶,如果pod1基因的表达水平低、该茶树品种适于制作绿茶。基于现有技术,过氧化物酶水平高预示着该茶树品种或个体有较强的抗病能力,过氧化物酶活性越高,其植物的抗病性越强。所以本发明可以用于培育抗病能力提高的茶树品种,也可以用于筛选抗病性高的茶树品种或个体。附图说明图1为实施例1中各个样本的总蛋白的多酚氧化酶酶活和过氧化物酶酶活结果。图2为实施例1中儿茶素类化合物含量的结果。图3为实施例1中pod1基因的表达量的结果。图4为实施例2中舒茶早不同组织中pod1基因的表达差异的结果。图5为实施例3中不同茶树品种的酶活比较的结果。图6为实施例4中pod1基因在不同茶树品种的表达差异的结果。图7为实施例5中重组菌甲进行目的蛋白表达和纯化过程中的聚丙烯酰氨凝胶电泳图。图8为实施例5中步骤四中酶活检测的结果。图9为实施例5中步骤五中反应结束时刻的照片。图10为实施例5中步骤五中hplc检测的色谱图。图11为实施例5中步骤五中反应结束时刻,反应体系中表儿茶素浓度的结果。图12为实施例5中步骤五中反应结束时刻,反应体系中茶黄素浓度的结果。图13为实施例5中步骤五中lc-ms的结果。图14为实施例5中步骤六中酶学性质检测的结果。图15为实施例6中pod1基因的相对表达水平的结果。图16为实施例6中通过抑制pod1基因表达降低茶黄素含量的结果。具体实施方式以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。实施例中所用的分光光度计为spectramax190(softmaxpro5serialnumber:smp500-14530-xusl)。茶叶品种舒茶早,简称舒茶早。从舒茶早中发现一个新蛋白,命名为pod1蛋白,如序列表的序列1所示。将编码pod1蛋白的基因命名为pod1基因,开放阅读框如序列表的序列2所示。pod1蛋白具有过氧化物酶的功能。舒茶早以及其它各个茶树品种,植株种植于安徽省庐阳区合肥安徽农业大学农业产业园,叶片采摘条件为25-28℃。多酚氧化酶酶活测定方法(比色法):反应体系为400μl;初始体系由50μl待测样本(提供蛋白)、邻苯二酚(作为底物)和ph7.0、0.1mm的磷酸缓冲液组成,邻苯二酚的浓度为0.2%(重量体积比,g/ml);初始体系室温静置反应3min,即为终止体系;采用分光光度计分别检测初始体系和终止体系在460nm的吸光值,终止体系的吸光值-初始体系的吸光值=吸光度差值;多酚氧化酶酶活=吸光度差值÷(总蛋白含量×反应时间),总蛋白的单位为mg,反应时间的单位为min。过氧化物酶酶活测定方法(比色法):反应体系为1ml;初始体系由50μl待测样本(提供蛋白)、愈创木酚(作为底物)、30%过氧化氢溶液和ph6.0、0.1m的磷酸缓冲液组成,愈创木酚的浓度为0.56μl/ml,过氧化氢的浓度为0.38μl/ml;初始体系室温静置反应3min,即为终止体系;采用分光光度计分别检测初始体系和终止体系在470nm的吸光值,终止体系的吸光值-初始体系的吸光值=吸光度差值;过氧化物酶酶活=吸光度差值÷(总蛋白含量×反应时间),总蛋白的单位为mg,反应时间的单位为min。实施例1、红茶/绿茶制作过程中过氧化物酶和多酚氧化酶活性的变化、儿茶素含量的变化、基因表达的变化一、各个样本的获得绿茶的制作过程主要为采摘、摊放、杀青、揉捻、干燥。具体为:采摘舒茶早植株的一芽一叶(此时为鲜叶样本);在室温摊放3h左右(完成后为摊放样本);用180℃的杀青3-5min(完成后为杀青样本);用手揉捻成一定形状(完成后为揉捻样本);110℃干燥15min左右(完成后为干燥样本)。红茶的制作过程主要为采摘、萎凋、揉捻、发酵、干燥。具体为:采摘舒茶早植株的一芽一叶(此时为鲜叶样本);在室温摊放16h左右(完成后为萎凋样本);将茶叶拢成球状先轻揉后重揉再轻揉(完成后为揉捻样本);用纱布包住茶叶30℃发酵12h(完成后为发酵样本),发酵期间要每隔2h散开一次然后继续发酵;110℃干燥15min左右(完成后为干燥样本)。二、酶活取步骤一得到的各个样本,进行蛋白提取,得到含有总蛋白的蛋白提取溶液,将蛋白提取溶液或其稀释液(采用ph6.0、0.1m的磷酸钾缓冲液进行稀释)作为待测样本,检测多酚氧化酶酶活和过氧化物酶酶活,计算得到总蛋白的多酚氧化酶酶活和过氧化物酶酶活。各个样本的总蛋白的多酚氧化酶酶活和过氧化物酶酶活结果见图1。图1中,上图为终止体系的照片,下图为酶活数据。红茶加工过程中,发酵阶段pod/ppo活性达到最高。绿茶加工过程中,杀青导致ppo活性急剧下降。三、儿茶素类化合物含量取步骤一得到的各个样本,分别检测儿茶素类化合物含量。检测儿茶素类化合物含量的方法:取0.1g样本,加至1.5ml80%(体积比)甲醇水溶液中,涡旋震荡充分混匀,然后冰浴中超声30min,然后13000rpm离心30min,采用0.22μm孔径滤网过滤,收集滤液;取滤液,采用hplc检测(参数同实施例5的步骤五中的hplc检测,进样量15μl);标准品分别为:gc、egc、c、egcg、ec、gcg、ecg。在相同色谱条件下,与标准品出峰位置±0.5min以内的峰,判断为同一物质。在相同色谱条件下,制作标准品含量与峰面积的标准曲线,通过对照标准曲线,通过计算,得到样品中各个儿茶素类化合物的浓度(每mg样本中含多少μg儿茶素类化合物)。结果见图2。红茶加工过程中,各个儿茶素类化合物含量均下降,说明大部分儿茶素类化合物在加工过程中生成了茶黄素类化合物。绿茶加工过程中,各个儿茶素类化合物含量变化不显著。四、pod1基因的表达量取步骤一得到的各个样本,分别检测pod1基因的表达量(提取总rna并反转录为cdna,采用csactin基因为内参基因,采用实时定量pcr检测pod1基因的相对水平。用于检测pod1基因的引物对如下:上游引物(序列表的序列5):atgctttggggctacccttg;下游引物(序列表的序列6):gggttcccttcacacttgact。结果见图3。红茶加工过程中,与萎凋样本相比,发酵样本中pod1基因的表达水平增加了9.4倍。绿茶加工过程中,与鲜叶样本相比,杀青样本中pod1基因的表达水平降低了92%。结果表明,pod1蛋白参与红茶/绿茶的加工过程。实施例2、舒茶早不同组织中pod1基因的表达差异分别采摘舒茶早植株的根、茎、花、果、芽、一叶、二叶、三叶。分别检测各个样本中pod1基因的表达量(采用高通量测序的方法)。结果见图4。pod1基因在舒茶早植株不同组织中存在表达差异,在作为茶叶原料的组织(幼芽、嫩叶)中表达量最高。实施例3、不同茶树品种的酶活比较各个茶树品种分别摘取一叶和三叶(一叶和三叶混合作为样本)。各个样本,进行蛋白提取,得到含有总蛋白的蛋白提取溶液,将蛋白提取溶液或其稀释液(采用ph6.0、0.1m的磷酸钾缓冲液进行稀释)作为待测样本,检测多酚氧化酶酶活和过氧化物酶酶活,计算得到总蛋白的多酚氧化酶酶活和过氧化物酶酶活。结果见图5。适合做红茶的茶树品种与适合做绿茶的茶树品种的pod/ppo活性差异较大。说明pod/ppo活性对于该茶树品种决定适合做何种茶较为关键。实施例4、pod1基因在不同茶树品种的表达差异各个茶树品种分别摘取一叶和三叶(一叶和三叶混合作为样本)。分别检测各个样本中pod1基因的表达量(采用高通量测序的方法)。结果见图6。pod1基因在不同适合红茶绿茶的典型茶树品种的表达差异较大。说明pod1基因在不同茶树品种中,对决定该茶树品种适合做绿茶或红茶起着关键作用。实施例5、pod1蛋白的纯化和功能验证一、构建重组质粒1、取舒茶早的叶子,提取总rna,反转录得到cdna。2、以步骤1得到的cdna为模板,采用f1和r1组成的引物对进行pcr扩增。f1:aggatccatggggatggtctctttcatctc;r1:cctcgagctataatttcaacttgctg。3、取步骤2得到的pcr扩增产物,用限制性内切酶bamhⅰ和xhoⅰ进行双酶切,回收酶切产物。4、取pet-28a(+)载体,用限制性内切酶bamhⅰ和xhoⅰ进行双酶切,回收载体骨架。5、将步骤3的酶切产物和步骤4的载体骨架连接,得到重组质粒。根据测序结果,对重组质粒进行结构描述如下:在pet-28a(+)载体的bamhⅰ和xhoⅰ酶切位点之间插入了序列表的序列2所示的双链dna分子。重组质粒中,具有序列表的序列4所示的融合基因,表达序列表的序列3所示的融合蛋白。该融合蛋白又称为具有6×his标签的pod1蛋白。二、制备重组菌将步骤一构建的重组质粒导入大肠杆菌bl21(de3),得到重组菌甲。将pet-28a(+)载体导入大肠杆菌bl21(de3),得到重组菌乙。三、目的蛋白的表达和纯化1、将重组菌接种至含50mg/l卡那霉素的液体lb培养基中,37℃、180rpm振荡培养至od600nm=0.6。2、完成步骤1后,在体系中加入iptg并使其在体系中的浓度为0.5mmol/l,16℃、180rpm振荡培养16h。3、完成步骤2后,12000rpm离心10min,收集菌体沉淀。4、取步骤3得到的菌体沉淀,用裂解缓冲液悬浮,然后冰浴中进行超声破碎(300w,每超声3s停4s,100次),然后10000rpm离心30min,收集上清液。裂解缓冲液:由25ml1mtris水溶液、30ml5mnacl水溶液和945mlddh2o组成。5、取步骤4得到的上清液,采用ni-nta琼脂胶进行纯化,纯化过程中采用washbuffer洗涤以去除杂蛋白,采用elutionbuffer洗涤以收集目的蛋白,得到蛋白溶液。washbuffer:由25ml1mtris水溶液、30ml5mnacl水溶液、3ml5mimidazole水溶液和942mlddh2o组成。elutionbuffer:由25ml1mtris水溶液、20ml5mimidazole水溶液和955mlddh2o组成。采用重组菌甲进行上述步骤,得到的蛋白溶液命名为pod1蛋白溶液。采用重组菌乙进行上述步骤,得到的蛋白溶液命名为对照溶液。分别取重组菌甲进行上述步骤过程中的如下样品进行聚丙烯酰氨凝胶电泳:完成步骤1后收集的上清液样品(样品1),步骤4收集的上清液样品(样品2)和步骤5得到的pod1蛋白溶液(设置两个重复,样品3和样品4)。电泳图见图7。四、酶活检测取步骤三制备的pod1蛋白溶液或对照溶液,作为待测样本,检测多酚氧化酶酶活和过氧化物酶酶活,计算得到总蛋白的多酚氧化酶酶活和过氧化物酶酶活。终止体系的照片见图8左,酶活结果见图8右。具有6×his标签的pod1蛋白的多酚氧化酶酶活为37.53吸光度差值/(mg蛋白×min)。具有6×his标签的pod1蛋白的过氧化物酶酶活为22.50吸光度差值/(mg蛋白×min)。对照溶液的多酚氧化酶酶活为0吸光度差值/(mg蛋白×min)。对照溶液的过氧化物酶酶活为0吸光度差值/(mg蛋白×min)。五、制备茶黄素类化合物的能力反应体系(100μl):在ph8.0的磷酸氢二钠-柠檬酸缓冲液中加入ec和egc,并使它们的浓度均为1mm,然后加入步骤三制备的pod1蛋白溶液(总蛋白含量为30μg)和1μl30%过氧化氢溶液。设置用等体积对照溶液代替pod1蛋白溶液的对照体系。反应条件:室温静置反应10min。反应结束时刻的照片见图9。反应结束后,采用0.22μm孔径滤网过滤,收集滤液。分别将滤液进行hplc检测和lc-ms检测。hplc检测参数:waterse2695高效液相色谱,2489紫外可见检测器,empower2色谱工作站,色谱柱为phenomenexgemini5μmc18250×4.6mm;进样量为10μl;流动相为a相(0.2%乙酸水溶液)、b相(纯甲醇),流动相流速为1ml/min。洗脱过程见表2。标准品为表儿茶素标准品或茶黄素标准品。在相同色谱条件下,与标准品出峰位置±1min以内的峰,判断为同一物质。在相同色谱条件下,制作标准品含量与峰面积的标准曲线,通过对照标准曲线,通过计算,得到反应结束的体系中相应化合物的浓度。表2时间(min)a%b%0595259514208020257522425828425831100035100038595表2中显示的是某一时刻a相和b相的配比,事实上洗脱是动态过程,以0至14min为例,描述如下:0-2min过程中,a相占流动相的体积分数为5%(相应的b相占流动相的体积分数为95%),2-14min过程中,a相占流动相的体积分数由5%线性上升至20%(相应的b相占流动相的体积分数由95%线性下降至80%)。lc-ms检测参数:agilenttechnologies1290infinity液相色谱系统,质谱检测器(model#g6545a,serial#sg1637e002,madeinsingapore),色谱柱为hypersilgoldcolumn(2.1×100mm,particlesizeof1.9μm,thermoscientific);流动相为a相(含1%乙腈和0.1%乙酸的水溶液,%代表体积比)、b相(含0.1%乙酸的乙腈溶液,%代表体积比),流动相流速为0.2ml/min;洗脱程序如下:0-1min,b相占流动相的体积分数保持5%;1-12min,b相占流动相的体积分数从5%线性上升至50%;12-13min,b相占流动相的体积分数50%线性上升至100%;13-18min,b相占流动相的体积分数保持100%;18-18.1min,b相占流动相的体积分数从100%线性下降至5%;18.1-22min,b相占流动相的体积分数保持5%。hplc检测的色谱图(369nm的色谱图)见图10。反应结束时刻,反应体系中表儿茶素浓度的结果见图11,反应体系中茶黄素浓度的结果见图12。lc-ms的结果见图13。结果表明,pod1蛋白确实可以催化茶黄素生成。六、酶学性质检测过氧化物酶酶活测定方法(比色法):反应体系为1ml;初始体系由50μl待测样本(步骤三制备的pod2蛋白溶液)、愈创木酚(作为底物)、30%过氧化氢溶液和0.1mm的磷酸缓冲液组成,愈创木酚的浓度为0.56μl/ml,过氧化氢的浓度为0.38μl/ml;初始体系静置反应3min,即为终止体系;采用分光光度计分别检测初始体系和终止体系在470nm的吸光值,终止体系的吸光值-初始体系的吸光值=吸光度差值;过氧化物酶酶活=吸光度差值÷(总蛋白含量×反应时间),总蛋白的单位为mg,反应时间的单位为min。磷酸缓冲液分别采用如下ph:ph6.0、6.5、7.0、7.5、8.0。反应温度为室温。结果见图14a。分别采用如下反应温度:30、40、50、60、70或80℃。磷酸缓冲液采用ph6.0。结果见图14b。结果表明,pod1蛋白在ph8.0、30℃条件下过氧化物酶酶活最高。实施例6、通过抑制pod1基因表达降低茶黄素含量采摘舒茶早植株的一芽一叶,相似大小的60个样本。将60个样本随机分为两组,每组30个样本。第一组:浸没于80mm蔗糖水溶液中,室温96小时;第二组:浸没于含700μm反义核酸和80mm蔗糖的水溶液中,室温96小时;反义核酸(序列表的序列7):5’-atccatttgggccaccag-3’。反义核酸为单链dna分子。完成处理后,检测样本中pod1基因的表达量,方法同实施例1的步骤四。相对表达水平见图15。结果表明,与第一组处理后的样本相比,第二组处理后样本的pod1基因的表达量显著降低。完成处理后,取出样本,依次进行如下操作:吸除表面水分,然后在室温摊放16h左右,然后将茶叶拢成球状先轻揉后重揉再轻揉,然后用纱布包住茶叶30℃发酵12h(发酵期间要每隔2h散开一次然后继续发酵),然后110℃干燥15min左右,得到干燥样本;然后取0.1g干燥样本,加至1.5ml80%(体积比)甲醇水溶液中,涡旋震荡充分混匀,然后冰浴中超声30min,然后13000rpm离心30min,采用0.22μm孔径滤网过滤,收集滤液;取滤液,采用hplc检测(参数同实施例5的步骤五中的hplc检测,进样量15μl);标准品为tf,在相同色谱条件下与标准品出峰位置±0.5min以内的峰判断为同一物质,在相同色谱条件下制作标准品含量与峰面积的标准曲线,通过对照标准曲线,通过计算,得到干燥样本中tf的浓度(每g干燥样本中含多少μgtf)。结果见图16。与第一组得到的干燥样本相比,第二组得到的干燥样本中的tf浓度显著降低。sequencelisting<110>安徽农业大学<120>来源于茶叶的与茶黄素生成相关的过氧化物酶pod1及其应用<130>gncyx181158<160>7<170>patentinversion3.5<210>1<211>352<212>prt<213>camelliasinensis<400>1metglymetvalserpheileserthrvalproserleuleualaleu151015alaproleuproserprothrthrserthrthrservalalavalser202530lystyrproilehisalaserthrvalargcyslysileglualaasp354045asnglysergluaspglnpheglyargargaspileleulyscysphe505560glyalathrleuglymetgluileilealaserserglyserpheval65707580gluglualaasnalaalaaspleuileglnargargglnargserglu859095pheglnserservallysglythrleuphethralailelysalaasn100105110proaspleuvalproserleuleuthrleualametasnaspalamet115120125thrtyrasplysalathrlysserglyglyproasnglyservalarg130135140phesersergluileserargprogluasnlysglyleuseralaala145150155160metasnleuleugluglualalyslysgluileaspsertyrserlys165170175glyglyproileserphealaaspleuileglnphealaalaglnser180185190alaleulysserthrpheleualaseralailearglyscysglygly195200205asngluglulysglyserleuleutyrthralatyrglyserasngly210215220glntrpglyleupheasplysglnpheglyargseraspalaglnglu225230235240proaspprogluglyargvalproleutrpalalysalaservalgln245250255glumetlysasplyspheseralaileglypheglyproargglnleu260265270alavalmetseralapheleuglyproaspglnmetalathrgluthr275280285leuleualathraspargaspvalalaprotrpvalglulystyrgln290295300argserarggluthrvalsergluthrasptyrgluvalaspleuile305310315320thrthrleuthrlysleuseralaleuglyglnglnileasntyrglu325330335alatyralatyrprovalglnargvalasppheserlysleulysleu340345350<210>2<211>1059<212>dna<213>camelliasinensis<400>2atggggatggtctctttcatctcaactgtaccttccttgcttgcacttgctcctctccca60tctcccaccaccagcaccacatctgttgctgtctccaaatacccaattcatgctagtaca120gttcgctgtaaaattgaagctgacaatggtagtgaggatcaatttggtcgaagagacatt180cttaaatgctttggggctacccttggcatggaaataatagcaagctcaggctcatttgtt240gaagaggctaatgctgctgatctaatacagcgcagacagcgttctgagtttcagtcaagt300gtgaagggaaccctttttacagctataaaggcaaacccagatcttgttccatccttattg360actttggcgatgaatgatgctatgacttatgataaggccacaaaatctggtggcccaaat420ggatctgtacgtttcagctcagagattagcagaccagagaataaggggctctctgccgca480atgaatttattagaggaagcaaagaaggaaatagattcatattccaagggtggtcctatt540tcatttgcggatctcatccaatttgcagcacaaagtgccttaaagtctacatttctagct600tctgccatccgtaaatgtggtggaaatgaagagaaaggaagcttactatacactgcatat660ggttcaaatgggcagtggggcttgtttgacaagcaatttgggaggtcagatgctcaagag720ccagatccagaagggagggttcccctgtgggcgaaagcaagtgttcaggaaatgaaagat780aagttctcggccataggctttggtccccgccagctagctgttatgtctgcattcttgggt840cctgatcaaatggccactgagaccttattggccacagatcgagatgttgctccatgggtt900gagaaataccaaagaagccgagaaacagtctctgaaactgactacgaggttgacctaata960actaccctcacaaaattaagtgctttggggcaacaaatcaattatgaggcatacgcatat1020cctgttcaaagagttgatttcagcaagttgaaattatag1059<210>3<211>386<212>prt<213>artificialsequence<400>3metglyserserhishishishishishisserserglyleuvalpro151015argglyserhismetalasermetthrglyglyglnglnmetglyarg202530glysermetglymetvalserpheileserthrvalproserleuleu354045alaleualaproleuproserprothrthrserthrthrservalala505560valserlystyrproilehisalaserthrvalargcyslysileglu65707580alaaspasnglysergluaspglnpheglyargargaspileleulys859095cyspheglyalathrleuglymetgluileilealaserserglyser100105110phevalgluglualaasnalaalaaspleuileglnargargglnarg115120125serglupheglnserservallysglythrleuphethralailelys130135140alaasnproaspleuvalproserleuleuthrleualametasnasp145150155160alametthrtyrasplysalathrlysserglyglyproasnglyser165170175valargphesersergluileserargprogluasnlysglyleuser180185190alaalametasnleuleugluglualalyslysgluileaspsertyr195200205serlysglyglyproileserphealaaspleuileglnphealaala210215220glnseralaleulysserthrpheleualaseralailearglyscys225230235240glyglyasngluglulysglyserleuleutyrthralatyrglyser245250255asnglyglntrpglyleupheasplysglnpheglyargseraspala260265270glngluproaspprogluglyargvalproleutrpalalysalaser275280285valglnglumetlysasplyspheseralaileglypheglyproarg290295300glnleualavalmetseralapheleuglyproaspglnmetalathr305310315320gluthrleuleualathraspargaspvalalaprotrpvalglulys325330335tyrglnargserarggluthrvalsergluthrasptyrgluvalasp340345350leuilethrthrleuthrlysleuseralaleuglyglnglnileasn355360365tyrglualatyralatyrprovalglnargvalasppheserlysleu370375380lysleu385<210>4<211>1161<212>dna<213>artificialsequence<400>4atgggcagcagccatcatcatcatcatcacagcagcggcctggtgccgcgcggcagccat60atggctagcatgactggtggacagcaaatgggtcgcggatccatggggatggtctctttc120atctcaactgtaccttccttgcttgcacttgctcctctcccatctcccaccaccagcacc180acatctgttgctgtctccaaatacccaattcatgctagtacagttcgctgtaaaattgaa240gctgacaatggtagtgaggatcaatttggtcgaagagacattcttaaatgctttggggct300acccttggcatggaaataatagcaagctcaggctcatttgttgaagaggctaatgctgct360gatctaatacagcgcagacagcgttctgagtttcagtcaagtgtgaagggaacccttttt420acagctataaaggcaaacccagatcttgttccatccttattgactttggcgatgaatgat480gctatgacttatgataaggccacaaaatctggtggcccaaatggatctgtacgtttcagc540tcagagattagcagaccagagaataaggggctctctgccgcaatgaatttattagaggaa600gcaaagaaggaaatagattcatattccaagggtggtcctatttcatttgcggatctcatc660caatttgcagcacaaagtgccttaaagtctacatttctagcttctgccatccgtaaatgt720ggtggaaatgaagagaaaggaagcttactatacactgcatatggttcaaatgggcagtgg780ggcttgtttgacaagcaatttgggaggtcagatgctcaagagccagatccagaagggagg840gttcccctgtgggcgaaagcaagtgttcaggaaatgaaagataagttctcggccataggc900tttggtccccgccagctagctgttatgtctgcattcttgggtcctgatcaaatggccact960gagaccttattggccacagatcgagatgttgctccatgggttgagaaataccaaagaagc1020cgagaaacagtctctgaaactgactacgaggttgacctaataactaccctcacaaaatta1080agtgctttggggcaacaaatcaattatgaggcatacgcatatcctgttcaaagagttgat1140ttcagcaagttgaaattatag1161<210>5<211>20<212>dna<213>artificialsequence<400>5atgctttggggctacccttg20<210>6<211>21<212>dna<213>artificialsequence<400>6gggttcccttcacacttgact21<210>7<211>18<212>dna<213>artificialsequence<400>7atccatttgggccaccag18当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1