一种色烯化合物及其制备方法与流程
本发明属于化学合成技术领域,涉及一种色烯化合物及其制备方法。
背景技术:
光致变色指的是某些化合物在一定的波长和强度的光作用下分子结构会发生变化,从而导致其对光的吸收峰值即颜色的相应改变,且这种改变一般是可逆的。光致变色材料的分类如下:
1、无机光致变色材料:典型无机体系的光致变色效应伴随着可逆的氧化-还原反应,具有良好的可逆性和耐疲劳性能;缺点就是光致变色效率较低、附着力弱,分散不均匀,带有底色且不透明。无机光致变色化合物主要有过渡金属氧化物、金属卤化物和稀土配合物等三大类。
2、有机光致变色材料:有机光致变色材料种类繁多,反应机理也不尽相同,其反应方式主要包括:价键异构、顺反异构、键断裂、聚合作用、氧化-还原、周环反应等。以偶氮化合物为例,其光致变色效应基于分子中偶氮基-n=n-的顺-反异构反应,通常偶氮化合物顺-反异构体有不同的吸收峰,虽两者一般差值不大,但摩尔消光系数往往相差很大,另外,偶氮化合物还有明显的光偏振效应,即光致变色效果与光的偏振态有关。生物光致变色材料如细菌视紫红质等的感光效应也属于这一类反应机制。
将光致变色化合物加入透明树脂中,制成光变色材料,可以用于树脂眼镜片,国内外在变色眼镜方面已开始应用。由此,得到光致变色现象明显且可以保证主变色色调范围的色烯化合物,是本领域的一项重要课题。
技术实现要素:
本发明设计合成了一类新型光致变色化合物,结构式如式i所示:
该类化合物在紫外线照射下,能从无色变为青色,而紫外线消失后,又能从青色变为无色,光致变色现象明显,并且具有持久的变色褪色特性;该类化合物不同结构显示的主变色色调都为青色,变色全部处在淡青色到青蓝色范围之内。
本发明采用以下技术方案:
一种色烯化合物,其特征在于,具有下述结构式(i)表示的基本结构:
其中,r1为取代或未取代的c1-c6烷基;r2为取代或未取代的c1-c6烷基。
一种色烯化合物的制备方法,其特征在于,包括如下步骤:
(1)化合物qf-1在酸性条件下发生环合得到qf-2,反应式如下:
(2)qf-2与1-(4-甲氧基苯基)-2-丙炔-1-醇在酸催化作用下生成qf-3,反应式如下:
(3)qf-3与烷基格氏试剂或者烷基锂试剂反应生成qf-4,反应式如下:
(4)qf-4在酸酐和三氟化硼乙醚溶液作用下与醇反应生成光致变色化合物i,反应式如下:
优选地,步骤(1)中使用的酸为醋酸、三氟乙酸、甲磺酸、磷酸、硫酸或多聚磷酸中的一种;使用的反应溶剂为甲苯、二甲苯、或者不加溶剂。
优选地,步骤(1)的反应温度为30~130℃。
优选地,步骤(2)中使用的酸为醋酸、三氟乙酸、甲磺酸、对甲苯磺酸、磷酸、硫酸中的一种;使用的反应溶剂为苯、甲苯、二甲苯、二氯甲烷、氯仿、四氢呋喃、甲基四氢呋喃中的一种。
优选地,步骤(2)的反应温度为10~100℃。
优选地,步骤(3)中所述的烷基格式试剂为烷基氯化镁或烷基溴化镁;烷基锂试剂为烷基锂;反应中所用的溶剂为乙醚、四氢呋喃或甲基四氢呋喃中的一种。
优选地,步骤(3)的烷基化反应温度为-50~20℃。
优选地,步骤(4)中所述的酸酐为醋酸酐或三氟乙酸酐;所述的醇为c1-c6烷基醇;反应溶剂为乙醚、乙腈、甲苯、二甲苯、四氢呋喃或甲基四氢呋喃中的一种。
优选地,步骤(4)的烷基化反应温度为-10~50℃。
本发明的优选制备方法为:
(1)化合物qf-1在酸性条件下发生环合得到中间体5-羟基-3,9-二甲氧基-7h-苯并[c]芴-7-酮,反应中所使用的酸为醋酸、三氟乙酸、甲磺酸、磷酸、硫酸或多聚磷酸;酸的摩尔数为化合物qf-1的6-18倍;反应温度为30-130℃,反应时间为1-8小时;所述的溶剂为甲苯、二甲苯、或者不加溶剂。
(2)qf-2与1-(4-甲氧基苯基)-2-丙炔-1-醇在对酸催化作用下生成光致变色化合物qf-3;其中,相对于1mol的qf-2,1-(4-甲氧基苯基)-2-丙炔-1-醇的量为1.0-1.4mol,使用的酸为醋酸、三氟乙酸、甲磺酸、对甲苯磺酸、磷酸、或硫酸;对酸为0.1-0.3mol;反应温度为10-100℃,反应时间为2-16小时;反应溶剂为苯、甲苯、二甲苯、二氯甲烷、氯仿、四氢呋喃、甲基四氢呋喃中的一种。
(3)化合物qf-3与烷基格式试剂反应得到化合物qf-4,其中所用的烷基格式试剂为烷基氯化镁或烷基溴化镁,烷基锂试剂为烷基锂,其所用摩尔数为qf-3的1-5倍,烷基化反应温度为-50~20℃;反应时间为1-8小时;反应中所用的溶剂为乙醚、四氢呋喃或甲基四氢呋喃。
(4)化合物qf-4在酸酐和三氟化硼乙醚溶液作用下与醇反应生成光致变色化合物i,所用的酸酐为醋酸酐、三氟乙酸酐,其所用摩尔数为qf-4的1-3倍,用到的醇为c1-c6烷基醇;如甲醇、乙醇、异丁醇等,其所用摩尔数为qf-4的1-2倍;反应温度为-10~50℃;反应时间为1-8小时;反应中所用的溶剂为乙醚、乙腈、甲苯、二甲苯、四氢呋喃或甲基四氢呋喃等。
本发明一种色烯化合物可作为光致变色材料的应用。
本发明一种色烯化合物可应用于树脂眼镜片。将式i化合物的苯乙烯等树脂单体配成透明溶液,加上适量v65,浇注、加热固化,使之变成无色透明树脂镜片。
本发明中,式i中,r1为取代或未取代的c1-c6烷基;可以是甲基、乙基、异丙基、丁基等;r2为取代或未取代的c1-c6烷基;可以是甲基、乙基、异丙基、丁基等。除本发明的实施例外,式i包括但不限于如下结构:
本发明的有益效果:本发明一种色烯化合物在紫外线照射下,能从无色变为青色,而紫外线消失后,又能从青色变为无色,光致变色现象明显。该类化合物不同结构显示的主变色色调都为青色,变色全部处在淡青色到青蓝色范围之内。且经过10000次的变色褪色循环后,其变色性能没有明显的下降。同时,经过高温实验,该化合物可以耐受350℃高温。
附图说明
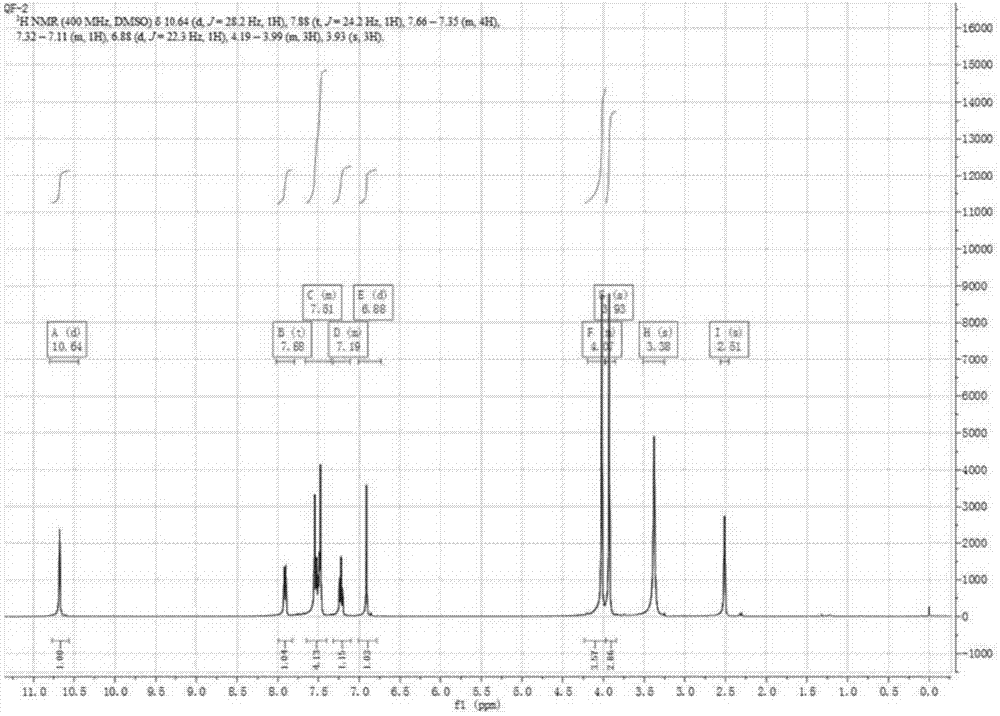
图1qf-2的核磁谱图。
图2qf-3的核磁谱图。
图3实施例1制备的6,10-二甲氧基-3-苯基-3-(4-甲氧基苯基)-13-戊基-13-甲氧基-3,13-二氢苯并[h]茚[2,1-f]吡喃核磁谱图。
图4实施例2制备的qf-c-4核磁谱图。
图5实施例2制备的qf-c-5核磁谱图。
具体实施方式
下面结合具体实施例对本发明作进一步详细的说明。
下述实施例中,核磁共振由brukeramx-400型核磁共振仪测定,tms为内标,化学位移单位为ppm;高效液相(hplc)由agilent1100检测;tlc硅胶板gf254为青岛海洋化工厂生产,采用紫外灯显色;实施例中若未特别指出操作方法,减压浓缩指用旋转蒸发仪将制备化合物溶液中的溶剂蒸出;干燥指用无水硫酸钠或硫酸镁干燥,真空干燥指用真空干燥箱中真空干燥制备化合物。
文中涉及的英文缩写:meoh为甲醇;tlc为薄层分析;dcm为二氯甲烷。
实施例1:
色烯化合物6,10-二甲氧基-3-苯基-3-(4-甲氧基苯基)-13-戊基-13-甲氧基-3,13-二氢苯并[h]茚[2,1-f]吡喃的制备:
(1)qf-2的制备
10l三口烧瓶中,加入化合物qf-1(300g,0.93mo1)、甲苯(3000ml)以及700g甲磺酸,加热至110℃,反应4h,将反应液倒入5000ml水中,过滤,滤渣用1000ml水洗涤,鼓风干燥箱干燥,得土灰色固体266g,收率93.4%。直接用于下一步反应。
esi-ms:[m+h]+=307.3
核磁共振数据:1hnmr(400mhz,dmso)δ10.64(d,j=28.2hz,1h),7.88(t,j=24.2hz,1h),7.66–7.35(m,4h),7.32–7.11(m,1h),6.88(d,j=22.3hz,1h),4.19–3.99(m,3h),3.93(s,3h).
(2)qf-3的制备
向反应瓶中依次加入qf-2(260g,0.85mo1)、1-(4-甲氧基苯基)-2-丙炔-1-醇(300g,1.26mo1)、甲苯2.5l、甲磺酸30g;反应温度为90-100℃,搅拌8-10小时,结束反应,有机层干燥后减压(t<40℃)蒸除溶剂,真空干燥得紫红色固体305g,收率约68%;无需提纯直接用于下一步反应。
esi-ms:[m+h]+=527.6
核磁共振数据:1hnmr(400mhz,dmso)δ8.85(s,1h),8.43(s,1h),8.01(d,j=7.5hz,1h),7.93(s,1h),7.70(d,j=9.9hz,1h),7.64–7.45(m,5h),7.40(dd,j=14.7,8.6hz,3h),7.28(s,2h),7.11(d,j=7.6hz,1h),6.91(d,j=8.2hz,2h),6.68(d,j=9.8hz,1h),4.16–4.02(m,3h),3.98(d,j=18.8hz,3h),3.70(s,3h).
(3)qf-4的制备
在三口瓶中投入qf-3(300g,0.57mo1),加入5l四氢呋喃,冷却体系至-30℃;逐滴加入约430ml戊基锂,保持体系温度为-25℃以下,反应时间为4小时;反应完全,慢慢滴加饱和氯化铵溶液2000ml淬灭反应;分液,取有机层,无水硫酸钠干燥,旋干,得到黑色固体;真空干燥得qf-4。
(4)6,10-二甲氧基-3-苯基-3-(4-甲氧基苯基)-13-戊基-13-甲氧基-3,13-二氢苯并[h]茚[2,1-f]吡喃的制备
将干燥好的qf-4加入到乙腈4l中,搅拌,冰浴冷却<5℃,加三氟乙酸酐(320g),固体全部溶解,室温反应2h,冷却至15~30℃,加入甲醇48g和三氟化硼乙醚180g溶液,室温反应3h,反应完毕,滴加饱和碳酸氢钠淬灭,加入乙酸乙酯(8l)分液,有机层无水硫酸钠干燥,旋干,得粗品,粗品经柱层析(石油醚:乙酸乙酯=15∶1洗脱)得到类白色产品i:253g,收率:74.1%。
esi-ms:[m+h]+=599.7
核磁共振数据:1hnmr(400mhz,cdcl3)δ7.90(d,j=7.6hz,1h),7.63–7.52(m,2h),7.49(d,j=8.1hz,3h),7.43(t,j=7.6hz,4h),7.33–7.23(m,2h),6.96(d,j=8.4hz,2h),6.70(d,j=8.7hz,2h),6.15(d,j=9.8hz,1h),3.94(s,3h),3.85(s,3h),3.70(d,j=8.5hz,6h),2.30(dtd,j=32.6,12.3,4.6hz,2h),1.60(d,j=0.6hz,2h),1.13–0.86(m,4h),0.68(t,j=6.9hz,3h).
实施例2:
色烯化合物6,10-二甲氧基-3-苯基-3-(4-甲氧基苯基)-13-甲基-13-甲氧基-3,13-二氢苯并[h]茚[2,1-f]吡喃的制备:
(1)qf-2的制备
10l三口烧瓶中,加入化合物qf-1(300g,0.93mo1)、甲苯(3000ml)以及700g甲磺酸,加热至110℃,反应4h,将反应液倒入5000ml水中,过滤,滤渣用1000ml水洗涤,鼓风干燥箱干燥,得土灰色固体266g,收率93.4%。直接用于下一步反应。
esi-ms:[m+h]+=307.3
核磁共振数据:1hnmr(400mhz,dmso)δ10.64(d,j=28.2hz,1h),7.88(t,j=24.2hz,1h),7.66–7.35(m,4h),7.32–7.11(m,1h),6.88(d,j=22.3hz,1h),4.19–3.99(m,3h),3.93(s,3h).
(2)qf-3的制备
向反应瓶中依次加入qf-2(260g,0.85mo1)、1-(4-甲氧基苯基)-2-丙炔-1-醇(300g,1.26mo1)、甲苯2.5l、甲磺酸30g;反应温度为90-100℃,搅拌8-10小时,结束反应,有机层干燥后减压(t<40℃)蒸除溶剂,真空干燥得紫红色固体305g,收率约68%;无需提纯直接用于下一步反应。
esi-ms:[m+h]+=527.6
核磁共振数据:1hnmr(400mhz,dmso)δ8.85(s,1h),8.43(s,1h),8.01(d,j=7.5hz,1h),7.93(s,1h),7.70(d,j=9.9hz,1h),7.64–7.45(m,5h),7.40(dd,j=14.7,8.6hz,3h),7.28(s,2h),7.11(d,j=7.6hz,1h),6.91(d,j=8.2hz,2h),6.68(d,j=9.8hz,1h),4.16–4.02(m,3h),3.98(d,j=18.8hz,3h),3.70(s,3h).
(3)qf-c-4的制备
在三口瓶中投入qf-3(100g,0.19mo1),加入2l四氢呋喃,冷却体系至-20℃;逐滴加入约140ml甲基锂(2.5m),保持体系温度为-15℃以下,反应时间为4小时;反应完全,慢慢滴加饱和氯化铵溶液800ml淬灭反应;分液,取有机层,无水硫酸钠干燥,旋干,得到黑色固体;真空干燥得90gqf-c-4,收率约为:87.3%。
esi-ms:[m+h]+=543.6
核磁共振数据:1hnmr(400mhz,cdcl3)δ8.16(d,j=9.2hz,1h),7.79(d,j=8.5hz,1h),7.59–7.41(m,4h),7.40–7.33(m,1h),7.33–7.19(m,2h),7.25(s,1h),7.13(dd,j=2.4,1.0hz,1h),7.02(dd,j=9.2,2.0hz,1h),6.92–6.69(m,2h),6.27–6.16(m,1h),3.86(d,j=7.3hz,3h),3.82–3.75(m,3h),3.73(d,j=7.0hz,3h),1.74(d,j=5.0hz,3h).
(4)6,10-二甲氧基-3-苯基-3-(4-甲氧基苯基)-13-甲基-13-甲氧基-3,13-二氢苯并[h]茚[2,1-f]吡喃的制备
将干燥好的qf-4加入到乙腈2l中,搅拌,冰浴冷却<5℃,加三氟乙酸酐(120g),固体全部溶解,室温反应2h,冷却至15~30℃,加入甲醇18g和三氟化硼乙醚80g溶液,室温反应3h,反应完毕,滴加饱和碳酸氢钠淬灭,加入乙酸乙酯(3l)分液,有机层无水硫酸钠干燥,旋干,得粗品,粗品经柱层析(石油醚:乙酸乙酯=15∶1洗脱)得到类白色产品qf-c-5:77g,收率:83.4%。
esi-ms:[m+h]+=557.7
核磁共振数据:1hnmr(400mhz,cdcl3)δ8.17(d,j=9.2hz,1h),7.81–7.71(m,1h),7.51(d,j=2.7hz,1h),7.47(dd,j=12.6,2.6hz,1h),7.43–7.35(m,3h),7.33(d,j=2.3hz,1h),7.08–7.02(m,1h),6.85–6.70(m,5h),6.34(s,1h),6.21–6.08(m,1h),3.79(t,j=4.4hz,3h),3.78–3.75(m,3h),3.71(dd,j=8.8,6.4hz,3h),3.65(d,j=12.0hz,3h),1.68(s,3h).
实施例3:
色烯化合物的光致变色试验
将实施例1制备的色烯化合物的苯乙烯等树脂单体配成透明溶液,加上适量v65,浇注、加热固化,使之变成无色透明树脂镜片,之后,采用紫外光照射约2s之后溶液逐渐变成青色,且随着照射时间的延长吸收峰的强度也在增强,变色后的液体着色深度逐渐变深。当紫外线消失后,溶液的颜色又迅速的褪至无色,时间约90s。这说明了化合物i在紫外光的作用下发生了光致变色反应,反应式如下:
经过10000次的变色褪色循环后,其变色性能没有明显的下降。
实施例4:
耐高温试验
将10g实施例1制备的色烯化合物固体放置坩埚中,再将坩埚转移至马弗炉中,升温至350℃,并在该温度下保温1小时。将固体取出,取30mg溶于100ml苯乙烯等树脂单体配成透明溶液,加上适量v65,浇注、加热固化,使之变成无色透明树脂镜片,之后,采用紫外光照射,树脂镜片迅速变青变深,再将溶液转移至可见光条件下,约90s左右基本褪至无色。由此可知,该化合物可以耐受350℃高温。
实施例5:
色烯化合物6,10-二甲氧基-3-苯基-3-(4-甲氧基苯基)-13-乙基-13-乙氧基-3,13-二氢苯并[h]茚[2,1-f]吡喃的制备:
(1)qf-2的制备
10l三口烧瓶中,加入化合物qf-1(300g,0.93mo1)、二甲苯(3000ml)以及9.3mol三氟乙酸,加热至90℃,反应3h,将反应液倒入5000ml水中,过滤,滤渣用1000ml水洗涤,鼓风干燥箱干燥,得土灰色固体255.2g,收率89.6%。直接用于下一步反应。
esi-ms:[m+h]+=307.3
核磁共振数据:1hnmr(400mhz,dmso)δ10.64(d,j=28.2hz,1h),7.88(t,j=24.2hz,1h),7.66–7.35(m,4h),7.32–7.11(m,1h),6.88(d,j=22.3hz,1h),4.19–3.99(m,3h),3.93(s,3h).
(2)qf-3的制备
向反应瓶中依次加入qf-2(260g,0.85mo1)、1-(4-甲氧基苯基)-2-丙炔-1-醇(300g,1.26mo1)、氯仿2.5l、对甲苯磺酸0.20mol;反应温度为100℃,搅拌2小时,结束反应,有机层干燥后减压(t<40℃)蒸除溶剂,真空干燥得紫红色固体300.5g,收率约67%;无需提纯直接用于下一步反应。
esi-ms:[m+h]+=527.6
核磁共振数据:1hnmr(400mhz,dmso)δ8.85(s,1h),8.43(s,1h),8.01(d,j=7.5hz,1h),7.93(s,1h),7.70(d,j=9.9hz,1h),7.64–7.45(m,5h),7.40(dd,j=14.7,8.6hz,3h),7.28(s,2h),7.11(d,j=7.6hz,1h),6.91(d,j=8.2hz,2h),6.68(d,j=9.8hz,1h),4.16–4.02(m,3h),3.98(d,j=18.8hz,3h),3.70(s,3h).
(3)qf-4的制备
在三口瓶中投入qf-3(300g,0.57mo1),加入5l四氢呋喃,冷却体系至-30℃;逐滴加入约430ml乙基锂,保持体系温度为0℃,反应时间为6小时;反应完全,慢慢滴加饱和氯化铵溶液2000ml淬灭反应;分液,取有机层,无水硫酸钠干燥,旋干,得到黑色固体;真空干燥得qf-4。
(4)6,10-二甲氧基-3-苯基-3-(4-甲氧基苯基)-13-乙基-13-乙氧基-3,13-二氢苯并[h]茚[2,1-f]吡喃的制备
将干燥好的qf-4加入到甲基四氢呋喃4l中,搅拌,冰浴冷却<5℃,加醋酸酐(0.57mo1),固体全部溶解,室温反应2h,冷却至50℃,加入乙醇48g和三氟化硼乙醚180g溶液,室温反应1h,反应完毕,滴加饱和碳酸氢钠淬灭,加入乙酸乙酯(8l)分液,有机层无水硫酸钠干燥,旋干,得粗品,粗品经柱层析(石油醚:乙酸乙酯=15∶1洗脱)得到类白色产品i:234.9g,收率:68.8%。
esi-ms:[m+h]+=585.7
实施例6:
色烯化合物6,10-二甲氧基-3-苯基-3-(4-甲氧基苯基)-13-丁基-13-异丁氧基-3,13-二氢苯并[h]茚[2,1-f]吡喃的制备:
(1)qf-2的制备
10l三口烧瓶中,加入化合物qf-1(300g,0.93mo1)以及16.74mol硫酸,加热至30℃,反应8h,将反应液倒入5000ml水中,过滤,滤渣用1000ml水洗涤,鼓风干燥箱干燥,得土灰色固体238.4g,收率83.7%。直接用于下一步反应。
esi-ms:[m+h]+=307.3
核磁共振数据:1hnmr(400mhz,dmso)δ10.64(d,j=28.2hz,1h),7.88(t,j=24.2hz,1h),7.66–7.35(m,4h),7.32–7.11(m,1h),6.88(d,j=22.3hz,1h),4.19–3.99(m,3h),3.93(s,3h).
(2)qf-3的制备
向反应瓶中依次加入qf-2(260g,0.85mo1)、1-(4-甲氧基苯基)-2-丙炔-1-醇(0.85mo1)、苯2.5l、磷酸0.26mol;反应温度为10℃,搅拌16小时,结束反应,有机层干燥后减压(t<40℃)蒸除溶剂,真空干燥得紫红色固体291.5g,收率约65%;无需提纯直接用于下一步反应。
esi-ms:[m+h]+=527.6
核磁共振数据:1hnmr(400mhz,dmso)δ8.85(s,1h),8.43(s,1h),8.01(d,j=7.5hz,1h),7.93(s,1h),7.70(d,j=9.9hz,1h),7.64–7.45(m,5h),7.40(dd,j=14.7,8.6hz,3h),7.28(s,2h),7.11(d,j=7.6hz,1h),6.91(d,j=8.2hz,2h),6.68(d,j=9.8hz,1h),4.16–4.02(m,3h),3.98(d,j=18.8hz,3h),3.70(s,3h).
(3)qf-4的制备
在三口瓶中投入qf-3(300g,0.57mo1),加入5l乙醚,冷却体系至-30℃;逐滴加入约430ml丁基氯化镁,保持体系温度为-50℃,反应时间为1小时;反应完全,慢慢滴加饱和氯化铵溶液2000ml淬灭反应;分液,取有机层,无水硫酸钠干燥,旋干,得到黑色固体;真空干燥得qf-4。
(4)6,10-二甲氧基-3-苯基-3-(4-甲氧基苯基)-13-丁基-13-异丁氧基-3,13-二氢苯并[h]茚[2,1-f]吡喃的制备
将干燥好的qf-4加入到甲苯4l中,搅拌,冰浴冷却<5℃,加三氟乙酸酐(1.71mol),固体全部溶解,室温反应2h,冷却至-10℃,加入异丁醇48g和三氟化硼乙醚180g溶液,室温反应8h,反应完毕,滴加饱和碳酸氢钠淬灭,加入乙酸乙酯(8l)分液,有机层无水硫酸钠干燥,旋干,得粗品,粗品经柱层析(石油醚:乙酸乙酯=15∶1洗脱)得到类白色产品i:246.2g,收率:72.1%。
esi-ms:[m+h]+=641.8
实施例7:
色烯化合物6,10-二甲氧基-3-苯基-3-(4-甲氧基苯基)-13-(1-氯-2-甲基丙氧基)-13-(3-环戊基丁基)-3,13-二氢苯并[h]茚[2,1-f]吡喃的制备:
(1)qf-2的制备
10l三口烧瓶中,加入化合物qf-1(300g,0.93mo1)、甲苯(3000ml)以及5.58mol醋酸,加热至130℃,反应1h,将反应液倒入5000ml水中,过滤,滤渣用1000ml水洗涤,鼓风干燥箱干燥,得土灰色固体256.6g,收率90.1%。直接用于下一步反应。
esi-ms:[m+h]+=307.3
核磁共振数据:1hnmr(400mhz,dmso)δ10.64(d,j=28.2hz,1h),7.88(t,j=24.2hz,1h),7.66–7.35(m,4h),7.32–7.11(m,1h),6.88(d,j=22.3hz,1h),4.19–3.99(m,3h),3.93(s,3h).
(2)qf-3的制备
向反应瓶中依次加入qf-2(260g,0.85mo1)、1-(4-甲氧基苯基)-2-丙炔-1-醇(1.19mo1)、四氢呋喃2.5l、三氟乙酸0.09mol;反应温度为50℃,搅12小时,结束反应,有机层干燥后减压(t<40℃)蒸除溶剂,真空干燥得紫红色固体282.6g,收率约63%;无需提纯直接用于下一步反应。
esi-ms:[m+h]+=527.6
核磁共振数据:1hnmr(400mhz,dmso)δ8.85(s,1h),8.43(s,1h),8.01(d,j=7.5hz,1h),7.93(s,1h),7.70(d,j=9.9hz,1h),7.64–7.45(m,5h),7.40(dd,j=14.7,8.6hz,3h),7.28(s,2h),7.11(d,j=7.6hz,1h),6.91(d,j=8.2hz,2h),6.68(d,j=9.8hz,1h),4.16–4.02(m,3h),3.98(d,j=18.8hz,3h),3.70(s,3h).
(3)qf-4的制备
在三口瓶中投入qf-3(300g,0.57mo1),加入5l甲基四氢呋喃,冷却体系至-30℃;逐滴加入约430ml3-环戊基丁基溴化镁,保持体系温度为20℃,反应时间为8小时;反应完全,慢慢滴加饱和氯化铵溶液2000ml淬灭反应;分液,取有机层,无水硫酸钠干燥,旋干,得到黑色固体;真空干燥得qf-4。
(4)6,10-二甲氧基-3-苯基-3-(4-甲氧基苯基)-13-(1-氯-2-甲基丙氧基)-13-(3-环戊基丁基)-3,13-二氢苯并[h]茚[2,1-f]吡喃的制备
将干燥好的qf-4加入到乙醚4l中,搅拌,冰浴冷却<5℃,加三氟乙酸酐(320g),固体全部溶解,室温反应2h,冷却至10℃,加入1-氯-2-甲基丙醇48g和三氟化硼乙醚180g溶液,室温反应3h,反应完毕,滴加饱和碳酸氢钠淬灭,加入乙酸乙酯(8l)分液,有机层无水硫酸钠干燥,旋干,得粗品,粗品经柱层析(石油醚:乙酸乙酯=15∶1洗脱)得到类白色产品i:223g,收率:65.3%。
esi-ms:[m+h]+=744.4
上述实施例仅用以说明本发明的技术方案而并非对其进行限制,凡未脱离本发明精神和范围的任何修改或者等同替换,其均应涵盖在本发明技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!