检测栗黑水疫霉菌的LAMP引物对及其扩增方法和用途与流程
本发明涉及使用lamp技术检测植物及植物产品中栗黑水疫霉菌的方法,属于植物病原真菌检测领域。
背景技术:
栗黑水疫霉,是我国检疫部门十分重视的检疫性真菌。它除了能引起栗树黑水病,还可在许多果树上引起根、茎腐烂病。栗树黑水病的病菌通常侵染树干基部和较大的根,引起树干和根腐烂,病菌侵染初期,症状不明显;后期,树叶变小,变黄,脱落,或者不表现明显症状,而树木很快死亡。该病菌与其他根部腐烂病害典型的根部变软、水状腐烂的症状不同,感染后,主要症状为,根部腐烂使被侵染的根部变褐、变硬、变脆,危害严重。
栗黑水疫霉引起的疫病已成为多个国家水果产业面对的难题,是国内各水果进境口岸重点关注的疫情之一。
目前疫霉菌常规生物学检测方法是植物带菌检测,经过分离培养可通过肉眼直接观察菌落、孢子囊、卵孢子等形态特征来进行鉴定。病原菌菌株培养时间需达20天左右才能诱激产生孢子囊,此种情况不仅耗时费力,疫霉病原菌的形态特征、培养性状及生理特性等极为相似,很难根据菌落形态、孢子囊的形态和脱落性、有性器官的产生和形态、厚垣孢子的有无、菌丝的生长温度等特性来准确、快速有效地鉴定出栗黑水疫霉,分子生物学方法如elisa(mohan.evaluationofantiseraraisedagainstphytophthorafragariaefordetectingtheredcorediseaseofstrawberriesbyenzyme-linkedimmunosorbentassay(elisa).plantpathology1988,37:206-216)、单克隆抗体(burnsetal.theuseofmonoclonalantibodiesforthedetectionoffungi.bulletinoepp/eppobulletin.1995,25:31-38)等已有应用,但是只能检测到疫霉属的水平。目前的检测方法不能满足口岸检测“快验快放”的要求,易导致病害在我国传播。因此,加强对口岸进境植物产品携带疫霉的快速、准确的检测鉴定显得极为重要。环介导等温扩增技术(loop-mediatedisothermalamplification,lamp)是日本学者notomi等于2000年开发的一种新型恒温核酸扩增方法。该技术有灵敏度高、特异性强、方便简捷、检测周期短、仪器设备要求低等优点,大大降低了投入成本,具有较高的应用价值,目前已广泛应用于临床、食品安全、农业等领域。在植物病毒、细菌方面的应用也已相当成熟,如fukuta等应用lamp先后检测番茄黄化曲叶病毒(tylcv)和番茄斑萎病毒(tswv),okuda等建立了黄龙病的lamp检测方法等。但还没有将lamp技术应用于栗黑水疫霉检测的报道。
技术实现要素:
本发明所要解决的技术问题是:设计栗黑水疫霉的lamp引物,建立栗黑水疫霉的lamp检测方法。
为了解决该问题,本发明的解决方案是,设计栗黑水疫霉的特异lamp引物,用于栗黑水疫霉基因组dna特异性检测。栗黑水疫霉的lamp特异引物,序列如下:
pc-f3:tctgtcctaggtccaccat
pc-b3:ctacaattccgaataatcacagtgt
pc-fip:tgatggtcttgccgtccagtgacctccaggctgacgttat
pc-bip:ccagattgtgcgtgcattccgttagctccatgaagcactttgaa
反应结束后,可通过肉眼观察反应液是否为白色浑浊(白色浑浊为阳性,否则为阴性)来判断扩增结果;也可在扩增产物中加入sybrgreeni荧光染料观察颜色变化,反应液颜色由橙色变成绿色为阳性,否则颜色保持不变,或者采用琼脂糖凝胶电泳观察梯状条带的有无来判断。
一种检测栗黑水疫霉菌的lamp引物对及其扩增方法和用途,包括下述的扩增体系和扩增程序:
(1)扩增体系
建立25μl的扩增体系为,包括10×thermopolbuffer2.5μl(200mmol/ltris-hcl、100mmol/lkcl、20mmol/lmgso4、100mmol/l(nh4)2so4、1.0%tritonx-100)、2.5mmol/ldntps2.5μl、100mmol/lmgso41μl、10mmol/lpc-f30.2μl、10mmol/lpc-b30.2μl、10mmol/lpc-fip1.6μl、10mmol/lpc-bip1.6μl、8u/μlbstdnapolymerase1μl、dna模板1μl,余量为双蒸水;
(2)反应程序
63℃水浴锅中反应60min,之后在85℃下灭活5min结束反应。
一种检测栗黑水疫霉菌的lamp引物对及其扩增方法的用途。
本发明的有益效果是:建立了方法简便的栗黑水疫霉的lamp特异性引物,能将栗黑水疫霉与其它疫霉区别开来。简化和方便了对该疫霉的检测,节约了检测时间,该方法快速、可靠,可有效在口岸检测中推广应用。
附图说明
图一是栗黑水疫霉的lamp特异引物的扩增。
具体实施方式
本发明的栗黑水疫霉lamp特异性引物,实现了栗黑水疫霉的快速检测。
设计栗黑水疫霉的特异lamp引物,序列如下:
pc-f3:tctgtcctaggtccaccat
pc-b3:ctacaattccgaataatcacagtgt
pc-fip:tgatggtcttgccgtccagtgacctccaggctgacgttat
pc-bip:ccagattgtgcgtgcattccgttagctccatgaagcactttgaa
反应结束后,可通过肉眼观察反应液是否为白色浑浊(白色浑浊为阳性,否则为阴性)来判断扩增结果;也可在扩增产物中加入sybrgreeni荧光染料观察颜色变化,反应液颜色由橙色变成绿色为阳性,否则颜色保持不变,用于栗黑水疫霉基因组dna特异性检测。
本发明建立一种检测栗黑水疫霉菌的lamp引物对及其扩增方法,包括扩增体系的建立和扩增程序设立:
(1)扩增体系
建立25μl的扩增体系为,总体积为25μl,包括10×thermopolbuffer2.5μl(200mmol/ltris-hcl、100mmol/lkcl、20mmol/lmgso4、100mmol/l(nh4)2so4、1.0%tritonx-100)、2.5mmol/ldntps2.5μl、100mmol/lmgso41μl、10mmol/lpc-f30.2μl、10mmol/lpc-b30.2μl、10mmol/lpc-fip1.6μl、10mmol/lpc-bip1.6μl、8u/μlbstdnapolymerase1μl、dna模板1μl,余量为双蒸水;
(2)反应程序
63℃水浴锅中反应60min,之后在85℃下灭活5min结束反应。
本发明设计合成栗黑水疫霉的lamp特异性引物,对所有实验材料菌丝dna进行质量检测,避免假阴性。
所述检测栗黑水疫霉菌的lamp引物对及其扩增方法的应用。
本发明建立了简便快速、特异性强、灵敏度高、准确可靠的栗黑水疫霉菌lamp检测方法,能将栗黑水疫霉与其他疫霉区别开来。该方法的建立为栗黑水疫霉的快速检测提供了特异可行的方法,节约了世界和时间,检测快速、可靠,整个过程在一个工作日内完成,可有效在口岸检测中推广应用。
下面结合附图与具体实施方式对本发明作进一步详细说明:
实施例1:实验材料菌丝的培养
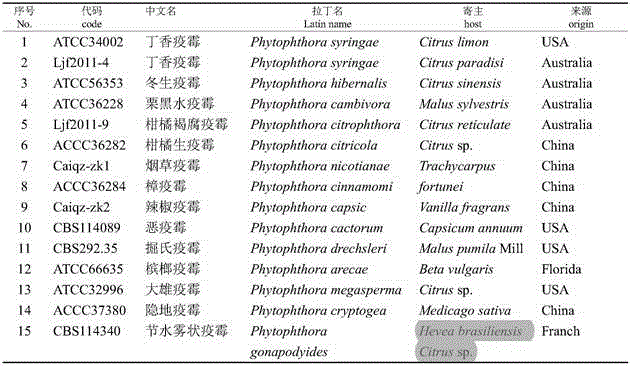
本实验疫霉属真菌菌株源于天津出入境检验检疫局动植食中心植检实验室。共计15种,相关信息见表2。
实施例2:菌丝基因组dna的提取
将菌丝挑于1.5ml离心管,液氮研磨,再按照qiagen公司生产的dna提取试剂盒提取dna,并将dna溶于100μl1×te缓冲液中,置于-20℃保存。
pcr扩增相关试剂为大连宝生物(takara)工程公司产品。
3.1反应混合液的配置
建立25μl的扩增体系为,包括10×thermopolbuffer2.5μl(200mmol/ltris-hcl、100mmol/lkcl、20mmol/lmgso4、100mmol/l(nh4)2so4、1.0%tritonx-100)、2.5mmol/ldntps2.5μl、100mmol/lmgso41μl、10mmol/lpc-f30.2μl、10mmol/lpc-b30.2μl、10mmol/lpc-fip1.6μl、10mmol/lpc-bip1.6μl、8u/μlbstdnapolymerase1μl、dna模板1μl,余量为双蒸水。以栗黑水疫霉的菌丝为阳性对照,无菌水为阴性对照;
3.2pcr反应程序
63℃水浴锅中反应60min,之后在85℃下灭活5min结束反应。2%琼脂糖凝胶电泳,eb染色及成像观察梯状目的条带,并在离心管中,加入1000×sybrgreeni显色液,观察结果。
3.3结果分析
实验结果表明,lamp产物采用瞬间离心观察焦磷酸镁白色沉淀和添加sybrgreeni荧光染料显色,判定结果均与电泳鉴定一致。
以上所述的实施例仅用于说明本发明的技术思想及特点,其目的在于使本领域内的技术人员能够理解本发明的内容并据以实施,不能仅以本实施例来限定本发明的专利范围,即凡本发明所揭示的精神所做的同等变化和修饰,仍落在本发明的专利范围内。
序列表
<110>天津出入境检验检疫局动植物与食品检测中心
<120>检测栗黑水疫霉菌的lamp引物对及其扩增方法和用途
<141>2018-08-07
<160>4
<170>siposequencelisting1.0
<210>1
<211>19
<212>dna
<213>栗疫霉黑水病菌(p.cambivora(petri)buisman)
<400>1
tctgtcctaggtccaccat19
<210>2
<211>25
<212>dna
<213>栗疫霉黑水病菌(p.cambivora(petri)buisman)
<400>2
ctacaattccgaataatcacagtgt25
<210>3
<211>39
<212>dna
<213>栗疫霉黑水病菌(p.cambivora(petri)buisman)
<400>3
tgaggtcttgccgtccagtgacctccaggctgacgttat39
<210>4
<211>44
<212>dna
<213>栗疫霉黑水病菌(p.cambivora(petri)buisman)
<400>4
ccagattgtgcgtgcattccgttagctccatgaagcactttgaa44
- 还没有人留言评论。精彩留言会获得点赞!