一种掌叶覆盆子多糖及其制备方法和在制备肝脏细胞脂毒性损伤抑制剂中的应用与流程
本发明涉及植物多糖的
技术领域:
,具体涉及一种掌叶覆盆子多糖及其制备方法和在制备肝脏细胞脂毒性损伤抑制剂中的应用。
背景技术:
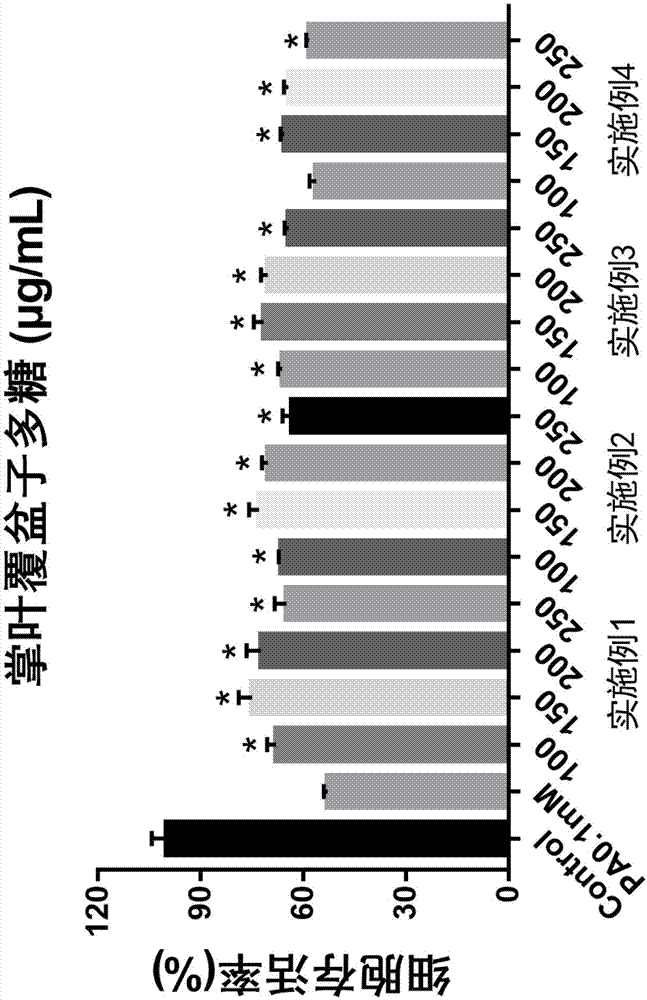
:掌叶覆盆子(拉丁名:rubuschingiihu),又称华东覆盆子、大号角公、牛奶母等,蔷薇科悬钩子属植物,分布于江苏、安徽、浙江、江西、福建,等地。未成熟果实可入药,《中国药典》记载其性微温,味甘、酸,入肝肾经,具补肝肾、缩小便、助阳固精,明目之功效,主治阳痿、遗精、虚劳、目暗等症。成熟果实口感细腻,酸甜可口,营养丰富,其富含氨基酸、维生素c、维生素e和维生素b3等成分,具有较高的营养价值和医疗保健作用。现代研究表明,其主要成分有萜类、黄酮等,药理作用主要有抗诱变作用,改善学习记忆能力、延缓衰老,还能增强免疫,对性腺轴有调控作用等(苗菊茹,谢一辉,刘红宁.覆盆子的研究进展[j].江西中医药,2004,35(1):54-55.)。此外,刘明学等(刘明学,牛靖娥,苏忠伟,等.覆盆子多糖提取,结构分析及自由基清除作用研究[j].食品科技,2009(7):163-167.)采用体外评价体系发现,覆盆子多糖对氧自由基具有较强清除能力,然而在细胞和体内水平未有相关研究;其在纯化多糖过程中,采用naoh和ctab溶液等方法沉淀多糖,步骤复杂;同时因采用碱法提纯,易破坏多糖的结构,多糖损失较大。多糖(polysaccharide)是由多个单糖分子缩合、失水而形成的由糖苷键结合的糖链,是一类分子结构复杂且庞大的高分子碳水化合物。多糖组成与结构十分复杂,不是一种纯粹的化学物质,而是聚合程度不同的物质的混合物。多糖是一类具有广泛生物活性的生物大分子,具有多种药理活性,如抗氧化、降血糖、降血脂、抗肿瘤以及增强免疫力等,具有较高的开发价值。如李桂兰(李桂兰.覆盆子多糖的提取及其产品开发[d].南昌大学,2014.)建立了内部沸腾法提取覆盆子多糖的工艺,发现提取温度80℃、液料比10:1、提取时间10min时覆盆子多糖得率最高。公开号为cn107266603a的中国专利文献中公开了一种具有清除自由基功能的覆盆子多糖类成分提取方法,其通过聚酰胺柱和deae—纤维素阴离子柱纯化多糖,然而通过柱纯化的步骤繁杂,且原材料价格昂贵。徐丽萍等(徐丽萍,吴媛媛,王鑫,等.响应曲面法优化红树莓多糖提取工艺[j].中国食品添加剂,2017(9):182-187.)采用响应面法研究料液比、提取温度、提取时间对红树莓(悬钩子属)多糖提取得率的影响,此方法获得的红树莓多糖是混合物,含有多酚、蛋白等杂质。目前,尚未发现高纯度掌叶覆盆子多糖的快速提取方法。肝脏是人体生物代谢和解毒的重要器官,饱和脂肪酸含量过高会引起肝脏损伤。棕榈酸(palmiticacid,pa)是人体血液中含量最多的一种游离脂肪酸,同时也是游离脂肪酸中最主要的饱和脂肪酸。棕榈酸广泛用于脂毒性和代谢综合征等体外研究。因此,抑制棕榈酸对肝脏脂毒性损伤的物质具有很大的研究意义。技术实现要素:基于上述技术问题,本发明通过超声辅助水提与醇沉工艺制备得到一种组成特殊、高纯度的掌叶覆盆子多糖,该掌叶覆盆子多糖可显著提升棕榈酸诱导损伤的肝脏细胞的存活率、显著降低棕榈酸诱导产生的细胞ros水平、有效缓解棕榈酸诱导产生的细胞线粒体膜电位水平降低、有效减少棕榈酸诱导产生的细胞gsh消耗并有效恢复棕榈酸诱导产生的细胞核损伤,因此,可用于制备肝脏细胞脂毒性损伤抑制剂。具体技术方案如下:一种掌叶覆盆子多糖,以摩尔百分比计,所述掌叶覆盆子多糖包括以下单糖:多糖是由单糖以一定的连接方式组成的重复结构单元,单糖以一定的糖苷键连接,不同糖苷键的连接的单糖称为多糖的结构单位。以摩尔比计,所述掌叶覆盆子多糖包括以下结构单位:优选地,所述掌叶覆盆子多糖的重均分子量为758.03~837.82kda。本发明还公开了所述的掌叶覆盆子多糖的制备方法,包括如下提取步骤:(1)掌叶覆盆子经粉碎、除杂后得到原料粉末;(2)所述原料粉末经超声辅助水提后,再经醇沉后收集沉淀物,记为粗提物;(3)将所述粗提物溶于水中,除去蛋白类杂质,收集的水相经透析袋过滤截留,滤出液再经真空冷冻干燥,得到所述的掌叶覆盆子多糖。本发明采用超声辅助水提与醇沉工艺,通过对工艺参数的精确调控实现对掌叶覆盆子多糖中各单糖以及各结构单位的含量的有效调控。步骤(1)中,所述掌叶覆盆子冻干后,经超微粉碎机粉碎,过40目筛,再使用无水乙醇抽提掌叶覆盆子中的脂溶性杂质,收集沉淀,即为原料粉末。步骤(2)中,所述超声辅助水提,超声功率为150~250w,提取温度为70~95℃,时间为2~4h,重复次数为3~6次。所述醇沉,加入体积浓度为70~95%的乙醇,如无特殊说明,本发明中一定浓度的乙醇均为乙醇-水溶液。醇沉次数为3~5次,因掌叶覆盆子中含有大量的脂溶性杂质,在提取多糖的过程中可通过此步骤除去。步骤(3)中:采用sevag法除去蛋白类杂质,重复次数为6~9次,可有效除去掌叶覆盆子多糖中的蛋白类杂质。透析袋截留可以将掌叶覆盆子多糖中的小分子杂质除去,获得高纯度掌叶覆盆子多糖;优选地,所述透析袋过滤截留分子量大于3.5kda的成分。进一步优选:所述超声辅助水提的提取温度为80~95℃,所述醇沉采用体积浓度为70~90%的乙醇。经试验发现,采用上述进一步优选的工艺条件提取得到的掌叶覆盆子多糖,以摩尔百分比计,包括以下单糖:以摩尔比计,所述掌叶覆盆子多糖包括以下结构单位:针对上述特殊工艺提取得到的掌叶覆盆子多糖进行了一系列的活性试验发现:提取得到的掌叶覆盆子多糖对棕榈酸诱导的肝脏细胞脂毒性损伤具有保护作用,体现在:1、可显著提升棕榈酸诱导损伤的肝脏细胞的存活率;2、显著降低棕榈酸诱导产生的细胞ros水平;3、有效降低棕榈酸诱导产生的细胞超氧化物阴离子水平;4、有效缓解棕榈酸诱导产生的细胞线粒体膜电位水平降低;5、有效减少棕榈酸诱导产生的细胞gsh消耗;6、有效恢复棕榈酸诱导产生的细胞核损伤。因此,本发明还公开了该掌叶覆盆子多糖在制备肝脏细胞脂毒性损伤抑制剂中的应用。具体为,经棕榈酸诱导的肝脏细胞脂毒性损伤。优选地,所述抑制剂中,掌叶覆盆子多糖的有效剂量为150μg/ml。进一步优选,以摩尔百分比计,所述掌叶覆盆子多糖包括以下单糖:以摩尔比计,所述掌叶覆盆子多糖包括以下结构单位:经活性试验发现,上述组成的掌叶覆盆子多糖在在针对由棕榈酸诱导产生的肝脏细胞脂毒性损伤中具有更显著的抑制作用。与现有技术相比,本发明具有如下优点:1、本发明采用超声辅助水提与醇沉工艺,通过对工艺参数的精确调控获得具有特定成分组成,分子量及糖苷键的掌叶覆盆子多糖。2、本发明首次发现了掌叶覆盆子多糖能够有效抑制棕榈酸诱导的脂毒性损伤,为掌叶覆盆子多糖提供了新的医疗用途,拓展了一个新的应用领域。附图说明图1为实施例1~4分别制备的掌叶覆盆子多糖对棕榈酸诱导的肝脏细胞lo2氧化损伤的保护作用;图2为实施例1~4分别制备的掌叶覆盆子多糖对棕榈酸诱导的肝脏细胞lo2活性氧自由基ros爆发的抑制作用;图3为实施例1~4分别制备的掌叶覆盆子多糖对棕榈酸诱导的肝脏细胞lo2超氧化物阴离子的抑制作用;图4为实施例1~4分别制备的掌叶覆盆子多糖对棕榈酸诱导的肝脏细胞lo2线粒体膜电位水平降低的缓解作用;图5为实施例1~4分别制备的掌叶覆盆子多糖对棕榈酸诱导的肝脏细胞lo2gsh消耗的缓解作用;图6为实施例1制备的莲掌叶覆盆子多糖对棕榈酸诱导的肝脏细胞lo2核损伤的抑制作用。具体实施方式下面结合附图及实施例对本发明作进一步详细描述,需要指出的是,以下实施例旨在便于对本发明的理解,而对其不起任何限定作用。实施例1掌叶覆盆子冻干后,经超微粉碎机粉碎,过40目筛,使用无水乙醇抽提掌叶覆盆子中的脂溶性物质,重复3次,收集沉淀;沉淀物进一步采用超声辅助热水提取,超声功率250w,提取温度为90℃,提取时间为2h,重复4次;提取液中加入乙醇,使体系中乙醇体积浓度为70%,收集沉淀。将沉淀溶于水中,采用sevag法除蛋白类杂质,重复7次,收集水相溶液。溶液经透析袋过滤截留分子量大于3.5kda的组分,滤出液再经真空冷冻干燥,得到掌叶覆盆子多糖。本实施例制备的掌叶覆盆子多糖,重量平均分子量为758.03kda。经液相色谱测试可知,该掌叶覆盆子多糖的主要成分如下表1所示:表1成分摩尔百分比半乳糖醛酸45.20%阿拉伯糖32.65%半乳糖8.53%葡萄糖7.63%甘露糖1.19%鼠李糖3.37%葡糖醛酸1.05%岩藻糖0.38%经甲基化实验测定,以摩尔比计,本实施例制备的掌叶覆盆子多糖由表2中的特定结构单位组成:表2实施例2掌叶覆盆子冻干后,经超微粉碎机粉碎,过40目筛,使用无水乙醇抽提掌叶覆盆子中的脂溶性物质,重复4次,收集沉淀;沉淀物进一步采用超声辅助热水提取,超声功率200w,提取温度为80℃,提取时间为3h,重复6次;提取液中加入乙醇,使体系中乙醇体积浓度为80%,收集沉淀。将沉淀溶于水中,采用sevag法除蛋白类杂质,重复9次,收集水相溶液。溶液经透析袋过滤截留分子量大于3.5kda的组分,滤出液再经真空冷冻干燥,得到掌叶覆盆子多糖。本实施例制备的掌叶覆盆子多糖,重量平均分子量为837.82kda。经液相色谱测试可知,该掌叶覆盆子多糖的主要成分如下表3所示:表3成分摩尔百分比半乳糖醛酸44.21%阿拉伯糖32.17%半乳糖9.57%葡萄糖7.54%甘露糖1.26%鼠李糖3.54%葡糖醛酸1.13%岩藻糖0.58%经甲基化实验测定,以摩尔比计,本实施例的掌叶覆盆子多糖由以下特定结构单位组成:表4成分摩尔比1,3-阿拉伯糖2.691,6-半乳糖2.24t-半乳糖醛酸1.861,6-葡萄糖1.251,4-半乳糖醛酸1.171,4,6-半乳糖1.211,4-鼠李糖1.001,2-阿拉伯糖0.801,4-阿拉伯糖0.67t-阿拉伯糖0.36t-葡萄糖醛酸0.301,3-岩藻糖0.291,3-甘露糖0.281,4-葡萄糖醛酸0.24实施例3掌叶覆盆子冻干后,经超微粉碎机粉碎,过40目筛,使用无水乙醇抽提掌叶覆盆子中的脂溶性物质,重复5次,收集沉淀;沉淀物进一步采用超声辅助热水提取,超声功率150w,提取温度为95℃,提取时间为2h,重复3次;提取液中加入乙醇,使体系中乙醇体积浓度为90%,收集沉淀。将沉淀溶于水中,采用sevag法除蛋白类杂质,重复6次,收集水相溶液。溶液经透析袋过滤截留分子量大于3.5kda的组分,滤出液再经真空冷冻干燥,得到掌叶覆盆子多糖。本实施例制备的掌叶覆盆子多糖,重量平均分子量为823.68kda。经液相色谱测试可知,该掌叶覆盆子多糖的主要成分如下表5所示:表5成分摩尔百分比半乳糖醛酸44.44%阿拉伯糖31.71%半乳糖9.15%葡萄糖6.95%甘露糖1.29%鼠李糖4.89%葡糖醛酸1.09%岩藻糖0.48%经甲基化实验测定,以摩尔比计,本实施例的掌叶覆盆子多糖由以下特定结构单位组成:表6成分摩尔比1,3-阿拉伯糖2.491,6-半乳糖2.22t-半乳糖醛酸2.011,6-葡萄糖1.171,4-半乳糖醛酸1.261,4,6-半乳糖1.031,4-鼠李糖0.751,2-阿拉伯糖0.791,4-阿拉伯糖0.58t-阿拉伯糖0.46t-葡萄糖醛酸0.301,3-岩藻糖0.291,3-甘露糖0.181,4-葡萄糖醛酸0.24实施例4掌叶覆盆子冻干后,经超微粉碎机粉碎,过40目筛,使用无水乙醇抽提掌叶覆盆子中的脂溶性物质,重复5次,收集沉淀;沉淀物进一步采用超声辅助热水提取,超声功率220w,提取温度为70℃,提取时间为4h,重复6次;提取液中加入乙醇,使体系中乙醇体积浓度为95%,收集沉淀。将沉淀溶于水中,采用sevag法除蛋白类杂质,重复8次,收集水相溶液。溶液经透析袋过滤截留分子量大于3.5kda的组分,滤出液再经真空冷冻干燥,得到掌叶覆盆子多糖。本实施例制备的掌叶覆盆子多糖,重量平均分子量为787.66kda。经液相色谱测试可知,该掌叶覆盆子多糖的主要成分如下表7所示:表7成分摩尔百分比半乳糖醛酸43.62%阿拉伯糖30.97%半乳糖8.84%葡萄糖9.55%甘露糖1.29%鼠李糖3.99%葡糖醛酸1.11%岩藻糖0.63%经甲基化实验测定,以摩尔比计,本实施例的掌叶覆盆子多糖由以下特定结构单位组成:表8性能测试:研究掌叶覆盆子多糖对棕榈酸诱导的肝脏细胞脂毒性损伤的保护作用,以实施例1~4分别制备的掌叶覆盆子多糖进行测试(1)细胞存活率测定(mtt法)按照参考文献的方法,采用mtt法检测细胞的存活率。将对数期的lo2细胞接种到96孔细胞培养板中(浓度为4.5×103个细胞/孔),孵育24h后;在含有掌叶覆盆子多糖的条件下,用棕榈酸(pa0.1mm)处理lo2细胞24h,然后用mtt(0.5mg/ml)孵育4h。生成的沉淀物溶解于200μl的dmso中,用酶标仪检测费490nm处的吸光度。细胞存活率(%)=[a样品/a空白]×100%;如图1显示,lo2细胞经0.1mmpa损伤24h后,细胞密度明显降低,与正常组相比,细胞存活率为52.96%,具有统计学意义(p<0.05)。掌叶覆盆子多糖在0.1mmpa浓度作用下时,对lo2细胞有较好的保护作用,与对照组相比,具有显著性差异,150μg/ml掌叶覆盆子多糖(实施例1)作用下,细胞存活率达75.00%(p<0.05),且实施例1~3的作用效果明显优于实施例4。上述结果证实了掌叶覆盆子多糖具有干预棕榈酸诱导的细胞脂毒性损伤的保护作用。(2)细胞内ros水平检测收集对数期的lo2细胞,将细胞接种到24孔细胞培养板中(浓度为3.5×104个细胞/孔),孵育24h后;在含有掌叶覆盆子多糖的条件下,用棕榈酸(pa0.1mm)处理lo2细胞24h,然后用dcfh-da染色,37℃孵育30min,将染料洗净后用荧光显微镜观察并拍照,然后分析其荧光强度。如图2显示,与未处理的对照组(control)相比,经0.1mmpa作用肝细胞lo224h,荧光强度明显增强(荧光强度137.72%)。掌叶覆盆子多糖能显著降低棕榈酸诱导产生的ros荧光强度,且具有统计学意义,150μg/ml掌叶覆盆子多糖(实施例1)效果最佳(荧光强度102.8%),且实施例1~3的作用效果明显优于实施例4。上述结果表明掌叶覆盆子多糖能有效降低pa诱导产生的细胞ros水平。(3)细胞内超氧化物阴离子水平检测收集对数期的lo2细胞,将细胞接种到24孔细胞培养板中(浓度为3.5×104个细胞/孔),孵育24h后;在含有掌叶覆盆子多糖的条件下,用棕榈酸(pa0.1mm)处理lo2细胞24h,然后用dhe染色,37℃孵育30min,将染料洗净后用荧光显微镜观察并拍照,然后分析其荧光强度。如图3显示,与未处理的对照组(control)相比,经0.1mmpa作用肝细胞lo224h,荧光强度明显增强(荧光强度151.30%)。掌叶覆盆子多糖能显著降低棕榈酸诱导产生的ros荧光强度,且具有统计学意义,150μg/ml掌叶覆盆子多糖(实施例2)效果最佳(荧光强度99.12%),且实施例1~3的作用效果明显优于实施例4。上述结果表明掌叶覆盆子多糖能有效降低pa诱导产生的细胞超氧化物阴离子水平。(4)细胞内线粒体膜电位水平检测收集对数期的lo2细胞,将细胞接种到24孔细胞培养板中(浓度为3.5×104个细胞/孔),孵育24h后;在含有掌叶覆盆子多糖的条件下,用棕榈酸(pa0.1mm)处理lo2细胞24h,然后用rh123染色,37℃孵育30min,将染料洗净后用荧光显微镜观察并拍照,然后分析其荧光强度。如图4显示,与未处理的对照组(control)相比,经0.1mmpa作用肝细胞lo224h,荧光强度明显降低(荧光强度83.65%)。掌叶覆盆子多糖能显著缓解棕榈酸诱导产生的线粒体膜电位荧光强度降低,且具有统计学意义,150μg/ml掌叶覆盆子多糖(实施例1)效果最佳(荧光强度101.90%)。上述结果表明掌叶覆盆子多糖能有效缓解pa诱导产生的细胞线粒体膜电位水平降低。(5)细胞内gsh水平检测收集对数期的lo2细胞,将细胞接种到24孔细胞培养板中(浓度为3.5×104个细胞/孔),孵育24h后;在含有掌叶覆盆子多糖的条件下,用棕榈酸(pa0.1mm)处理lo2细胞24h,然后用nda染色,37℃孵育30min,将染料洗净后用荧光显微镜观察并拍照,然后分析其荧光强度。如图5显示,与未处理的对照组(control)相比,经0.1mmpa作用肝细胞lo224h,荧光强度明显增强(荧光强度50.00%)。掌叶覆盆子多糖能显著缓解棕榈酸诱导产生的gsh荧光强度降低,且具有统计学意义,150μg/ml掌叶覆盆子多糖(实施例1)效果最佳(荧光强度74.85%),且实施例1~3的作用效果明显优于实施例4。上述结果表明掌叶覆盆子多糖能有效减少pa诱导产生的细胞gsh消耗。(6)细胞核损伤hochest水平检测收集对数期的lo2细胞,将细胞接种到24孔细胞培养板中(浓度为4.0×104个细胞/孔),孵育24h后;在含有掌叶覆盆子多糖的条件下,用棕榈酸(pa0.1mm)处理lo2细胞24h,pbs洗净后用荧光探针染色,37℃孵育10-15min,将染料洗净后用荧光显微镜观察并拍照,然后分析图片。如图6显示,正常lo2细胞(control)细胞核体积较大,染色质是均一的,经棕榈酸(pa0.1mm)作用lo2细胞,部分细胞的染色质明显发生了浓缩,并出现凋亡小体,而加入150μg/ml掌叶覆盆子多糖(实施例1)预处理24h后,染色质稍有舒展,细胞核形态有所恢复。上述结果表明掌叶覆盆子多糖能有效恢复pa诱导产生的细胞核损伤。最后,本发明可用其他的不违背本发明的精神和主要特征的具体形式来概述。因此,无论从那一点来看,本发明的上述实施方案都只能认为是对本发明的说明而不能限制本发明,权利要求书指出了本发明的范围,而上述的说明并未指出本发明的范围,因此,在与本发明的权利要求书相当的含义和范围内的任何改变,都应认为是包括在权利要求书的范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1