ALDH18A1在结直肠癌的治疗和诊断中的应用的制作方法
本发明属于疾病诊断和治疗领域,具体涉及aldh18a1在结直肠癌的治疗和诊断中的应用。
背景技术:
结直肠癌是最常见的恶性肿瘤之一,全球每年初诊患者超过120万。根据美国癌症协会(americancancersociety,acs)资料,2018年新发病例约14万,占所有癌症病例的8.1%,死亡人数约5万,占癌症死亡人数的8.3%。目前,结直肠癌患者5年总体生存率为64.5%,约25%的患者在就诊时已出现转移,而发生转移的患者5年总体生存率仅为14%。传统的外科手术治疗以及辅助化疗,依然是结直肠癌患者的主要治疗方式。因此,寻找新的治疗靶点和策略,具有重要的临床意义。
肿瘤细胞通过改变自身代谢状态以适应细胞外微环境。同时,代谢异常又可调控众多基因表达,从而改变肿瘤细胞表型。其中,乙醛脱氢酶家族18成员a1(aldehydedehydrogenasefamily18membera1,aldh18a1),又称为吡咯啉-5-羧酸合成酶(pyrroline-5-carboxylatesynthetase,p5cs),在脯氨酸、鸟氨酸及谷氨酸代谢中发挥重要作用。研究表明,aldh18a1通过蛋白质合成代谢的调控,进而促进黑色素瘤细胞增殖,提示aldh18a1可能发挥促癌作用。然而,aldh18a1在结直肠癌患者中的临床病理学意义,目前尚不清楚。本研究利用tcga和geo数据库的基因表达信息以及结直肠癌组织芯片的免疫组化分析,探讨aldh18a1与结直肠癌临床病理参数和生存预后的关系,观察敲低aldh18a1对结直肠癌细胞增殖活性的影响以及与myc基因表达的关系,并进一步通过基因集富集分析(genesetenrichmentanalysis,gsea)评价aldh18a1与myc靶基因活化的关系,旨在为探索新的结直肠癌治疗靶点和策略提供实验依据。
技术实现要素:
有鉴于此,本发明的目的之一在于提供aldh18a1mrna或aldh18a1蛋白在作为治疗和诊断结直肠癌的标志物中的应用;本发明的目的之二在于提供检测aldh18a1mrna或aldh18a1蛋白的试剂在制备治疗和诊断结直肠癌的试剂盒中的应用;本发明的目的之三在于提供aldh18a1mrna的捕获剂或aldh18a1蛋白的捕获剂在制备治疗和诊断结直肠癌的试剂或试剂盒中的应用;本发明的目的之四在于提供下调aldh18a1表达的试剂和抑制aldh18a1活性的试剂在制备治疗结直肠癌的药物中的应用;本发明的目的之五在于提供下调aldh18a1表达的试剂和抑制aldh18a1活性的试剂在制备抑制结直肠癌细胞增殖活性的药物中的应用;本发明的目的之六在于提供下调aldh18a1表达的试剂和抑制aldh18a1活性的试剂在制备抑制myc基因表达的药物中的应用。
为实现上述发明目的,本发明提供如下技术方案:
1、aldh18a1mrna或aldh18a1蛋白在作为治疗和诊断结直肠癌的标志物中的应用。
2、检测aldh18a1mrna或aldh18a1蛋白的试剂在制备治疗和诊断结直肠癌的试剂盒中的应用。
3、aldh18a1mrna的捕获剂或aldh18a1蛋白的捕获剂在制备治疗和诊断结直肠癌的试剂或试剂盒中的应用。
优选的,所述aldh18a1mrna的捕获剂为特异识别aldh18a1mrna的引物或探针。
优选的,所述引物的核苷酸序列为seqidno.5和seqidno.6所示。
优选的,所述aldh18a1蛋白的捕获剂为抗aldh18a1蛋白的抗体。
优选的,所述抗aldh18a1蛋白的抗体为aldh18a1兔抗人多克隆抗体。
4、下调aldh18a1表达的试剂或抑制aldh18a1活性的试剂在制备治疗结直肠癌的药物中的应用。
优选的,所述下调aldh18a1表达的试剂或抑制aldh18a1活性的试剂为aldh18a1shrna或aldh18a1sirna。
优选的,所述aldh18a1shrna的序列由如seqidno.1和seqidno.2杂交形成;所述aldh18a1sirna如seqidno.9、seqidno.10或seqidno.11所示。
6、下调aldh18a1表达的试剂或抑制aldh18a1活性的试剂在制备抑制结直肠癌细胞增殖活性的药物中的应用。
7、下调aldh18a1表达的试剂或抑制aldh18a1活性的试剂在制备抑制myc基因表达的药物中的应用。
本发明的有益效果在于:本发明公开了aldh18a1在结直肠癌的治疗和诊断中的应用,通过数据库比较aldh18a1在人结直肠癌和正常结肠组织的表达,列联表分析aldh18a1与临床病理参数的相关性,kaplan-meier及cox回归分析aldh18a1的预后判断意义;mts检测下调aldh18a1表达对结直肠癌细胞增殖的影响;分析aldh18a1与myc基因表达之间的相关性;real-timepcr和westernblot检测敲低aldh18a1后myc基因的表达,gsea分析aldh18a1与myc下游靶基因活化的关系。结果发现aldh18a1在结直肠癌组织高表达,与其临床病理参数及预后相关;下调aldh18a1表达抑制结直肠癌细胞增殖;aldh18a1与myc表达正相关;下调aldh18a1抑制myc基因表达;aldh18a1高表达患者中,c-myc靶基因显著富集。因此aldh18a1可作为结直肠癌患者的预后判断因子,并可能通过下调myc基因表达而抑制结肠癌细胞的增殖,用于结直肠癌的治疗。
附图说明
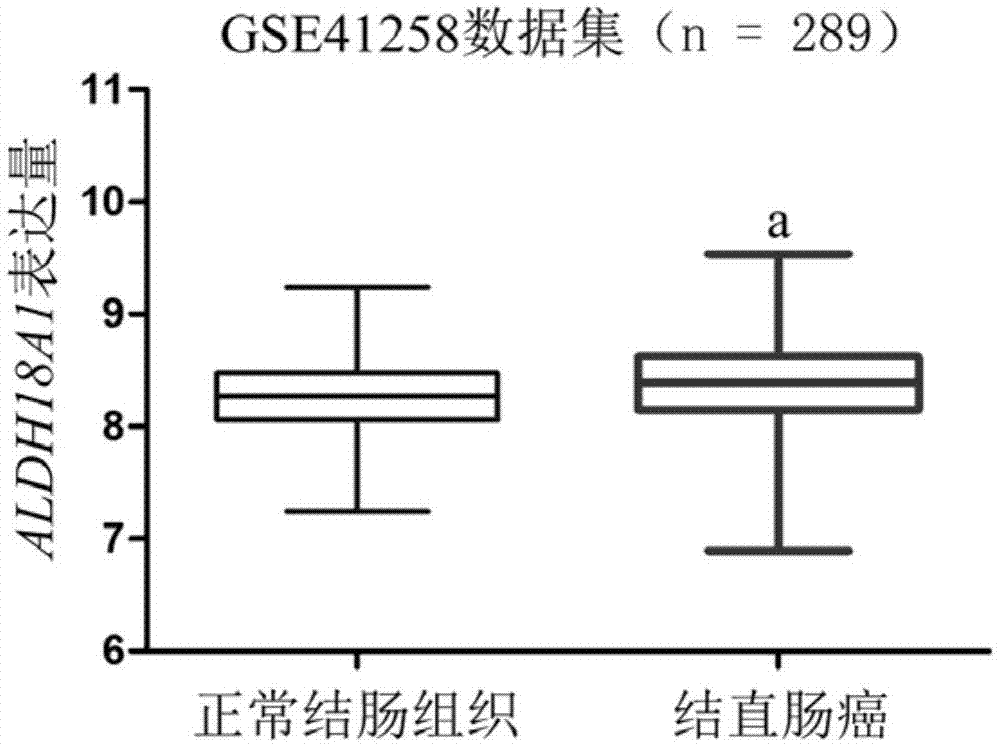
图1为正常结肠组织和结直肠癌患者的aldh18a1mrna表达水平(a:p<0.01,与正常结肠组织比较)。
图2为免疫组化检测aldh18a1在不同原发肿瘤大小/蔓延范围结直肠癌组织的表达(a:免疫组化检测结果,代表性图片;b:aldh18a1定量分析结果(独立样本t检验,p=0.0076)a:p<0.01,与t1+t2比较)。
图3为免疫组化检测aldh18a1在不同淋巴结转移状态结直肠癌组织的表达(a:免疫组化检测结果,代表性图片;b:aldh18a1定量分析结果(独立样本t检验,p=0.0297)a:p<0.05,与n0比较)。
图4为免疫组化检测aldh18a1在不同ajcc临床分期结直肠癌组织的表达(a:免疫组化检测结果,代表性图片;b:aldh18a1定量分析结果(独立样本t检验,p=0.0297)a:p<0.05,与i+ii比较)。
图5为aldh18a1高/低表达患者之间的预后差异(a:基于tcga结直肠癌数据库aldh18a1表达水平差异的kaplan-meier生存曲线;b:基于结直肠癌组织芯片aldh18a1表达差异的kaplan-meier生存曲线)。
图6为下调aldh18a1表达后结直肠癌细胞增殖活性的变化(a:ht29:对照组和aldh18a1敲低组,独立样本t检验,n=6,p=9.4306×10-12;b:hct116:对照组和aldh18a1敲低组,独立样本t检验,n=6,p=3.0567×10-14;a:p<0.01,与ht29对照组比较;b:p<0.01,与hct116对照组比较)。
图7为aldh18a1和myc在mrna水平的相关性(a:gse41258数据集结直肠癌患者aldh18a1与myc表达之间的相关性;b:myc高/低表达组的表达谱差异分析)。
图8为免疫组化分析aldh18a1和c-myc蛋白之间的相关性(a:结直肠癌组织芯片中aldh18a1与c-myc表达之间的相关性;b:免疫组化检测结直肠癌患者aldh18a1和c-myc的表达,代表性图片)。
图9为基于aldh18a1表达水平差异的gsea分析(a:正常结肠上皮细胞和结直肠癌细胞的aldh18a1、c-myc在蛋白水平的表达情况;b:下调aldh18a1表达后mycmrna的变化a:p<0.01,与sictr组比较;c:下调aldh18a1表达后c-myc蛋白的变化)。
图10为基于aldh18a1表达水平差异的gsea分析(a:hallmark_myc_targets_v1;b:hallmark_myc_targets_v2;c:dang_regulated_by_myc_up;d:dang_myc_targets_up)。
具体实施方式
下面将对本发明的优选实施例进行详细的描述。
实施例1、aldh18a1在结直肠癌中高表达并具有预后判断价值
(1)aldh18a1在结直肠癌组织中高表达
登录xenapublicdatahubs(http://xena.ucsc.edu/public-hubs/)下载结直肠癌rna测序数据(tcgacolonandrectalcancer,coadread),芯片平台为illuminahiseq2000rnasequencingplatform;通过r数据包(affy1.42.3)下载geo数据库的gse41258数据集,芯片平台为affymetrixhumangenomeu133aarray,表达谱差异分析利用r语言包(limma3.20.9)。
整理gse41258数据集的表达数据,取aldh18a1中位表达量为临界值,分为aldh18a1高/低表达组,制作表型数据文件。gse41258数据集显示,与正常结肠组织(平均表达量8.237±0.0374,n=103)相比,结直肠癌患者(平均表达量8.365±0.0296,n=186)的aldh18a1mrna表达水平显著升高(独立样本t检验,p=0.0088)(图1)。
(2)aldh18a1与结直肠癌临床病理参数密切相关
对结直肠癌患者的组织芯片(共90例)进行免疫组化染色,具体方法如下:样本烘烤30分钟后标准脱蜡处理,37℃过氧化氢阻断液内浸泡30分钟以阻断内源性过氧化氢酶,随后用pbs液洗涤3次,每次5分钟,放入枸橼酸抗原修复工作液中进行修复,血清封闭30分钟。之后加入aldh18a1兔抗人多克隆抗体(1:20)(abgent,美国),4℃孵育过夜;第二天用pbs液洗涤3次,每次5分钟,滴加鼠兔通用二抗,37℃孵育30分钟;dab显色3-5分钟,苏木素复染细胞核30秒,酒精梯度脱水后置于二甲苯中透明,待晾干后用中性树胶封片。用光学显微镜下观察并拍照,采用image-pro-plus6.0软件定量分析aldh18a1累积光密度值。
并采用image-proplus软件对aldh18a1表达进行量化分析,发现aldh18a1与原发肿瘤大小蔓延范围(pt)、区域淋巴结转移(pn)以及ajcc(americanjointcommitteeoncancer,美国癌症联合委员会)临床分期等结直肠癌病理参数密切相关(表1及图2-4)。
表1、aldh18a1表达量与结直肠癌临床病理参数的关系
aldh18a1low为aldh18a1低表达患者,aldh18a1high为aldh18a1高表达患者,取aldh18a1中位表达量为临界值;p值采用continuity连续性校正公式所得。
(3)aldh18a1高表达的结直肠癌患者预后不良
将tcga结直肠癌数据库的结直肠癌患者进行基于aldh18a1表达差异的kaplan-meier生存分析(利用roc曲线确定临界值),结果显示:aldh18a1低表达患者,其生存时间(中位生存时间2821天,n=325)较aldh18a1高表达患者(中位生存时间1566天,n=93)显著延长(log-rank检验,p=0.0333)(图5a)。同时,基于结直肠癌患者组织芯片的免疫组化数据,发现aldh18a1低表达患者的预后(中位生存时间77.65月,n=43)较高表达患者(中位生存时间52.39月,n=46)显著延长(log-rank检验,p=0.0021),与tcga结直肠癌数据库分析结果一致(图5b)。
进一步对上述90例结直肠癌患者的预后预测因子进行单因素和多因素回归分析,结果提示aldh18a1在结直肠癌中具有显著的预后判断价值(风险比为1.996,95%置信区间为1.012~3.939,p=0.046)(表2)。
表2、结直肠癌预后预测因素的单因素及多因素cox回归分析a
aldh18a1low为aldh18a1低表达患者,aldh18a1high为aldh18a1高表达患者,取aldh18a1中位表达量为临界值。a:pn的自由度已由于线性相关协变量ajcc临床分期而降低;b:线性相关协变量ajcc=pn
实施例2、shrna敲低aldh18a1基因的表达对结直肠癌细胞增殖活性的影响(1)细胞培养
人结直肠癌细胞系ht29、hct116以及正常结肠上皮细胞ncm460,采用含10%胎牛血清的dmem高糖培养基,置于37℃、5%co2、95%湿度的恒温培养箱中培养,隔日换液,3天~5天传代。
(2)aldh18a1shrna慢病毒包装及感染
采用分子克隆技术将aldh18a1shrna(5’-ccggccattatttgaccagatcattctcgagaatgatctggtcaaataatggtttttg-3’(seqidno.1),5’-aattcaaaaaccattatttgaccagatcattctcgagaatgatctggtcaaataatgg-3’(seqidno.2))(sigma-aldrich,美国)构建到plvshrna-egfp慢病毒载体(英茂盛业,北京)中,命名为aldh18a1shrna。利用lipofectamine3000转染试剂(invitrogen,美国)将5μgaldh18a1shrna,3.75μgpspax2和1.25μgpmd2.g包装质粒转入5×10-6生长状态良好的hek293t细胞,48小时后收取病毒上清加入ht29、hct116细胞中,置于37℃恒温培养箱中培养,6小时后换成新鲜培养基,流式细胞分选仪筛选egfp阳性细胞。mts检测,具体是将ht29、hct116细胞消化后,用含10%胎牛血清的dmem高糖培养基配成单细胞悬液,按1000个细胞/孔的密度接种于96孔板中,每孔体积100μl,置于37℃、5%co2、95%湿度的恒温培养箱中培养24小时;第二天,每孔加入mts溶液10μl,继续孵育2小时;选择490nm波长,在分光光度计上测定各孔吸光度值,记录结果,以时间为横坐标,吸光度值为纵坐标,绘制细胞生长曲线。结果发现,利用aldh18a1shrna下调其表达后,结直肠癌细胞的增殖能力显著抑制(图6)。
实施例3、aldh18a1表达与癌基因myc相关性
(1)aldh18a1和myc在mrna水平呈正相关
研究发现,几乎所有结直肠癌患者都有不同程度的myc基因表达失控,其在结直肠癌的恶性增殖、干性维持、癌性转化等方面扮演重要的角色。于是,我们接下来探讨aldh18a1对结直肠癌细胞增殖能力的调控,是否与myc基因有关。
提取结肠癌患者gse41258数据集中aldh18a1和myc的mrna表达量信息,采用real-timepcr检测aldh18a1和myc的mrna水平,具体方法如下:按照rnaisoplus说明书提取结肠癌患者细胞rna,利用nanodrop2000超微量分光光度计测量rna浓度。根据primescriptrtreagentkit(takara)说明书,将上述提取的rna反转录为cdna,并按照sybrpremixextaqtmii说明书,取7.5μlsybrpremixextaqtmii、1μlcdna、1μl上游引物、1μl下游引物、4.5μlddh2o,配制成15μlreal-timepcr反应体系。gapdh引物(上游:5’-acaactttgtatcgtggaagg-3’(seqidno.3),下游:5’-gccatcacgccacagtttc-3’(seqidno.4));aldh18a1引物(上游:5’-gcccttcaaccaacatcttct-3’(seqidno.5),下游:5’-aggggtacagtgataaacggg-3’(seqidno.6));myc引物(上游:5’-ggctcctggcaaaaggtca-3’(seqidno.7),下游:5’-ctgcgtagttgtgctgatgt-3’(seqidno.8))。反应条件为:95℃30秒,1个循环;95℃5秒,60℃30秒,72℃30秒,40个循环;溶解曲线65.0℃~95.0℃,温度间隔0.5℃,每15秒读板一次。相关性分析结果提示:aldh18a1与myc的表达水平呈显著正相关(相关系数r=0.3647,p=1.0390×10-13)(图7,a)。
同时,提取gse41258数据集中的myc基因表达值,并根据患者生存结局,利用roc曲线确定临界值,将结直肠癌患者分为myc高表达组和低表达组。表达谱差异分析结果显示,与myc低表达组相比,aldh18a1在myc高表达组的表达水平较高,差异显著(log2foldchange=0.1947,p=0.0149)(图7,b),提示两者在mrna水平存在高度相关性。
(2)aldh18a1和myc在蛋白水平呈正相关
进一步,对结直肠癌组织芯片免疫组化结果进行aldh18a1和c-myc蛋白水平的量化分析,采用westernblot检测aldh18a1和c-myc的蛋白表达,具体方法如下:收集直肠癌患者细胞,加入适量m-pertmmammalianproteinextractionreagent(thermoscientific,美国),并按100:1加入蛋白酶抑制剂,吹打混匀后置于冰上裂解30分钟,之后4℃、14000转/分钟离心10分钟,提取上清,bca试剂盒测定蛋白浓度。随后加入适量蛋白上样缓冲液(5×),混匀后金属浴加热至100℃,10分钟变性。配置电泳凝胶,蛋白上样量为50μg/孔。恒压电泳80v、40分钟,之后120v、45分钟,pvdf转膜100v、100分钟。将膜放入含5%脱脂奶粉的pbst中封闭1小时后孵育一抗,gapdh兔抗人多克隆抗体(1:1000)(cellsignalingtechnology,美国)、aldh18a1兔抗人多克隆抗体(1:1000)以及c-myc兔抗人单克隆抗体(1:1000),4℃孵育过夜。pbst洗膜10分钟×3次,然后将膜放入1:3000的羊抗兔二抗(中杉金桥,北京)中,室温孵育1小时;pbst洗膜10分钟×3次,加入supersignalingtechnologyit\o"pe(thermoscientific,34095),bio-rad凝胶成像仪显影。结果发现结直肠癌患者的aldh18a1和c-myc蛋白水平呈显著的正相关(相关系数r=0.4278,p=2.6000×10-5)(图8)。
westernblot实验结果提示,与正常结肠上皮细胞ncm460相比,aldh18a1在结直肠癌细胞中表达明显较高。同时,c-myc的表达趋势与aldh18a1基本一致(图9,a)。
实施例4、下调aldh18a1对myc基因表达的影响
(1)下调aldh18a1基因表达显著抑制mycmrna水平
根据广州锐博生物设计合成的sirna干扰系列:sialdh18a1#1:5’-gttcgttcttggagcaaca-3’(seqidno.9);sialdh18a1#2:5’-gaacctcaatggaacactt-3’(seqidno.10);sialdh18a1#3:5’-gaagggatctgtcacatgt-3’(seqidno.11),以及及产品使用说明书,分别将5μlsialdh18a1-1、sialdh18a1-2和sialdh18a1-3以及阴性对照,与5μl的lipofectaminernaimax(invitrogen,美国)转染试剂在200μl的opti-mem(gibco,美国)中混匀,室温孵育15分钟。同时,将ht29、hct116细胞消化后按(3-5)×105/孔的密度接种于6孔板中,并加入上述混合液,置于37℃、5%co2、95%湿度的恒温培养箱中培养,转染48小时后收集细胞用于aldh18a1的mrna和蛋白表达水平的检测。
real-timepcr结果显示,sialdh18a1组与sictr组相比,其aldh18a1mrna水平显著下调(sictr组,1.0000±0.0856;sialdh18a1#1组,0.0985±0.0053;sialdh18a1#2组,0.1811±0.0060;sialdh18a1#3组,0.0758±0.0044。sictr组与sialdh18a1#1组相比,独立样本t检验,n=4,p=2.8687×10-5;sictr组与sialdh18a1#2组相比,独立样本t检验,n=4,p=5.5047×10-8;sictr组与sialdh18a1#3组相比,独立样本t检验,n=4,p=2.3631×10-8);而下调aldh18a1之后,mycmrna水平呈现同向变化(sictr组,1.0000变化(sictr组,1.0000±0.0502;sialdh18a1#1组,0.39635±0.0260;sialdh18a1#2组0.6403±0.0218;sialdh18a1#3组0.5696±0.0435。sictr组与sialdh18a1#1组相比,独立样本t检验,n=4,p=1.8975×10-7;sictr组与sialdh18a1#2组相比,独立样本t检验,n=4,p=4.0000×10-6;sictr组与sialdh18a1#3组相比,独立样本t检验,n=4,p=2.0000×10-6)(图9,b)。
(3)下调aldh18a1表达显著降低c-myc蛋白水平
westernblot检测同样提示,sialdh18a1可显著降低aldh18a1蛋白水平,而c-myc与aldh18a1在蛋白水平上呈现同向变化:即下调aldh18a1,c-myc在蛋白水平同样出现显著性下降(图9,c)。
(4)aldh18a1高表达患者存在c-myc靶基因的活化
接下来,对gse41258数据集进行基因集富集分析(genesetenrichmentanalysis,gsea),具体如下在gsea官方网站(http://software.broadinstitute.org/gsea)下载功能基因集文件:hallmark_myc_targets_v1、hallmark_myc_targets_v2、dang_regulated_by_myc_up和dang_myc_targets_up。完善参数设置,进行gsea分析,提取标准化富集得分(normalizedenrichmentscore,nes)、错误发现率(falsediscoveryrate,fdr)和p值(nominalpvalue)。结果显示,高表达aldh18a1的结直肠癌患者存在多个c-myc靶基因集的富集,包括:hallmark_myc_targets_v1(共含200个基因,其中152个基因显著富集,fdr=0.0060,p=0.0041)、hallmark_myc_targets_v2(共含58个基因,其中44个基因显著富集,fdr=0.0359,p=0.0425))、c-myc正向调控基因(dang_regulated_by_myc_up(含72个基因,其中39个基因显著富集,fdr=0.0467,p=0.0418)和dang_myc_targets_up(含143个基因,其中75个基因显著富集,fdr=0.0040,p=0.0041))(图10)。
最后说明的是,以上优选实施例仅用以说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
序列表
<110>余时沧
<120>aldh18a1在结直肠癌的治疗和诊断中的应用
<160>11
<170>siposequencelisting1.0
<210>1
<211>58
<212>dna
<213>人工序列(artificialsequence)
<400>1
ccggccattatttgaccagatcattctcgagaatgatctggtcaaataatggtttttg58
<210>2
<211>58
<212>dna
<213>人工序列(artificialsequence)
<400>2
aattcaaaaaccattatttgaccagatcattctcgagaatgatctggtcaaataatgg58
<210>3
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>3
acaactttgtatcgtggaagg21
<210>4
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>4
gccatcacgccacagtttc19
<210>5
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>5
gcccttcaaccaacatcttct21
<210>6
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>6
aggggtacagtgataaacggg21
<210>7
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>7
ggctcctggcaaaaggtca19
<210>8
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>8
ctgcgtagttgtgctgatgt20
<210>9
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>9
gttcgttcttggagcaaca19
<210>10
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>10
gaacctcaatggaacactt19
<210>11
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>11
gaagggatctgtcacatgt19
- 还没有人留言评论。精彩留言会获得点赞!