一种壳-核结构固定化酶及其制备方法和应用与流程
本发明属于固定化酶领域,具体涉及一种壳-核结构固定化酶及其制备方法和应用。
背景技术:
酶是一类高效、专一的生物催化剂,其广泛应用于生物制药、食品加工、环境保护、清洁能源开发等诸多领域。在大力倡导可持续发展的理念下,发展绿色、节能的工业化生产方式以及使用可再生资源和能源的新形势下,酶催化将在大宗商品生产加工、精细化工等方面发挥越来越重要的作用。
酶是由活细胞产生的具有催化活性和高度选择性的特殊有机物(蛋白质,rna),其中大多数酶的化学本质为蛋白质。受限于蛋白质自身的特性,酶对环境的变化十分敏感,高温、高压、重金属离子以及过高或过低的ph均可能会使酶丧失活力。因而,对天然酶分子进行固定化,以提高酶的结构稳定性,使其稳定地发挥催化作用就显得很有必要。
传统的固定化酶方法主要包括物理吸附法、共价结合法、交联法和包埋法等。要获得理想的固定化酶,提高固定化酶的活力和稳定性,既要选用高效的固定化方法,又要有理想的固定化载体。传统方法由于其自身的弊端,如物理吸附法固定化酶,其对酶的固载量有限,稳定性差;共价结合法要求结合位点的基团必须不是酶的活性中心,通常获得的固定化酶的酶活回收率低;交联法要求在酶与载体材料结合,反应条件较为剧烈,固定化酶的活性较低;包埋法由于载体材料的网络尺寸难以控制,酶易泄露。
技术实现要素:
为解决现有技术的缺点和不足之处,本发明的首要目的在于提供一种壳-核结构固定化酶的制备方法。
本发明采用一种基于对单个目标蛋白分子进行精细化固定的策略,该方法是在分子水平上对酶进行固定化,与传统固定化酶方法相比,这种固定化酶技术实现了在更小尺度上对酶进行固定化,提高了酶的固定化效率,使得最终形成的“壳”结构实现了对所有酶分子的包埋固定,同时得到的固定化酶体系具有较高的酶活保留率、环境稳定性和更广泛的应用领域等诸多优良性质。
本发明的另一目的在于提供一种由上述制备方法制得的壳-核结构固定化酶。
本发明的再一目的在于提供上述壳-核结构固定化酶的应用。
本发明目的通过以下技术方案实现:
一种壳-核结构固定化酶的制备方法,包括如下步骤:
(1)蛋白表面的双键修饰:将酶蛋白配制成酶溶液,向酶溶液中添加修饰剂,混匀后,将溶液至于4-30℃下反应2-10h,得到表面双键修饰的酶溶液;其中修饰剂和酶的摩尔比为(5-200):1;
(2)双键修饰酶蛋白的胶囊化:向步骤(1)双键修饰的酶溶液中添加质量比为1-10倍的单体,其中单体与酶的质量比为(1-10):1;涡旋混匀后,除去溶解氧,然后,依次添加交联剂、引发剂和催化剂,其中交联剂与酶的质量比为(0.1-1):1、引发剂与酶的质量比为(0.5-1):1、催化剂与酶的质量比为(1-2):1;将溶液置于室温下反应1-5h后,透析纯化,得到“壳-核”结构的固定化酶,该结构中,酶蛋白作为“核”,酶蛋白表面形成的高分子聚合物为“壳”。
为了更好的实现本发明,优选地,步骤(1)所述的酶溶液浓度为1-10mg/ml。
优选地,步骤(1)所述的酶蛋白其底物的分子量小于1000,包括脂肪酶、漆酶、甲酸脱氢酶、甲醛脱氢酶、甲醇脱氢酶、葡萄糖氧化酶、葡萄糖异构酶、过氧化氢酶、辣根过氧化物酶、有机磷水解酶中的一种或构成级联反应的两种以上的酶。
在具体的实施过程中,酶溶液可以是发生级联反应的两种酶或者多种酶的混合溶液,该混合溶液的特点是,一种酶的产物作为另一种酶的底物,具体实例包括但不限于葡萄糖氧化酶和辣根过氧化物酶、苹果酸酶和丙氨酸脱氢酶、甲酸脱氢酶、甲醛脱氢酶和甲醇脱氢酶等。
步骤(1)所添加的修饰剂为丙烯酸、丙烯酸盐类或丙烯酸酯类,包括但不限于丙烯酰胺、丙烯酸钠、n-丙烯酰氧基琥珀酰亚胺等。修饰剂可以是一种、两种或者多种按任意比例混合之后添加。
优选地,步骤(1)中用ph值为6.0-9.0的磷酸盐缓冲溶液配制成1-10mg/ml的酶溶液。
步骤(2)中所添加的单体具有可发生聚合反应的不饱和化学键的化合物,如具有碳碳双键结构的苯乙烯、丙烯酰胺、丙烯酸酯类、甲基丙烯酸酯类、丙烯酸盐类、甲基丙烯酸盐类等;在某些单体中具有多不饱和化学键,如具有共轭双键结构的吡咯、噻吩、吡啶等;值得指出的是,本发明并不仅仅局限于以上所列出的单体,这类具有可聚合的不饱和化学键的单体对于本领域的技术人员是显然的。单体可以是一种、两种或者多种按任意比例混合之后添加。
步骤(2)所述除去溶解氧是通过通入氮气3min以上实现。
步骤(2)中所添加的交联剂为含有多个不饱和双键的化合物,如多异氰酸酯、多元胺类或丙烯酸酯类等,具体实例包括但不限于二异氰酸酯、丙二胺、n,n-亚甲基双丙烯酰胺、二乙烯基苯和乙烯基三乙氧基硅烷等。交联剂可以是一种、两种或者多种按任意比例混合之后添加。
步骤(2)中所述的引发剂为过氧化合物引发剂、偶氮类引发剂或氧化还原引发剂等。作为实例,常用过氧化物引发剂如过硫酸铵、过硫酸钾等。引发剂可以是一种、两种或者多种按任意比例混合之后添加。
步骤(2)中所述的催化剂为四甲基乙二胺。
步骤(2)所述透析纯化采用的是3.5kd的透析袋,用磷酸盐缓冲液透析3次。
本发明所提供的壳-核结构的固定化酶可应用于催化领域或蛋白药物靶向输送领域。
本发明和现有技术相比,具有如下优点:
本发明是在分子水平上对酶进行固定化,与传统固定化酶方法相比,这种固定化酶技术实现了在更小尺度上对酶进行固定化,提高了酶的固定化效率,使得最终形成的“壳”结构实现了对所有酶分子的包埋固定。
本发明在酶分子表面组装聚合物层,可以提高了酶分子的结构稳定性,因而最终得到的“壳-核”结构固定化酶具有更高的环境稳定性,同时聚合物层表面丰富的官能团给酶分子提供了良好的微环境,使得最终的酶活回收率更高。
本发明是基于分子水平上对酶进行固定化,因此,得到的固定化酶尺寸在纳米级,具有更宽应用领域,如,除了可发挥酶的催化作用外,还可用于蛋白药物靶向输送等领域。
附图说明
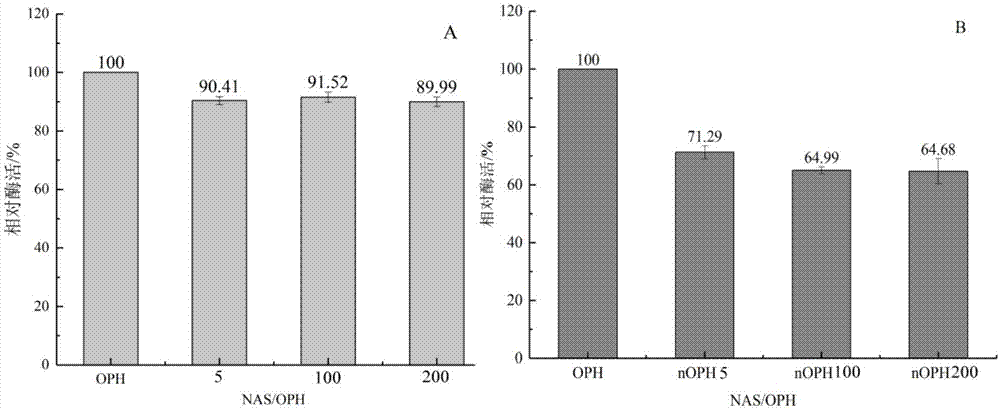
图1为实施例1中双键修饰后的有机磷水解酶(a)和固定化酶的相对酶活(b);
图2为实施例1中固定化有机磷水解酶的粒径分布图;
图3为实施例1中固定化有机磷水解酶的热稳定性;
图4为实施例2中固定化酶的相对酶活,其中四种固定化酶具有不同交联程度的聚合物“壳”;
图5为实施例4中采用吡咯单体制备的固定化酶的凝胶电泳图。
具体实施方式
下面结合实施例和附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
下列实施例中未注明具体实验条件的试验方法,通常按照常规实验条件或按照制造厂所建议的实验条件。所使用的材料、试剂等,如无特别说明,为从商业途径得到的试剂和材料。
实施例1
(1)准确称取一定量的有机磷水解酶(oph),用50mm、ph=9.0的磷酸盐缓冲溶液配制成浓度为1mg/ml的酶溶液;
(2)对蛋白进行双键修饰:对步骤(1)配制的酶溶液,分别移取20ml酶溶液置于3个25ml的玻璃小瓶中,按照n-丙烯酰氧基琥珀酰亚胺(nas):酶=[5:1;100:1;200:1](摩尔比)进行投料,将溶液置于30℃水浴中反应1h,得到双键修饰的酶溶液oph-nas5、oph-nas100、oph-nas200;
(3)随后,分别移取10ml步骤(2)中经双键修饰的酶溶液oph-nas5、oph-nas100、oph-nas200,置于3个25ml的玻璃小瓶中,添加单体丙烯酰胺(aam),向溶液中缓慢地通入氮气3min;然后,向酶溶液中依次添加交联剂n,n-亚甲基双丙烯酰胺(bis)、引发剂过硫酸铵(aps)和催化剂四甲基乙二胺(temed),各组分添加量与酶的质量比例为aam:bis:aps:temed:oph=10:1:1:2:1,胶囊化反应时间为5h,反应结束后,采用3.5kd透析袋透析纯化得到“壳-核”结构的固定化酶noph-5、noph-100、noph-200。
对上述得到的双键修饰的酶溶液样品oph-nas5、oph-nas100、oph-nas200和“壳-核”结构固定化酶样品noph-5、noph-100、noph-200进行酶活测试。37℃,ph=8.0下,以甲基对硫磷为水解底物,准确反应10min后灭活,410nm测定吸光度。如图1所示,结果以相对酶活表示,设置oph相对活力为100,则oph-nas5、oph-nas100、oph-nas200相对酶活分别为90.41%、91.52%、89.99%;noph-5、noph-100、noph-200相对酶活分别为71.29%、64.99%、64.68%。固定化之后,有机磷降解酶依然保留了较高的酶活。
采用马尔文粒度仪测试oph和noph的粒径。结果如图2所示,原酶oph的粒径大约5nm,固定化后,得到的“壳-核”结构固定化酶的粒径增加,大约15-20nm,这说明我们已经成功的在oph的表面固定上一层聚合物“壳”。
固定化酶热稳定性测试:分别在37℃、50℃、60℃、70℃下测定oph和noph-5、noph-100、noph-200的酶活力,设置37℃下oph相对活力为100,其他温度下测定的酶活取相对值。由图2可知:①随着温度的升高,oph原酶的活力逐渐降低,这是由于温度升高,导致酶的结构发生不可逆的破坏,因而酶活力降低;②固定化酶noph的活力均呈现先升高再降低的趋势,这是因为酶表面的聚合物“壳”引起的,在较低的温度下,聚合物层使底物传质速度下降,而随着温度的升高,底物的布朗运动增加,提高了底物和酶的相互作用,因而,酶活力增加。
实施例2
(1)准确称取一定量的有机磷水解酶,用50mm、ph=8.0的磷酸盐缓冲溶液配制成浓度为10mg/ml的酶溶液;
(2)对蛋白进行双键修饰:对步骤(1)配制的酶溶液,按照nas:酶=10:1(摩尔比)进行投料,将溶液置于4℃冰箱中反应10h,得到双键修饰的酶溶液oph-nas10;
(3)随后,分别移取10ml步骤(2)中经双键修饰的酶溶液oph-nas10,置于4个25ml的玻璃小瓶中,添加n-(3-氨丙基)-甲基丙烯酰胺盐酸盐(apm),向溶液中缓慢地通入氮气3min,再分别向4个小瓶中添加以下质量比例的交联剂bis(oph:bis=1:0.1/0.2/0.5/1);
(4)然后,向步骤(3)的酶溶液中依次添加引发剂过硫酸铵(aps)和催化剂四甲基乙二胺(temed),各组分添加量与酶的质量比例为apm:aps:temed:oph=5:0.5:1:1,胶囊化反应时间为1h,反应结束后,采用3.5kd透析袋透析纯化得到“壳-核”结构的固定化酶noph-bis0.1、noph-bis0.2、noph-bis0.5、noph-bis1。
对上述得到的不同交联程度的“壳-核”结构固定化酶样品noph-bis0.1、noph-bis0.2、noph-bis0.5、noph-bis1进行酶活测试。结果以相对酶活表示,设置oph相对活力为100%,则noph-bis0.1、noph-bis0.5、noph-bis1的相对酶活分别为81.26%、82.41%、75.98%。固定化酶的活力随着表面壳结构交联程度的增加,呈现先增加后降低的趋势,分析酶活变化的原因:①bis增加,聚合物层的交联程度增加,限制了底物的扩散,使得酶活降低;②oph:bis=1:0.5时,酶活力增加可能是酶的构象发生转变,使得在该交联度下的酶更易于与底物结合。
实施例3
(1)准确称取一定量的有机磷水解酶,用50mm、ph=7.5的磷酸盐缓冲溶液配制成浓度为5mg/ml的酶溶液;
(2)对蛋白进行双键修饰:对步骤(1)配制的酶溶液,按照丙烯酸钠(aas):酶=200:1(摩尔比)进行投料,将溶液置于室温25℃下反应5h,得到双键修饰的酶溶液oph-nas50;
(3)随后,分别移取10ml步骤(2)中经双键修饰的酶溶液oph-aas200,置于3个25ml的玻璃小瓶中,分别添加混合单体1(质量比aam:apm=1:3)、混合单体2(质量比aam:apm=2:2)、混合单体3(质量比aam:apm=3:1),向溶液中缓慢地通入氮气3min;然后,向酶溶液中依次添加交联剂n,n-亚甲基双丙烯酰胺(bis),引发剂过硫酸铵(aps)和催化剂四甲基乙二胺(temed),各组分添加量与酶的质量比例为混合单体:bis:aps:temed:oph=4:0.2:0.5:1.5:1,胶囊化反应时间为2.5h,反应结束后,采用3.5kd透析袋透析纯化得到“壳-核”结构的固定化酶noph-aam1、noph-aam2、noph-aam3。
对上述得到的不同单体制备的“壳-核”结构固定化酶样品noph-aam1、noph-aam2、noph-aam3进行酶活测试。结果以相对酶活表示,设置oph相对活力为100%,则noph-aam1、noph-aam2、noph-aam3的相对酶活分别为81.26%、82.41%、75.98%、72.41%。
实施例4
(1)准确称取一定量的有机磷水解酶,用50mm、ph=7.0的磷酸盐缓冲溶液配制成浓度为8mg/ml的酶溶液;
(2)对蛋白进行双键修饰:对步骤(1)配制的酶溶液,分别移取20ml置于3个25ml的玻璃小瓶中,按照aas:酶=[10:1;30:1;50:1](摩尔比)进行投料,将溶液置于10℃冰水浴中反应2h,反应结束后,采用3.5kd的透析袋透析纯化,得到双键修饰的酶溶液oph-aas10、oph-aas30、oph-aas50;
(3)随后,分别移取10ml步骤(2)中经双键修饰的酶溶液oph-aas10、oph-aas30、oph-aas50,置于3个25ml的玻璃小瓶中,添加单体吡咯(pyr),向溶液中缓慢地通入氮气3min;
(4)然后,向步骤(3)的酶溶液中依次添加交联剂n,n-亚甲基双丙烯酰胺(bis)、引发剂过硫酸铵(aps)和催化剂四甲基乙二胺(temed),各组分添加量与酶的质量比例为pyr:bis:aps:temed:oph=4:0.2:1:2:1,胶囊化反应时间为2h,反应结束后,采用3.5kd透析袋透析纯化得到“壳-核”结构的固定化酶noph-pyr-10、noph-pyr-30、noph-pyr-50。
对上述得到的“壳-核”结构固定化酶样品noph-pyr10、noph-pyr30、noph-pyr50进行酶活测试。结果以相对酶活表示,设置oph相对活力为100%,则noph-pyr10、noph-pyr30、noph-pyr50相对酶活分别为98.95%、93.30%、87.12%。
采用凝胶电泳表征固定化前后的oph。如图5所示,oph和核壳结构的noph-pyr10、noph-pyr30、noph-pyr50表现出相似的电泳行为,这说明oph表面修饰上聚合物壳后,对其整体结构影响较小,这也是固定化酶保持较高酶活力的原因。
实施例5
(1)准确称取一定量的脂肪酶(lps),用50mm、ph=6.0的磷酸盐缓冲溶液配制成浓度为2mg/ml的酶溶液;
(2)对蛋白进行双键修饰:移取20ml步骤(1)配制的酶溶液置于25ml的玻璃小瓶中,按照nas:酶=30:1(摩尔比)进行投料,将溶液置于4℃冰箱中反应4h,得到双键修饰的酶溶液lps-nas30;
(3)随后,移取10ml步骤(2)中经双键修饰的酶溶液lps-nas30,置于25ml的玻璃小瓶中,添加单体aam,向溶液中缓慢地通入氮气3min;然后,向酶溶液中依次添加交联剂n,n-亚甲基双丙烯酰胺(bis),引发剂过硫酸铵(aps)和催化剂四甲基乙二胺(temed),各组分添加量与酶的质量比例为aam:bis:aps:temed:lps=4:0.2:0.5:2:1,胶囊化反应时间为2h,反应结束后,采用3.5kd透析袋透析纯化得到“壳-核”结构的固定化酶nlps-30。
对上述得到的“壳-核”结构固定化酶样品nlps-30进行酶活测试。结果以相对酶活表示,设置lps相对活力为100%,则nlps-30相对酶活分别为87.25%。
实施例6
(1)准确称取一定量的辣根过氧化物酶(hrp),用50mm、ph=7.0的磷酸盐缓冲溶液配制成浓度为2mg/ml的酶溶液;
(2)对蛋白进行双键修饰:移取20ml步骤(1)配制的酶溶液置于25ml的玻璃小瓶中,按照aas:酶=150:1(摩尔比)进行投料,将溶液置于4℃冰箱中反应4h,得到双键修饰的酶溶液hrp-aas150;
(3)随后,移取10ml步骤(2)中经双键修饰的酶溶液hrp-aas150,置于25ml的玻璃小瓶中,添加单体aam和apm,向溶液中缓慢地通入氮气3min;然后,向酶溶液中依次添加交联剂n,n-亚甲基双丙烯酰胺(bis),引发剂过硫酸铵(aps)和催化剂四甲基乙二胺(temed),各组分添加量与酶的质量比例为aam:apm:bis:aps:temed:hrp=2:2:0.2:0.5:2:1,胶囊化反应时间为2h,反应结束后,采用3.5kd透析袋透析纯化得到“壳-核”结构的固定化酶nhrp-150。
对上述得到的“壳-核”结构固定化酶样品nhrp-150进行酶活测试。结果以相对酶活表示,设置lps相对活力为100%,则nhrp-150相对酶活分别为81.66%。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!