通过丁醇发酵高效合成溶剂和有机酸的方法与流程
本发明涉及微生物发酵领域,特别涉及一种通过丁醇发酵高效合成溶剂和有机酸的方法。
背景技术:
丙酮-丁醇-乙醇发酵也称为abe(acetone-butanol-ethanol)发酵或丁醇发酵,是利用梭状芽孢杆菌(clostridia)在严格厌氧的条件下进行丙酮、丁醇和乙醇溶剂生产的发酵过程。发酵主产物丁醇是重要的平台化合物,同时,也是一种极具潜力、清洁可再生的新型液态燃料和柴油助燃剂。一直以来,人们更希望利用abe发酵生产获得高纯度丁醇溶剂。但丁醇的亲脂性会破坏细胞膜的磷脂结构、增强细胞膜的流动性,对细胞损伤极强,发酵液中丁醇浓度一般难以超过13g/l的阈值。
目前,用于丁醇发酵的微生物菌株主要是丙酮丁醇梭菌(clostridiumacetobutylicum)和拜氏梭菌(clostridiumbeijerinckii),发酵底物主要是玉米原料。传统的玉米丁醇发酵的丁醇终浓度仅为11-13g/l,且丁醇生产效率仅为0.2g/l/h的低水平,导致玉米丁醇发酵的经济性能较差。丙酮丁醇梭菌代谢过程包括产酸期和产溶剂期:第一阶段为产酸期,该过程主要特征是发酵液ph逐渐下降、乙酸和丁酸浓度持续增加,丙酮丁醇梭菌在该过程中迅速增殖,溶剂产品(丁醇、丙酮和乙醇)积累量较少;第二阶段为产溶剂期,该过程主要特征是发酵液ph逐渐上升、乙酸和丁酸浓度逐渐下降,细胞增殖几乎停止,溶剂产品大幅度增加。
为了降低丁醇生产过程的原料成本,利用木质纤维素类原料替代玉米原料已成为普遍认可的解决途径之一。然而,在利用木质纤维素类原料生产丁醇时,需要首先对其进行预处理操作以获得微生物可以直接利用的可发酵糖(葡萄糖、木糖)。在预处理过程中,会产生很多种发酵抑制物(例如糠醛、5-羟甲基糠醛、乙酰丙酸、甲酸、乙酸和酚类物质),其中酚类物质是由木质素组分降解产生的。同时,酚类物质对微生物细胞的毒害作用远大于糠醛和5-羟甲基糠醛等呋喃类衍生物。因此,目前研究的重点是通过采取脱毒工艺降低木质纤维素水解液中的酚类物质浓度。另一方面,虽然乙酸和丁酸是丁醇发酵的副产物,但是通过在发酵过程中添加酯酶却可以实现丁酸和丁醇的酯化反应,在降低丁醇对微生物细胞毒性的前提下,实现丁醇发酵的持续进行,而且丁酸丁酯是一种高附加值的平台化合物和生物燃料。因此,如果可以在丁醇发酵过程中实现丁酸丁酯的在线高效合成,将大大提高丁醇发酵的应用范畴。然而,丁酸在发酵结束时浓度较低,丁酸/丁醇比较低,无法得到原位合成丁酸丁酯或其他高附加值产品。因此,如何同时实现丁酸和丁醇的高效率合成是实现丁酸丁酯等产品高效合成的前提和关键。
技术实现要素:
发明目的:针对现有技术中存在的问题,本发明提供一种通过丁醇发酵高效合成溶剂和有机酸的方法,通过简单地添加少量发酵抑制物——酚类物质,实现溶剂和有机酸同时提高的目标,并最终改善了丁醇发酵性能。
技术方案:本发明提供了一种通过丁醇发酵高效合成溶剂和有机酸的方法,包括以下步骤:s1:将保藏于孢子管中的丙酮丁醇梭菌在活化培养基中活化,然后转接至梭菌种子培养基中培养,以得到高活力的丙酮丁醇梭菌种子液;s2:将丙酮丁醇梭菌种子液转接至梭菌发酵培养基中,进行生产丁醇、丙酮、乙醇、乙酸和丁酸;发酵的第一阶段为产酸期,产酸期的发酵液ph控制在5.0;发酵进行至产溶剂期后,ph不控制;s3:在梭菌发酵培养基中添加木质纤维素衍生酚类物质,于厌氧发酵罐中考察丁醇发酵过程的动力学特征。
优选地,在所述s3中,木质纤维素衍生酚类物质的浓度为0.2g/l。
优选地,在所述s3中,所述木质纤维素衍生酚类物质为香兰素和/或香草酸。
优选地,若所述木质纤维素衍生酚类物质为香兰素和香草酸,则所述香兰素、所述香草酸的浓度分别为0.1g/l。
优选地,在所述s1中,所述活化培养基为5%玉米醪培养基。
优选地,所述玉米醪培养基的制作方法如下:称取25g玉米粉加入至3l去离子水中,缓慢煮沸,维持煮沸状态1.5-2h,将水逐渐挥发,体积直至500ml结束,此即为5%玉米醪培养基。
优选地,在所述s1中,所述梭菌种子培养基为葡萄糖浓度为30g/l的梭菌生长培养基。
优选地,所述梭菌生长培养基配方为:kh2po40.75g/l,k2hpo40.75g/l,nacl1.0g/l,mnso4∙5h2o0.017g/l,mgso4∙7h2o0.70g/l,feso4∙7h2o0.01g/l,l-天冬酰胺2.0g/l,酵母抽提物5.0g/l,(nh4)2so42.0g/l,葡萄糖30g/l。
优选地,在所述s2中,所述梭菌发酵培养基中的葡萄糖浓度为60g/l。
优选地,所述梭菌发酵培养基的配方如下:kh2po40.75g/l,k2hpo40.75g/l,nacl1.0g/l,mnso4∙5h2o0.017g/l,mgso4∙7h2o0.70g/l,feso4∙7h2o0.01g/l,l-天冬酰胺2.0g/l,酵母抽提物5.0g/l,(nh4)2so42.0g/l,葡萄糖60g/l。
有益效果:本发明通过添加香兰素、香草酸或二者混合物,均可以实现溶剂和有机酸的高效合成。其中,混合添加香兰素和香草酸时,丁醇产量与对照基本相当,总溶剂产量高于对照批次,且有机酸浓度是对照批次的2倍左右,解决了目前需要外添丁酸合成丁酸丁酯的技术不足,在降低发酵原料成本的同时,有望实现丁酸丁酯的绿色可持续生产。
与现有技术相比,本发明的技术优势可以体现在以下几个方面:
(1)本发明首先通过丙酮丁醇梭菌活化和培养,得到高活力的种子液。然后向发酵培养基中添加低浓度的木质纤维素衍生酚类物质,由于酚类物质在高浓度时会抑制丁醇发酵,导致丁醇合成能力降低;通过添加低浓度的酚类物质,可以实现丁醇合成正常进行,同时在相同甚至更短的发酵时间内大幅提高丁酸和有机酸的产量。产生该现象的生理机制如下:由于木质纤维素衍生酚类物质对于丙酮丁醇梭菌是一种环境胁迫因子;在低浓度添加条件下,酚类物质并没有对梭菌细胞的正常生理代谢造成明显抑制作用,梭菌为了应对酚类物质胁迫需要提高/响应自身的应答机制,即通过强化葡萄糖代谢以提供足够高的能量物质atp以维持细胞的生理代谢;另一方面,在产溶剂期过量合成能量物质atp则只能来源于乙酸合成、丁酸合成和糖酵解途径。因此,在添加低浓度酚类物质时,会提高丙酮丁醇梭菌对葡萄糖的代谢速率以及乙酸/丁酸的合成能力。
(2)当利用丁醇发酵过程合成丁酸丁酯时,通常需要向发酵体系中添加丁酸和酯酶。因为在传统丁醇发酵过程中,丁酸的发酵终浓度很低,无法达到与丁醇进行酯化反应(丁酸:丁醇=1:1mol/mol)的浓度,外添丁酸进行丁酸丁酯合成的技术存在生产过程操作复杂、无法实现丁酸丁酯的一锅法合成。本发明公布了一种高效合成溶剂和有机酸的方法,该方法无需外添昂贵的丁酸,只需添加极少量的酯酶即可实现丁酸丁酯的绿色合成。
(3)发酵过程的操作成本会对产品的生产成本产生影响,本发明一次性添加木质纤维素衍生酚类物质,使得整个操作过程极为简单,降低了发酵过程的操作成本,提高了发酵过程的经济性。
附图说明
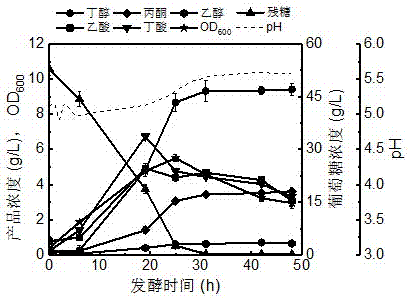
图1为丁醇分批发酵动力学;
图2为添加0.2g/l香兰素的丁醇发酵动力学;
图3为添加0.2g/l香草酸后的丁醇发酵动力学;
图4为添加0.1g/l香兰素和0.1g/l香草酸后的丁醇发酵动力学。
具体实施方式
下面结合附图对本发明进行详细的介绍。
实施方式1(对比例):丁醇分批发酵过程
将保藏于4℃的丁醇发酵模式菌株丙酮丁醇梭菌atcc824孢子管转接至5%玉米醪培养基中活化,接种瓶为100ml厌氧瓶,内装50ml5%玉米醪培养基,接种量为10%(v/v)。然后,分别在100℃沸水和0℃冰水混合物中进行热激和低温处理各2min。利用真空泵进行抽真空操作1.5-2min,然后将其放置于37℃水浴锅中培养20-25h,即为活化液。
将活化好的活化液转接至100ml厌氧瓶中,厌氧瓶中装有50ml梭菌生长培养基(其中葡萄糖浓度为30g/l),接种量为10%(v/v),然后,分别在100℃沸水和0℃冰水混合物中进行热激和低温处理各2min。利用真空泵进行抽真空操作1.5-2min,然后将其放置于37℃水浴锅中培养20-25h,即为丙酮丁醇梭菌种子液。
将丙酮丁醇梭菌种子液以10%(v/v)的接种量转接至5l厌氧发酵罐中,厌氧发酵罐装有3l梭菌发酵培养基(其中葡萄糖浓度为60g/l),发酵温度为37℃,发酵过程中的ph控制策略表述如下:在产酸期(~0-15h),通过控制柜自动控制ph为5.0,利用的是14%(w/v)氨水;在产溶剂期(~15-48h),ph无需控制。接种前,向发酵液中通入无菌氮气15-20min以除去发酵液中游离的氧气。发酵时间为48h,每小时记录发酵过程的产气量,每隔4-6h取样离心后,测定发酵液中的溶剂浓度、细胞生物量、有机酸浓度和葡萄糖浓度等参数。
上述5%玉米醪培养基的具体制备方法如下:
称取25g玉米粉加入至3l去离子水中,缓慢煮沸,维持煮沸状态1.5-2h,将水逐渐挥发,体积直至500ml结束,此即为5%玉米醪培养基。
上述梭菌生长培养基的配方为:kh2po40.75g/l,k2hpo40.75g/l,nacl1.0g/l,mnso4∙5h2o0.017g/l,mgso4∙7h2o0.70g/l,feso4∙7h2o0.01g/l,l-天冬酰胺2.0g/l,酵母抽提物5.0g/l,(nh4)2so42.0g/l,葡萄糖30g/l。
上述梭菌发酵培养基的配方如下:kh2po40.75g/l,k2hpo40.75g/l,nacl1.0g/l,mnso4∙5h2o0.017g/l,mgso4∙7h2o0.70g/l,feso4∙7h2o0.01g/l,l-天冬酰胺2.0g/l,酵母抽提物5.0g/l,(nh4)2so42.0g/l,葡萄糖60g/l。
细胞生物量的测定:利用分光光度计测定,测定波长为600nm。
发酵ph的测定:利用ph电极测定。
溶剂测定方法:以异丁醇为检测样品的内标,色谱条件为阶段升温程序法(40-70℃,3℃/min;70-140℃,5℃/min;140-200℃,15℃/min),进样量为0.6μl。产物出峰时间为丙酮(4min)、乙醇(5min)、异丁醇(9min)、丁醇(11min)、乙酸(21min)和丁酸(26min)。
葡萄糖浓度的测定:将发酵上清液稀释,使得其中的葡萄糖浓度低至0.2-1.0g/l,利用进样针吸取25μl至生物传感仪sba-40c中,测定葡萄糖浓度。
发酵结果如图1所示,发酵至48h结束,葡萄糖消耗量为52.8g/l。发酵过程中的ph在前10h左右稳定在5.0左右,当发酵进入到产溶剂后,溶剂大量积累,葡萄糖消耗量逐渐增加,到发酵结束48h时,发酵液的ph为~5.5。从图中可以看出,发酵过程中的细胞量od600在产酸期(~0-15h)急剧增加;当发酵进入到产溶剂期后,细胞量增加不明显,且到发酵后期呈现逐渐下降的趋势。发酵过程中的丁醇浓度最大值出现在48h,溶剂浓度分别为丁醇(9.42g/l)、丙酮(3.62g/l)、乙醇(0.65g/l)和总溶剂(13.69g/l);同时,有机酸浓度分别为乙酸(3.08g/l)、丁酸(3.30g/l)和总酸(6.38g/l)。该发酵批次中,丁酸/丁醇比仅为0.35g/g。
实施方式2:添加0.2g/l香兰素的丁醇发酵过程
活化液的制备过程与实施方式1中完全相同,此处不做赘述。
丙酮丁醇梭菌种子液的制备过程与实施方式1中完全相同,此处不做赘述。
将丙酮丁醇梭菌种子液以10%(v/v)的接种量转接至5l厌氧发酵罐中,厌氧发酵罐装有3l梭菌发酵培养基(其中葡萄糖浓度为60g/l,香兰素浓度为0.2g/l),发酵温度为37℃,发酵过程中的ph控制策略表述如下:在产酸期(~0-15h),通过控制柜自动控制ph为5.0,利用的是14%(w/v)氨水;在产溶剂期(~15-48h),ph无需控制。接种前,向发酵液中通入无菌氮气15-20min以除去发酵液中游离的氧气。发酵时间为48h,每小时记录发酵过程的产气量,每隔4-6h取样离心后,测定发酵液中的溶剂浓度、细胞生物量、有机酸浓度和葡萄糖浓度等参数。
上述5%玉米醪培养基、梭菌生长培养基以及梭菌发酵培养基的具体制备方法与实施方式1完全相同,此处不做赘述。
上述细胞生物量的测定方法、发酵ph的测定方法、溶剂测定方法以及葡萄糖浓度的测定方法均与实施方式1完全相同,此处不做赘述。
发酵结果如图2所示,发酵至48h结束,葡萄糖消耗量为57.0g/l。从图中可以看出,发酵过程中的最大细胞量od600出现在26h,达到了7.55,明显高于对照批次的5.51,这说明低浓度的酚类物质并没有明显抑制梭菌细胞的生长;反之,由于酚类物质属于环境抑制因子,细胞为了响应外部环境的变化进行细胞增殖以提高细胞的胁迫抗性。发酵过程中的丁醇浓度最大值出现在48h,溶剂浓度分别为丁醇(8.58g/l)、丙酮(3.40g/l)、乙醇(0.59g/l)和总溶剂(12.57g/l);同时,有机酸浓度分别为乙酸(5.04g/l)、丁酸(5.75g/l)和总酸(10.79g/l)。该发酵批次中,丁酸/丁醇比为0.67g/g。与对照批次相比,总酸浓度得到大幅提高(从6.38g/l提高至10.79g/l)。
实施方式3:添加0.2g/l香草酸的丁醇发酵过程
活化液的制备过程与实施方式1中完全相同,此处不做赘述。
丙酮丁醇梭菌种子液的制备过程与实施方式1中完全相同,此处不做赘述。
将丙酮丁醇梭菌种子液以10%(v/v)的接种量转接至5l厌氧发酵罐中,厌氧发酵罐装有3l梭菌发酵培养基(其中葡萄糖浓度为60g/l,香草酸浓度为0.2g/l),发酵温度为37℃,发酵过程中的ph控制策略表述如下:在产酸期(~0-15h),通过控制柜自动控制ph为5.0,利用的是14%(w/v)氨水;在产溶剂期(~15-48h),ph无需控制。接种前,向发酵液中通入无菌氮气15-20min以除去发酵液中游离的氧气。发酵时间为48h,每小时记录发酵过程的产气量,每隔4-6h取样离心后,测定发酵液中的溶剂浓度、细胞生物量、有机酸浓度和葡萄糖浓度等参数。
上述5%玉米醪培养基、梭菌生长培养基以及梭菌发酵培养基的具体制备方法与实施方式1完全相同,此处不做赘述。
上述细胞生物量的测定方法、发酵ph的测定方法、溶剂测定方法以及葡萄糖浓度的测定方法均与实施方式1完全相同,此处不做赘述。
发酵结果如图3所示,发酵至48h结束,葡萄糖消耗量为58.6g/l。从图中可以看出,发酵过程中的最大细胞量od600出现在21h,达到了6.96,低于添加0.2g/l香兰素的发酵批次,仍然明显高于对照批次的5.51。发酵过程中的丁醇浓度最大值出现在33h,溶剂浓度分别为丁醇(8.42g/l)、丙酮(2.82g/l)、乙醇(0.58g/l)和总溶剂(11.77g/l);同时,有机酸浓度分别为乙酸(4.45g/l)、丁酸(4.76g/l)和总酸(9.21g/l)。该发酵批次中,丁酸/丁醇比为0.57g/g。与对照批次相比,总酸浓度得到大幅提高(从6.38g/l提高至9.21g/l)。
实施方式4:添加0.1g/l香兰素和0.1g/l香草酸的丁醇发酵过程
活化液的制备过程与实施方式1中完全相同,此处不做赘述。
丙酮丁醇梭菌种子液的制备过程与实施方式1中完全相同,此处不做赘述。
将丙酮丁醇梭菌种子液以10%(v/v)的接种量转接至5l厌氧发酵罐中,厌氧发酵罐装有3l梭菌发酵培养基(其中葡萄糖浓度为60g/l,香兰素浓度为0.1g/l,香草酸浓度为0.1g/l),发酵温度为37℃,发酵过程中的ph控制策略表述如下:在产酸期(~0-15h),通过控制柜自动控制ph为5.0,利用的是14%(w/v)氨水;在产溶剂期(~15-48h),ph无需控制。接种前,向发酵液中通入无菌氮气15-20min以除去发酵液中游离的氧气。发酵时间为48h,每小时记录发酵过程的产气量,每隔4-6h取样离心后,测定发酵液中的溶剂浓度、细胞生物量、有机酸浓度和葡萄糖浓度等参数。
上述5%玉米醪培养基、梭菌生长培养基以及梭菌发酵培养基的具体制备方法与实施方式1完全相同,此处不做赘述。
上述细胞生物量的测定方法、发酵ph的测定方法、溶剂测定方法以及葡萄糖浓度的测定方法均与实施方式1完全相同,此处不做赘述。
发酵结果如图4所示,发酵至48h结束,葡萄糖消耗量为58.8g/l。从图中可以看出,发酵过程中的最大细胞量od600出现在22h,达到了7.16,低于添加0.2g/l香兰素的发酵批次,仍然明显高于对照批次的5.51。发酵过程中的丁醇浓度最大值出现在31h,溶剂浓度分别为丁醇(9.07g/l)、丙酮(3.51g/l)、乙醇(1.27g/l)和总溶剂(13.85g/l);同时,有机酸浓度分别为乙酸(5.33g/l)、丁酸(7.24g/l)和总酸(12.57g/l)。该发酵批次中,丁酸/丁醇比为0.80g/g。与对照批次相比,总酸浓度得到大幅提高(从6.38g/l提高至12.57g/l)。因此,通过混合添加香兰素和香草酸可以实现丁醇发酵过程中溶剂和有机酸的高效合成,有利于后期高附加值平台化合物的绿色/经济性生产。
上述实施方式只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所做的等效变换或修饰,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!