一种基于硅类介质微球超微量DNA提取纯化试剂盒的制作方法
本发明涉及一种试剂盒,具体涉及一种基于硅类介质微球超微量dna提取纯化试剂盒。属于分子生物学
技术领域:
。
背景技术:
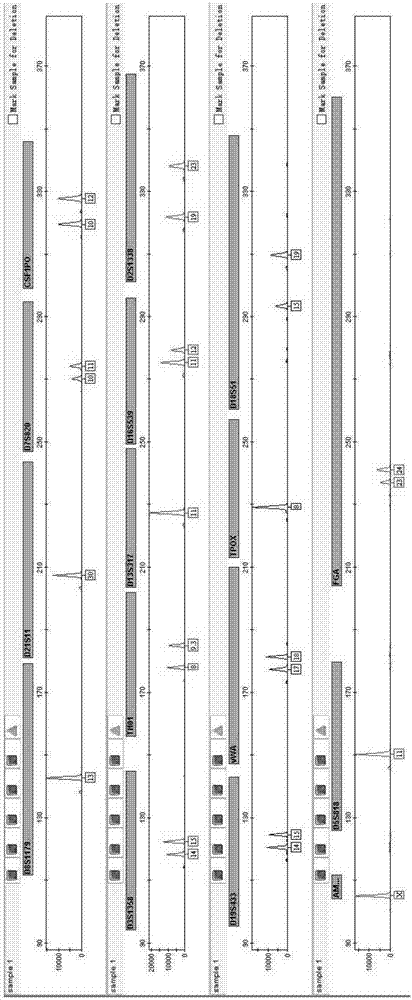
:dna提取纯化是分子生物学检测中非常重要的环节,核酸的得率及纯度直接关系到下游检测能否成功。常用核酸纯化方法一般都包括细胞裂解、去除与核酸结合的物质、沉淀核酸、去除盐类、有机溶剂等杂质、纯化分离dna等步骤。常用方法主要是有机法、微珠吸附法、chelex-100法和离心柱法,有机法步骤繁琐、耗时,并且用到氯仿、苯酚等毒性大的有机溶剂,对操作人员健康有一定的危害;chelex-100采用液相纯化原理,利用加热细胞裂解后,螯合剂去除生物样品中杂质从而达到纯化的目的,操作简单,但是所提取的dna纯度不够,不能满足超微量生物样品dna纯化的要求;离心柱法虽不使用有机溶剂,但dna得率不高,离心柱不可重复使用,提取单个样本价格昂贵。采用微珠吸附法的提取分离技术,无需接触氯仿、苯酚等毒性大的试剂且操作简便,短时间就能实现样本的快速、高质量的提取,是核酸提取的重要发展方向,具有传统提取方法无法比拟的优势。当核酸处在高浓度离液剂及低ph溶液中时,能够特异地吸附到硅类介质表面,并在低盐高ph溶液中解离下来,从而实现dna抽提。其中磁珠由于具有磁性内核,常在工作站上使用,实现dna的自动化提取,但针对痕量,超微量检材dna提取效率低,样本检测成功率不太乐观。硅珠提取法由于不具有磁性核心,所以规避不掉离心步骤,正是这点,目前还没有一台硅珠自动提取工作站,但硅珠介质相比磁珠介质有很多优势,体现在颗粒大小,吸附比表面积,均一性;另外一方面则是硅珠提取过程中,dna和硅珠形成的复合物通过离心收集相比磁珠法采用的磁力收集损失要少很多,另外在处理一些较脏的检材方面相比磁珠法有很大优势,很大程度上提高dna得率。传统硅珠法提取dna方法,主要有以下几个缺点:1、裂解操作繁琐,将检材放进离心管内,加入适量的裂解液后升温裂解,裂解结束后将裂解产物吸出转移至新的离心管或用镊子将检材取出,这些步骤很繁琐,尤其当检材量较大时容易出错。2、裂解产物损失大,传统方法无论是将裂解产物转移至新管还是用镊子将检材取出都会损失检材本身所粘吸的裂解产物,因为此时细胞已经破裂,此时损失裂解产物意味着dna的直接损失。3、裂解效率不高,传统硅珠法裂解液中含有异硫氰酸胍,胍盐做为一种变性剂,能够在一定程度上抑制蛋白酶k的活性,直接影响裂解效果。4、吸附效率不高,传统硅珠法的硅珠吸附dna主要依靠异硫氰酸胍及缓冲盐提供的高盐及低ph环境,吸附效率经测定后发现不到60%。5、洗脱效率不够,传统硅珠法洗脱较常用的是ph8.0的te或水,仅依靠高ph和低盐环境来洗脱dna,实验发现很大部分dna依然残留在硅珠上,所以有些厂家的硅珠提取试剂盒倡导带珠扩增,但带珠扩增的弊端显而易见。技术实现要素:本发明的目的是为克服上述现有技术的不足,提供一种基于硅类介质微球超微量dna提取纯化试剂盒。为实现上述目的,本发明采用下述技术方案:一种基于硅类介质微球超微量dna提取纯化试剂盒,包括裂解部分、吸附部分、漂洗部分和洗脱部分,所述裂解部分包括离心管及配套的提篮,在提篮的底部设有滤膜,该滤膜在不离心的情况下依靠张力阻挡水分渗透(保证检材加热裂解时裂解液不会渗透到离心管中,裂解完后在离心力作用下,液体能够顺利穿过滤膜下到离心管中,同时滤膜还发挥了一定程度的过滤除杂功能,有效挡住检材中的颗粒或絮状杂质,但不影响目标dna分子的通过,离心死角小,能有效控干诸如棉签等检材吸附的裂解液,实现最大程度地获得裂解产物);所述吸附部分包括结合缓冲液、硅类介质微球悬浮液、吸附增强剂,硅类介质微球的表面至少含有硅羟基,吸附增强剂的溶剂为水,溶质包括:质量浓度3~10%质子或非质子溶剂,80~120μg/ml外源添加的dna短片段扩增产物;所述洗脱部分包括高效洗脱液,高效洗脱液的溶剂为水,溶质包括:5~20mm的tris-hcl、0.5~2mm螯合剂、0.1~5mm多价阴离子,ph8.0~9.0。优选的,所述提篮嵌设于离心管内,提篮与离心管共用盖子,密闭性好,颠倒混匀不漏液。进一步优选的,所述提篮设有泄压槽,消除裂解加热过程中由于气压膨胀导致冲开盖子发生交叉污染的隐患。优选的,所述裂解部分还包括裂解液,裂解液的溶剂为水,溶质包括:5~50mm的tris-hcl、0.5~3wt%表面活性剂、0.5~20mm螯合剂、0.5~1.5m盐酸胍、50~120mm的氯化钠和0.5~3mg/ml的蛋白酶k,ph7.2~8.5。进一步优选的,所述表面活性剂为离子型表面活性剂或非离子表面活性剂,更进一步优选为非离子表面活性剂,更进一步优选为吐温20(tween-20)、吐温40(tween-40)、吐温80(tween-80)、tritonx-100、np40或span20,更进一步优选为tritonx-100。通常认为阴离子表面活性剂如sds、sls在加热的过程中会和蛋白质结合形成雪茄形复合物,此类物质显示出负电荷,会和dna竞争结合至硅类介质微球表面,影响目标dna分子的吸附效率。阳离子表面活性剂会直接和dna结合,影响其吸附至硅类介质微球表面。优选的,所述结合缓冲液的溶剂为水,溶质包括:40~150mm的tris-hcl、1~5wt%表面活性剂、5~6m的离液剂、10~50mm螯合剂和体积浓度20~35%的醇含量,ph5.2~6.0。进一步优选的,所述表面活性剂为离子型表面活性剂或非离子表面活性剂,更进一步优选为非离子表面活性剂,更进一步优选为吐温20(tween-20)、吐温40(tween-40)、吐温80(tween-80)、tritonx-100、np40或span20,更进一步优选为tritonx-100。通常认为阴离子表面活性剂如sds、sls在加热的过程中会和蛋白质结合形成雪茄形复合物,此类物质显示出负电荷,会和dna竞争结合至硅类介质微球表面,影响目标dna分子的吸附效率。阳离子表面活性剂会直接和dna结合,影响其吸附至硅类介质微球表面。进一步优选的,所述醇为乙醇、甲醇或异丙醇中的任一种,更进一步优选为异丙醇。通常一份异丙醇相当于2~2.5份乙醇。尤其适合加入体积有限制的情形,能够增加dna的疏水作用,促进dna与硅类介质微球的结合效率。进一步优选的,所述离液剂选自盐酸胍、异硫氰酸胍、碘化钾、硫氰酸钾、高氯酸钠、氯化锂或其组合,更进一步优选为盐酸胍或异硫氰酸胍,更进一步优选为异硫氰酸胍。通常离液剂浓度不能过高,因过高会导致蛋白质变性和dna降解,并从溶液中沉淀出来。高浓度的离液剂能够引起蛋白质打开折叠等二级结构并加大蛋白质和双链dna溶解。原理通常被认为是离液剂破坏了其所在溶液体系中的氢键,促使变性的蛋白质和dna表现出比其天然构象更高的热动力学稳定性,从而保证dna优先结合至硅类介质微球上。优选的,所述硅类介质微球悬浮液包括分散液和硅类介质微球,分散液为水,硅类介质微球为硅珠、磁珠、硅藻泥或玻璃奶,进一步优选为硅珠。优选的,所述硅类介质微球悬浮液含质量分数6%的微球,粒径1~10μm,该微球经酸化预处理,其ph值小于5,进一步优选为1.8。进一步优选的,酸化预处理通过加入酸实现,所述酸为无机酸或有机酸,无机酸选自盐酸或硝酸,有机酸选自醋酸或甲酸。更进一步优选的,酸化预处理通过加入盐酸实现,具体步骤如下:1)称取6g硅类介质微球,在100ml纯水中震荡分散后静置4小时,重复2次;2)移去上清,加入1mol/l盐酸50ml,震荡分散后静置24小时;3)移去上清,加入100ml纯水作为分散液,ph调至1.8。室温保存即可。优选的,所述吸附增强剂中,外源添加的dna短片段扩增产物是经如seqidno.1和seqidno.2所示一对引物扩增获得,片段长度在100-200bp区间内,因为硅类介质微球对小片段的吸附效率较低,从而避免和目标dna分了竞争结合微球的负面效应。5'-caacaaagcgagtgtggagc-3',seqidno.15'-gttccttgcgggcatttagc-3',seqidno.2优选的,所述吸附增强剂中的质子或非质子溶剂为n,n-二甲基甲酰胺(dmf)或乙腈,进一步优选的乙腈。优选的,所述漂洗部分包括漂洗液,其为体积浓度60~90%的乙醇水溶液。优选的,所述高效洗脱液中的多价阴离子为柠檬酸根离子、酒石酸根离子、磷酸根离子、硝酸根离子、硫酸根离子或盐酸根离子中的任一种,更进一步优选为磷酸根离子。因为dna分子也含有磷酸根离子,阴离子通常可以发挥一定的取代作用,把同是带负电的dna从硅类介质微球上竞争洗脱下来。一种利用上述试剂盒进行超微量dna提取的方法,具体步骤如下:(1)检材准备:取一根湿棉签擦拭凶器表面潜在斑迹后另取一根干棉签再次擦拭,将棉签头折断转移到离心提篮中,提篮置于配套离心管中,并编号记录;(2)细胞裂解:往检材中加入裂解液,混匀,金属干浴或水浴56℃加热30分钟,上机离心弃提篮,留下离心管及其中的裂解产物至下一步;(3)dna吸附:向离心管中加入结合缓冲液和硅珠悬浮液,混匀后加入吸附增强剂,混匀常温静置吸附;(4)漂洗除盐:吸附结束后离心,弃尽上清液,加入漂洗液震荡混匀,充分去除盐份和杂质;(5)洗脱:将漂洗液经离心弃尽后离心管室温晾干,挥发残留的醇,加入洗脱液,震荡混匀后洗脱,吸出扩增或-20℃保存。优选的,进行精斑、毛发或指甲中的dna提取时,应在裂解液中加入0.03~0.05m的二硫苏糖醇,用于破坏特殊细胞膜外膜结构。本发明的有益效果:本发明的吸附增强剂和高效洗脱液不只适用于硅珠提取试剂盒,同样适用于基于glassmilk,硅藻土,磁珠dna提取试剂盒。本发明涉及一种改良过的基于硅类介质微球超微量dna提取纯化试剂盒,包括有裂解、吸附、漂洗、洗脱四个部分,裂解部分主要针对除检材部分进行了优化,方便操作的同时最大限度地获得裂解产物,设计出离心管及配套的具有过滤功能的提篮;吸附部分主要发明了一种吸附增强剂,增加疏水作用,消除管壁静电效应,促进dna和硅类介质微球表面基团作用,使得吸附效率大幅提高;洗脱部分则发明了一种高效洗脱液,创新性地采用竞争洗脱原理,能够显著提高dna洗脱效率,减少硅类介质微球表面dna的残留。本案改良过的基于硅类介质微球超微量dna提取纯化试剂盒,操作简单,提取的dna得率高,纯度高、片段完整,综合以上特点尤其适合超微量生物检材dna的提取,满足了日益提出的高检出率要求。本发明所提供的试剂及试剂盒不仅能够实现从各种常规生物检材(血斑、精斑、唾液斑、毛发、组织、烟头、口腔擦拭物、水瓶口擦拭物)中提取纯化dna,且能够满足对痕量dna(指纹,手套印,鼠标,网线,钱包,手机等接触性检材上遗留的脱落细胞)的提取要求。利用本发明试剂纯化所得的dna无需进一步纯化即可应用于下一步检测,如dna定量、测序、str检测和snp检测等。本发明的试剂及其试剂盒纯化的dna特别适合于pcr扩增检测。本发明整体操作简单,和传统硅珠法相比优势集中体现在裂解环节,离心管及配套的提篮设计功妙地把步骤简化;大批量提取时也不易出错;裂解效果好,盐酸胍替代异硫氰酸胍保证蛋白酶k的活性使得细胞的充分裂解以释放最大量的dna;dna提率高,能够达到76%以上的提取效率。具体如下:1、本发明通过一套离心管和配套提篮将裂解步骤简化,裂解结束后离心直接丢弃装有裂解完后的检材即可进入dna吸附环节,操作简化,不易出错。本发明的提篮具有过滤功能,使得检材上粘附的裂解产物能够在离心力的作用下完全控干,最大化避免dna在提取操作过程的直接损失,实现最大程度地获得dna裂解产物,提高dna得率。本发明的裂解液将异硫氰酸胍更换成了盐酸胍,经实验验证,盐酸胍做为一种较异硫氰酸胍更为温和的变性剂,对蛋白酶k的活性影响可忽略不计。2、吸附效果好,在传统的配方上增加了吸附增强剂,包括3~10%质子或非质子溶剂,80~120μg/ml外源添加的dna短片段扩增产物。针对超微量样本提取核酸时,起到高效吸附核酸的作用。因为常用的试管壁都是聚丙烯的材料,管壁上有静电,会吸附核酸,在提取纯化过程中采用外源添加的dna短片段扩增产物可帮助去除静电效应,使得dna能很好被吸附硅类介质微球上,从而达到尽可能大的回收样本中核酸;质子或非质子溶剂可以进一步增强dna的疏水性,促使dna向硅类介质微球靠扰,增加吸附机率。3、洗脱效率高,创新性引入竞争洗脱的概念,在洗脱液中加入带负电的阴离子,可有有效地把同样带负电的dna从硅类介质微球上竞争下来,提高洗脱效率;纯化能力强,能够在混合有大量pcr抑制剂或污染物的样本中得到足够纯且可完全满足于下游pcr、dna测序,实时荧光定量等操作的dna;灵活的试剂体系,通过扩大试剂的操作体系,可实现大体积样本中所含微量dna样本的富集;广泛的生物样品适用范围,能够实现大多数生物样品的dna提取。附图说明图1是凶器上的痕量潜血斑str分型图谱;图2是手机home键脱落细胞str分型图谱。具体实施方式下面结合附图和实施例对本发明进行进一步的阐述,应该说明的是,下述说明仅是为了解释本发明,并不对其内容进行限定。实施例1:提取纯化凶器上的痕量潜血斑迹中的dna以及效果验证一、提取纯化凶器上的痕量潜在血液斑迹的dna以及str检测分析1、试剂如下:裂解液:溶剂是水,溶质包括如下物质:25mm的tris-hcl、1.5wt%tritonx-100、10mmedta、1.2m盐酸胍、100mm的氯化钠和2mg/ml的蛋白酶k,ph7.5。结合缓冲液:溶剂是水,溶质包括如下物质:100mm的tris-hcl、3wt%tritonx-100、25mmedta、5.7m的异硫氰酸胍、30%的异丙醇。ph5.5,使用时配合吸附增强剂使用。吸附增强剂:溶剂是水,溶质包括如下物质:5%乙腈、110μg/ml外源添加的dna短片段扩增产物。漂洗液:75%的乙醇水溶液。洗脱液:溶剂是水,溶质包括如下物质:10mm的tris-hcl、1mmedta,2mm磷酸氢二钠和磷酸二氢钠,ph8.5。硅类介质微球悬浮液:含质量分数为6%酸处理过的硅珠,粒径为1-10um,ph值为1.8。2、用步骤1的试剂纯化提取dna步骤1)检材准备:取一根湿棉签擦拭凶器表面潜在斑迹后另取一根干棉签再次擦拭,将棉签头折断转移到离心提篮中,提篮置于配套离心管中,并编号记录;步骤2)细胞裂解:往检材中加入300μl的裂解液,混匀,金属干浴或水浴56℃加热30分钟,上机离心弃提篮,留下离心管及其中的裂解产物至下一步;步骤3)dna吸附:向离心管中加入900μl结合缓冲液和20-50μl硅珠悬浮液,混匀后加入1μl吸附增强剂,混匀常温静置吸附10分钟(注:吸附增强剂务必在结合缓冲液之后加入);步骤4)漂洗除盐:吸附结束后9000rcf离心1min后弃尽上清液,加入1ml漂洗液震荡混匀,充分去除盐份和杂质;步骤5)若检材较脏,可以加一次漂洗步骤;步骤6)洗脱:将漂洗液经离心弃尽后离心管室温晾干8-10min,挥发残留的醇,根据需要加入20-200ul洗脱液,震荡混匀后56℃1200rpm混匀洗脱10-15分钟,吸出扩增或-20℃保存。3、str检测分析将步骤2提取的dna进行str复合扩增,复合扩增采用的是市售的商业str复合扩增试剂盒(如美国abi公司的id试剂盒)。然后用3500型遗传分析仪检测,结果如图1所示,str位点完整,分型准确,无等位基因丢失,不平衡扩增,pullup峰,stutter带、spike峰等现象表现,表明该纯化方法纯化效率高,得到的dna纯度高,完整性好。二、dna吸附效率评价采用50、100、150、200ngdna标准品(9947a,agcu公司)作为初始dna,每个浓度设三个重复。采用步骤1提供的试剂进行吸附效率测定,nanodrop2000测定上清液中的dna量,并按照公式(吸附效率=(加入dna标准品的量-上清液中的dna量(ng)/加入dna标准品的量(ng))计算得出dna吸附效率。表1、不同加入量的标准品dna吸附效率检测结果三、dna提取效率评价采用已知数量细胞液做为标准品,稀释到200个/μl,取15根棉签,三根一组,一共分为五组,一到五组分别滴加1μl、2μl、3μl、4μl、5μl的细胞稀释,晾干后,采用步骤1提供的试剂进行提取效率测定,采用相同的洗脱体积,最后洗脱下来的dna经nanodrop2000测定dna含量及od260/280值,结果取每组三个重复的平均值。并按照公式(提取效率=洗脱得到的dna量(ng)/加入dna标准品的量(ng))计算得出dna提取效率。人的一个上皮细胞中dna含量约为5.6×10-6μg。表2、不同体积细胞稀释液中提取的dna浓度检测结果实施例2:提取载玻片上的指纹dna以及效果验证1、选取干净的载玻片20枚,选取任一个手指按压载玻片,力度适中并维持5-7s,每根手指对应一张载玻片,然后采湿干棉签法采集载玻上留下的脱落细胞,采用实施例1步骤1提供的试剂进行dna提取纯化。2、str检测分析将实施例2步骤1提取的dna进行str复合扩增,复合扩增采用的是市售的商业str复合扩增试剂盒(如美国abi公司的id试剂盒)。然后用3500型遗传分析仪检测,结果20个指纹检材中成功检测出6枚完整的图谱,剩下的检材有基因座丢失的现象,检测统计结果见表3所示。表3、模拟指纹检材str检测结果(str位点数16个)序号检出str数检材数116621483103483实施例3:提取手机home键上脱落细胞dna以及效果验证1、将手机home键用消毒酒精擦拭干净后,正常使用1-2分钟,然后采湿干棉签法采集手机home键上留下的脱落细胞,采用实施例1步骤1提供的试剂进行dna提取纯化。2、str检测分析将实施例3步骤1提取的dna进行str复合扩增,复合扩增采用的是市售的商业str复合扩增试剂盒(如美国abi公司的id试剂盒)。然后用3500型遗传分析仪检测,str位点完整,分型准确,除稍显不均衡外无其他问题,表明该纯化方法纯化dna得率高,完整性好。结果如图2所示。上述虽然结合附图对本发明的具体实施方式进行了描述,但并非对本发明保护范围的限制,在本发明的技术方案的基础上,本领域技术人员不需要付出创造性劳动即可做出的各种修改或变形仍在本发明的保护范围以内。序列表<110>海宁市公安局上海锦博生物技术有限公司无锡中德美联生物技术有限公司<120>一种基于硅类介质微球超微量dna提取纯化试剂盒<160>2<170>siposequencelisting1.0<210>1<211>20<212>dna<213>人工序列(artificialsequence)<400>1caacaaagcgagtgtggagc20<210>2<211>20<212>dna<213>人工序列(artificialsequence)<400>2gttccttgcgggcatttagc20当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1