高通量微流控芯片、其制备方法及应用与流程
本发明属于药物化学领域,具体涉及一种高通量微流控芯片,及其制备方法和应用。
背景技术:
高通量的药物筛选是指在分子或细胞水平上,利用微板等作为筛选工具,以快速灵敏的自动化检测手段对大量的样品进行检测,因此对于新药的发现与评估具有重要意义。目前高通量的药物筛选主要借助微孔板实现,尽管其解决了传统药物筛选方法的耗时长、成本高等弊端,但仍然存在一些亟待解决的问题:基于微孔板的药物筛选由于细胞培养平台过于简单,不能模拟动物乃至人体内的细胞-细胞、细胞-微环境之间的相互作用。
与微孔板相比,微流控芯片操作所需的细胞量少,因其具有微米尺度空间以及相对独立、封闭环境等优点,在药物筛选等领域应用广泛。目前,微流控芯片细胞水平的药物筛选主要通过以下几种方式:(1)基于灌流模式的高通量筛选。(2)基于微液滴的高通量筛选。(3)微阵列模式的高通量筛选。虽然以上技术手段能够提高药物筛选的通量,但是对于研究细胞-细胞,细胞-微环境的相互作用方面来说,这些微流控芯片的设计仍然不能实现对细胞微环境进行精确控制和操纵。另外,对于细胞间识别成像分析来说,现有的基于微流控芯片的药物筛选主要通过荧光强弱等信号读出,且图像分析参数单一,速度低。因此,目前的基于微流控细胞水平的药物筛选平台在细胞-微环境的相互识别及图像分析方面仍然存在很大的局限性。
先前的文献报道了一种可以进行用于神经元及胶质细胞共培养的微流控芯片,用于研究胶质细胞对神经细胞转染效率的影响。尽管这种微流控芯片能够实现不同细胞的共培养,但是不能够满足药物筛选的高通量需求。此外,传统的基于微流控芯片的药物筛选,在表征药物代谢及细胞毒性的过程中,通常使用荧光信号进行表征,或者将芯片与esi-q-tof质谱分析仪联用。虽然这种微流控芯片与质谱联用的筛选平台能够实现药物筛选的目的,但是采用质谱进行药物代谢的评价具有很大的局限性,一方面,质谱分析手段繁琐,尤其对于蛋白质的分析,质谱分析过程繁琐,适用范围窄。另一方面,现有方法图像分析参数单一,速度低且难以定量。
技术实现要素:
因此,本发明的目的在于克服现有技术中的缺陷,提供一种高通量微流控芯片,及其制备方法和应用。
在阐述本发明内容之前,定义本文中所使用的术语如下:
术语“pdms”是指:聚二甲基硅氧烷。
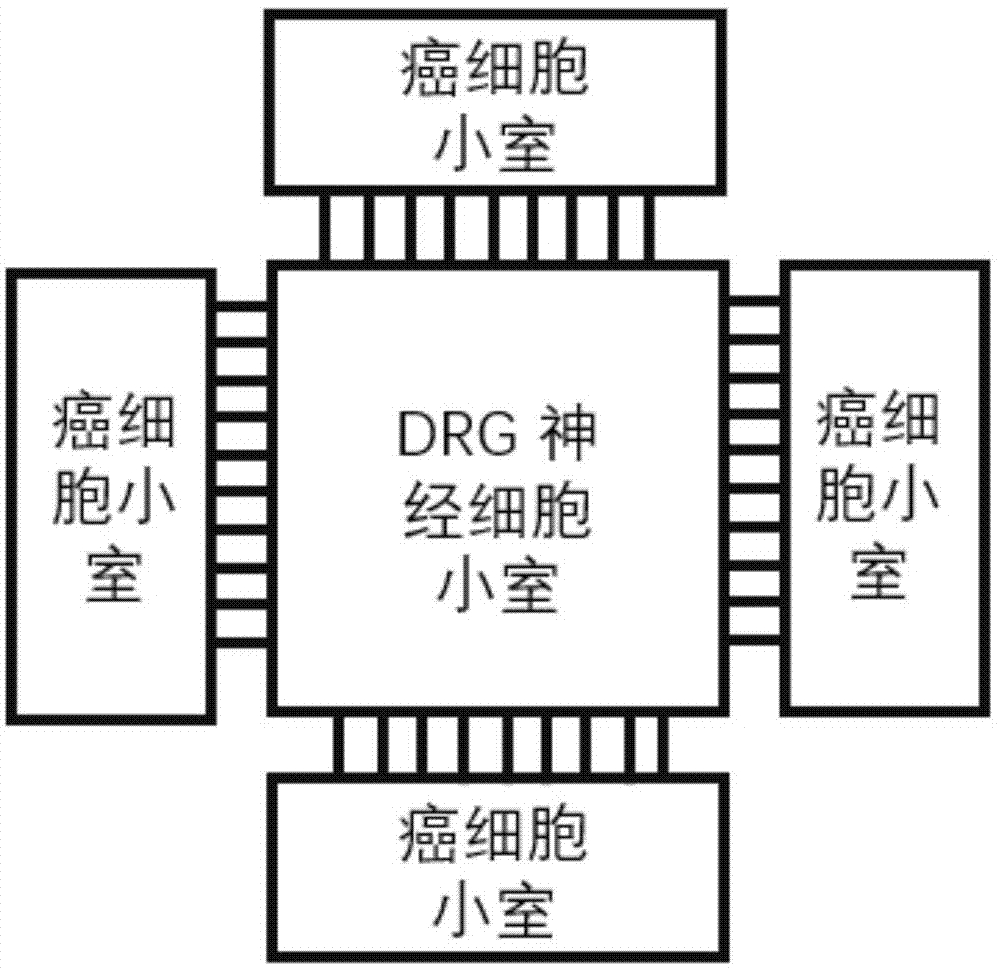
为实现上述目的,本发明的第一方面提供了一种高通量微流控芯片,所述微流控芯片包括:位于中央的神经细胞小室和位于所述神经细胞小室周围的癌细胞小室,所述神经细胞小室和癌细胞小室中间通过微通道连接;
优选地,所述微流控芯片包括2~6个癌细胞小室,最优选为4个。
根据本发明第一方面的微流控芯片,其中,所述神经细胞小室的长度为1~10mm,优选为2~6mm,最优选为4mm;
所述神经细胞小室的宽度为1~10mm,优选为2~6mm,最优选为4mm;和/或
所述神经细胞小室的厚度为10~200μm,优选为50~150μm,最优选为100μm。
根据本发明第一方面的微流控芯片,其中,所述癌细胞小室的长度为1~10mm,优选为2~6mm,最优选为4mm;
所述癌细胞小室的宽度为1~10mm,优选为1~3mm,最优选为2mm;和/或
所述癌细胞小室的厚度为10~200μm,优选为50~150μm,最优选为100μm。
根据本发明第一方面的微流控芯片,其中,所述微通道的长度为100~500μm,优选为100~300μm,最优选为200μm;
所述微通道的宽度为5~50μm,优选为5~20μm,最优选为10μm;和/或
所述微通道的厚度为5~50μm,优选为5~20μm,最优选为10μm。
本发明的第二方面提供了第一方面所述的微流控芯片的制备方法,所述方法包括以下步骤:
(1)设计微流控芯片,打印掩膜版;
(2)利用光刻技术制备模板;
(3)在模板上浇筑pdms预聚物,加热,从掩膜版上剥下所述pdms得到所述微流控芯片。
根据本发明第二方面的制备方法,其中,所述步骤(3)中,所述pdms预聚物中,pdms与交联剂的质量比为5~20:1,优选为5~15:1,最优选为10:1。
根据本发明第二方面的制备方法,其中,所述步骤(3)中,所述加热温度为50~150℃,优选为50~100℃,最优选为80℃。
本发明的第三方面提供了一种高通量药物筛选平台,所述平台包括:
第一方面所述的微流控芯片;和
高内涵成像系统。
本发明的第四方面提供了第一方面所述的第一方面所述的微流控芯片或第三方面所述的高通量药物筛选平台在制备药物筛选产品尤其是高通量药物筛选产品中的应用。
根据本发明第四方面的应用,其中,所述药物为神经-肿瘤微环境相关药物。
本发明的目的是基于一种具有高通量特性的微流控芯片,作为细胞-细胞、细胞-微环境识别的平台,利用高内涵成像系统及一种特殊的计算机图像分析算法对癌细胞与神经突之间的相互作用进行批量分析统计,以期成功筛选出与神经-肿瘤微环境相关的抗癌药物。
根据文献报道,许多癌细胞分泌神经生长因子(如ngf等)及神经营养因子(如bdnf,gal,nt-3等),这些细胞因子的表达与神经——肿瘤微环境的形成密切相关。本发明基于一种具有微通道的微流控芯片,作为癌细胞——神经突相互识别的平台,并结合高内涵成像分析系统以及独特的图像分析算法,对不同的sirna进行高通量筛选。
本发明中的微流控芯片不仅具有可以提供神经突定向生长的微通道,可以实现不同细胞的共培养。而且这种芯片具有五个小室,在中心小室培养神经元,四周小室进行不同药物筛选,并且结合12孔板,可以一次性实现48种不同的药物,具有高通量的特点。
本发明中的微流控芯片可以实现对神经突生长的精确控制,不同小室的设计可以实现对神经与癌细胞的共培养。此外,这种微流控芯片具有高通量的特点,与invitroscientific公司的12孔板相匹配,可以一次性筛选48种不同的药物。此外,本发明采用的独特图像分析算法,可以对癌细胞迁移过程中与神经突间相互识别的形态进行评价。
本发明中的微流控芯片作为一个细胞共培养的高通量分析平台,结合高内涵细胞,建立了体外高通量药物筛选平台,对于细胞进行自动的实时成像观察,实现了操作的便捷性;此外,本发明采用独特的图像分析算法,可满足药物研发的所有需求。
本发明的高通量微流控芯片可以具有但不限于以下有益效果:
本发明涉及采用微流控芯片联合高内涵成像系统进行高通量药物筛选的领域,可以用于筛选与神经-肿瘤微环境相关的抗肿瘤药物(包括小分子抗癌药物、sirna、crispr/cas9体系等),并且可以对同一药物在不同类别癌细胞体系中的抗肿瘤效果进行评价,这种基于高通量的微流控芯片的细胞间识别成像的筛选体系使得药物筛选的速度大大提高,节约了时间和成本。本发明在高通量药物筛选领域有广阔的应用前景。此外,本发明中所应用的图像分析算法对于研究肿瘤微环境中细胞间相互作用的机理具有重要意义。
附图说明
以下,结合附图来详细说明本发明的实施方案,其中:
图1示出了本发明高通量的微流控芯片示意图。
图2示出了试验例1中本发明高通量的微流控芯片不同小室对神经与癌细胞的共培养,其中图2a示出了本发明中高通量的微流控芯片实物图,图2b示出了海马神经元与胶质瘤细胞的共培养。
图3示出了不同药物处理下的胶质瘤与海马神经元共培养,不同时间点下胶质瘤细胞的迁移轨迹的追踪,其中3a示出了未经任何药物处理的胶质瘤细胞随神经突的迁移轨迹(对照组),图3b示出了经过ngf-sirna处理后的胶质瘤细胞随神经突的迁移轨迹(实验组),图3c示出了经过bdnf-sirna处理后的胶质瘤细胞随神经突的迁移轨迹(实验组)。
图4示出了不同药物处理(空白,ngf-sirna,bdnf-sirna)的胶质瘤细胞,在相同视野大小内的癌细胞数量不同,反映了药物处理(ngf-sirna,bdnf-sirna)后胶质瘤细胞迁移能力明显减弱。
图5示出了试验例2中不同sirna处理过的panc-1细胞沿神经突迁移能力变化的追踪。
图6示出了不同细胞器网络之间的通讯机制以及与之对应的图像分析算法,其中图6a示出了通过囊泡进行的细胞识别,图6b示出了通过膜融合的细胞识别,图6c示出了通过膜受体的细胞识别
具体实施方式
下面通过具体的实施例进一步说明本发明,但是,应当理解为,这些实施例仅仅是用于更详细具体地说明之用,而不应理解为用于以任何形式限制本发明。
本部分对本发明试验中所使用到的材料以及试验方法进行一般性的描述。虽然为实现本发明目的所使用的许多材料和操作方法是本领域公知的,但是本发明仍然在此作尽可能详细描述。本领域技术人员清楚,在上下文中,如果未特别说明,本发明所用材料和操作方法是本领域公知的。
以下实施例中使用的试剂和仪器如下:
试剂:
pdms预聚物,购自美国道康宁,道康宁sylgard184硅橡胶由液体组分组成的双组分套件产品,包括基本组分与固化剂,基本组分与固化剂按10:1重量比完全混合。
胶质瘤t98g细胞系购自盖宁生物,
胰腺癌panc-1细胞系及前列腺癌pc-3细胞系均购自北京鼎国昌盛生物技术有限公司
结肠癌caco2细胞系购自康为世纪,乳腺癌mcf-7细胞系购自凯基生物。
海马神经元神经及背根神经节(drg)神经取自出生24小时内的sd大鼠(动物由维通利华提供)。
dmem培养基,dmem/f12培养基,胎牛血清,双抗及胰酶均购自宝如亿(北京)生物技术有限公司,品牌为invitrogen(lifetechnologies)。
胶原酶购自北京鸿跃创新科技有限公司,品牌为invitroscientific。
dna酶购自北京普益华科技有限公司,品牌为sigma。
neurobasalmedium及n27均购自英潍捷基(上海)贸易有限公司,品牌为invitrogen(lifetechnologies)。购自。
实施例1
本实施例用于说明本发明药物筛选平台的制备方法。
1、微流控芯片的结构。
本发明中提及的具有高通量的微流控芯片如图1所示。
这种高通量的微流控芯片尺寸具体为:中间drg神经细胞小室长为4mm,宽为4mm,厚度为100μm;四个癌细胞小室的尺寸为:长4mm,宽2mm,厚度100μm;癌细胞小室与drg神经细胞小室中间通过200μm的微通道连接,微通道的宽为10μm,厚度为10μm。这种微流控芯片尺寸大小符合invitroscientific公司的12孔玻璃底板。
2、高通量的微流控芯片的具体制作步骤如下:
采用autocad软件按照上述尺寸设计微流控芯片,采用高分辨率打印得到掩膜版,利用光刻技术制备模板,在模板上面浇筑pdms预聚物(pdms:交联剂质量比为10:1)并置于80℃烘箱使其交联聚合,将聚合后的pdms从掩膜版上剥下,从而pdms材质的微流控芯片。在芯片的每个小室两侧进行打孔形成微流控通道,并置于高压灭菌锅中灭菌(121℃,15psi,15min)。
3、本发明中细胞培养条件如下:
本发明采用了胶质瘤t98g细胞系,胰腺癌panc-1细胞系,前列腺癌pc-3细胞系,结肠癌caco2细胞系,乳腺癌mcf-7细胞系,海马神经元以及背根神经节(drg)神经进行了神经-肿瘤细胞间识别的药物筛选研究。
胶质瘤t98g细胞,胰腺癌panc-1细胞及乳腺癌mcf-7细胞的培养环境为:dmem培养基+10%胎牛血清+1%双抗。
结肠癌caco2细胞的培养环境为:dmem培养基+20%胎牛血清+1%双抗。
前列腺癌pc-3细胞系的培养环境为:dmem/f12培养基+10%胎牛血清+1%双抗。
海马神经元的分离与培养:于冰上将出生24h内的sd系乳鼠断头处死并用箭头镊将头皮、软骨和脑膜剪开并向两侧分离,使脑组织暴露,用镊子将整个大脑挑至盛有预冷解剖液的培养皿中。在解剖镜下用镊子将两个大脑半球翻开,夹除海马区周围的毛细血管,将海马小心剥离出来放至另一培养皿中。用镊子将海马分离成1×1mm的小块,转至离心管中,用0.25%的胰酶于37℃水浴锅中消化15min,并每隔5min摇晃一次离心管使海马组织与消化液充分接触。消化结束后,用dmem培养基终止消化并轻轻漂洗两遍。利用无菌吸管对海马组织进行吹打5-10次,将细胞悬液离心(1300rpm×3min)后弃上清,底部的海马神经元重悬于神经元培养基中(neurobasalmedium+10%n27+1%双抗)。
drg神经元的分离与培养:于冰上将出生24h内的sd系乳鼠断头处死并取其脊椎,利用无菌咬骨钳暴露脊髓,将分布于脊髓两侧的背根神经节取下,放入预冷的dmem培养基中。用dmem培养基轻轻漂洗drg组织并转移至15ml离心管中,用10×消化液(配方为:胰酶4mg/ml,胶原酶10mg/ml及dna酶1mg/ml)于37℃消化30min,并每隔5min摇晃一次离心管使drg组织与消化液充分接触。消化结束后,用dmem培养基终止消化并轻轻漂洗三遍。利用无菌吸管对drg组织进行吹打5-10次,将细胞悬液离心(1300rpm×3min)后弃上清,底部的drg神经元重悬于神经元培养基中(neurobasalmedium+10%n27+1%双抗)。
4.癌细胞的药物预处理方案如下:
将不同的sirna(ngf-sirna,bdnf-sirna,gal-sirna,nt3-sirna,nsrna)分别与lipofectamine3000室温孵育5min(sirna的终浓度为100nm),使其形成脂质体-sirna复合物。将上述五种不同的脂质体-sirna复合物分别于胰腺癌panc-1细胞于细胞培养箱中孵育48h。此外,前列腺癌pc-3细胞,结肠癌caco2细胞,乳腺癌mcf-7细胞的药物处理方式同上所述。
5.微流控芯片联合高内涵系统的药物筛选平台的建立
将invitroscientific公司的12孔玻璃底板用100μg/ml的多聚赖氨酸进行过夜处理后用pbs洗涤并晾干,将灭菌后的微流控芯片置于12孔板中,使芯片与玻璃板底形成密封的通道。
将神经元以1×107的密度注入到芯片的drg神经细胞小室中,采用神经元培养基培养4天左右,可以观察到神经突能够沿着200μm的微通道进行生长并到达癌细胞小室的一侧。当神经突生长至癌细胞小室时,将第4步中药物预处理过的癌细胞以6×106的密度分别加到不同的癌细胞小室中,待其贴壁后,用镊子轻轻将芯片移除,加入神经元培养基培养。将移除芯片的12孔板放至高内涵成像系统中,环境控制设置为37℃,5%co2;采用数字相差模式对细胞进行连续8h成像观察。
6.神经-肿瘤细胞间识别的图像分析
进入高内涵“harmony”软件的“imageanalysis”模块,选用“cellmigration:tracking”分析模块,对癌细胞8h内的迁移能力进行评估,可以得到不同药物对癌细胞迁移能力的影响。
对采集到的图像轨迹进行后处理,进行统计数据分析及数据挖掘,建立细胞-细胞相互识别的数学模型,使用生物图像信息学技术定量表征癌细胞边缘的突出和回缩,对肿瘤细胞沿神经突的迁移进行定量评价,得出癌细胞的形态动力学变化曲线。
试验例1
本试验例用于说明本发明微流控芯片对神经突生长的精确控制。
本发明中的微流控芯片可以实现对神经突生长的精确控制,不同小室的设计可以实现对神经与癌细胞的共培养。结果如图2所示。此外,这种微流控芯片具有高通量的特点,与invitroscientific公司的12孔板相匹配,可以一次性筛选48种不同的药物。
试验例2
本试验例用于说明本发明微流控芯片对药物的筛选。
通过这种微流控芯片进行胶质瘤-海马神经元共培养,并成功筛选出能够抑制肿瘤研神经突迁移的ngf-sirna及bdnf-sirna,结果如图3所示。此外,通过与高内涵系统联用,可以对药物筛选的结果进行定量评价,结果如图4所示。将微流控芯片与高内涵联用,增强了图像分析的速度和通量,可以对每个细胞进行轨迹追踪。图5为不同sirna处理过的panc-1细胞沿神经突迁移能力变化的追踪,点越分散,表明细胞迁移能力越强。从图5可以看出,经ngf-sirna处理过的panc-1细胞迁移能力明显减弱。
通过使用图像分析算法,可以对癌细胞迁移过程中与神经突间相互识别的形态进行评价。图6示出了不同细胞器之间的通讯机制,将每一种通讯机制设置为一种图像分析算法,利用这种算法可以分析癌细胞沿神经突迁移过程中的细胞识别机制。
尽管本发明已进行了一定程度的描述,明显地,在不脱离本发明的精神和范围的条件下,可进行各个条件的适当变化。可以理解,本发明不限于所述实施方案,而归于权利要求的范围,其包括所述每个因素的等同替换。
- 还没有人留言评论。精彩留言会获得点赞!