一种131I标记的抗CD80人-鼠嵌合抗体及其制备方法与流程
本发明涉及抗体标记技术领域,具体地说,涉及一种131i标记的抗cd80人-鼠嵌合抗体及其制备方法。
背景技术
放射免疫显像(radioimmunoimaging,rii)是将针对肿瘤相关抗原的特异性抗体用放射性核素标记后注入人体,随血流到达肿瘤组织,与肿瘤的相关抗原结合,从而使肿瘤组织局部放射性浓聚超过正常组织,然后用体外显像技术获得肿瘤的阳性显像图。放射性核素标记的抗肿瘤及其相关抗原的抗体,用作生物导弹,为肿瘤阳性显像剂,称为肿瘤免疫显像诊断技术,不仅可作为生长存活肿瘤的确定性检查,也可用来筛选适合于用不同的核素标记相同抗体作放射免疫治疗的病人。
放射免疫治疗(radioimmunotherapy,rit)是应用放射性核素标记的单克隆抗体治疗肿瘤的方法。它通过抗体特异性识别肿瘤细胞表面的特异抗原或肿瘤相关抗原,借助与抗体结合的放射性核素发射射线杀伤肿瘤靶细胞。放射免疫治疗剂由抗体和放射性核素两部分组成,抗体作为一种特殊性载体与放射性核素相结合,前者以生物导弹的方式通过识别肿瘤细胞的相应抗原自动导向肿瘤组织,则载体本身和放射性核素可以同时定位在肿瘤组织,利用浓聚在肿瘤组织内的放射性核素发射的β射线所产生的放射性生物学效应,破坏干扰肿瘤靶细胞的结构与功能,达到杀死肿瘤细胞的目的。该方法对正常组织的影响较小,为肿瘤内放射(免疫)治疗开辟了新途径。
恶性淋巴瘤是原发于淋巴结及其他器官淋巴组织的恶性肿瘤,分为霍奇金淋巴瘤(hl)和非霍奇金淋巴瘤(nhl)。发病主要以欧美国家常见,在美国nhl是发病人数增加最快的恶性肿瘤。我国nhl的发病率也一样在上升,其中90%以上淋巴瘤为nhl。nhl的发病原因目前还不十分明确,可能与感染有关,人口老龄化、hiv感染和环境污染可能是其发病率增长的原因。
共刺激因子cd80在免疫应答、自身免疫性疾病及肿瘤免疫中均起到重要作用。研究表明,一些恶性b淋巴细胞可高表达cd80分子,且该分子介导的信号与肿瘤细胞的恶性增殖和转移有关。因此,通过放射免疫显像技术检测细胞表面cd80分子的表达,或通过放射免疫治疗靶向杀死肿瘤细胞,为相关疾病的诊断和治疗提供了新的工具。
中国期刊《中国免疫学杂志》2009年第25卷第2期刊出的论文“cd80鼠-人嵌合抗体的cho细胞表达及体外生物学功能的初步研究”,在cho细胞中成功表达了抗人cd80鼠-人嵌合抗体ch4e5,具体方法为:构建含有嵌合重、轻链基因的表达载体pires/ch4e5;表达载体先转染293t细胞,fcm检测到ch4e5抗体的瞬时表达后,表达载体再转染cho细胞,构建稳定表达细胞株cho-ch4e5;proteing亲和层析法从cho-ch4e5细胞无血清培养上清中纯化ch4e5抗体。然后作者通过fcm检测了ch4e5抗体对膜型cd80的识别,并以丝裂霉素处理的正常人外周血单核细胞pbmcs为刺激细胞,以异体正常人外周血淋巴细胞pbls为反应细胞,用mtt法分析了ch4e5抗体的阻断作用,证实了在体外该嵌合抗体具有亲本抗体阻断cd80介导的共刺激信号的生物学活性。因此,抗人cd80鼠-人嵌合抗体ch4e5可用于肿瘤的治疗。苏州大学2008年硕士论文《cd80鼠-人嵌合抗体的构建、表达及生物学功能的初步研究》也详细地介绍了ch4e5的表达和生物学功能。
中国期刊《核技术》2009年第32卷第5期刊出的论文“iodogen法125i标记单克隆抗体10d9”,采用iodogen法,选择最佳标记条件进行125i标记单克隆抗体10d9。标记产物用sephadexg-50分离纯化,三氯醋酸(tca)法测定标记率和放化纯,并对标记物的免疫活性及稳定性进行分析。结果显示,125i标记10d9的最佳条件为iodogen用量10μg、10d9用量20μg、加入na125i22.2mbq、室温反应8min,125i-10d9的标记率为(84.10±3.18)%,放化纯为(98.49±1.14)%,比活度为933.51mbq/mg;125i-10d9与daudi细胞的特异性结合率为(23.21±1.14)%;标记物加到含1%bsa的pbs中放置3w后放化纯度仍>90%。结果表明:iodogen法125i标记10d9标记率和放化纯高,方法简便,标记物的稳定性好且能较好地保持其免疫活性。中国期刊《中国辐射卫生》2014年第23卷第5期刊出的论文“131i标记抗cd80单克隆抗体在荷瘤裸鼠体内的放射免疫显像”,采用iodogen法进行了抗cd80单克隆抗体4e5的131i标记,并对标记抗体的免疫活性及稳定性等进行了分析。结果131i标记单克隆抗体4e5的标记率为(78.3±2.4)%,放射化学纯度为(95.7±1.8)%;131i-4e5抗体与raji细胞的最大结合率为(36.1±2.6)%,131i-4e5抗体加入到血清中放置3天后放化纯度仍大于90%;荷瘤裸鼠注入131i-4e5抗体后,随时间的延长,肿瘤部位放射性浓聚逐渐增加,在72h时肿瘤显影最为清晰,t/nt值此时最大达到3.2。专利文献cn107286243a,公开日2017.10.24,公开了一种放射碘标记pd-l1单克隆抗体及其制备方法与应用。该方法包括:向磷酸盐缓冲液中加入pd-l1单克隆抗体、na131i溶液和氯胺-t进行反应,反应结束后,以与氯胺-t等量的偏重硫酸钠终止反应;其中,所述pd-l1单克隆抗体、所述na131i溶液和所述氯胺-t的用量配比为50μg:0.58-2.9mci:10-60μg;所述na131i溶液的量以131i的放射性活度计,结果表明该探针能够明显地靶向肿瘤组织,所得图像清晰。以上各文献均涉及抗体的放射性碘标记。
多肽或蛋白质的碘化标记方法很多,例如一氯化碘法、氯胺-t法、过氧化物酶法、iodogen法、电解标记法、连接标记法等。针对每种方法,不同的标记条件影响标记多肽或蛋白质的标记率、免疫活性、稳定性等。当碘化反应终止后,再选用各种生化或物理方法将被碘化的物质和游离碘分离,常用方法有透析、电泳、各种色谱技术等。分离的效果直接影响放化纯度。
目前未见具备优异的标记率、放射化学纯度、稳定性和特异性细胞结合率的放射性核素标记的抗cd80人-鼠嵌合抗体。
技术实现要素:
本发明的目的是针对现有技术中的不足,提供一种131i标记的抗cd80人-鼠嵌合抗体。
本发明的再一的目的是,提供所述131i标记的抗cd80人-鼠嵌合抗体的制备方法。
为实现上述第一个目的,本发明采取的技术方案是:
一种131i标记的抗cd80人-鼠嵌合抗体,其按照以下方法制备:
(1)使用10-100μgiodogen碘标管,加入0.04mpb+0.1mnacl溶液,继续加入抗cd80人-鼠嵌合抗体10-160μg,最后加入碘(131i)化钠18.5-111.0mbq,在常温下混合后反应4-12分钟,反应结束后将反应液吸出反应管;
(2)使用前用0.04mpb+0.1mnacl溶液平衡活化pd10柱,待溶液全部流干后弃去所有流出液,将步骤(1)的反应液加入到pd10柱上,待溶液全部流尽,弃去所有流出液,再加入0.04mpb+0.1mnacl至pd10柱淋洗产品,收集所有流出液即得产品。
作为一个优选例,所述131i标记的抗cd80人-鼠嵌合抗体按照以下方法制备:
(1)使用30μgiodogen碘标管,加入0.04mpb+0.1mnacl溶液,继续加入抗cd80人-鼠嵌合抗体80μg,最后加入碘(131i)化钠55.5mbq,在常温下混合后反应10分钟,反应结束后将反应液吸出反应管;
(2)使用前用0.04mpb+0.1mnacl溶液平衡活化pd10柱,待溶液全部流干后弃去所有流出液,将步骤(1)的反应液加入到pd10柱上,待溶液全部流尽,弃去所有流出液,再加入0.04mpb+0.1mnacl至pd10柱淋洗产品,收集所有流出液即得产品。
作为另一优选例,所述的131i标记的抗cd80人-鼠嵌合抗体的放化纯大于90%。
为实现上述第二个目的,本发明采取的技术方案是:
一种131i标记的抗cd80人-鼠嵌合抗体的制备方法,包括以下步骤:
(1)使用10-100μgiodogen碘标管,加入0.04mpb+0.1mnacl溶液,继续加入抗cd80人-鼠嵌合抗体10-160μg,最后加入碘(131i)化钠18.5-111.0mbq,在常温下混合后反应4-12分钟,反应结束后将反应液吸出反应管;
(2)使用前用0.04mpb+0.1mnacl溶液平衡活化pd10柱,待溶液全部流干后弃去所有流出液,将步骤(1)的反应液加入到pd10柱上,待溶液全部流尽,弃去所有流出液,再加入0.04mpb+0.1mnacl至pd10柱淋洗产品,收集所有流出液即得产品。
作为一个优选例,包括以下步骤:
(1)使用30μgiodogen碘标管,加入0.04mpb+0.1mnacl溶液,继续加入抗cd80人-鼠嵌合抗体80μg,最后加入碘(131i)化钠55.5mbq,在常温下混合后反应10分钟,反应结束后将反应液吸出反应管;
(2)使用前用0.04mpb+0.1mnacl溶液平衡活化pd10柱,待溶液全部流干后弃去所有流出液,将步骤(1)的反应液加入到pd10柱上,待溶液全部流尽,弃去所有流出液,再加入0.04mpb+0.1mnacl至pd10柱淋洗产品,收集所有流出液即得产品。
作为另一优选例,制备的131i标记的抗cd80人-鼠嵌合抗体的放化纯大于90%。
本发明优点在于:
1、本发明使用131i标记了抗cd80人-鼠嵌合抗体,选择了合适的标记条件和纯化条件,其标记率和放化纯度高,标记物的稳定性好,且方法简便、便于推广;131i标记后的抗体能保持较高的免疫活性。该方法的建立为以cd80为靶点的放射免疫显像和治疗研究打下了良好的基础。
2、本发明意外地发现,iodogen用量为30μg,抗cd80人-鼠嵌合抗体用量为80μg,碘(131i)化钠55.5mbq,在常温下混合后反应10min,用pd10柱纯化,0.04mpb+0.1mnacl溶液洗脱,得到的标记抗体在标记率、放化纯度等方面的性能均十分优异,特别是具备很高的稳定性,为临床检测或治疗提供了便利。
附图说明
图1.放射性薄层色谱扫描法检测标记抗体标记率。其中,该标记抗体的标记条件为:使用iodogen(20μg)碘标管,加入20μl的0.04mpb+0.1mnacl溶液,抗cd80人-鼠嵌合抗体加入量80μg,最后加入碘(131i)化钠74.0mbq,在常温下混合后反应8min;纯化条件为:pd10柱,0.04mpb+0.1mnacl溶液洗脱。
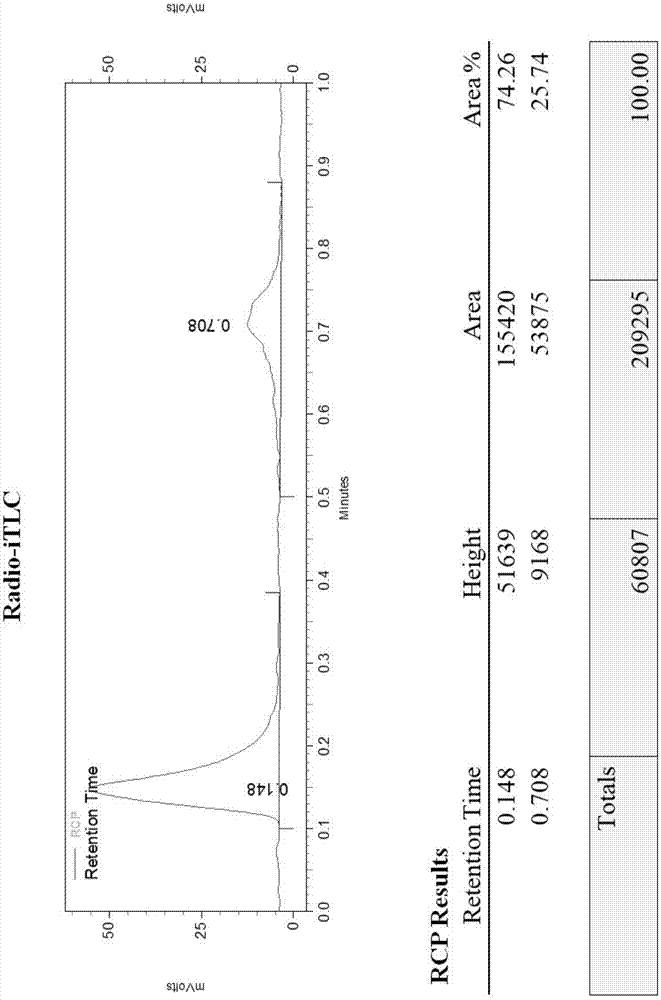
图2.放射性薄层色谱扫描法检测标记抗体放化纯度。其中,该标记抗体的标记条件为:使用iodogen(30μg)碘标管,加入20μl的0.04mpb+0.1mnacl溶液,抗cd80人-鼠嵌合抗体加入量80μg,最后加入碘(131i)化钠55.5mbq,在常温下混合后反应10min;纯化条件为:pd10柱,0.04mpb+0.1mnacl溶液洗脱。
图3.放射性薄层色谱扫描法检测游离碘[131i]对照组放化纯度。
具体实施方式
下面结合附图对本发明提供的具体实施方式作详细说明。
实施例1131i标记抗cd80人-鼠嵌合抗体的预实验
一、实验方法
1标记
方法一:
采用iodogen法进行标记,使用iodogen(50μg)碘标管,加入抗cd80人-鼠嵌合抗体(苏州大学邱玉华实验室馈赠,也可按照文献的记载制备:徐耀瑜,胡玲玲,陈永井等.cd80鼠-人嵌合抗体的cho细胞表达及体外生物学功能的初步研究.中国免疫学杂志.2009(25):114-117,文献中所述杂交瘤细胞株4e5即cn102190729a,2011.09.21中所述分泌抗人cd80分子双价抗体的细胞株,保藏信息为:保藏单位:中国微生物菌种保藏管理委员会普通微生物中心;保藏地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所;保藏日期:2011年01月24日;保藏编号:cgmccno.4571;分类命名:分泌抗人cd80分子双价抗体的细胞株)100μg,再加入碘(131i)化钠74mbq,在常温下混合后反应8min。
将反应物用sephadexg-50层析柱纯化,用0.05mph7.4的pbs洗脱,收集洗脱液每管0.5ml,测定各管的放射性计数,直至第二高峰洗脱至本底,合并第一个放射性峰溶液即为产品峰。
方法二:
采用iodogen法进行标记,使用iodogen(50μg)碘标管,加入20μl的0.04mpb+0.1mnacl溶液,继续加入抗cd80人-鼠嵌合抗体100μg,最后加入碘(131i)化钠74mbq,在常温下混合后反应8min,反应结束后将反应液吸出反应管。
首先使用前用0.03mpb+0.05mnacl溶液35ml平衡活化pd10柱,待溶液全部流干后弃去所有流出液,将上述反应液加入到pd10柱上,待溶液全部流尽,弃去所有流出液,再加入2ml0.03mpb+0.05mnacl至pd10柱淋洗产品,收集所有流出液即得产品。
方法三:
采用iodogen法进行标记,使用iodogen(50μg)碘标管,加入20μl的0.04mpb+0.1mnacl溶液,继续加入抗cd80人-鼠嵌合抗体100μg,最后加入碘(131i)化钠74mbq,在常温下混合后反应8min,反应结束后将反应液吸出反应管。
首先使用前用0.04mpb+0.1mnacl溶液35ml平衡活化pd10柱,待溶液全部流干后弃去所有流出液,将上述反应液加入到pd10柱上,待溶液全部流尽,弃去所有流出液,再加入2ml0.04mpb+0.1mnacl至pd10柱淋洗产品,收集所有流出液即得产品。
方法四:
采用iodogen法进行标记,使用iodogen(50μg)碘标管,加入20μl的0.04mpb+0.1mnacl溶液,继续加入抗cd80人-鼠嵌合抗体100μg,最后加入碘(131i)化钠74mbq,在常温下混合后反应8min,反应结束后将反应液吸出反应管。
首先使用前用0.05mpb+0.15mnacl溶液35ml平衡活化pd10柱,待溶液全部流干后弃去所有流出液,将上述反应液加入到pd10柱上,待溶液全部流尽,弃去所有流出液,再加入2ml0.05mpb+0.15mnacl至pd10柱淋洗产品,收集所有流出液即得产品。
2放射性化学纯度检测
将上述收集到的产品点样到radio-itlc纸上,在85%甲醇体系中上行展开,用薄层放射性扫描仪扫描;将放射性碘化钠原液点样到radio-itlc纸上,在85%甲醇体系中上行展开作为对照组,计算rf值,rf值计算公式如下:
其中0.15min为点样原点,0.78min为展开剂前沿。保留时间小于0.15min的rf值定义为0,保留时间大于0.78min的rf值定义为1。要求目标产物rf=0~0.1,放射性碘化钠原液rf=0.8~1;产品放射性化学纯度大于90%。
3标记抗体的稳定性观察
将标记物分别加入到血清及pbs中,置37℃条件下,于5天后测定标记物的放化纯,观察标记抗体的稳定性。
4标记抗体的活性测定
配制细胞数分别为1×105、1×106、1×107、5×107、1×108个/ml的raji细胞悬液,各取100μl细胞悬液加入离心管中,每个浓度点做3管;每管加入20μl的标记抗体(~5×104counts/min),混匀,37℃培养2h;然后加0.05mph7.4的pbs500μl,摇匀,3000rpm/min,4℃低温离心10min,吸出上清液,用pbs洗涤沉淀2次,测沉淀的放射性计数,计算标记抗体的细胞结合率;同时做非特异结合对照管:取各浓度细胞悬液100μl加入离心管中,均设3支复管,每管加入过量(约1000倍,根据加入的131i-cd80抗体蛋白量计算加入未标记抗体的量)未标记抗体,37℃培养1h后,再加入标记抗体(加入量与结合管一致),其余步骤同上。特异性结合率(%)=总细胞结合率(%)-非特异性细胞结合率(%)。
标准管:取放免管3个,向其中加入标记抗体(与结合管一致)作为标准管,进行γ计数。
二、实验结果
1标记率和放化纯
用sephadexg-50层析柱纯化得到的标记抗体放射性化学纯度均低于90%,不满足要求。
方法二、方法三和方法四采用pd10柱纯化,得到的标记抗体的标记率分别为(73.6±2.1)%、(76.0±1.9)%、(77.4±2.5)%,放射化学纯度分别为(95.4±1.8)%、(95.7±1.7)%、(96.3±2.2)%,加入到血清中放置5d后的放化纯度分别为(48.6±1.5)%、(68.9±1.8)%、(42.4±1.3)%,加入到pbs中放置5d后的放化纯度分别为(45.3±1.6)%、(67.2±1.9)%、(39.7±1.2)%,特异性细胞结合率分别为(27.1±2.7)%、(28.5±2.6)%、(23.2±1.9)%。
故使用pd10柱纯化,0.04mpb+0.1mnacl溶液洗脱,可以满足标记抗体放射性化学纯度的要求,同时有利于标记抗体稳定性和活性的维持。
实施例2131i标记抗cd80人-鼠嵌合抗体的条件优化
一、实验方法
1标记方法
采用iodogen法进行标记,使用iodogen碘标管,加入0.04mpb+0.1mnacl溶液,继续加入抗cd80人-鼠嵌合抗体,最后加入碘(131i)化钠,在常温下混合后反应,反应结束后将反应液吸出反应管。
2分离纯化
首先使用前用0.04mpb+0.1mnacl溶液35ml平衡活化pd10柱,待溶液全部流干后弃去所有流出液,将上述反应液加入到pd10柱上,待溶液全部流尽,弃去所有流出液,再加入2ml0.04mpb+0.1mnacl至pd10柱淋洗产品,收集所有流出液即得产品。
3放射性化学纯度检测
将上述收集到的产品点样到radio-itlc纸上,在85%甲醇体系中上行展开,用薄层放射性扫描仪扫描;将放射性碘化钠原液点样到radio-itlc纸上,在85%甲醇体系中上行展开作为对照组,计算rf值,rf值计算公式如下:
其中0.15min为点样原点,0.78min为展开剂前沿。保留时间小于0.15min的rf值定义为0,保留时间大于0.78min的rf值定义为1。要求目标产物rf=0~0.1,放射性碘化钠原液rf=0.8~1;产品放射性化学纯度大于90%。
4标记抗体的稳定性观察
将标记物分别加入到血清及pbs中,置37℃条件下,于5天后测定标记物的放化纯,观察标记抗体的稳定性。
5标记抗体的活性测定
配制细胞数分别为1×105、1×106、1×107、5×107、1×108个/ml的raji细胞悬液,各取100μl细胞悬液加入离心管中,每个浓度点做3管;每管加入20μl的标记抗体(~5×104counts/min),混匀,37℃培养2h;然后加0.05mph7.4的pbs500μl,摇匀,3000rpm/min,4℃低温离心10min,吸出上清液,用pbs洗涤沉淀2次,测沉淀的放射性计数,计算标记抗体的细胞结合率;同时做非特异结合对照管:取各浓度细胞悬液100μl加入离心管中,均设3支复管,每管加入过量(约1000倍,根据加入的131i-cd80抗体蛋白量计算加入未标记抗体的量)未标记抗体,37℃培养1h后,再加入标记抗体(加入量与结合管一致),其余步骤同上。特异性结合率(%)=总细胞结合率(%)-非特异性细胞结合率(%)。
标准管:取放免管3个,向其中加入标记抗体(与结合管一致)作为标准管,进行γ计数。
6参数设置
改变iodogen的量,分别为10、20、30、50、100μg,其余的成分固定不变;改变抗体的量,分别为10、20、40、80、160μg,其余的成分固定不变;改变131i的活度,分别为18.5、37.0、55.5、74.0、111.0mbq,其余的成分固定不变;改变反应时间,分别为4、6、8、10、12min,其余的成分固定不变;每个量3管重复,摸索在不同条件下标记的效果,寻找一最佳标记条件。
7最佳标记条件的验证
按照所得出的最佳标记条件制备131i标记抗cd80人-鼠嵌合抗体,测定其标记率、放化纯、稳定性以及活性。
二、实验结果
1标记率和放化纯
标记完成后进行分离纯化,获得纯131i-cd80人-鼠嵌合抗体,放射性薄层色谱扫描法检测结果显示各处理的标记率和放化纯如表1所示。
表1不同标记条件下抗体的标记率和放化纯
2稳定性
标记抗体加入到血清及pbs中放置5d后,各处理的稳定性如表2所示。
表2不同标记条件下抗体的稳定性
3标记抗体细胞结合率
各处理的标记抗体最大特异性细胞结合率如表3所示。
表3不同标记条件下标记抗体的最大特异性细胞结合率
由此可以看出,131i标记抗cd80人-鼠嵌合抗体的最佳标记条件为iodogen用量20μg,抗体用量40μg,加入na131i74mbq,室温反应时间8min。
4最佳标记条件的验证
进一步验证,得出以上最佳标记条件下的标记抗体标记率为(82.5±2.3)%,放射化学纯度为(96.4±1.3)%,加入到血清及pbs中放置5d后的放化纯度分别为(80.3±1.6)%和(74.4±1.5)%,最大特异性细胞结合率为(36.3±2.0)%。可见其抗体标记率和放化纯水平较佳,稳定性尚可。
发明人经过进一步的分析,设定了新的标记条件,iodogen用量30μg,抗体用量80μg,加入na131i55.5mbq,室温反应时间10min。意外地发现该标记条件下的标记抗体标记率为(84.2±2.4)%,放射化学纯度为(100.0±0.1)%(见图2),加入到血清及pbs中放置5d后的放化纯度分别为(94.8±0.3)%和(91.3±1.3)%(见表4),与raji细胞的结合率随细胞数的增加而增高,当细胞数为1×107个时结合率达到最高水平,该条件下特异性细胞结合率为(38.2±2.3)%,各方面结果均十分优异。
表4标记抗体稳定性观察(37℃,放化纯%)
本发明成功使用131i标记了抗cd80人-鼠嵌合抗体,尤其是得出最佳标记条件,显著提高了标记抗体稳定性,为临床应用打下了基础。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!