一种利用模拟移动床分离D-果糖和D-阿洛酮糖的方法与流程
本发明属于分离提纯技术领域,具体涉及一种利用模拟移动床分离d-果糖和d-阿洛酮糖的方法。
背景技术:
d-阿洛酮糖作为d-果糖的差向异构体是一种在自然界中较为稀有的天然己酮糖,属于稀少糖的一种。其甜味强度和种类方面与d-果糖非常相似,而热量只有0.007kcal/g,因此被称为零热量甜味剂。同时,d-阿洛酮糖还具有良好的功能特性,d-阿洛酮糖在消化道仅有少量的吸收,且具有较低程度的热量供给,作为甜味剂被用于减肥辅助治疗;口服d-阿洛酮糖可抑制肠道α-葡萄糖苷酶的活性,抑制餐后血糖升高;可抑制肝脏脂肪合成酶活性,减少脂肪沉积。
模拟移动色谱床(smb)是一种先进高效的分离技术,对现代功能糖与功能糖醇、葡萄糖、蔗糖以及中草药的发展具有重要作用。目前国际上最先进的模拟移动床色谱是顺序式模拟移动床色谱(ssmb)。ssmb比传统smb先进了许多,其特点是分离柱数量减少,比传统的色谱分离设备减少运行成本30%-50%,溶剂用量降低20%-40%。在保证高纯度的基础上,具有高分离性、高回收率、高效率、低成本、高稳定性等性能。
虽然阿洛酮糖的市场需求日益增加,但高昂的价格限制了它们的市场规模和应用。近年来,利用酶工程技术,以果糖为原料利用生物催化法合成阿洛酮糖成为了阿洛酮糖降低生产成本的方法,但反应平衡时大约一半的果糖未被转化,需要加以去除才能到高纯度阿洛酮糖,但是果糖与阿洛酮糖的性质极为相近,很难将二者分离开来,现有技术中利用单柱色谱分离设备进行分离,分离得到的阿洛酮糖和果糖纯度都不高,而利用顺序式模拟移动床色谱分离果糖与阿洛酮糖目前还没有研究成果。
技术实现要素:
针对以上存在的技术问题,本发明提供一种利用模拟移动床分离d-果糖和d-阿洛酮糖的方法。
本发明的技术方案为:一种利用模拟移动床分离d-果糖和d-阿洛酮糖的方法,包括以下步骤:
(1)d-阿洛酮糖的转化:将d-果糖经固定化d-阿洛酮糖差向异构酶纳米微球转化成d-阿洛酮糖,得到d-果糖和d-阿洛酮糖的混合糖液;
(2)混合糖液的预处理:将d-果糖和d-阿洛酮糖的混合液加水稀释至糖度为5%-10%,用0.45μm滤膜真空抽滤除杂,再经颗粒碳色谱柱进行脱色预处理,得到混合糖液原料;
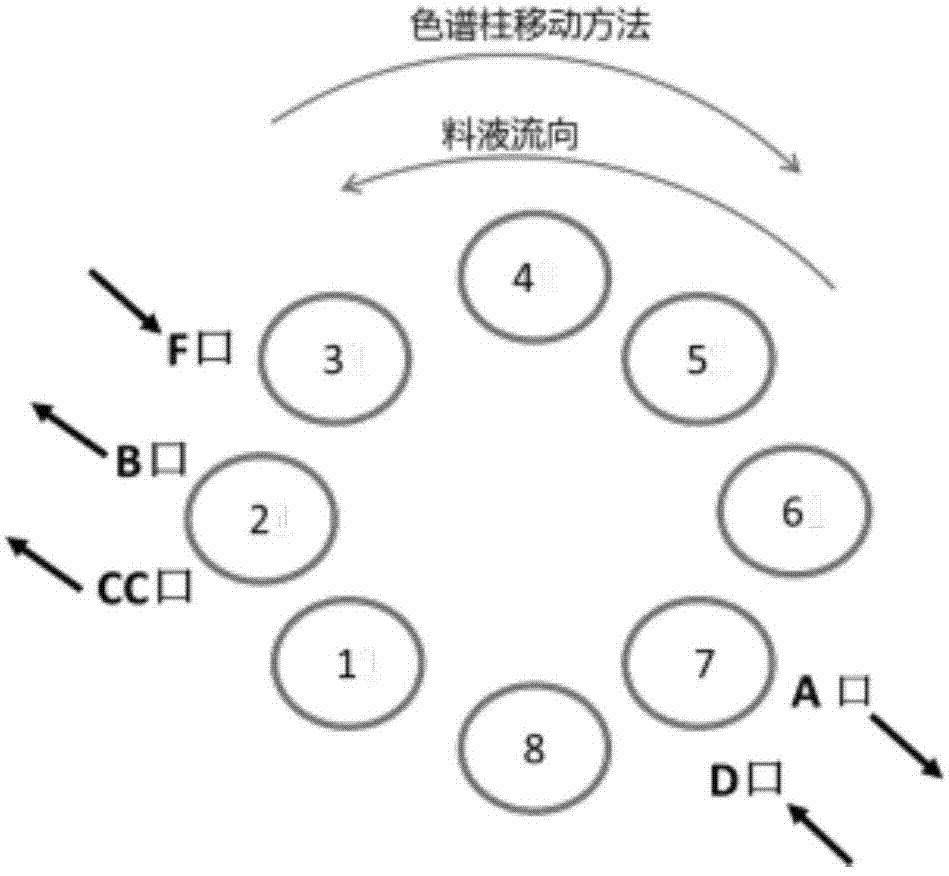
(3)顺序式模拟移动床分离:将所述预处理后的混合糖液通过顺序式模拟移动床色谱设备进行分离,所述设备由一个具有12个入口,13个出口的旋转阀分配、8根环状连接的吸附分离柱和4台恒流柱塞计量泵组成,设备为间歇进料,流动相逆时针旋转,固定相模拟顺时针旋转,通过逆流操作对样品进行分离纯化,分别得到d-果糖溶液和d-阿洛酮糖溶液的分离糖液,每根色谱柱的分离过程包括以下3个步骤:
s1:精馏阶段,由8根柱串联运行,流向:d口→cc口,去离子水作为解析剂经d口进入第7根柱中,再注入第6根柱中,再注入第5根柱中,依次循环至从第2根柱底部的cc口流出,使得d-果糖和d-阿洛酮糖两个组分在6柱中分离展开其中,控制流速为1.5-2.0ml/min,时间为305-320s,体积为9.24-9.56ml;
s2:解析阶段,由第3-7根柱串联运行,料液流向:d口→b口,去离子水作为解析剂经d口进入第7根柱中,d-果糖和d-阿洛酮糖两个组分会在5柱中进一步分离展开,当循环至第3根柱子时,由于d-果糖跟柱子中的树脂吸附能力较弱,会随着解析剂从第3根柱底部的b口流出,而吸附能力较强的d-阿洛酮糖仍然留在柱子中;其中,控制流速为1.5-2.0ml/min,时间为305-320s,体积为9.24-9.56ml;
s3:产物提取/进料阶段,分为洗脱和进料两部分,两部分同时运行;
产物提取阶段,由第7根柱进行单柱运行,料液流向:d口→a口,去离子水作为洗脱剂经d口进入第7根柱中,再由第7根柱底部的a口排出吸附较强的d-阿洛酮糖溶液,其中,控制流速为1.5-2.0ml/min,时间为415-425s,体积为12.43-12.64ml;
进料阶段,由第2根和第3根进行双柱串联运行,料液流向:f口→b口,混合糖液原料经f口进入第3根柱中,第2根柱底部的b口排出吸附较弱的d-果糖溶液,其中,控制流速为0.8-1.0ml/min,时间为415-425s,体积为6.24-6.32ml;
固定相模拟顺时针旋转,直至8根色谱柱全部轮换一个周,即完成一个周期,重复几个周期直至分离过程达到稳态,分别得到d-果糖溶液和d-阿洛酮糖溶液的分离糖液;
(4)将d-果糖溶液和d-阿洛酮糖溶液的分离糖液分别收集起来,45℃真空旋转蒸发,使其浓缩至80%的糖度,冷冻干燥,4摄氏度冰箱储存。
进一步地,所述步骤(3)中的色谱柱的参数为:径高比为35-40:1,填料为钙型阳离子凝胶树脂,柱温为30-65℃。
进一步地,所述步骤(3)的s5中最后分离得到的d-阿洛酮糖溶液的纯度≧99%,回收率≧95%,最后分离得到的d-果糖溶液的纯度≧99%,回收率≧90%。
更进一步地,所述填料还可替换为温敏性凝胶微球。
更进一步地,所述温敏性凝胶微球的制备方法包括以下步骤;
(1)取一定比例n-异丙基丙烯酰胺和n-乙烯基吡咯烷酮的混合单体,将所述混合单体完全溶解在bis溶剂中,加入所述混合单体13-15wt%的亚甲基双丙烯酰胺,搅拌混合均匀,通氮除氧30min,在22-25℃下反应2-4h;
(2)继续在氮气保护下迅速加入混合单体30-40wt%的苯乙烯单体,0.5-1.0wt%的过硫酸铵作为引发剂,6-12wt%的去离子水作为制孔剂,升温至45-50℃,超声波辅助反应20-22h,得到温敏性凝胶微球粗品;苯乙烯单体可以增加凝胶微球的机械强度,防止其在模拟床运行过程中由于材质过软而发生粘结现象;去离子水作为制孔剂相较于其它化学药剂,更加温和,且无副反应发生;超声波辅助反应可提高去离子水的制孔效果。
(3)采用电透析法对所述温敏性凝胶微球粗品进行纯化,去除残留单体,真空干燥,最终得到纯化后的温敏性凝胶微球。
进一步地,所述n-异丙基丙烯酰胺和n-乙烯基吡咯烷酮的摩尔比为(90-95):(5-10),n-乙烯基吡咯烷酮为亲水单体,可提高n-异丙基丙烯酰胺单体制成的温敏性凝胶微球的lcst值。
进一步地,所述纯化后的温敏性凝胶微球的lcst为50-60℃,相较于由n-异丙基丙烯酰胺单体制备成凝胶的lcst(32℃)有明显提升,更加适合顺序式模拟移动床的分离条件。
更进一步地,在顺序式模拟移动床分离过程中,进样阶段的柱温为65℃,高于lcst值,有利于吸附,解析阶段和排杂和产物提取阶段的柱温为50℃,直接降温至50℃,低于lcst值,则有利于解析脱附。
与现有技术相比,本发明的有益效果为:
(1)本发明利用顺序式模拟移动床通过调节分离参数对d-果糖和d-阿洛酮糖的混合液进行分离,最后分离得到的d-阿洛酮糖溶液的纯度≧99%,回收率≧95%,最后分离得到的d-果糖溶液的纯度≧99%,回收率≧90%。
(2)另外,本发明还对顺序式模拟移动床中色谱柱的填料进行了改进,利用n-异丙基丙烯酰胺和亲水性的n-乙烯基吡咯烷酮进行共聚,最终得到改性后的温敏性凝胶微球,将温敏性凝胶微球的lcst从32℃提高到了50-60℃,有利于原料的吸附与解析,解决了凝胶树脂解析较难的问题。总之,本发明具有分离产品纯度及回收率高,采用顺序式模拟移动床代替传统模拟床,减少了色谱柱使用数量,降低了生产成本。
附图说明
图1是本发明模拟移动床设备的俯视示意图;
图2本发明单柱分离d-果糖和d-阿洛酮糖的实验结果;
图3是本发明利用模拟移动床(smb)分离d-果糖的实验结果;
图4是本发明利用模拟移动床(smb)分离d-阿洛酮糖的实验结果。
具体实施方式
下面结合实施例对本发明的技术方案作进一步详细说明,但本发明不限于以下列举的特定例子。
实施例1
利用模拟移动床分离d-果糖和d-阿洛酮糖的方法,包括以下步骤:
(1)d-阿洛酮糖的转化:将d-果糖经固定化d-阿洛酮糖差向异构酶纳米微球转化成d-阿洛酮糖,得到d-果糖和d-阿洛酮糖的混合糖液;
(2)混合糖液的预处理:将d-果糖和d-阿洛酮糖的混合液加水稀释至糖度为5%,用0.45μm滤膜真空抽滤除杂,再经颗粒碳色谱柱进行脱色预处理,得到混合糖液原料;
(3)顺序式模拟移动床分离:如图1所示,将所述预处理后的混合糖液通过顺序式模拟移动床色谱设备进行分离,所述设备由一个具有12个入口,13个出口的旋转阀分配、8根环状连接的吸附分离柱和4台恒流柱塞计量泵组成,设备为间歇进料,流动相逆时针旋转,固定相模拟顺时针旋转,通过逆流操作对样品进行分离纯化,分别得到d-果糖溶液和d-阿洛酮糖溶液的分离糖液,每根色谱柱的分离过程包括以下3个步骤:
s1:精馏阶段,由8根柱串联运行,流向:d口→cc口,去离子水作为解析剂经d口进入第7根柱中,再注入第6根柱中,再注入第5根柱中,依次循环至从第2根柱底部的cc口流出,使得d-果糖和d-阿洛酮糖两个组分在6柱中分离展开其中,其中,控制流速为1.5ml/min,时间为305s,体积为9.24ml;
s2:解析阶段,由第3-7根柱串联运行,料液流向:d口→b口,去离子水作为解析剂经d口进入第7根柱中,d-果糖和d-阿洛酮糖两个组分会在5柱中进一步分离展开,当循环至第3根柱子时,由于d-果糖跟柱子中的树脂吸附能力较弱,会随着解析剂从第3根柱底部的b口流出,而吸附能力较强的d-阿洛酮糖仍然留在柱子中;其中,控制流速为1.5ml/min,时间为305s,体积为9.24ml;
s3:产物提取/进料阶段,分为洗脱和进料两部分,两部分同时运行;
产物提取阶段,由第7根柱进行单柱运行,料液流向:d口→a口,去离子水作为洗脱剂经d口进入第7根柱中,再由第7根柱底部的a口排出吸附较强的d-阿洛酮糖溶液,控制流速为0.8ml/min,时间为415s,体积为6.24ml;
进料阶段,由第2根和第3根进行双柱串联运行,料液流向:f口→b口,混合糖液原料经f口进入第3根柱中,第2根柱底部的b口排出吸附较弱的d-果糖溶液,其中,控制流速为1.5ml/min,时间为415s,体积为12.43ml;
固定相模拟顺时针旋转,直至8根色谱柱全部轮换一个周,即完成一个周期,重复几个周期直至分离过程达到稳态,分别得到d-果糖溶液和d-阿洛酮糖溶液的分离糖液;
(4)将d-果糖溶液和d-阿洛酮糖溶液的分离糖液分别收集起来,45℃真空旋转蒸发,使其浓缩至80%的糖度,冷冻干燥,4摄氏度冰箱储存。
最后分离得到的d-阿洛酮糖溶液的纯度为99.0%,回收率为95.2%,最后分离得到的d-果糖溶液的纯度为99.0%,回收率为90.4%。
实施例2
利用模拟移动床分离d-果糖和d-阿洛酮糖的方法,包括以下步骤:
(1)d-阿洛酮糖的转化:将d-果糖经固定化d-阿洛酮糖差向异构酶纳米微球转化成d-阿洛酮糖,得到d-果糖和d-阿洛酮糖的混合糖液;
(2)混合糖液的预处理:将d-果糖和d-阿洛酮糖的混合液加水稀释至糖度为8%,用0.45μm滤膜真空抽滤除杂,再经颗粒碳色谱柱进行脱色预处理,得到混合糖液原料;
(3)顺序式模拟移动床分离:如图1所示,将所述预处理后的混合糖液通过顺序式模拟移动床色谱设备进行分离,所述设备由一个具有12个入口,13个出口的旋转阀分配、8根环状连接的吸附分离柱和4台恒流柱塞计量泵组成,设备为间歇进料,流动相逆时针旋转,固定相模拟顺时针旋转,通过逆流操作对样品进行分离纯化,分别得到d-果糖溶液和d-阿洛酮糖溶液的分离糖液,每根色谱柱的分离过程包括以下3个步骤:
s1:精馏阶段,由8根柱串联运行,流向:d口→cc口,去离子水作为解析剂经d口进入第7根柱中,再注入第6根柱中,再注入第5根柱中,依次循环至从第2根柱底部的cc口流出,使得d-果糖和d-阿洛酮糖两个组分在6柱中分离展开其中,其中,控制流速为1.8ml/min,时间为314s,体积为9.42ml;
s2:解析阶段,由第3-7根柱串联运行,料液流向:d口→b口,去离子水作为解析剂经d口进入第7根柱中,d-果糖和d-阿洛酮糖两个组分会在5柱中进一步分离展开,当循环至第3根柱子时,由于d-果糖跟柱子中的树脂吸附能力较弱,会随着解析剂从第3根柱底部的b口流出,而吸附能力较强的d-阿洛酮糖仍然留在柱子中;其中,控制流速为1.8ml/min,时间为314s,体积为9.42ml;
s3:产物提取/进料阶段,分为洗脱和进料两部分,两部分同时运行;
产物提取阶段,由第7根柱进行单柱运行,料液流向:d口→a口,去离子水作为洗脱剂经d口进入第7根柱中,再由第7根柱底部的a口排出吸附较强的d-阿洛酮糖溶液,其中,控制流速为0.9ml/min,时间为419s,体积为6.28ml;
进料阶段,由第2根和第3根进行双柱串联运行,料液流向:f口→b口,混合糖液原料经f口进入第3根柱中,第2根柱底部的b口排出吸附较弱的d-果糖溶液,其中,控制流速为1.8ml/min,时间为419s,体积为12.56ml;
固定相模拟顺时针旋转,直至8根色谱柱全部轮换一个周,即完成一个周期,重复几个周期直至分离过程达到稳态,分别得到d-果糖溶液和d-阿洛酮糖溶液的分离糖液;
(4)将d-果糖溶液和d-阿洛酮糖溶液的分离糖液分别收集起来,45℃真空旋转蒸发,使其浓缩至80%的糖度,冷冻干燥,4摄氏度冰箱储存。
最后分离得到的d-阿洛酮糖溶液的纯度为99.4%,回收率为96.2%,最后分离得到的d-果糖溶液的纯度为99.3%,回收率为91.3%。
实施例3
利用模拟移动床分离d-果糖和d-阿洛酮糖的方法,包括以下步骤:
(1)d-阿洛酮糖的转化:将d-果糖经固定化d-阿洛酮糖差向异构酶纳米微球转化成d-阿洛酮糖,得到d-果糖和d-阿洛酮糖的混合糖液;
(2)混合糖液的预处理:将d-果糖和d-阿洛酮糖的混合液加水稀释至糖度为10%,用0.45μm滤膜真空抽滤除杂,再经颗粒碳色谱柱进行脱色预处理,得到混合糖液原料;
(3)顺序式模拟移动床分离:如图1所示,将所述预处理后的混合糖液通过顺序式模拟移动床色谱设备进行分离,所述设备由一个具有12个入口,13个出口的旋转阀分配、8根环状连接的吸附分离柱和4台恒流柱塞计量泵组成,设备为间歇进料,流动相逆时针旋转,固定相模拟顺时针旋转,通过逆流操作对样品进行分离纯化,分别得到d-果糖溶液和d-阿洛酮糖溶液的分离糖液,每根色谱柱的分离过程包括以下3个步骤:
s1:精馏阶段,由8根柱串联运行,流向:d口→cc口,去离子水作为解析剂经d口进入第7根柱中,再注入第6根柱中,再注入第5根柱中,依次循环至从第2根柱底部的cc口流出,使得d-果糖和d-阿洛酮糖两个组分在6柱中分离展开其中,控制流速为2.0ml/min,时间为320s,体积为9.56ml;
s2:解析阶段,由第3-7根柱串联运行,料液流向:d口→b口,去离子水作为解析剂经d口进入第7根柱中,d-果糖和d-阿洛酮糖两个组分会在5柱中进一步分离展开,当循环至第3根柱子时,由于d-果糖跟柱子中的树脂吸附能力较弱,会随着解析剂从第3根柱底部的b口流出,而吸附能力较强的d-阿洛酮糖仍然留在柱子中;其中,控制流速为2.0ml/min,时间为320s,体积为9.56ml;
s3:产物提取/进料阶段,分为洗脱和进料两部分,两部分同时运行;
产物提取阶段,由第7根柱进行单柱运行,料液流向:d口→a口,去离子水作为洗脱剂经d口进入第7根柱中,再由第7根柱底部的a口排出吸附较强的d-阿洛酮糖溶液,其中,控制流速为2.0ml/min,时间为4425s,体积为12.64ml;
进料阶段,由第2根和第3根进行双柱串联运行,料液流向:f口→b口,混合糖液原料经f口进入第3根柱中,第2根柱底部的b口排出吸附较弱的d-果糖溶液,其中,控制流速为1.0ml/min,时间为425s,体积为6.32ml;
固定相模拟顺时针旋转,直至8根色谱柱全部轮换一个周,即完成一个周期,重复几个周期直至分离过程达到稳态,分别得到d-果糖溶液和d-阿洛酮糖溶液的分离糖液;
(4)将d-果糖溶液和d-阿洛酮糖溶液的分离糖液分别收集起来,45℃真空旋转蒸发,使其浓缩至80%的糖度,冷冻干燥,4摄氏度冰箱储存。
最后分离得到的d-阿洛酮糖溶液的纯度为99.3%,回收率为95.7%,最后分离得到的d-果糖溶液的纯度为99.1%,回收率为91.0%。
实施例4
本实施例与实施例2基本相同,不同之处在于:
所述顺序式模拟移动床中色谱柱参数为:径高比为35:1,填料为n-异丙基丙烯酰胺型温敏性凝胶微球,柱温为65℃和50℃。其中,进样阶段的柱温为65℃,解析阶段和排杂和产物提取阶段的柱温为30℃。
最后分离得到的d-阿洛酮糖溶液的纯度为54.6%,回收率为75.3%,最后分离得到的d-果糖溶液的纯度为55.7%,回收率为86%。
由于n-异丙基丙烯酰胺型温敏性凝胶微球的lcst值为32℃,高于32℃利于吸附,20℃左右利于解析,由于该温度太低,与顺序式模拟移动床设备的参数不吻合,不能发挥其温敏特点,因此效果远不如钙型阳离子凝胶树脂填料。
实施例5
本实施例与实施例2基本相同,不同之处在于:
所述顺序式模拟移动床中色谱柱参数为:径高比为35:1,填料为n-异丙基丙烯酰胺/n-乙烯基吡咯烷酮型温敏性凝胶微球,柱温为65℃和50℃。其中,进样阶段的柱温为65℃,解析阶段和排杂和产物提取阶段的柱温为50℃。并且还提供了n-异丙基丙烯酰胺/n-乙烯基吡咯烷酮型温敏性凝胶微球的制备方法:(1)取n-异丙基丙烯酰胺和n-乙烯基吡咯烷酮(摩尔比为90:10)的混合单体,将所述混合单体完全溶解在bis溶剂中,加入所述混合单体14wt%的亚甲基双丙烯酰胺,搅拌混合均匀,通氮除氧30min,在23℃下反应4h;
(2)继续在氮气保护下迅速加入0.75wt%的过硫酸铵作为引发剂,9wt%的去离子水作为制孔剂,升温至47℃,超声波辅助反应20h,得到温敏性凝胶微球粗品;苯乙烯单体可以增加凝胶微球的硬度,防止其在模拟床运行过程中由于材质过软而发生粘结现象,去离子水作为制孔剂相较于其它化学药剂,更加温和,且无副反应发生;超声波辅助反应可提高去离子水的制孔效果。。
(3)采用电透析法对所述温敏性凝胶微球粗品进行纯化,去除残留单体,真空干燥,最终得到纯化后的温敏性凝胶微球。
最后分离得到的d-阿洛酮糖溶液的纯度为88.3%,回收率为80.0%,最后分离得到的d-果糖溶液的纯度为79.1%,回收率为81.2%。
实施例6
本实施例与实施例5基本相同,不同之处在于:
n-异丙基丙烯酰胺/n-乙烯基吡咯烷酮型温敏性凝胶微球的制备方法:
(1)取摩尔比为90:10的n-异丙基丙烯酰胺和n-乙烯基吡咯烷酮进行混合,得到混合单体,将所述混合单体完全溶解在bis溶剂中,加入所述混合单体14wt%的亚甲基双丙烯酰胺,搅拌混合均匀,通氮除氧30min,在23℃下反应4h;
(2)继续在氮气保护下迅速加入混合单体35wt%的苯乙烯单体,0.7wt%的过硫酸铵作为引发剂,9wt%的去离子水作为制孔剂,升温至47℃,超声波辅助反应20h,得到温敏性凝胶微球粗品;苯乙烯单体可以增加凝胶微球的硬度,防止其在模拟床运行过程中由于材质过软而发生粘结现象。
(3)采用电透析法对所述温敏性凝胶微球粗品进行纯化,去除残留单体,真空干燥,最终得到纯化后的温敏性凝胶微球。
最后分离得到的d-阿洛酮糖溶液的纯度为99.8%,回收率为96.2%,最后分离得到的d-果糖溶液的纯度为99.6%,回收率为92.7%。对比实施例5和实施例6可知,增加苯乙烯单体能稍提高分离产物的纯度和回收率,这是由于苯乙烯单体增加了温敏性凝胶微球的机械强度,避免了其在模拟床运行过程中由于材质过软而发生粘结现象,提高了最终分离效果,并且对比实施例6与实施例2,可发现实施例6的分离产物的纯度和回收率均高于实施例2,由于通过改性的n-异丙基丙烯酰胺/n-乙烯基吡咯烷酮型温敏性凝胶微球相较于钙型阳离子凝胶树脂能够通过调节色谱柱温度辅助吸附和解析,从而效果更佳。
实验例
以实施例6分离d-阿洛酮糖溶液和d-果糖溶液混合液作为实验组,检测最终分离得到d-阿洛酮糖溶液和d-果糖溶液的分离结果,结果如图3和4所示,以单柱分离d-阿洛酮糖溶液和d-果糖溶液混合液作为对照组,检测最终分离得到d-阿洛酮糖溶液和d-果糖溶液的分离结果,结果如图2所示。由图2可以看出,单柱分离d-果糖和d-阿洛酮糖效果并不好,d-果糖和d-阿洛酮糖还是有大部分重合为完全分离。由图3可看出,由本发明实施例6顺序模拟移动床分离得到的d-阿洛酮糖溶液中d-果糖的浓度几乎为0,同样由图4可以看出d-果糖溶液中的d-阿洛酮糖溶液也几乎为0。
最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明实施例技术方案的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!