一种茂型钌配合物的制备方法及其抗肿瘤应用与流程
本发明属于抗肿瘤试剂的研发领域,尤其涉及一种茂型钌配合物的制备方法及其对三种不同肿瘤细胞的抑制作用。
背景技术:
恶性肿瘤是危害人类健康的重大疾病之一,是仅次于心血管病的人类第二大致死病因。化疗是治疗癌症的重要手段。自1969年美国科学家rosenberg发现顺铂具有抗肿瘤活性以来,以铂为代表的金属配合物类的研究证明,金属化合物具有巨大的药用价值和抗肿瘤潜力(daltontrans.,2007,4929-4937)。但是铂类抗癌药物在临床使用中比较容易产生副作用,如神经毒性、肾毒性、骨髓毒性等,这严重制约了铂类药物的疗效和长期使用(cancertreat.rev.,2008,34,368-377;cancerther.,2009,8,10-16)。近年来,基于非铂类金属抗癌药物的研究十分活跃,并得到了很大的发展。大多数报告认为钌的配合物是低毒性的而且易于被肿瘤组织吸收(curr.med.chem.,200,13,1085-1107;j.inorg.biochem.,2006,100,891-904)。国际上普遍认为,钌配合物将成为最有前途的抗癌药物之一,而且欧盟自1997年就成立了钌抗癌药物的研究和发展工作组(costd8),加强相应的研究。钌(ii)配合物能通过复杂的化学生物学过程跟生物大分子发生作用,利用这一点,设计让它们与特定的生物分子作用,从而达到进攻癌细胞的目的。
研究表明,具有“琴凳”结构的芳基钌配合物是以双功能方式与dna发生相互作用,这是与顺铂完全不同的抗癌机理(chem.sci.,2010,1,258-270)。sadler等研发的一组芳烃钌化合物在体外和体内的抗癌活性都很高(j.med.chem.,2006,49,6858-6868;chem.commun.,2005,4764-4776)。这类芳烃钌配合物除了对dna中鸟嘌呤碱基n7的直接配位结合外,还有配体的嵌入结合和特殊氢键作用。这些附加作用导致这类配合物能以独特方式与dna双螺旋结合,使dna产生不同的结构扭曲,这也许是它们与顺铂无交叉抗药性的原因(angew.chem.int.ed.,2006,45,8153-8156)。芳烃钌配合物中的芳基配体与dna的疏水相互作用能促进其与dna的结合(biochemistry,2000,39,8439-8447)。芳基钌配合物具有活性的配位反应位点,并能与dna形成单官能加合物,芳基配体能够与碱基通过疏水作用和范德华力结合(j.am.chem.soc.,2002,124,3064-3082)。由于茂型钌特别的“琴凳”结构,研究表明增加配体芳烃的尺寸能增加其在人类卵巢癌细胞系的活性(br.j.cancer,2002,86,1652-1657),而更改钌芳烃配合物中的螯合配体也会对其动力学产生巨大的影响,甚至能改变他们的碱基选择性(j.am.chem.soc.,125,173-186)。
本专利发明了一种具有良好水溶性和光谱性质的茂型钌配合物,并在其结构中引入以双功能方式与dna发生相互作用的“琴凳”结构,使其能够同时发挥中心金属钌与dna碱基的配位作用和平面配体对dna碱基对的插入结合作用,从而增强其抗肿瘤活性。该茂型钌配合物不仅作为良好的dna结合试剂,还能对dna进行光谱响应,是潜在的抗肿瘤药物和光谱检测试剂。
技术实现要素:
本发明的目的在于针对当前高效低副作用抗肿瘤药物研究,提供一种具有良好水溶性和光谱性质的茂型钌配合物,其能够高亲和力的结合dna,以及在较低的配合物浓度即可显著抑制几种不同肿瘤细胞的生长。
本发明的第二个目的是提供所述茂型钌配合物的制备方法。
本发明的第三个目的是提供所述茂型钌配合物作为高亲和力dna结合试剂本发明的第四个目的是提供所述茂型钌配合物在抑制肿瘤细胞生长中的应用。
本发明的上述目的通过如下技术方案予以实现:
一种茂型钌配合物,由阳离子和阴离子组成,所述阳离子结构式如式i所示:
式ⅰ
本发明所述茂型钌配合物并不限定阴离子的种类,本领域常规阴离子均能实现本发明目的,尤其是无机盐阴离子,如pf6-,clo4-、cl-等,作为一种最优选方案,本发明所述茂型钌配合物的阴离子为pf6-。
上述单核茂型钌(ii)配合物的制备方法,包括以下步骤:
s1.将rucl3·3h2o和1,4-环己二烯溶于乙醇中,加热回流。冷却后,将所得的棕色混合物抽滤,得到棕色粉末,用少量甲醇洗涤,真空干燥,得棕色固体,即得到前体配合物[(η6-ben)rucl2]2。类似地,用1-甲基-4-异丙基-1,4-环己二烯代替1,4-环己二烯,依照相同方法,即得前体配合物[(η6-cym)rucl2]2。前体结构如式ii所示:
s2.邻菲咯啉-5,6-二酮和乙酸铵溶于冰醋酸中,分别与10-甲基蒽-9-甲醛、1-芘甲醛反应加热回流,待反应液冷却至室温后,用水稀释,浓氨水中和,析出沉淀。减压过滤,纯水洗,干燥。用无水乙醇重结晶,即得配体maip、pipy,如式iii所示:
s3.前体配合物[(η6-ben)rucl2]2和[(η6-cym)rucl2]2分别与配体maip、pyip溶于甲醇中,加热回流。趁热过滤反应液后,加入nh4pf6,析出沉淀。将沉淀抽滤,乙醚洗涤,真空干燥,得到黄色固体。无水甲醇重结晶,即得到所述目标茂型钌配合物(式i)。
优选地,上述步骤所述加热回流反应的条件为在80~85℃下,回流3小时。
优选地,所述前体配合物与配体反应摩尔比为1:4。
优选地,所述nh4pf6与前体配合物的摩尔比为1:1~2:1。
本发明具有以下有益效果:
本发明提供了一种新型的茂型钌配合物,可作为双功能高亲和力dna结合试剂,以及抗肿瘤试剂,是潜在的抗肿瘤药物。
本发明合成的茂型钌配合物在dna结合和抗肿瘤试剂中的应用,具有以下优势:(1)具有良好的水溶性和稳定性;(2)具有良好的光谱性质,能够对dna进行光谱响应;(3)与传统的芳基钌配合物仅以钌与碱基配位结合相比,还具有插入结合dna的作用模式,显著提高其dna结合能力。
附图说明
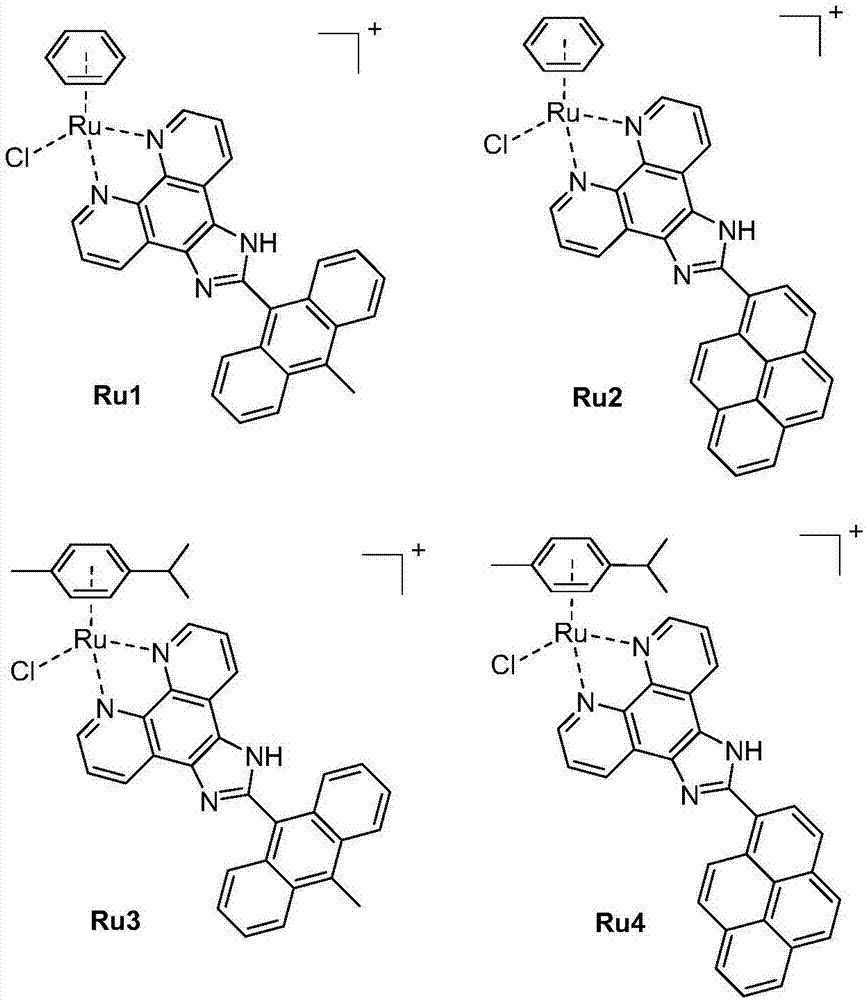
图1为本发明所制备的茂型钌配合物分子结构图;
图2为配体maip,pyip的合成途径;
图3为配合物ru1和ru2的合成途径;
图4为配合物ru3和ru4的合成途径;
图5为茂型钌配合物与dna作用的紫外可见光谱滴定图及其拟合曲线;
图6为茂型钌配合物与dna作用粘度实验图。
图7为茂型钌配合物水解动力学光谱变化及其拟合曲线;
图8为茂型钌配合物与22rv1细胞作用的流式细胞术图;
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明。实施例仅用以解释本发明,而不用于对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备,所用试剂和材料均为市购。
实施例1茂型钌配合物的制备
所合成的茂型钌配合物分子结构如图1所示。
1、前体配合物[(η6-ben)rucl2]2和[(η6-cym)rucl2]2的制备:
将2.00grucl3•3h2o(9.64mmol)和10.0ml1,4-环己二烯(106mmol)溶于100ml乙醇中,温度维持在80-85oc,加热回流12个小时。冷却后,将所得的棕色混合物抽滤,得到棕色粉末,用少量甲醇洗涤,真空干燥,得棕色固体1.96g。
将2.00grucl3•3h2o(9.64mmol)和16.8ml1-甲基-4-异丙基-1,4-环己二烯(106mmol)溶于100ml乙醇中,温度维持在80-85oc,加热回流12个小时。冷却后,将所得的棕色混合物抽滤,得到棕色粉末,用少量的甲醇洗涤,真空干燥,得棕色固体1.85g。
2、配体maip,pyip的制备:
将邻菲咯啉-5,6-二酮0.16g(0.72mmol)和乙酸铵1.20g(15mmol)溶于7ml冰醋酸中,搅拌溶解,再加入0.221g10-甲基蒽-9-甲醛(1mmol)加热至130oc,回流3小时,溶液呈橙黄色透明状,冷至室温后,用10cm3水稀释,然后滴加浓氨水(25﹪)中和,立即析出大量絮状橙黄色沉淀。抽滤,水洗数次后用抽干。放在干燥箱里干燥一天,再用无水乙醇溶解,重结晶,析出黄色晶体maip,产量0.4642g,产率87%。
将邻菲咯啉-5,6-二酮0.53g(2.5mmol)和乙酸铵3.88g(50mmol)溶于7ml冰醋酸中,搅拌溶解,再滴加0.805g1-芘甲醛(3.5mmol)加热至130oc,回流3h,溶液呈橙黄色透明状,冷至室温后,用40ml水稀释,然后滴加浓氨水(25%),大概10ml,中和,立即析出大量絮状淡黄色沉淀。抽滤,水洗数次后抽干。放在干燥箱里干燥一天,再用无水乙醇溶解,重结晶,析出黄色晶体pyip,产量0.798g,产率76%。
3、配合物[(η6-ben)ru(maip)cl]pf6(ru1)的制备:
按照图3所示的途径合成。将0.0496g[(η6-ben)rucl2]2(0.1mmol)和0.17g配体maip(0.40mmol)溶于10ml甲醇中,温度维持在80~85oc,加热回流3个小时。将所得的溶液过滤后,加入0.278gnh4pf6(1.71mmol),旋转蒸发,将体积浓缩至5ml左右,晶体析出,抽滤,用乙醚洗涤,真空干燥,得到黄棕色固体ru1,产率为80%。1hnmr(300mhz,dmso)δ9.97(d,j=5.0hz,2h),9.27–9.19(m,2h),8.53(s,2h),8.22–8.17(m,2h),7.67(s,2h),7.64(s,4h),6.34(s,6h),2.72(s,3h).esi-ms:m/z625.6(m+,100%)。
4、配合物[(η6-ben)ru(pyip)cl]pf6(ru2)的制备:
按照图3所示的途径合成。制备步骤同配合物ru1,不同点在于将其中的配体maip替代为配体pyip(0.113g,0.27mmol),其余步骤及操作不变。配合物[(η6-ben)ru(pyip)cl]pf6为黄色固体,产率为60%。1hnmr(400mhz,dmso)δ9.98(d,j=4.8hz,2h),9.14(s,2h),8.93(s,1h),8.25(d,j=8.7hz,2h),8.22–8.17(m,2h),7.74(d,j=8.8hz,2h),7.64–7.57(m,2h),7.55–7.47(m,2h),6.34(s,6h).esi-ms:m/z633.4(m+,100%)。
5、配合物[(η6-cym)ru(maip)cl]pf6(ru3)的制备:
按照图4所示的途径合成。将0.0608g[(η6-cym)rucl2]2(0.1mmol)和0.17g配体maip(0.40mmol)溶于20ml甲醇中,温度维持在80~85oc,加热回流3个小时。将所得的溶液过滤后,加入0.25gnh4pf6(1.53mmol),旋转蒸发,将体积浓缩至5ml左右,置于277k下6个小时使晶体析出,抽滤,用乙醚洗涤,真空干燥,得到黄棕色固体ru3,产率80%。1hnmr(300mhz,dmso)δ9.88(d,j=4.4hz,2h),9.26–9.18(m,1h),9.07–8.98(m,1h),8.52(d,j=9.1hz,2h),8.47–8.37(m,2h),8.20(s,2h),7.62(s,2h),7.57–7.41(m,2h),6.40(dd,j=14.6,6.2hz,2h),6.16(dd,j=19.4,6.3hz,2h),2.71(s,3h),0.98(dd,j=13.3,6.9hz,6h).esi-ms:m/z680.0(m+,100%)。
6、配合物[(η6-cym)ru(pyip)cl]pf6(ru4)的制备:
按照图4所示的途径合成。制备步骤同配合物ru3,不同点在于将其中的配体maip替代为配体pyip(0.168g,0.40mmol),其余步骤及操作不变。配合物[(η6-cym)ru(pyip)cl]pf6为黄棕色固体,产率为70%。1hnmr(400mhz,dmso)δ9.89(d,j=4.3hz,2h),9.42(d,j=9.4hz,1h),9.33(s,2h),8.66(d,j=8.1hz,1h),8.55(d,j=8.1hz,1h),8.44–8.35(m,4h),8.33(d,j=5.9hz,1h),8.25(s,2h),8.17(t,j=7.6hz,1h),6.37(d,j=6.3hz,2h),6.12(d,j=6.3hz,2h),2.67–2.60(m,1h),2.22(s,3h),0.91(d,j=6.9hz,6h).esi-ms:m/z690.4(m+,100%)。
实施例2茂型钌配合物与dna相互作用的紫外可见光谱滴定
溶液的配置均采用称量法。溶剂为二次蒸馏水,缓冲体系为tris-nacl,ph7.0。茂型钌配合物的浓度为20μm,dna浓度范围约为5×10-6~5×10-5mol/l,向固定浓度的茂型钌配合物的溶液中逐渐增加dna的浓度,分别记录配合物本身和不同dna浓度下的紫外可见光谱。如图5和表1所示,随着dna浓度的增加,可以看出茂型钌配合物的紫外可见光谱均随dna的逐渐加入出现了明显的减色效应和一定的红移现象,其中ru2的红移现象最为明显,并且它们都具有较大的结合常数,可以推测配合物与dna之间存在较强的相互作用,插入结合的可能性比较大。
通过对比相同插入配体的配合物ru1和ru3以及ru2和ru4,可以看出cym类配合物的dna结合常数更大,说明cym类配合物与dna的结合能力要比ben类的强。与文献报道的不具有平面性插入配体的茂型钌配合物相比,本发明所设计合成的茂型钌配合物与dna的结合能力显著增强。
表1:茂型钌配合物与dna作用的实验数据
实施例3茂型钌配合物与dna作用的粘度实验
采用乌氏粘度计测量dna与配合物溶液的粘度。测量粘度时,温度恒定在(28±0.1)°c。其中dna浓度固定为100μm,配合物浓度依次为0、20、40、60、80μm。相对粘度按下式计算:
η=(t-t0)/t0
其中,t0为缓冲液流经毛细管所需的时间,t为dna溶液(含不同浓度的配合物)流经毛细管所需的时间。η是dna-配合物体系溶液的相对粘度,η0为未加配合物时dna溶液的相对粘度。以(η/η0)1/3对[complex]/[dna]作图,得到dna粘度随配合物浓度变化的曲线。如图6所示,随着配合物浓度的增加,ct-dna的粘度明显增大,证明配合物能够以插入方式与dna结合。另一方面,含cym类配合物的dna相对粘度变化大于ben类,说明cym类的配合物与dna的结合能力要比ben类的强,规律与紫外可见光谱滴定实验结果一致。
实施例4茂型钌配合物水解动力学研究
采用紫外吸收光谱来对茂型钌配合物进行水解动力学研究。将配合物溶于少量无水甲醇,再用纯水配成一定浓度的水溶液,在310k下每隔5min记录一次在不同波长下的吸光度。各个配合物的吸光度和时间数据符合一级速率方程:a=c0+c1e-kt
其中,c0和c1都是常数,而k是水解速率常数,a则是随时间t变化的吸光度。配合物的水解平衡常数和半衰期数据根据上式求得。由7图和表2可以看出,配合物吸光度随时间变化明显,都出现了较为明显的减色或红移现象,说明了配合物结构中的氯离子能够有效的被溶剂水分子替换。得到的水合配合物中的中心钌离子能够更高活性的与dna的碱基配位。
表2:茂型钌配合物的水解动力学数据
实施例5茂型钌配合物对肿瘤细胞生长的抑制作用
利用cck-8试剂盒,分别测试不同浓度的茂型钌配合物对人乳腺癌细胞mcf-7、人前列腺癌细胞22rv1和人肺癌细胞a549三种不同肿瘤细胞生长的抑制作用,拟合出ic50。如表3所示,ru4对三种肿瘤细胞凋亡的诱导能力最强,其他化合物也具有较好的诱导凋亡能力;ru3对22rv1细胞也有很强的诱导凋亡的能力。总的来看,本发明合成的四种茂型钌配合物对三种肿瘤细胞都表现出较好的抑制能力,是很具潜力的潜在抗肿瘤化合物。
表3:茂型钌配合物的抑制三种肿瘤生长的ic50(μm)
实施例6茂型钌配合物与肿瘤细胞的流式细胞分析
采用annexinvfitc染色和流式细胞术分析研究茂型钌配合物的抗肿瘤活性。将人细胞以每孔2×105个细胞的密度接种在六孔板中,并在37℃,含5%co2的湿润培养箱中保持过夜。第二天,用40μm不同浓度的单核茂型钌(ii)配合物分别处理细胞72小时,收集细胞,用膜联蛋白v-fitc染色之后使用bdfacscalibur流式细胞术进行凋亡测定。如图8所示,茂型钌配合物ru1、ru2、ru3和ru4处理的人前列腺癌细胞22rv1在凋亡阶段的细胞分别为88.40%,90.17%,87.87%和87.91%。ru2诱导肿瘤细胞凋亡的活性相对最高。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种荔枝多糖铁配合物的制备方法
- 一种含4,4’-二溴-2,2’-联吡啶的新型钌配合物的制备方法及其抗肿瘤活性的制作方法
- 一种羰基锝-99m标记的美法仑配合物及其制备方法与用图
- 一种锝-99m标记的美法仑配合物及其制备方法与用图
- Ru配合物Ru(bpy)<sub>3</sub>(NH<sub>2</sub>)<sub>2</sub>与石墨烯量子相结合的方法
- 1,4-二甲基-2,5-二-1h-1,2,4-双三唑二维铜配合物单晶与应用
- 1,4-二甲基-2,5-二-1h-双三唑均苯四酸钴配合物单晶与应用
- 一种含双氮配体低价金属铑(Ⅰ)的环辛二烯配合物及其制备方法
- 1,4-二甲基-2,5-二-1h-双三唑三维铜配合物单晶与应用
- 一种2-羰基-3-苯基丙酸苯甲酰腙二(2,4-二氯苄基)锡配合物及其制备方法和应用