一种基于过表达tfox基因的自然感受态的基因编辑方法及其应用与流程
本发明涉及一种基于过表达tfox基因的自然感受态的基因编辑方法及其应用,属于生物工程领域。
背景技术:
在自然条件下,细菌主动摄取外源dna,通过同源重组整合入染色体稳定遗传的过程被称作自然转化(naturaltransformation)。自然转化是细菌中基因水平转移的重要策略之一。通过自然转化,细菌能够获得新的性状以适应外界不同的环境。大量的研究表明自然转化现象在弧菌科细菌中普遍存在,在弧菌的遗传多样性和进化中具有重要的作用。
细胞能够从周围环境中摄取dna分子,并且不易被细胞内的限制性核酸内切酶分解时所处的一种特殊生理状态称感受态(competence)。自然环境中细菌可以吸收外源遗传物质以增加自身对环境的适应性。细菌的感受态有两种类型:一种是自然感受态(naturalcompetence),自然感受态细菌可以自由地吸收dna,通过它来进行遗传转化;另一种是人工感受态(artificialcompetence),在这种转化中,细菌发生改变使得它们能摄入外源dna。
感受态细胞就是通过处理使细胞的通透性变大,使外源基因或载体进入感受态细胞,由于细胞膜的流动性,孔洞会被细胞自身修复。人工感受态的形成,需要低温和钙处理,这样可能破坏了细胞膜上的脂质阵列,ca2+与膜上的多聚羟基丁酸化合物、多聚无机磷酸形成复合物利于外源dna的渗入,外部理化因素促进了感受态的形成。
发生自然转化的前提条件是细菌须处于自然感受状态(naturalcompetence)。现有的自然感受态可以通过电转化和基因工程的方式诱导细菌自然产生。研究表明,多种弧菌属都能够通过诱导关键基因产生自然感受态,转变成自然感受态的细胞具有从外界吸收遗传物质并整合到自身基因组上的功能。因此,关键基因的编辑和表达成为了人工诱导弧菌自然感受态的一种重要方法。
技术实现要素:
针对现有技术存在的上述问题,本发明的目的是获得一种基于过表达tfox基因的自然感受态的基因编辑方法及其应用。
为实现上述发明目的之一,本发明采用的基于过表达tfox基因的自然感受态的基因编辑方法的技术方案如下:
诱导自然感受态关键基因tfox的基因编辑方法,所述基因编辑方法将带有tfox基因的质粒转化至弧菌内,弧菌基因进行编辑及抗性筛选后得到含有tfox基因片段的弧菌,后通过诱导剂诱导弧菌自然感受态的产生以及相应的弧菌的基因编辑工作,其中基因编辑采用重叠延伸pcr的方法插入抗性基因对弧菌的待编辑基因进行编辑。
优选的,所述重叠延伸pcr法采用cm抗性基因取代弧菌基因片段。
具体的,所述基因编辑方法包括如下步骤:
a)构建表达质粒:通过双酶切连接的方式构建表达tfox基因的质粒,转入大肠杆菌复制获取表达tfox基因的过表达质粒;
b)转化过表达质粒:将步骤a)中获得的过表达质粒电转化至通过常规技术手段获得的弧菌感受态细胞内,并通过抗性筛选获得阳性菌株;
c)重叠延伸pcr:设计抗性基因特异性引物、待编辑基因上游和下游特异性引物,重叠延伸pcr获得待编辑位点的同源片段;
d)诱导弧菌自然感受态及基因编辑:将步骤c)中的扩增产物与步骤b)中的阳性菌株混合培养,并加入诱导剂诱导弧菌自然感受态的产生,共同培养后稀释涂布至抗性平板,筛选出的阳性克隆即为发生基因编辑的弧菌。
优选的,步骤c)中的待编辑位点的同源片段不小于3kb。
优选的,待编辑基因至少为一个,待编辑位点的同源片段的上游和下游各设计一对特异性引物。
优选的,本方法通过ncbi网站搜索以及与已有的其他弧菌属tfox比对获取tfox基因序列,设计特异引物并加入与所选择用来进行过表达的质粒相对应的酶切位点,以选取的弧菌基因组作为模板扩增获取tfox基因片段,通过酶切连接的方式构建过表达tfox基因的质粒,随后转入大肠杆菌进行复制获取大量过表达质粒。
优选的,本方法中弧菌的电转流程参照第三版《molecularcloning》,稍作修改:
1)将单菌落从新鲜琼脂平板接种到含有50ml富营养的培养基中。将培养物在37℃下孵育过夜,200rpm旋转振荡培养;
2)将两等份250ml预热的富营养培养基分装到1l烧瓶中,分别接种25ml上述过夜细菌培养物,37℃孵育4小时,200rpm旋转振荡培养;
3)将培养物转移到预冷的无菌一次性50ml离心管中,置于冰上15~30分钟,将培养物冷却至4℃;
4)在4℃下以2700g(sorvallgsa转子,4100rpm)离心15分钟来回收细胞;
5)采用500ml冰冷的2mmcacl2溶液温和涡旋重悬菌体;
6)在4℃下以2700g(sorvallgsa转子,4100rpm)离心15分钟来回收细胞;
7)在250ml冰冷的10%甘油中温和涡旋重悬菌体;
8)在2700g(sorvallgsa转子,4100rpm)在4℃下离心20分钟,并用10ml冰冷的10%甘油重悬菌体;
9)在2700g(sorvallgsa转子,4100rpm)在4℃下离心20分钟,并通过2ml冰冷的gyt重悬菌体;
10)快速将等分样品悬浮液分配到冷却的无菌预冷管中。将管存放在-80℃直至需要从-80℃冰箱中取出一管感受态细胞。在细胞解冻时将管转移到冰上,向每个管中加入约50ng,体积为2μl的前文构建的过表达质粒,轻轻旋转混合;
11)设置电转仪以提供1.8kv的电脉冲;
12)将质粒菌体混合物移液到冷的电转杯中,确保质粒菌体悬浮液位于底部。擦拭干外部的冷凝水,将电转杯放入电转仪中;
13)在上述设置下向细胞提供电脉冲,仪器读数4~5毫秒的时间表明正常,脉冲后尽快取出电击杯,室温下加入1ml富营养培养基;
14)将细胞转移到无菌管中并在37℃温和旋转孵育培养2小时;
15)将不同体积和稀释度的细胞铺在含有对应于转化质粒浓度抗生素的富营养琼脂培养基上;
16)翻转平板并在37℃下孵育,转化的菌落应在12~16小时内出现。
优选的,诱导弧菌自然感受态及基因编辑步骤具体包括:
i.挑取步骤b)中的单克隆,接种到3ml富营养培养基,加入对应浓度的抗生素以及终浓度100um的诱导剂iptg,37℃下200rpm振荡过夜培养12~18小时;
ii.次日,取出7ul过夜培养物稀释到350μl0.5xio中,并加入终浓度100um的iptg,温和混匀,加入步骤c)中的待编辑位点的同源片段(插入抗性片段,上下游片段大于3kb可获得较高效率,总量3~5μg),同时设置一个不添加dna片段的对照,温和混匀后放入37℃静置6~16小时;
iii.向体系中加入0.5ml富营养培养基,转入37℃下200rpm旋转振荡培养2小时;
iv.梯度稀释并体系涂布到选择标记以及不带选择标记的富营养平板上,计数转化效率;
进行多基因编辑时,需要在第2)步加入多基因的目标同源片段,最后进行多重pcr筛选即可。
本发明的第二个目的在于提供一种上述任一种技术方法所述的基于过表达tfox基因的自然感受态的基因编辑方法的应用,所述基因编辑方法诱导弧菌属自然感受态形成基因编辑成功的阳性克隆。
优选的,所述弧菌属包括河流弧菌或霍乱弧菌。
本发明的第三个目的在于提供一种弧菌自然感受态的制备方法,所述制备方法采用根据上述任一种过表达自然感受态关键基因tfox的方法进行。
本发明的第四个目的在于提供一种河流弧菌的基因编辑方法,所述方法通过过表达tfox诱导河流弧菌自然感受态,采用cm抗性片段插入并取代lacz基因,所述编辑方法包括如下步骤:
a)构建表达质粒:参考pmalc2x质粒信息以及tfox基因序列,通过双酶切连接的方式构建表达tfox基因的质粒tfox-pmalc2x,转入大肠杆菌复制获取过表达质粒tfox-pmalc2x;
b)转化过表达质粒:将步骤a)中获得的过表达质粒tfox-pmalc2x电转化至通过常规技术手段获得的河流弧菌感受态细胞内,并通过抗性筛选获得阳性菌株;
c)重叠延伸pcr:用氯霉素抗性片段替代河流弧菌lacz部分区域,设计cm抗性基因特异性引物、lacz基因上游和下游特异性引物,重叠延伸pcr获得扩增产物;
d)诱导弧菌自然感受态及基因编辑:将步骤c)中的扩增产物与步骤b)中的阳性菌株混合培养,加入诱导剂,培养后稀释涂布至抗性显色平板,筛选出的阳性克隆即为发生基因编辑的河流弧菌。
优选的,步骤a)中双酶切位点序列如序列表seqidno:1~2所示;步骤a)中引入检测引物tfox-check-r和tfox-check-f筛选阳性克隆,检测引物tfox-check-r和tfox-check-f的位点序列如序列表seqidno:3~4所示;步骤c)中lacz上下游特异性引物序列如序列表seqidno:5~8所示;步骤c)中cm抗性基因的特异性引物序列如序列表seqidno:9~10所示。
优选的,步骤d)中的显色底物为x-gal。
优选的,抗性平板为cm和amp抗性lb平板。
具体的,转化过表达质粒的转化过程如下:
1)野生型河流弧菌(lacz+)种子从-80℃冰箱划板接出,37℃过夜培养;
2)将单菌落从平板接种到含有50ml的bhi培养基中。将培养物在37℃下孵育过夜,200rpm旋转振荡培养;
3)将两等份250ml预热的bhi培养基分装到1l烧瓶中,分别接种25ml上述过夜细菌培养物,37℃孵育4小时,200rpm旋转振荡培养;
4)将培养物转移到预冷的无菌一次性50ml离心管中,置于冰上15-30分钟,将培养物冷却至4℃;
5)在4℃下以2700g(sorvallgsa转子,4100rpm)离心15分钟来回收细胞;
6)采用500ml冰冷的2mmcacl2溶液温和涡旋重悬菌体;
7)在4℃下以2700g(sorvallgsa转子,4100rpm)离心15分钟来回收细胞;
8)在250ml冰冷的10%甘油中温和涡旋重悬菌体;
9)在2700g(sorvallgsa转子,4100rpm)在4℃下离心20分钟,并用10ml冰冷的10%甘油重悬菌体;
10)在2700g(sorvallgsa转子,4100rpm)在4℃下离心20分钟,并通过2ml冰冷的gyt重悬菌体;
11)快速将等分样品悬浮液分配到冷却的无菌预冷管中。将管存放在-80℃直至需要;
12)从-80℃冰箱中取出一管感受态细胞。在细胞解冻时将管转移到冰上,向每个管中加入约50ng,体积为2μl的前文构建的过表达质粒,轻轻旋转混合;
13)设置电转仪以提供1.8kv的电脉冲;
14)将质粒菌体混合物移液到冷的电转杯中,确保质粒菌体悬浮液位于底部。擦拭干外部的冷凝水,将电转杯放入电转仪中;
15)在上述设置下向细胞提供电脉冲,仪器读数4~5毫秒的时间表明正常,脉冲后尽快取出电击杯,室温下加入1mlbhi培养基;
16)将细胞转移到无菌管中并在37℃温和旋转孵育培养2小时;
17)将不同体积和稀释度的细胞铺在含有20ug/ml氨苄青霉素的bhi琼脂培养基上;
18)翻转平板并在37℃下孵育,挑选单克隆理论上既是构建好的含有过表达质粒的弧菌;
最终通过pcr再次检查阳性结果,所用引物为tfox-check-f和tfox-check-r,挑取的单克隆都是阳性。
优选的,诱导弧菌自然感受态及基因编辑步骤具体为:
i.接种上面构建的含有tfox-pmalc2x质粒的河流弧菌(lacz+)到3mlbhi培养基,加入终浓度100μmiptg以及30μg/ml对应于pmalc2x质粒的氨苄青霉素,放入37℃,200rpm旋转过夜培养;
ii.次日,在无菌1.5mlep管中,加入350μl海盐(7g海盐溶于1lddh20,高压灭菌)以及终浓度100μmiptg,加入上述菌液7ul以及纯化的同源pcr产物(约1μg),温和的混合均匀后静置于37℃过夜,培养大于16小时,该步骤需要设置不加入同源pcr产物的对照;
iii.加入0.5ml新鲜bhi培养基,置于37℃,200rpm旋转培养2小时;
iv.进行梯度稀释后,各取50μl分别涂布到新鲜的含有cm、amp以及x-gal的lb平板进行阳性克隆筛选,以及amp以及x-gal的lb平板进行总菌计数,37℃过夜培养;
v.按照cm、amp以及x-gal的lb平板统计的克隆数/amp以及x-gal的lb平板统计的克隆数既是基因编辑的效率。
优选的,添加了抗生素的显色lb平板,其中抗生素浓度为cm:1ug/ml,amp:20ug/ml,x-gal:40ug/ml。
通过在河流弧菌体内过表达tfox基因诱导自然感受态将cm抗性基因插入到lacz基因,对照未添加待编辑基因片段的处理平板上没有单菌落形成,在含有cm、amp以及x-gal的平板上长出较大量的白色单菌落,说明基因编辑完成,cm抗性基因得到表达以及lacz基因被破坏,最终统计的基因编辑效率约为1/300。
本发明还提供一种河流弧菌自然感受态的制备方法,所述制备方法采用上述任一种过表达自然感受态关键基因tfox的方法进行。
具体的,所述自然感受态的制备方法包括构建表达质粒、转化过表达质粒两个步骤,自然感受态的基因编辑方法包括构建表达质粒、转化过表达质粒、重叠延伸pcr和诱导弧菌自然感受态及基因编辑四个步骤。
优选的,参考pmalc2x质粒信息以及tfox基因序列,通过双酶切连接的方式构建表达tfox基因的质粒tfox-pmalc2x;用氯霉素抗性片段替代河流弧菌lacz部分区域。
本发明的第五个目的在于提供一种霍乱弧菌的基因编辑方法,通过过表达tfox诱导霍乱弧菌自然感受态,采用cm抗性片段取代vc1807基因,并同时对lacz引入突变,所述编辑方法包括如下步骤:
a)构建表达质粒:参考pmalc2x质粒信息以及tfox基因序列,通过双酶切连接的方式构建表达tfox基因的质粒tfox-pmalc2x,转入大肠杆菌复制获取过表达质粒tfox-pmalc2x;
b)转化过表达质粒:将步骤a)中获得的过表达质粒tfox-pmalc2x电转化至通过常规技术手段获得的霍乱弧菌感受态细胞内,并通过抗性筛选获得阳性菌株;
c)重叠延伸pcr:用氯霉素抗性片段替代霍乱弧菌vc1807部分区域,并对lacz基因引入突变,设计cm抗性基因特异性引物、vc1807基因和lacz基因的上游和下游特异性引物,重叠延伸pcr获得扩增产物;
d)诱导弧菌自然感受态及基因编辑:将步骤c)中的扩增产物与步骤b)中的阳性菌株混合培养,加入诱导剂,共同培养后稀释涂布至抗性x-gal平板,筛选出的蓝色克隆和白色克隆即为发生基因编辑的霍乱弧菌。
优选的,霍乱弧菌的过表达质粒构建以及转化基本步骤同河流弧菌,不同之处仅在于克隆霍乱弧菌tfox基因所有的引物,步骤a)中双酶切位点序列如序列表seqidno:11~12所示;步骤a)中引入检测引物tfox-check-r和tfox-check-f筛选阳性克隆,检测引物tfox-check-r和tfox-check-f的位点序列如序列表seqidno:3~4所示;步骤c)中lacz上下游特异性引物序列如序列表seqidno:13~16所示;步骤c)中vc1807基因上下游特异性引物序列如序列表seqidno:17~20所示;步骤c)中cm抗性基因的特异性引物序列如序列表seqidno:21~22所示。
优选的,霍乱弧菌的基因编辑设计两个基因片段,诱导弧菌自然感受态及基因编辑的步骤具体为:
i.接种构建的含有tfox-pmalc2x质粒的霍乱弧菌(lacz+)到3mllb培养基,加入终浓度100μmiptg以及30μg/ml对应于pmalc2x质粒的氨苄青霉素,放入37℃,200rpm旋转过夜培养;
ii.次日,在无菌1.5mlep管中,加入350μl海盐(7g海盐溶于1lddh20,高压灭菌)以及终浓度100μmiptg,加入上述菌液7ul以及纯化的同源pcr产物(抗性片段约100ng,取代vc1807的抗性片段以及插入突变lacz片段分别约3μg),温和的混合均匀后静置于37℃过夜,培养大于16小时,设置不加入同源pcr产物的对照;
iii.加入0.5ml的新鲜lb培养基,置于37℃,200rpm旋转培养2小时;
iv.进行梯度稀释后,各取50μl分别涂布到新鲜的含有cm、amp以及x-gal的lb平板进行阳性克隆筛选,以及amp+x-gal的lb平板进行总菌计数,37℃过夜培养;
v.按照cm、amp以及x-gal的lb平板统计的克隆数比上amp以及x-gal的lb平板统计的克隆数既是基因编辑的效率。
优选的,抗性平板为cm和amp抗性lb平板。
优选的,添加了抗生素的显色lb平板,其中抗生素浓度为cm:1ug/ml,amp:20ug/ml,x-gal:40ug/ml。
通过在霍乱弧菌体内过表达tfox基因诱导自然感受态,同时用cm抗性基因取代vc1807以及引入缺失突变到lacz基因,lb平板检验,对照未添加待编辑基因片段的处理平板上没有单菌落形成,在cm、amp以及x-gal的lb平板上,计数蓝色菌落以及白色菌落的数目,白色的菌落既是发生双基因编辑的个体;在添加了待编辑同源基因片段的培养体系涂布到含有cm、amp以及x-gal的平板上,既有蓝色菌落又有白色菌落,菌落代表发生了cm抗性替代的个体,总效率约为1/200,其中白色菌落代表既发生了抗性替代又发生了lacz突变的个体,约占发生抗性替代个体的1/10。
本发明还提供一种霍乱弧菌自然感受态的制备方法,所述制备方法采用上述任一项过表达自然感受态关键基因tfox的方法进行。
具体的,所述自然感受态的制备方法包括构建表达质粒、转化过表达质粒两个步骤,自然感受态的基因编辑方法包括构建表达质粒、转化过表达质粒、重叠延伸pcr和诱导弧菌自然感受态及基因编辑四个步骤。
优选的,参考pmalc2x质粒信息以及tfox基因序列,通过双酶切连接的方式构建表达tfox基因的质粒tfox-pmalc2x;用氯霉素抗性片段替代霍乱弧菌vc1807部分区域,并对lacz基因引入突变。
与现有技术相比,本发明采用过表达关键基因tfox,引起弧菌自然感受态的产生,进而仅通过直接外源添加同源遗传片段达到特定基因编辑的目的。本方法操作简单、原理通用,编辑过程用时短,可以快速将弧菌诱导至自然感受态,并进行需要的基因编辑,具有良好的推广价值。通过本发明的方法诱导的河流弧菌和霍乱弧菌,均处于自然感受态,是良好的外源dna受体。本发明中的方法不仅可以诱导弧菌属产生自然感受态,而且该方法可以推广至所有细菌用于诱导自然感受态,具有良好的推广价值。
附图说明
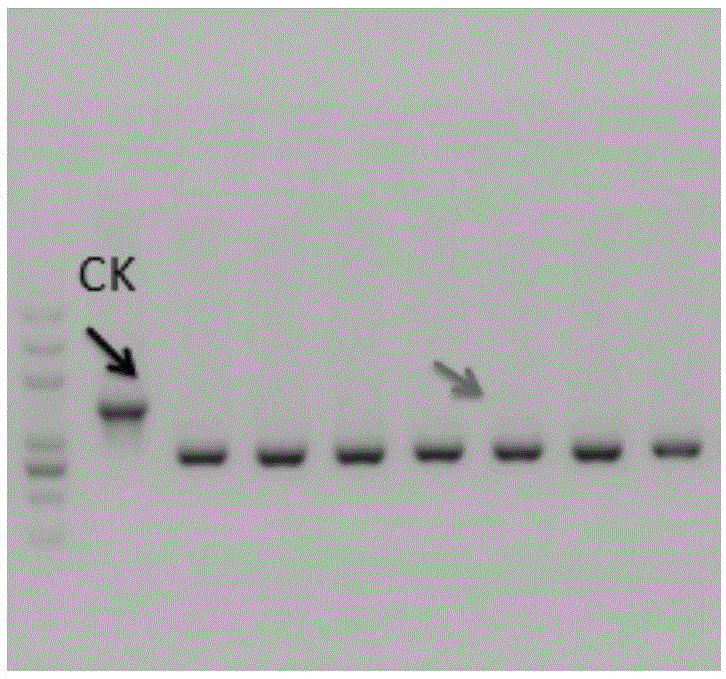
图1为本发明实施例1的过表达质粒电泳检测图;
图2为本发明实施例1的soepcr示意图;
图3a为本发明实施例1未添加了待编辑同源基因片段的培养体系涂布到含有cm、amp以及x-gal的平板上的lb培养示意图;
图3b为本发明实施例1添加了待编辑同源基因片段的培养体系涂布到含有cm、amp以及x-gal的平板上的lb培养示意图;
图4a为本发明实施例2未添加了待编辑同源基因片段的培养体系涂布到含有cm、amp以及x-gal的平板上的lb培养示意图;
图4b为本发明实施例2添加了待编辑同源基因片段的培养体系涂布到含有cm、amp以及x-gal的平板上的lb培养示意图。
具体实施方式
下面结合实施例对本发明提供的一种基于过表达tfox基因的自然感受态的基因编辑方法及其应用作进一步详细、完整地说明。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的实验材料如无特殊说明,均为市场购买得到。
实施例1
本实施例公开了河流弧菌的自然感受态快速基因编辑方法,所述方法通过过表达tfox诱导河流弧菌自然感受态,采用cm抗性片段插入并取代lacz基因,从而完成河流弧菌的基因编辑。具体操作步骤如下:
1.1克隆河流弧菌的tfox基因并构建过表达质粒:
参考pmalc2x质粒信息以及tfox基因序列,引入双酶切位点设计引物扩增河流弧菌的tfox基因,引物序列为表1中ndei-vftfox-f和xbai-vftfox-r,通过双酶切方法分别切割质粒以及插入片段,后采用t4连接酶连接产物,采用常规大肠杆菌电转方法将连接产物转入到dh5αλpir感受态细胞,随后通过氨苄青霉素抗性平板筛选转入质粒的细菌,随机挑选5个单克隆,通过表1的检测引物tfox-check-f和tfox-check-r筛选阳性克隆,具有目标条带的菌进行扩大培养保存,以及提取更多质粒作为后续实验。
表1
1.2转化过表达质粒到河流弧菌:
通过电转的方式将构建的质粒转入到河流弧菌,参考第三版《分子克隆》手册大肠杆菌杆菌电感受态细胞的制备以及转化流程,并对流程稍作修改:
1)野生型河流弧菌(lacz+)种子从-80℃冰箱划板接出,37℃过夜培养;
2)将单菌落从平板接种到含有50ml的bhi培养基中。将培养物在37℃下孵育过夜,200rpm旋转振荡培养;
3)将两等份250ml预热的bhi培养基分装到1l烧瓶中,分别接种25ml上述过夜细菌培养物,37℃孵育4小时,200rpm旋转振荡培养;
4)将培养物转移到预冷的无菌一次性50ml离心管中,置于冰上15-30分钟,将培养物冷却至4℃;
5)在4℃下以2700g(sorvallgsa转子,4100rpm)离心15分钟来回收细胞;
6)采用500ml冰冷的2mmcacl2溶液温和涡旋重悬菌体;
7)在4℃下以2700g(sorvallgsa转子,4100rpm)离心15分钟来回收细胞;
8)在250ml冰冷的10%甘油中温和涡旋重悬菌体;
9)在2700g(sorvallgsa转子,4100rpm)在4℃下离心20分钟,并用10ml冰冷的10%甘油重悬菌体;
10)在2700g(sorvallgsa转子,4100rpm)在4℃下离心20分钟,并通过2ml冰冷的gyt重悬菌体;
11)快速将等分样品悬浮液分配到冷却的无菌预冷管中。将管存放在-80℃直至需要;
12)从-80℃冰箱中取出一管感受态细胞。在细胞解冻时将管转移到冰上,向每个管中加入约50ng,体积为2μl的前文构建的过表达质粒,轻轻旋转混合;
13)设置电转仪以提供1.8kv的电脉冲;
14)将质粒菌体混合物移液到冷的电转杯中,确保质粒菌体悬浮液位于底部。擦拭干外部的冷凝水,将电转杯放入电转仪中;
15)在上述设置下向细胞提供电脉冲,仪器读数4~5毫秒的时间表明正常,脉冲后尽快取出电击杯,室温下加入1mlbhi培养基;
16)将细胞转移到无菌管中并在37℃温和旋转孵育培养2小时;
17)将不同体积和稀释度的细胞铺在含有20ug/ml氨苄青霉素的bhi琼脂培养基上;
18)翻转平板并在37℃下孵育,挑选单克隆理论上既是构建好的含有过表达质粒的弧菌;
19)最终通过pcr再次检查阳性结果,所用引物为tfox-check-f和tfox-check-r,结果如图1所示,挑取的单克隆都是阳性。
1.3构建目标编辑区域同源片段
采用重叠延伸pcr(genesplicingbyoverlapextensionpcr,简称soepcr)方法,用氯霉素抗性片段替代河流弧菌lacz部分区域,分别扩增大于3kb的河流弧菌lacz基因上下游片段(上游vflacz-f1和vflacz-r1,下游为flacz-f2和vflacz-r2)以及cm抗性基因片段(cm-f和cm-r),通过soepcr技术将三段片段连接起来,soepcr技术示意图如图2所示,pcr产物采用试剂盒纯化并测定浓度,设计原理如下图所示,采用的引物序列如表2所示:
表2
1.4诱导河流弧菌的自然感受态并进行基因编辑
i.接种上面构建的含有tfox-pmalc2x质粒的河流弧菌(lacz+)到3mlbhi培养基,加入终浓度100μmiptg以及30μg/ml对应于pmalc2x质粒的氨苄青霉素,放入37℃,200rpm旋转过夜培养;
ii.次日,在无菌1.5mlep管中,加入350μl海盐(7g海盐溶于1lddh20,高压灭菌)以及终浓度100μmiptg,加入上述菌液7ul以及纯化的同源pcr产物(约1μg),温和的混合均匀后静置于37℃过夜,培养大于16小时,该步骤需要设置不加入同源pcr产物的对照;
iii.加入0.5ml新鲜bhi培养基,置于37℃,200rpm旋转培养2小时;
iv.进行梯度稀释后,各取50μl分别涂布到新鲜的含有cm、amp以及x-gal的lb平板进行阳性克隆筛选,以及amp以及x-gal的lb平板进行总菌计数,37℃过夜培养;
v.按照cm、amp以及x-gal的lb平板统计的克隆数/amp以及x-gal的lb平板统计的克隆数既是基因编辑的效率。
1.5lb平板检验
通过在河流弧菌体内过表达tfox基因诱导自然感受态将cm抗性基因插入到lacz基因,lb平板检验结果如图3a和图3b所示,图中为添加了抗生素的lb平板,其中抗生素浓度为cm:1ug/ml,amp:20ug/ml,x-gal:40ug/ml。图3b在含有cm、amp以及x-gal的平板上长出较大量的白色单菌落,说明基因编辑完成,cm抗性基因得到表达以及lacz基因被破坏,图3a中对照未添加待编辑基因片段的处理平板上没有单菌落形成,最终统计的基因编辑效率约为1/300。
实施例2
本实施例公开了霍乱弧菌的自然感受态快速基因编辑方法,通过过表达tfox诱导霍乱弧菌自然感受态,采用cm抗性片段取代vc1807基因,并同时对lacz引入突变,从而构建霍乱弧菌的自然感受态。具体操作步骤如下:
2.1过表达质粒构建以及2.2转化基本步骤同实施例1河流弧菌,不同之处仅在于克隆霍乱弧菌tfox基因所有的引物如下表3所示,用于克隆质粒和检查的引物同河流弧菌:
表3
2.3构建编辑区域同源片段
选择霍乱弧菌的假转座酶基因vc1807以及lacz基因,分别采用氯霉素抗性基因替代以及引入点突变,原理同soepcr。所用到的引物分别为:
vc1807-f1/vc1807-r1和vc1807-f2/vc1807-r2分别扩增霍乱弧菌的vc1807基因的上下游片段,vccm-f/vccm-r扩增插入的氯霉素抗性片段,vclacz-f1/vclacz-r1和vclacz-f2/vclacz-r2分别用于扩增霍乱弧菌lacz基因的上下游。
2.4诱导霍乱弧菌自然感受态,同时加入两个基因片段进行多基因编辑:
i.接种构建的含有tfox-pmalc2x质粒的霍乱弧菌(lacz+)到3mllb培养基,加入终浓度100μmiptg以及30μg/ml对应于pmalc2x质粒的氨苄青霉素,放入37℃,200rpm旋转过夜培养;
ii.次日,在无菌1.5mlep管中,加入350μl海盐(7g海盐溶于1lddh20,高压灭菌)以及终浓度100μmiptg,加入上述菌液7ul以及纯化的同源pcr产物(抗性片段约100ng,取代vc1807的抗性片段和插入突变lacz片段分别约3μg),温和的混合均匀后静置于37℃过夜,培养大于16小时,设置不加入同源pcr产物的对照;
iii.加入0.5ml的新鲜lb培养基,置于37℃,200rpm旋转培养2小时;
iv.进行梯度稀释后,各取50μl分别涂布到新鲜的含有cm、amp以及x-gal的lb平板进行阳性克隆筛选,以及amp+x-gal的lb平板进行总菌计数,37℃过夜培养;
v.按照cm、amp以及x-gal的lb平板统计的克隆数比上amp以及x-gal的lb平板统计的克隆数既是基因编辑的效率。
2.5lb平板检验
通过在霍乱弧菌体内过表达tfox基因诱导自然感受态,同时用cm抗性基因取代vc1807以及引入缺失突变到lacz基因,lb平板检验结果如图4a和图4b所示,图中为添加了抗生素的lb平板,其中抗生素浓度为cm:1ug/ml,amp:20ug/ml,x-gal:40ug/ml。
同时,在cm、amp以及x-gal的lb平板上,计数蓝色菌落以及白色菌落的数目,白色的菌落既是发生双基因编辑的个体;在添加了待编辑同源基因片段的培养体系涂布到含有cm、amp以及x-gal的平板上,既有蓝色菌落又有白色菌落,图4a中对照未添加待编辑基因片段的处理平板上没有单菌落形成,图4b平板上的菌落代表发生了cm抗性替代的个体,总效率约为1/200,其中箭头所指之处的白色菌落代表既发生了抗性替代又发生了lacz突变的个体,约占发生抗性替代个体的1/10。
最后有必要在此说明的是:以上实施例只用于对本发明的技术方案作进一步详细地说明,不能理解为对本发明保护范围的限制,本领域的技术人员根据本发明的上述内容作出的一些非本质的改进和调整均属于本发明的保护范围。
序列表
<110>华中科技大学鄂州工业技术研究院华中科技大学
<120>一种诱导自然感受态关键基因tfox的基因编辑方法及其应用
<130>2018
<160>22
<170>siposequencelisting1.0
<210>1
<211>28
<212>dna
<213>artificialsequence
<220>
<221>misc_feature
<222>(1)..(28)
<223>ndei-vftfox-f序列
<400>1
cgccgcatatggatatgtttgagcatag28
<210>2
<211>31
<212>dna
<213>artificialsequence
<220>
<221>misc_feature
<222>(1)..(31)
<223>xbai-vftfox-r序列
<400>2
gcgtctagattaacgaccgagacagatatcg31
<210>3
<211>19
<212>dna
<213>artificialsequence
<220>
<221>misc_feature
<222>(1)..(19)
<223>tfox-check-r序列
<400>3
cattcaggctgcgcaactg19
<210>4
<211>19
<212>dna
<213>artificialsequence
<220>
<221>misc_feature
<222>(1)..(19)
<223>tfox-check-f序列
<400>4
cagccagtccgtttaggtg19
<210>5
<211>21
<212>dna
<213>artificialsequence
<220>
<221>misc_feature
<222>(1)..(21)
<223>vflacz-f1序列
<400>5
atggccgtcaatgatgtcctg21
<210>6
<211>40
<212>dna
<213>artificialsequence
<220>
<221>misc_feature
<222>(1)..(40)
<223>vflacz-r1序列
<400>6
gtcgacggatccccggaatgccgcttcttcactgtgatag40
<210>7
<211>37
<212>dna
<213>artificialsequence
<220>
<221>misc_feature
<222>(1)..(37)
<223>vflacz-f2序列
<400>7
gaagcagctccagcctacacaccaagtgtgcatgaac37
<210>8
<211>18
<212>dna
<213>artificialsequence
<220>
<221>misc_feature
<222>(1)..(18)
<223>vflacz-r2序列
<400>8
aacgataacggccagtag18
<210>9
<211>40
<212>dna
<213>artificialsequence
<220>
<221>misc_feature
<222>(1)..(40)
<223>vfcm-f序列
<400>9
ctatcacagtgaagaagcggcattccggggatccgtcgac40
<210>10
<211>37
<212>dna
<213>artificialsequence
<220>
<221>misc_feature
<222>(1)..(37)
<223>vfcm-r序列
<400>10
gttcatgcacacttggtgtgtaggctggagctgcttc37
<210>11
<211>27
<212>dna
<213>artificialsequence
<220>
<221>misc_feature
<222>(1)..(27)
<223>ndei-vctfox-f序列
<400>11
cgccgcatgtgattaaaggatcaatgg27
<210>12
<211>31
<212>dna
<213>artificialsequence
<220>
<221>misc_feature
<222>(1)..(31)
<223>xbai-vctfox-r序列
<400>12
gcgtctagattaacgctgacaactttctaac31
<210>13
<211>27
<212>dna
<213>artificialsequence
<220>
<221>misc_feature
<222>(1)..(27)
<223>vclacz-f1序列
<400>13
accctaagcggttcaattttgtcgatg27
<210>14
<211>55
<212>dna
<213>artificialsequence
<220>
<221>misc_feature
<222>(1)..(55)
<223>vclacz-r1序列
<400>14
gaacatggggtgtacggcagtgccattaaacgatgtgcgggttttgccaatcttg55
<210>15
<211>55
<212>dna
<213>artificialsequence
<220>
<221>misc_feature
<222>(1)..(55)
<223>vclacz-f2序列
<400>15
caagattggcaaaacccgcacatcgtttaatggcactgccgtacaccccatgttc55
<210>16
<211>25
<212>dna
<213>artificialsequence
<220>
<221>misc_feature
<222>(1)..(25)
<223>vclacz-r2序列
<400>16
tgatccgatgatcttttcgcccacc25
<210>17
<211>24
<212>dna
<213>artificialsequence
<220>
<221>misc_feature
<222>(1)..(24)
<223>vc1807-f1序列
<400>17
gtagaataagtgcggcgttgagcc24
<210>18
<211>54
<212>dna
<213>artificialsequence
<220>
<221>misc_feature
<222>(1)..(54)
<223>vc1807-r1序列
<400>18
gtcgacggatccccggaatacgtttcattagtcacctctattgttaacttgttc54
<210>19
<211>50
<212>dna
<213>artificialsequence
<220>
<221>misc_feature
<222>(1)..(50)
<223>vc1807-f2序列
<400>19
gaagcagctccagcctacatagtcgaaaataaaaaaaagaggctcgcctc50
<210>20
<211>24
<212>dna
<213>artificialsequence
<220>
<221>misc_feature
<222>(1)..(24)
<223>vc1807-r2序列
<400>20
gcgcccaatgttgtccctttgatg24
<210>21
<211>19
<212>dna
<213>artificialsequence
<220>
<221>misc_feature
<222>(1)..(19)
<223>vccm-f序列
<400>21
attccggggatccgtcgac19
<210>22
<211>19
<212>dna
<213>artificialsequence
<220>
<221>misc_feature
<222>(1)..(19)
<223>vccm-r序列
<400>22
tgtaggctggagctgcttc19
- 还没有人留言评论。精彩留言会获得点赞!