一种高表达高活性多形拟杆菌肝素酶I融合蛋白及其编码基因和应用的制作方法
本发明属于基因工程技术领域,尤其是一种高表达高活性多形拟杆菌肝素酶i融合蛋白及其编码基因和应用。
背景技术:
肝素(heprain)是一种特异性质多分散的混合硫酸化多糖,广泛分布于哺乳动物组织中,以共价键形式和蛋白质结合。目前商业肝素主要是从牛肺和猪小肠黏膜中提,结构复杂且具有多种重要的生物学功能,一般在临床上用于血栓、心血管等疾病的治疗。低分子量肝素(lowmolecularheparin,lmwh)是肝素通过某些物理化学方法裂解而产生的一小段肝素,与蛋白质或细胞结合的能力有所下降,但抗凝活性显著增加。与正常肝素相比,低分子肝素可降低抗因子iia的活性,极大程度地减小了出血的危险性。目前,制备低分子肝素有物理、化学、生物和合成方法。其中,生物酶解法由于具备条件温和、选择性强、污染小等优点,现已成为一种新兴的方法。
肝素酶i(heparinasei,l12534.1)是一类能够裂解肝素类结构物质、制备低分子肝素的多糖裂解酶,来源比较广泛,主要存在于原核生物肝素黄杆菌中,还包括一些拟杆菌和芽孢杆菌等。肝素酶i首先发现于肝素黄杆菌(pedobacterheparinus),可选择性地剪切硫酸化肝素聚糖中葡萄糖胺和糖醛酸之间α(1-4)糖苷键。根据肝素酶i的各个来源的氨基酸序列以及蛋白结构特点,肝素酶i被划分为糖苷水解酶pls的13家族。目前肝素酶i主要应用于低分子肝素的制备、体外循环中肝素的消除、肝素确切结构的解析、以及在体外诊断试剂方面用于凝血试验和血小板实验。
自上世纪九十年代开始,对于肝素酶i的基因工程表达,以大肠杆菌为宿主异源表达研究最多。但结果表明,大肠杆菌的表达容易聚集成不溶性包涵体,很难再进行复性。此外,许多融合表达策略已被用于改善肝素酶i的生产。例如,kapust等将肝素酶i与gst标签在大肠杆菌中进行融合表达,从而获得高产量的可溶性产物,促进一步纯化过程;cheny等将mbp蛋白和肝素酶i进行融合表达,得到90%的可溶性目的蛋白。但是以上研究都是以肝素黄杆菌来源的肝素酶i为研究对象,并且表达的肝素酶i的活性和产量都难以达到工业化水平。因此寻找和建立表达效率高、酶活性高的肝素酶重组表达技术具有重要的理论和现实意义。
通过检索,尚未发现与本发明专利申请相关的专利公开文献。
技术实现要素:
本发明的目的在于克服现有技术的不足之处,克服当前肝素酶i产量低、活性低的缺点,提供一种高表达高活性多形拟杆菌肝素酶i融合蛋白及其编码基因和应用,该融合蛋白融合sumo标签后提高了目的蛋白的可溶性表达,使可溶性表达达到95%以上,比酶活提高了48.9%;该多形拟杆菌肝素酶i融合蛋白5l发酵罐的酶活可达3.412×105iu/l,表达量可达3.4g/l,为多形拟杆菌肝素酶i的应用开发奠定基础。
本发明解决其技术问题是采取以下技术方案实现的:
一种高表达高活性多形拟杆菌肝素酶i融合蛋白,所述融合蛋白的氨基酸序列如seqidno.1所示。
一种如上所述的高表达高活性多形拟杆菌肝素酶i融合蛋白的编码基因,所述编码基因的核苷酸序列如seqidno.2所示。
一种利用如上所述的编码基因的重组表达载体,所述重组表达载体中插入了高表达高活性多形拟杆菌肝素酶i融合蛋白的编码基因。
而且,所述表达载体选自大肠杆菌表达载体、酵母表达载体、枯草表达载体、乳酸菌表达载体、链霉菌表达载体、噬菌体表达载体、丝状真菌表达载体、植物表达载体、昆虫表达载体或哺乳动物细胞表达载体。
如上所述的利用编码基因的重组表达载体在制备多形拟杆菌肝素酶i融合蛋白中的应用。
一种利用如上所述的编码基因的重组菌或转基因细胞系,在宿主细胞或细胞系中插入了高表达高活性多形拟杆菌肝素酶i融合蛋白的编码基因。
而且,所述宿主细胞或细胞系选自大肠杆菌宿主细胞、酵母菌宿主细胞、枯草芽孢杆菌宿主细胞、乳酸菌宿主细胞、放线菌宿主细胞、丝状真菌宿主细胞、昆虫细胞或哺乳动物细胞。
而且,所述大肠杆菌为:escherichiacolibl21、escherichiacolirosetta(de3)、escherichiacolijm109或escherichiacolidh5α;或者,所述酵母菌为:saccharomycescerevisiae、pichiapastoris或kluyveromycesiactis;或者,所述枯草芽孢杆菌为:bacillussubtilisr25或bacilluussubtilis9920;或者,所述乳酸菌为:lacticacidbacteriac0cc101;或者,所述放线菌为:streptomycespp;或者,所述丝状真菌宿主为:trichodermaviride、trichodermareesei、aspergillusniger或aspergillusnidulans;或者,所述昆虫细胞为:bombyxmori或antharaeaeucalypti或;或者,所述哺乳动物细胞为:中国仓鼠卵巢细胞cho,幼小仓鼠肾脏细胞bhk或中国仓鼠肺细胞chl。
如上所述的利用编码基因的重组菌或转基因细胞系在制备多形拟杆菌肝素酶i融合蛋白中的应用。
本发明取得的优点和积极效果是:
1、本发明方法通过利用pe-sumo载体对多形拟杆菌肝素酶i的表达基因进行改造,增加了sumo蛋白的核苷酸序列,获得了多形拟杆菌肝素酶i融合蛋白,融合sumo标签后提高了目的蛋白的可溶性表达,使可溶性表达达到95%以上,比酶活提高了48.9%;该多形拟杆菌肝素酶i融合蛋白5l发酵罐的酶活可达3.412×105iu/l,表达量可达3.4g/l。并且,该酶还可以通过钴柱分离实现该融合蛋白的一步纯化。为肝素酶i的工业化应用奠定基础。
2、本发明方法通过利用pe-sumo载体对多形拟杆菌肝素酶i的表达基因进行改造,增加了一段表达sumo蛋白的核苷酸序列,获得多形拟杆菌肝素酶i融合蛋白sumo-bt-hepi;该融合蛋白较野生型提高48.9%的比酶活,并且融合蛋白的5l发酵罐的发酵液酶活可达3.412×105iu/l,表达量可达3.4g/l。该融合蛋白可以通过钴柱实现一步分离纯化。并且该融合蛋白可以通过sumo蛋白酶将融合蛋白sumo切除下来,得到天然的多形拟杆菌肝素酶i(bt-hepi)。
3、本发明中的编码基因、重组表达载体、重组菌或转基因细胞系可以应用在制备多形拟杆菌肝素酶i融合蛋白中。
附图说明
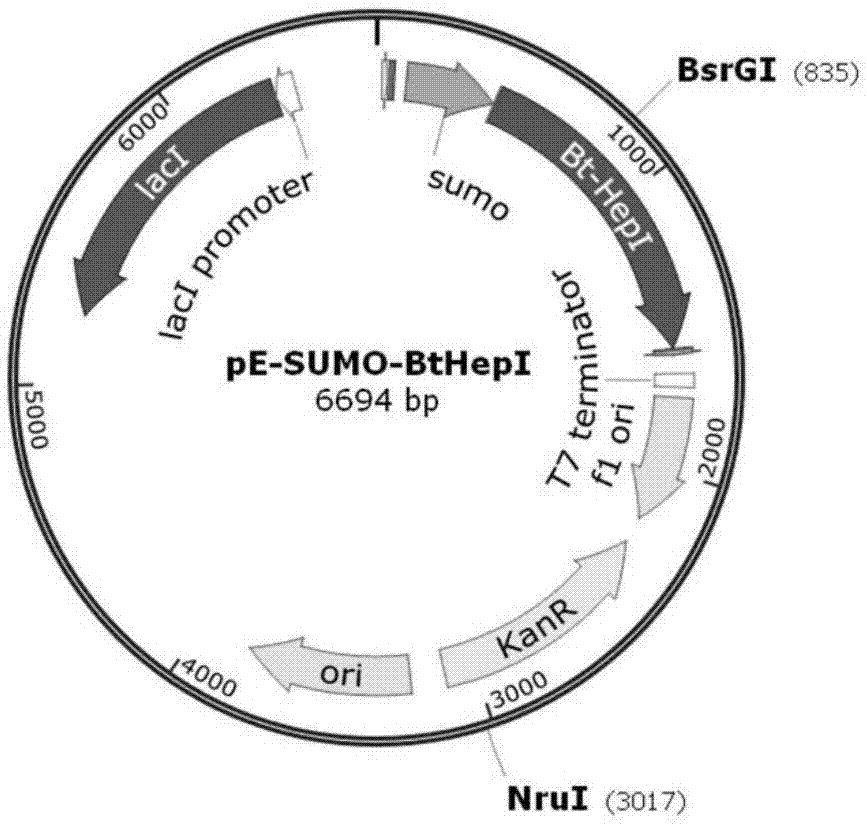
图1为本发明中表达载体pe-sumo-bt-hepi的示意图;
图2为本发明中质粒双酶切验证的电泳图谱;
图3为本发明中pe-sumo的空载质粒和pe-sumo-bt-hepi重组质粒的表达产物sds-page分析图;
其中:m、蛋白质分子量标准,条带自上至下大小为170kd,130kd,100kd,70kd,55kd,40kd,35kd,25kd,15kd;泳道1、pe-sumo空载体表达产物,上样20ul,泳道2、重组表达质粒pe-sumo-bt-hepi不进行诱导的表达产物,上样20ul,泳道3、重组表达质粒pe-sumo-bt-hepi进行诱导后的表达产物,上样量20ul;
图4为本发明中重组融合蛋白sumo-bt-hepi的表达、纯化以及脱盐的聚丙烯酰胺凝胶电泳图(sds-page);
其中:m、蛋白质分子量标准,条带自上至下大小为170kd,130kd,100kd,70kd,55kd,40kd,35kd,25kd,15kd;泳道1、重组菌超声破壁上清,上样20ul,泳道2、5mm咪唑洗脱液,上样20ul,泳道3、150mm咪唑洗脱液,稀释10倍后上样20ul,泳道4、经脱盐柱拖延后的重组蛋白,稀释10倍后上样20ul;
图5为本发明中融合sumo蛋白前后多形拟杆菌肝素酶i的比酶活比较图;
图6、7为本发明中bt-hepi和sumo-bt-hepi的最适ph及ph稳定性测定图;
图8、9为本发明中bt-hepi和sumo-bt-hepi的最适温度及温度稳定性测定图;
图10为本发明中二价金属离子对bt-hepi和sumo-bt-hepi的酶活影响图。
具体实施方式
下面结合通过具体实施例对本发明作进一步详述,以下实施例只是描述性的,不是限定性的,不能以此限定本发明的保护范围。
本发明中所使用的原料,如无特殊说明,均为常规的市售产品;本发明中所使用的方法,如无特殊说明,均为本领域的常规方法。
本发明中使用到的菌株和载体可以为:菌株大肠杆菌dh5α,大肠杆菌rosetta(de3);pet-28a载体和pe-sumo载体;本发明中使用到的试剂盒可以为dna切胶回收试剂盒、质粒小提试剂盒、bradford蛋白浓度定量试剂盒;本发明中使用到的酶可以为fastpfudna聚合酶、dntps、t4连接酶、限制性内切酶bamhi、xhoi、nrui、bsrgi;pcr引物合成以及序列测序均可以由生物科技有限公司完成。
一种高表达高活性多形拟杆菌肝素酶i融合蛋白,所述融合蛋白的氨基酸序列如seqidno.1所示。
一种如上所述的高表达高活性多形拟杆菌肝素酶i融合蛋白的编码基因,所述编码基因的核苷酸序列如seqidno.2所示。
一种利用如上所述的编码基因的重组表达载体,所述重组表达载体中插入了高表达高活性多形拟杆菌肝素酶i融合蛋白的编码基因。
较优地,所述表达载体选自大肠杆菌表达载体、酵母表达载体、枯草表达载体、乳酸菌表达载体、链霉菌表达载体、噬菌体表达载体、丝状真菌表达载体、植物表达载体、昆虫表达载体或哺乳动物细胞表达载体。
如上所述的利用编码基因的重组表达载体在制备多形拟杆菌肝素酶i融合蛋白中的应用。
一种利用如上所述的编码基因的重组菌或转基因细胞系,在宿主细胞或细胞系中插入了高表达高活性多形拟杆菌肝素酶i融合蛋白的编码基因。
较优地,所述宿主细胞或细胞系选自大肠杆菌宿主细胞、酵母菌宿主细胞、枯草芽孢杆菌宿主细胞、乳酸菌宿主细胞、放线菌宿主细胞、丝状真菌宿主细胞、昆虫细胞或哺乳动物细胞。
较优地,所述大肠杆菌为:escherichiacolibl21、escherichiacolirosetta(de3)、escherichiacolijm109或escherichiacolidh5α;或者,所述酵母菌为:saccharomycescerevisiae、pichiapastoris或kluyveromycesiactis;或者,所述枯草芽孢杆菌为:bacillussubtilisr25或bacilluussubtilis9920;或者,所述乳酸菌为:lacticacidbacteriac0cc101;或者,所述放线菌为:streptomycespp;或者,所述丝状真菌宿主为:trichodermaviride、trichodermareesei、aspergillusniger或aspergillusnidulans;或者,所述昆虫细胞为:bombyxmori或antharaeaeucalypti或;或者,所述哺乳动物细胞为:中国仓鼠卵巢细胞cho,幼小仓鼠肾脏细胞bhk或中国仓鼠肺细胞chl。
如上所述的利用编码基因的重组菌或转基因细胞系在制备多形拟杆菌肝素酶i融合蛋白中的应用。
具体地,内容包括:
(1)通过分子生物学手段,将密码子优化后的多形拟杆菌肝素酶i的基因,插入到pe-sumo载体,构建表达载体pe-sumo-bt-hepi,获得比酶活提高48.9%的融合蛋白基因。
(2)融合蛋白的表达:将构建好的表达载体pe-sumo-bt-hepi转化至基因工程宿主菌或细胞。
(3)重组产物sumo-bt-hepi的表达、纯化以及脱盐后的sds-page分析。
(4)重组产物sumo-bt-hepi与野生型的比酶活比较。
更具体地,相关操作可以如下:
一、重组表达载体的构建
1、多形拟杆菌肝素酶i的基因扩增
根据ncbigenbank数据库中bacteroidesthetaiotaomicron编码heparinasei的dna序列(no.ae015928.1),进行大肠杆菌的密码子优化,合成构建puc57-bt-hepi质粒(可以由基因公司合成构建),设计引物(可以使用软件primerpremier5设计);
上游引物p1:5'-ccggatccatgttaaccgcccagacc-3',
下游引物p2:5'-cgactcgagttagcgctcactatagccggccag-3',下划线的碱基为酶切位点选用bamhi、xhoi作为上下游的酶切位点。
pcr扩增密码子优化后的多形拟杆菌肝素酶i(bt-hepi)的基因序列:
pcr扩增的反应体系为:50ng提取的puc57-bt-hepi为模板,上游引物和下游引物各10μm,1×扩增缓冲液(可以为北京康为生物有限公司的扩增缓冲液),1mmdntps,1单位高保真fastpfudnapolymerase;pcr反应程序:95℃预变性5min,95℃变形30s,55℃引物退火50s,72℃延伸1.5min,循环30次,72延伸10min结束反应。
2、重组大肠杆菌表达载体的构建
将载体pe-sumo和pcr产物(以puc57-bt-hepi为模板)分别用bamhi和xhoi双酶切,用t4dna连接酶(thremoscientific)连接,转化dh5α。pcr鉴定以及测序验证正确,得到重组表达载体命名为pe-sumo-bt-hepi(如图1所示)。提取含有pe-sumo-bt-hepi的大肠杆菌dh5α中的质粒,经过卡那霉素筛选以及使用nrui和bsrgi双酶切验证(如图2所示)。图2中m为分子量maker条带大小依次为(5kb、3kb、2kb、1.5kb、1kb、750bp、500bp、250bp、100bp),泳道1为重组质粒pe-sumo-bt-hepi未酶切的电泳图,泳道2为重组质粒pe-sumo-bt-hepi被nrui和bsrgi双酶切后电泳图,箭头所指处为酶切后的两个片段。片段大小与预期大小一致,将含有目的基因的重组载体pe-sumo-bt-hepi进行测序。
二、多形拟杆菌肝素酶i融合蛋白sumo-bt-hepi的表达
提取含有pe-sumo-bt-hepi的大肠杆菌dh5α中的质粒,按照常规方法转化至大肠杆菌rosetta(de3)。经过卡那霉素和氯霉素筛选和利用p1和p2引物进行菌落pcr鉴定,得到含有pe-sumo-bt-hepi的大肠杆菌rosetta(de3),即rosetta(de3)/pe-sumo-bt-hepi作为表达的工程菌株。
将质粒pe-sumo转化至大肠杆菌rosetta(de3),得到空载对照rosetta(de3)/pe-sumo。
1、将空载体对照和工程菌分别接种于含卡那霉素和氯霉素抗性的lb培养基(nacl10g/l,酵母提取物5g/l,蛋白胨10g/l,含50ug/l卡那霉素和34ug/l氯霉素),37℃,220r/min培养过夜。
2、将过夜培养菌液按1%接种量接入50ml发酵培养基中(250ml摇瓶),37℃,220r/min培养至od600约为0.6-0.8时,加入终浓度为0.4mm的iptg,在25℃,200r/min条件下诱导12h。
3、4℃、8000r/min离心10min收集菌体,用缓冲液(20mmol/ltris-hcl,200mmol/lnaclph7.4)洗涤两遍,再将其悬于40ml缓冲液中,超声破碎细胞。
4、12000r/min、4℃离心20min,收集上清,即得多形拟杆菌肝素酶i融合蛋白粗液,取部分上清液进行sds-page分析(如图3所示),图3中,m为标准蛋白分子量maker条带大小分别为(170kda、130kda、100kda、70kda、55kda、40kda、35kda、25kda、10kda),泳道1为空载质粒的表达产物;泳道2为重组表达质粒未诱导的表达产物;泳道3为重组表达质粒诱导后的表达产物。由图可知,目的蛋白经诱导后得到大量表达。
三、对多形拟杆菌肝素酶i融合蛋白sumo-bt-hepi进行纯化和脱盐
1、使用co-nta亲和层析进行纯化多形拟杆菌肝素酶i融合蛋白粗液,co柱使用10ml的平衡缓冲液(20mmol/ltris-hcl,300mmol/lnaclph7.4)平衡后上样,并使用10ml结合缓冲液(20mmol/ltris-hcl,300mmol/lnacl,5mmol/l咪唑)冲洗除掉非特异性结合蛋白,使用3ml洗脱缓冲液(20mmol/ltris-hcl,300mmol/lnacl,150mmol/l咪唑)洗脱重组目的蛋白,收集洗脱液即为纯化后的重组酶,即纯化后的多形拟杆菌肝素酶i融合蛋白。使用pd-10预装脱盐柱对纯化后的酶进行脱盐处理。使用25ml的平衡缓冲液(20mmol/ltris-hcl,200mmol/lnacl,ph7.4)平衡后上样2.5ml,3.5ml缓冲液洗脱,从上样开始收集2.5-6ml的洗脱液为脱盐后的酶液,即脱盐后的多形拟杆菌肝素酶i融合蛋白。
2、将表达、纯化和脱盐后的蛋白进行sds-page(如图4所示),图4中,m为标准蛋白分子量maker条带大小分别为(170kda、130kda、100kda、70kda、55kda、40kda、35kda、25kda、10kda),泳道1为重组表达产物的超声上清;泳道2为5mm咪唑洗脱的洗脱液;泳道3为150mm咪唑洗脱的洗脱液;泳道4为脱盐柱脱盐后目的蛋白缓冲液。由图可知,目的蛋白的纯化和脱盐效果很好,表达产物可以达到胶纯的程度。分析重组蛋白的表达水平、纯化和脱盐情况以及分子量,浓缩胶电压为80v,分离胶电压为120v。蛋白含量的测定使用bradford法,具体操作可以参照试剂盒说明书。
本发明的相关检测:
一、多形拟杆菌肝素酶i融合蛋白的酶活测定
1、酶活测定采用232nm的光吸收法,以肝素钠为底物测定肝素酶i的活性,一个酶活力单位(1iu)指在30℃,1min内产生1μmol的△4,5不饱和糖醛酸反应效力。反应体系为:1.5ml的ep管中加入100μl的底物缓冲液(50mmol/l醋酸钠,5mmol/l醋酸钙,5mmol/l肝素钠),金属浴中40℃恒温孵育10min,加入使用缓冲液(20mmol/ltris-hcl,200mmol/lnacl)稀释150倍的纯化脱盐后的酶液10μl,反应10min,立即加入0.06mol/l盐酸1ml终止反应。在12000r/min条件下离心5min,取上清液测定其在232nm的吸光值。
2、实验结果表明,与野生型多形拟杆菌肝素酶i(bt-hepi)相比,融合sumo蛋白的融合蛋白(sumo-bt-hepi)酶活性得到了显著的提高,结果如图5所示。
二、多形拟杆菌肝素酶i融合蛋白的酶学性质测定
1、bt-hepi和sumo-bt-hepi的最适ph及ph稳定性测定
对上述纯化脱盐后的bt-hepi和sumo-bt-hepi进行最适ph及ph稳定性研究。在37℃,不同ph4-13条件下测定重组肝素酶i的酶活,得出其最适ph;在4℃下把纯化脱盐后的酶在不同ph值(2-12)的缓冲液中保存2h,测定剩余酶活。在不同的ph条件下测定bt-hepi和sumo-bt-hepi的酶活,发现两者的最适ph都为9(图6)。融合sumo标签后并未改变其最适ph。将这两种重组酶分别在不同ph缓冲液中4℃保存2h,分别测定剩余酶活(图7-a:sumo-bt-hepi;图7-b:bt-hepi)。
从ph稳定性曲线可以看出,两种重组酶在中性附近较为稳定,在ph5-9的缓冲液中保存2h,两者的剩余酶活都在80%以上。在偏酸和偏碱时,sumo-bt-hepi的耐受性相对较好。sumo-bt-hepi的最佳保存ph为8,而bt-hepi的最佳保存ph为7,可能是因为融合sumo标签之后,目的蛋白带有更多的碱性氨基酸,使其成为弱碱性酶。在ph12时两者几乎均失去活性。
2、bt-hepi和sumo-bt-hepi的最适温度及温度稳定性测定
对上述纯化脱盐后的bt-hepi和sumo-bt-hepi进行最适温度及温度稳定性研究。在最适ph,不同温度的条件下,测定重组肝素酶i的酶活,得出其最适反应温度;最适ph条件下把纯化脱盐后的酶在不同温度(30、40、50、60℃)下孵育一定时间(1、2、10min),测定剩余酶活。在最适ph,不同温度下测定sumo-bt-hepi和bt-hepi的酶活,发现两者的最适温度均为45℃(图8)。将上述两种重组酶分别在最适ph不同温度条件孵育一定时间,测定剩余酶活(图9-a:sumo-bt-hepi;图9-b:bt-hepi)。
从温度稳定性曲线可以明显看出,sumo-bt-hepi和bt-hepi对较高温度(50、60℃)的耐受性都比较差,而对于较低温度(30、40℃)的耐受性相对较好。sumo-bt-hepi在50℃下保温2min剩余酶活约89.46%,bt-hepi在50℃下保温2min剩余酶活约75.75%,两者在60℃下保温10min酶活几乎完全损失;两者在温度低于40℃时,保存10min酶活几乎不发生改变。
3、二价金属离子对bt-hepi和sumo-bt-hepi的酶活影响
二价金属离子对重组肝素酶i酶活影响的分析过程:在上述标准酶活缓冲液中,分别加入5mmol/l的二价金属离子(mnso4,mgcl2,cacl2,cucl2,znso4,feso4),标准条件下(最适ph、温度,反应10min)进行酶活分析。把筛选出来的ca2+和mg2+,设置一系列不同浓度(0.5、1、5、10、15、50、100mmol/l)进行最适离子浓度的研究。将最优的ca2+和mg2+的浓度复配测定其酶活。将重组酶分别在最优的ca2+和mg2+的浓度下孵育饱和后,再添加不同浓度的另一个离子测定其酶活。进而深入地研究金属离子对重组酶活性的影响。研究了不同二价金属离子对sumo-bt-hepi和bt-hepi的酶活影响(图10-a)。结果发现,ca2+和mg2+对二者酶活均有促进作用,cu2+、mn2+、zn2+都表现出了明显的抑制作用,尤其是cu2+和zn2+几乎使酶失活;研究了ca2+和mg2+的最佳浓度(图10-b:sumo-bt-hepi、图10-c:bt-hepi)。结果表明,两个重组酶的最佳ca2+和mg2+浓度均为10mm和50mm。在最佳ca2+和mg2+浓度下,sumo-bt-hepi的酶活分别提高了71.11%和95.46%,bt-hepi的酶活分别提高了56.12%和81.84%;对ca2+和mg2+复合添加对酶活的影响进行了探索(图10-d)。由图可得,ca2+和mg2+的促进作用可以相互叠加;分别在ca2+和mg2+浓度饱和的情况下,另一个离子的影响(图10-e:10mmca2+饱和、图10-f:50mmmg2+饱和)。结果表明,ca2+和mg2+的促进作用是相互独立的,两者之间互不影响。
综上,本发明所获得sumo-bt-hepi融合蛋白具有显著高于野生型bt-hepi的产量以及酶活,所建立的基因工程表达体系可实现高效的可溶性表达。并且纯化以及脱盐后的sumo-bt-hepi可以达到胶纯的效果。
sequencelisting
天津科技大学
一种高表达高活性多形拟杆菌肝素酶i融合蛋白及其编码基因
1
(1)sumo-bt-hepi氨基酸序列:
mghhhhhhgslqdsevnqeakpevkpevkpethinlkvsdgsseiffkikkttplrrlmeafakrqgkemdslrflydgiriqadqapedldmedndiieahreqigg
mltaqtkntqtlmpltervnvqadsarinqiidgcwvavgtnkphaiqrdftnlfdgkpsyrfelktedntlegyakgetkgraefsycyatsddfrglpadvyqkaqitktvyhhgkgacpqgssrdyefsvyipssldsnvstifaqwhgmpdrtlvqtpqgevkkltvdefvelekttffkknvghekvarldkqgnpvkdkngkpvykagkpngwlveqggypplafgfsgglfyikansdrkwltdkddrcnanpgktpvmkpltseykastiayklpfadfpkdcwitfrvhidwtvygkeaetivkpgmldvrmdyqeqgkkvskhivdnekiligrndedgyyfkfgiyrvgdstvpvcynlagyser*
人工合成
2
(2)sumo-bt-hepi核苷酸序列:
atgggtcatcaccatcatcatcacgggtccctgcaggactcagaagtcaatcaagaagctaagccagaggtcaagccagaagtcaagcctgagactcacatcaatttaaaggtgtccgatggatcttcagagatcttcttcaagatcaaaaagaccactcctttaagaaggctgatggaagcgttcgctaaaagacagggtaaggaaatggactccttaagattcttgtacgacggtattagaattcaagctgatcaggcccctgaagatttggacatggaggataacgatattattgaggctcaccgcgaacagattggaggtggatccatgttaaccgcccagaccaaaaatacccagaccctgatgccgctgacagagcgtgttaacgttcaggcagatagcgcccgcatcaaccagattatcgacggctgctgggtggcagtgggcacaaacaaaccgcacgcaattcagcgcgactttaccaatctgttcgatggtaagccgagctatcgctttgagctgaagaccgaagacaacaccctggaaggctatgcaaagggtgagacaaagggccgcgccgaattcagctactgctacgcaaccagcgatgattttcgcggtctgccggccgacgtgtatcagaaagcccagattaccaaaaccgtgtaccaccacggcaaaggcgcatgtccgcagggtagcagccgcgattatgagttcagcgtgtacatcccgagcagcctggacagtaacgtgagtacaatcttcgcccagtggcacggcatgcctgaccgtaccttagttcagacaccgcagggcgaagtgaaaaagctgaccgttgatgagtttgttgagctggaaaaaaccaccttttttaaaaagaacgttggccatgagaaagttgcacgcctggataagcagggcaacccggttaaggacaagaatggcaagccggtgtataaagcaggcaagccgaatggctggctggtggaacagggtggttatccgccgctggccttcggctttagtggcggcctgttctacatcaaagccaacagcgatcgcaaatggctgaccgataaagacgaccgttgcaatgccaacccgggtaagacccctgtgatgaaaccgctgaccagtgagtacaaggccagcacaattgcctacaaactgccgttcgccgactttccgaaagattgctggatcaccttccgcgttcacattgactggaccgtgtatggcaaagaagctgaaaccattgttaaaccgggcatgctggacgtgcgcatggattaccaggaacagggtaaaaaagtgagtaaacacatcgtggacaacgaaaaaatcctgatcggccgcaacgacgaagacggctactactttaagttcggcatttatcgtgtgggcgatagcaccgttccggtgtgttacaatctggccggctatagtgagcgctaa。
尽管为说明目的公开了本发明的实施例,但是本领域的技术人员可以理解:在不脱离本发明及所附权利要求的精神和范围内,各种替换、变化和修改都是可能的,因此,本发明的范围不局限于实施例所公开的内容。
序列表
<110>天津科技大学
<120>一种高表达高活性多形拟杆菌肝素酶i融合蛋白及其编码基因和应用
<160>4
<170>siposequencelisting1.0
<210>1
<211>484
<212>prt
<213>融合蛋白的氨基酸序列(unknown)
<400>1
metglyhishishishishishisglyserleuglnaspsergluval
151015
asnglnglualalysprogluvallysprogluvallysprogluthr
202530
hisileasnleulysvalseraspglysersergluilephephelys
354045
ilelyslysthrthrproleuargargleumetglualaphealalys
505560
argglnglylysglumetaspserleuargpheleutyraspglyile
65707580
argileglnalaaspglnalaprogluaspleuaspmetgluaspasn
859095
aspileileglualahisarggluglnileglyglymetleuthrala
100105110
glnthrlysasnthrglnthrleumetproleuthrgluargvalasn
115120125
valglnalaaspseralaargileasnglnileileaspglycystrp
130135140
valalavalglythrasnlysprohisalaileglnargaspphethr
145150155160
asnleupheaspglylysprosertyrargphegluleulysthrglu
165170175
aspasnthrleugluglytyralalysglygluthrlysglyargala
180185190
gluphesertyrcystyralathrseraspasppheargglyleupro
195200205
alaaspvaltyrglnlysalaglnilethrlysthrvaltyrhishis
210215220
glylysglyalacysproglnglyserserargasptyrglupheser
225230235240
valtyrileproserserleuaspserasnvalserthrilepheala
245250255
glntrphisglymetproaspargthrleuvalglnthrproglngly
260265270
gluvallyslysleuthrvalaspgluphevalgluleuglulysthr
275280285
thrphephelyslysasnvalglyhisglulysvalalaargleuasp
290295300
lysglnglyasnprovallysasplysasnglylysprovaltyrlys
305310315320
alaglylysproasnglytrpleuvalgluglnglyglytyrpropro
325330335
leualapheglypheserglyglyleuphetyrilelysalaasnser
340345350
asparglystrpleuthrasplysaspaspargcysasnalaasnpro
355360365
glylysthrprovalmetlysproleuthrserglutyrlysalaser
370375380
thrilealatyrlysleuprophealaasppheprolysaspcystrp
385390395400
ilethrpheargvalhisileasptrpthrvaltyrglylysgluala
405410415
gluthrilevallysproglymetleuaspvalargmetasptyrgln
420425430
gluglnglylyslysvalserlyshisilevalaspasnglulysile
435440445
leuileglyargasnaspgluaspglytyrtyrphelyspheglyile
450455460
tyrargvalglyaspserthrvalprovalcystyrasnleualagly
465470475480
tyrsergluarg
<210>2
<211>1461
<212>dna/rna
<213>融合蛋白的编码基因(unknown)
<400>2
atgggtcatcaccatcatcatcacgggtccctgcaggactcagaagtcaatcaagaagct60
aagccagaggtcaagccagaagtcaagcctgagactcacatcaatttaaaggtgtccgat120
ggatcttcagagatcttcttcaagatcaaaaagaccactcctttaagaaggctgatggaa180
gcgttcgctaaaagacagggtaaggaaatggactccttaagattcttgtacgacggtatt240
agaattcaagctgatcaggcccctgaagatttggacatggaggataacgatattattgag300
gctcaccgcgaacagattggaggtggatccatgttaaccgcccagaccaaaaatacccag360
accctgatgccgctgacagagcgtgttaacgttcaggcagatagcgcccgcatcaaccag420
attatcgacggctgctgggtggcagtgggcacaaacaaaccgcacgcaattcagcgcgac480
tttaccaatctgttcgatggtaagccgagctatcgctttgagctgaagaccgaagacaac540
accctggaaggctatgcaaagggtgagacaaagggccgcgccgaattcagctactgctac600
gcaaccagcgatgattttcgcggtctgccggccgacgtgtatcagaaagcccagattacc660
aaaaccgtgtaccaccacggcaaaggcgcatgtccgcagggtagcagccgcgattatgag720
ttcagcgtgtacatcccgagcagcctggacagtaacgtgagtacaatcttcgcccagtgg780
cacggcatgcctgaccgtaccttagttcagacaccgcagggcgaagtgaaaaagctgacc840
gttgatgagtttgttgagctggaaaaaaccaccttttttaaaaagaacgttggccatgag900
aaagttgcacgcctggataagcagggcaacccggttaaggacaagaatggcaagccggtg960
tataaagcaggcaagccgaatggctggctggtggaacagggtggttatccgccgctggcc1020
ttcggctttagtggcggcctgttctacatcaaagccaacagcgatcgcaaatggctgacc1080
gataaagacgaccgttgcaatgccaacccgggtaagacccctgtgatgaaaccgctgacc1140
agtgagtacaaggccagcacaattgcctacaaactgccgttcgccgactttccgaaagat1200
tgctggatcaccttccgcgttcacattgactggaccgtgtatggcaaagaagctgaaacc1260
attgttaaaccgggcatgctggacgtgcgcatggattaccaggaacagggtaaaaaagtg1320
agtaaacacatcgtggacaacgaaaaaatcctgatcggccgcaacgacgaagacggctac1380
tactttaagttcggcatttatcgtgtgggcgatagcaccgttccggtgtgttacaatctg1440
gccggctatagtgagcgctaa1461
<210>3
<211>26
<212>dna/rna
<213>上游引物p1(unknown)
<400>3
ccggatccatgttaaccgcccagacc26
<210>4
<211>33
<212>dna/rna
<213>下游引物p2(unknown)
<400>4
cgactcgagttagcgctcactatagccggccag33
- 还没有人留言评论。精彩留言会获得点赞!