鹅星状病毒、鹅副黏病毒、鹅细小病毒多重PCR检测引物对及检测方法和应用与流程
本发明涉及病毒检测技术领域,特别涉及鹅星状病毒、鹅副黏病毒、鹅细小病毒多重pcr检测引物对,还涉及使用引物对的检测方法,引物对的应用。
背景技术:
星状病毒属于星状病毒科(astroviridae)星状病毒属(astrovirus),根据宿主不同分为两个属:哺乳动物星状病毒属(mamastrovirus)和禽类星状病毒属(avastrovirus)。禽星状病毒属现有3个属(avastrovirus1-3),包括鸭星状病毒(duckastrovirus)、鸟肾炎病毒(aviannephritisastrovirus)、火鸡星状病毒(turkeyastrovirus)等,火鸡星状病毒是其代表种。星状病毒是单股正链、无囊膜的小rna病毒,其基因组长度大约6.8kb,,从5′端至3′端共包含4部分:1个85个核苷酸的5′端非编码区、3个开放阅读框(openreadingframes,orfs)(orf1a、orf1b、orf2)、1个80个核苷酸的3′端非编码区、1个30个核苷酸的多聚腺苷酸尾巴。2017年以来,我国山东、江苏、河南、广东及安徽等地的雏鹅群中陆续出现以内脏出现尿酸盐沉积和关节痛风为主要症状的传染性疾病,该病主要发生于20日龄以内的雏鹅,死亡率高达30%~50%。给我国的养鹅业造成巨大的经济损失。经病原学鉴定,引起雏鹅出现痛风症状的病原为新型星状病毒。
鹅副黏病毒病的病原为鹅黏病毒(gooseparamyxovirus,gpmv),属副黏病毒科副黏病毒属。病毒广泛存在于病鹅的内脏器官内(脾脏、肝脏、肠管等)。在电子显微镜下观察,病毒颗粒大小不一(平均直径为120纳米),形态不正,表面有密集纤突结构,病毒内部由囊膜包裹着螺旋对称核衣壳。分离的毒株接种10日龄发育鸡胚后能迅速繁殖,鸡胚在接种后2~3天死亡。鹅黏病毒能凝集鸡的红细胞,人工感染鸡可引起死亡。根据流行特点、临床症状和病理变化,可以作出初步诊断。确诊则需要进行病原诊断。
鹅细小病毒(gooseparvovirus,gpv)是小鹅瘟的病原体。自1965年以来,许多国家曾报道了鹅细小病毒(gpv)病。小鹅瘟的临床特征主要以败血性病变表现为主,根据病程的长短分为最急性、急性和亚急性三种类型。该病具有传播速度快、发病率和死亡率较高的特点。目前,小鹅瘟病的流行爆发还很难控制,一旦发生流行小鹅瘟这种传染病,会给养鹅业造成巨大的经济损失。
上述病毒实验室诊断方法有血清学方法、分子生物学诊断方法。常用的血清学方法有琼脂扩散试验、病毒中和试验、免疫酶琼脂扩散试验、免疫荧光诊断法、间接酶联免疫吸附试验、反向间接血凝试验和保护试验。分子生物学方法有核酸探针技术、pcr技术等。由于上述三种病毒感染后发病快、死亡率高,因此,尽快确定是哪种病毒感染以及时采取应对措施,尤为重要,因此,研究一种可以同时检测上述三种病毒的方法迫在眉睫。多重pcr(multiplexpcr),又称多重引物pcr或复合pcr,它是在同一pcr反应体系里加上二对以上引物,同时扩增出多个核酸片段的pcr反应。但现有技术中,还未有使用多重pcr对鹅星状病毒、鹅副黏病毒、鹅细小病毒三种病毒进行检测的相关报道。
技术实现要素:
为了解决以上现有技术中无同时检测鹅星状病毒、鹅副黏病毒、鹅细小病毒三种病毒的方法的问题,本申请公开了鹅星状病毒、鹅副黏病毒、鹅细小病毒多重pcr检测引物对,能够同时检测三种病毒。
本发明还提供了使用上述引物对的检测方法。
本发明更提供了上述引物对在病毒检测中的应用。
本发明是通过以下步骤得到的:
一种鹅星状病毒、鹅副黏病毒、鹅细小病毒多重pcr检测引物对,
鹅星状病毒的检测引物对碱基序列如下:
goast-f:5’-gctgcacaagttggttggac-3’,
goast-r:5’-gagtaatctgagcgtcggca-3’;
鹅副黏病毒的检测引物对碱基序列如下:
gpmv-f:5’-catcctccgacttaaagagagca-3’,
gpmv-r:5’-tacaggttgagctctacaccaac-3’;
鹅细小病毒的检测引物对碱基序列如下:
gpv-f:5’-tgcacgattcaatgaccgga-3’,
gpv-r:5’-gtgcagaccaaatcctccga-3’。
所述的鹅星状病毒、鹅副黏病毒、鹅细小病毒多重pcr检测引物对在检测水禽鹅星状病毒、鹅副黏病毒和鹅细小病毒的单一感染或混合感染中的应用。
所述的应用,提取待检测样品组织中的病毒dna和rna,将所述rna反转录为cdna,利用所述多重pcr检测引物对的多重pcr反应体系对所述病毒dna和cdna进行扩增。
所述的应用,所述多重pcr反应体系总体积为25μl,其中:premixrtaq酶10μl;针对鹅副黏病毒的引物1μl,其中gpmv-f和gpmv-r各0.5μl,(引物浓度为10μmol/l);针对鹅星状病毒的引物3μl,其中goast-f和goast-r各1.5μl(引物浓度为10μmol/l);针对鹅细小病毒的引物2μl,其中gpv-f和gpv-r各1μl(引物浓度为10μmol/l);dna模板3μl;加灭菌水至总体积为25μl;所述premixrtaq酶中溶质的浓度为10μmol/l。
所述的应用,扩增反应条件为:反应总体积为25μl:向所述多重pcr反应体系中加入所述组织中的病毒dna和cdna各1μl,加灭菌水至总体积为20μl,扩增程序为95℃3min,95℃30s,53℃30s,72℃50s,35个循环;然后72℃5min,再降温到4℃结束反应。
所述的应用,通过观察扩增产物电泳图是否包含相应病毒对应的预期条带,来判断临床样品是否为三种病毒的单一感染或混合感染,其中鹅副黏病毒对应的预期条带为200bp,鹅星状病毒对应的预期条带为400bp,鹅细小病毒对应的预期条带为760bp。
所述的应用,所述提取方法具体为采集死亡水禽的内脏组织作为待检测临床样品,将内脏组织与生理盐水按照质量比1:3的比例进行研磨后离心,使用离心柱型病毒dna/rna提取试剂盒提取组织中的病毒dna和rna。
所述的应用,反转录反应条件为:用hiscriptcdna第一链合成试剂盒对所述rna进行反转录:采用40μl体系,于ep管中依次加入rna模板16μl、随机引物2μl、2×rtmix20μl、hiscriptenzymemix2μl,总体积共40μl,置于pcr仪中进行cdna合成,以25℃5min、50℃45min、85℃5min、4℃5min的程序进行一个循环。
本发明的有益效果:
本发明建立的多重pcr体系可准确检测水禽鹅星状病毒、鹅副黏病毒、鹅细小病毒的单一或混合感染,并对该多重pcr体系进行了优化,确定了最佳的引物比例、引物浓度和premixrtaq酶,使得3种病毒的dna扩增效果更好,检测精度更高,在病毒鉴别领域具有重要优势。
附图说明
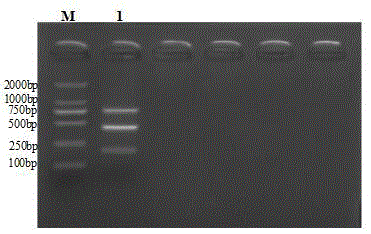
图1为多重pcr反应后检测的电泳图,其中:m为dna分子量标准,1:自上而下分别为鹅细小病毒、鹅星状病毒、鹅副黏病毒;
图2为多重pcr特异性试验的电泳图,其中:m为dna分子量标准,1:鹅星状病毒、鹅副黏病毒和鹅细小病毒混合物,2:鹅细小病毒,3:鹅星状病毒,4:鹅副黏病毒,5:h9亚型禽流感病毒,6:h5亚型禽流感病,7:阴性对照;
图3为多重pcr敏感性试验的电泳图,其中:m为dna分子量标准(dnamarker),鹅副黏病毒(gpmv)初始浓度为9.64×104拷贝/μl,鹅星状病毒(goast)初始浓度为6.78×104拷贝/μl,鹅细小病毒(gpv)初始浓度为8.26×104拷贝/μl;
1为9.64×104拷贝/μl鹅副黏病毒(gpmv),6.78×104拷贝/μl鹅星状病毒(goast),8.26×104拷贝/μl鹅细小病毒(gpv);
2为4.82×104拷贝/μl鹅副黏病毒(gpmv),3.39×104拷贝/μl鹅星状病毒(goast),4.13×104拷贝/μl鹅细小病毒(gpv);
3为2.41×104拷贝/μl鹅副黏病毒(gpmv),1.70×104拷贝/μl鹅星状病毒(goast),2.07×104拷贝/μl鹅细小病毒(gpv);
4为1.21×104拷贝/μl鹅副黏病毒(gpmv),8.50×103拷贝/μl鹅星状病毒(goast),1.04×104拷贝/μl鹅细小病毒(gpv);
5为6.05×103拷贝/μl鹅副黏病毒(gpmv),4.25×103拷贝/μl鹅星状病毒(goast),5.20×103拷贝/μl鹅细小病毒(gpv);
6为阴性对照(negativecontrol)。
具体实施方式
下面结合具体实施例对本发明进行进一步说明:
实施例1
1材料与方法
1.1病毒株鹅副黏病毒(gpmv)、鹅星状病毒(goast)、鹅细小病毒(gpv)、h9亚型禽流感病毒(h9aiv),由山东省农业科学院家禽研究所禽病研究室提供。h5亚型禽流感病毒(h5aiv)阳性质粒由华南农业大学动物医学院禽病研究室惠赠。
1.2主要试剂离心柱型病毒dna/rna提取试剂盒购自北京全式金生物技术有限公司;hiscriptcdna第一链合成试剂盒与premixrtaq酶购自南京诺唯赞生物科技有限公司;dl2000dnamarker购自英特生物有限公司。
1.3试验方法
1.3.1引物设计与合成设计3对能扩增3种鹅病原的特异性引物,置-20℃保存备用。3对引物序列如下所示:
鹅星状病毒的检测引物对碱基序列如下:
goast-f:5’-gctgcacaagttggttggac-3’,
goast-r:5’-gagtaatctgagcgtcggca-3’;
鹅副黏病毒的检测引物对碱基序列如下:
gpmv-f:5’-catcctccgacttaaagagagca-3’,
gpmv-r:5’-tacaggttgagctctacaccaac-3’;
鹅细小病毒的检测引物对碱基序列如下:
gpv-f:5’-tgcacgattcaatgaccgga-3’,
gpv-r:5’-gtgcagaccaaatcctccga-3’。
1.3.2病毒核酸提取和cdna合成
利用easypureviraldna/rnakit(离心柱型病毒dna/rna提取试剂盒)分别提取三种病毒dna/rna,用hiscriptcdna第一链合成试剂盒对三种病毒rna进行反转录:采用40μl体系,于ep管中依次加入rna模板16μl、随机引物2μl、2×rtmix20μl、hiscriptenzymemix2μl,总体积共40μl,置于pcr仪中进行cdna合成,以25℃5min、50℃45min、85℃5min、4℃5min的程序进行一个循环,cdna合成后-20℃保存备用。
1.3.3多重pcr反应条件的确定
多重pcr反应在25μl反应体系中进行。为了确定最佳的pcr反应条件,我们对各引物的添加量进行了多次调整,并最终确定了各引物的最佳浓度。其中反应条件为:premixrtaq酶(溶质的浓度为10μmol/l)10μl,其中针对鹅副黏病毒的引物1μl(gpmv-f和gpmv-r各0.5μl,引物浓度为10μmol/l),针对鹅星状病毒的引物3μl(goast-f和goast-r各1.5μl,引物浓度为10μmol/l),针对鹅细小病毒的引物2μl(gpv-f和gpv-r各1μl,引物浓度为10μmol/l),gpmvcdna、goastcdna、gpvdna各1μl,加灭菌水至总体积为25μl,扩增程序为95℃3min,95℃30s,53℃30s,72℃50s,35个循环;72℃5min,4℃结束反应。
1.3.4多重pcr特异性试验
采用最佳的pcr反应条件,以gpmvcdna、goastcdna、gpvdna、h9aivcdna、h5aivcdna作为待测样品进行检测,并以无菌水作为阴性对照,检测多重pcr特异性。
1.3.5多重pcr敏感性试验
在确定的最佳pcr反应条件下将提取的三种病毒的dna或cdna,用thermofisherqbuit3荧光光度计测定其浓度,并按2倍递增稀释,各取1μl进行pcr检测,以其最高稀释倍数扩增呈阳性为其pcr的敏感度。
1.3.6临床样品的检测
采用最佳的pcr反应条件对山东、河南、江苏地区鹅群收集150份临床样品进行检测,采集死亡鹅样品的肝脏、肾脏组织,与生理盐水按照1:3的比例进行研磨后离心,使用离心柱型病毒dna/rna提取试剂盒提取病毒的dna/rna,采用最佳的pcr反应条件进行反应,计算阳性率。
2结果
2.1最佳多重pcr反应条件的建立
最佳多重pcr反应条件为总体积25μl:premixrtaq酶(10μmol/l)10μl,gpmv-f和gpmv-r各0.5μl,goast-f和goast-r各1.5μl,gpv-f和gpv-r各1μl,gpmvcdna、goastcdna、gpvdna各1μl,加灭菌水至总体积为25μl。扩增程序为95℃3min,95℃30s,53℃30s,72℃50s,35个循环;72℃5min,4℃结束反应。结果显示,gpmv、goast、gpv的目的条带与预期相符,分别为200bp、400bp、760bp条带,如图1所示。
2.2特异性试验
对含有gpmv、goast、gpv核酸样品进行检测,均能扩增出与预期相符的200bp、400bp、760bp条带,混合模板扩增的产物条带清晰,亮度相近,在相同条件下,而其他鹅病病原体并未出现特异性条带,表明该方法具有良好的特异性,电泳测试结果如图2所示。
2.3敏感性试验
用thermofisherqubit3荧光光度计测得gpmv、goast、gpv的浓度分别为9.64×104拷贝/μl、6.78×104拷贝/μl、8.26×104拷贝/μl,应用优化后的多重pcr方法对2倍稀释的混合dna/cdna进行检测,结果表明,该多重pcr对gpmv、goast、gpv的检测极限分别为6.05×103拷贝/μl、4.25×103拷贝/μl和5.20×103拷贝/μl,如图3所示。
2.4临床样品检测
采用最佳的pcr反应条件对山东、河南、江苏地区鹅群收集150份临床样品进行临床检测,结果如下表1所示:检测出gpmv11份(阳性率为7.33%),goast12份(阳性率为8%),gpv8份(阳性率为5.33%),其中gpmv和gpv混合感染病例3例;利用常规单一pcr方法,对同一组临床样品进行检测,同样地,检测出gpmv11份(阳性率为7.33%),goast12份(阳性率为8%),gpv8份(阳性率为5.33%),其中gpmv和gpv混合感染病例3例。常规单一pcr与多重pcr检测对比,结果两者的符合率为100%。
表1
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受实施例的限制,其它任何未背离本发明的精神实质与原理下所做的改变、修饰、组合、替代、简化均应为等效替换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!