一种叶酸代谢基因多态性检测引物及试剂盒的制作方法
本发明属于基因突变检测技术领域,具体涉及一种叶酸代谢基因多态性检测引物及试剂盒。
背景技术:
叶酸是由喋啶、对氨基苯甲酸和谷氨酸3种成分结合而成,是人体利用糖分和氨基酸时的必要物质,是机体细胞生长和繁殖所必需的物质。作为体内生化反应中一碳单位转移酶系的辅酶,起着一碳单位传递体的作用。携带一碳单位的fl进入叶酸循环以后,随即参与分子内一碳单位的传递与转换。5-甲酰四氢叶酸及10-甲酰四氢叶酸被转化为5,10-甲川四氢叶酸,后者随即被还原为5,10-亚甲基四氢叶酸。亚甲基四氢叶酸还原酶将5,10-亚甲基四氢叶酸还原为5-甲基四氢叶酸,后者经甲硫氨酸合成酶催化转变为四氢叶酸,以接受下一个碳单位。
mthfr为亚甲基四氢叶酸还原酶蛋白编码基因,主要作用是在叶酸代谢通路中将5,10-亚甲基四氢叶酸转化为具有生物学功能的5-甲基四氢叶酸。5-甲基四氢叶酸可以进一步进入甲基传递通路,通过同型半胱氨酸的重新甲基化过程间接为dna甲基化和蛋白质甲基化提供甲基并且使血液中的同型半胱氨酸水平保持在一个较低的水平。因此亚甲基四氢叶酸还原酶(methylenetetrahydrofolatereductase,mthfr)在叶酸代谢、dna甲基化和dna合成等方面起重要作用。mthfr编码的基因呈多态性,其中第677位的c突变转换为t(c677t,rs1801133)是最常见的类型,c677t突变使mthfr第222位的丙氨酸被缬氨酸替代,导致酶与fad的亲和性、酶活力下降,热不稳定性增加,杂合体ct下降30%以上,纯合体tt下降70%左右。另一常见的mthfr突变为第1298位的a突变为c(a1298c,rs1801131),突变使mthfr第429位的丙氨酸被谷氨酸所代替,其频率分布徘徊在30%,该突变使mthfr酶活力下降30%左右。
mtrr为甲硫氨酸合成酶还原酶的编码基因,甲硫氨酸合成酶还原酶能够通过还原型甲基化作用将丧失酶活性甲硫氨酸合成酶(mtr)重新生成具有功能活性mtr,mtr能催化甲硫氨酸的生成,而甲硫氨酸是蛋白质合成和一碳代谢的必需氨基酸。rs1801394是位于5p15.3-p15.2之间的mtrr基因第2个外显子处的一个a/g多态,引起mtrr基因编码的蛋白第22个氨基酸由异亮氨酸变为蛋氨酸。该基因位点突变会造成酶的活性变化,造成体内叶酸缺乏或同型半胱氨酸水平升高。
由此可见,通过检测叶酸代谢关键酶mthfr和mtrr基因多态性,对mthfr和mtrr基因的三个多态性位点进行基因分型,可从分子水平评估个体对叶酸的利用能力,根据相关酶的活性程度实现个性化补充叶酸,并指导个体性用药,并可预测心脑血管疾病发生风险。
技术实现要素:
基于此,本发明的目的在于克服上述现有技术的不足之处而提供一种叶酸代谢基因多态性检测引物,其在用于叶酸代谢基因多态性检测时具有可在单管pcr体系中同时完成mthfr基因(rs1801133,c677t)多态性位点、mthfr基因(rs1801131,a1298c)多态性位点和mtrr基因(rs1801394,a66g)多态性位点三个位点的基因分型,具有操作简单方便,特异性强,灵敏度高,准确性高等优点。
为实现上述目的,本发明采用的技术方案为:一种叶酸代谢基因多态性检测引物,包括以下引物:
(1)针对mthfr基因(rs1801133,c677t)多态性位点的检测引物:如seqidno.1所示的上游引物、seqidno.2所示的下游引物和seqidno.3所示的探针;
(2)针对mthfr基因(rs1801131,a1298c)多态性位点的检测引物:如seqidno.4所示的上游引物、seqidno.5所示的下游引物和seqidno.6所示的探针;
(3)针对mtrr基因(rs1801394,a66g)多态性位点的检测引物:如seqidno.7所示的上游引物、seqidno.8所示的下游引物和seqidno.9所示的探针;
所述seqidno.3所示的探针、seqidno.6所示的探针和seqidno.9所示的探针的5’端连接有荧光报告基团,3’端连接有荧光猝灭基团,其中,带下划线的碱基为突变位点。
seqidno.1:5’-agtccctgtggtctcttc-3’;
seqidno.2:5’-atgtgtcagcctcaaagaa-3’;
seqidno.3:5’-aggtgtctgcgggagccgatttcatca-3’;
seqidno.4:5’-tgaaggactactacctctt-3’;
seqidno.5:5’-ccagcatcactcactttg-3’;
seqidno.6:5’-agctgaccagtgaagcaagtgtctttgaagtc-3’;
seqidno.7:5’-ttcactgttacatgccttga-3’;
seqidno.8:5’-ctatgtggtggtattagtgt-3’;
seqidno.9:5’-gcagaagaaatgtgtgagcaagc-3’;
优选地,所述seqidno.3所示的探针5’端连接的荧光报告基团为rox,3’端连接的荧光猝灭基团为bhq2;
所述seqidno.6所示的探针5’端连接的荧光报告基团为hex,3’端连接的荧光猝灭基团为bhq1;
所述seqidno.9所示的探针5’端连接的荧光报告基团为fam,3’端连接的荧光猝灭基团为bhq1。
优选地,所述检测引物的工作终浓度为:seqidno.1所示的上游引物0.0125-0.1umol/l、seqidno.2所示的下游引物0.25-2.0umol/l、seqidno.3所示的探针0.025-0.3umol/l;
seqidno.4所示的上游引物0.025-0.15umol/l、seqidno.5所示的下游引物0.25-1.5umol/l、seqidno.6所示的探针0.05-0.3umol/l;
seqidno.7所示的上游引物0.0125-0.1umol/l、seqidno.8所示的下游引物0.25-2.0umol/l、seqidno.9所示的探针0.025-0.3umol/l。
本发明还提供了所述的检测引物在制备叶酸代谢基因多态性检测试剂中的用途。
本发明所述的检测引物可在单管pcr体系中同时完成mthfr基因(rs1801133,c677t)多态性位点、mthfr基因(rs1801131,a1298c)多态性位点和mtrr基因(rs1801394,a66g)多态性位点三个位点的基因分型,可从分子水平评估个体对叶酸的利用能力,根据相关酶的活性程度实现个性化补充叶酸,并指导个体性用药,并可预测心脑血管疾病发生风险。
本发明还提供了一种叶酸代谢基因多态性检测试剂盒,包含所述的检测引物。
优选地,所述的检测试剂盒还可以包含以下组分:pcr缓冲液、mg2+、dntps和dna聚合酶;所述pcr缓冲液包含tris-hcl和kcl。
优选地,所述pcr缓冲液的ph值为8.0-9.0。
优选地,所述mg2+为mgcl2。
所述dntps包含datp、dgtp、dttp和dctp,且所述datp、dgtp、dttp和dctp的浓度相同。
优选地,所述的检测试剂盒各组分反应时的终浓度为:tris-hcl2-20mmol/l、kcl10-100nmol/l、mg2+1.875-5.0mmol/l、dntps0.1875-0.5mmol/l、seqidno.1所示的上游引物0.0125-0.1umol/l、seqidno.2所示的下游引物0.25-2.0umol/l、seqidno.3所示的探针0.025-0.3umol/l、seqidno.4所示的上游引物0.025-0.15umol/l、seqidno.5所示的下游引物0.25-1.5umol/l、seqidno.6所示的探针0.05-0.3umol/l、seqidno.7所示的上游引物0.0125-0.1umol/l、seqidno.8所示的下游引物0.25-2.0umol/l、seqidno.9所示的探针0.025-0.3umol/l和dna聚合酶0.025-0.125u/ul。
优选地,所述的检测试剂盒各组分反应时的终浓度为:tris-hcl10mmol/l、kcl50nmol/l、mg2+3.75mmol/l、dntps0.25mmol/l、seqidno.1所示的上游引物0.0125umol/l、seqidno.2所示的下游引物0.25umol/l、seqidno.3所示的探针0.05umol/l、seqidno.4所示的上游引物0.05umol/l、seqidno.5所示的下游引物0.5umol/l、seqidno.6所示的探针0.15umol/l、seqidno.7所示的上游引物0.0375umol/l、seqidno.8所示的下游引物0.75umol/l、seqidno.9所示的探针0.05umol/l和dna聚合酶0.05u/ul。
优选地,所述试剂盒的检测程序为:95℃3min;10个循环:95℃15s、60℃30s、72℃30s;40个循环:95℃15s、55℃30s(收集荧光)、72℃30s;1个循环:95℃3min、45℃2min;1个循环:45℃1min、80℃15s(收集荧光,升温速率0.06℃/s)。
优选地,所述试剂盒在用于检测时的结果判断标准为:
(1)mthfr基因(rs1801133,c677t)多态性位点野生型:ct值小于32;tm值:68.08±0.99℃,单峰;
(2)mthfr基因(rs1801133,c677t)多态性位点杂合突变型:ct值小于32;tm值:(68.08±0.99℃)/(61.77±0.99℃),双峰;
(3)mthfr基因(rs1801133,c677t)多态性位点纯合突变型:ct值小于32;tm值:61.77±0.99℃,单峰;
(4)mthfr基因(rs1801131,a1298c)多态性位点野生型:ct值小于32;tm值:65.81±0.99℃,单峰;
(5)mthfr基因(rs1801131,a1298c)多态性位点杂合突变型:ct值小于32;tm值:(65.81±0.99℃)/(72.99±0.99℃),双峰;
(6)mthfr基因(rs1801131,a1298c)多态性位点纯合突变型:ct值小于32;tm值:72.99±0.99℃,单峰;
(7)mtrr基因(rs1801394,a66g)多态性位点野生型:ct值小于32;tm值:54.47±0.99℃,单峰;
(8)mtrr基因(rs1801394,a66g)多态性位点杂合突变型:ct值小于32;tm值:(54.47±0.99℃)/(61.03±0.99℃),双峰;
(9)mtrr基因(rs1801394,a66g)多态性位点纯合突变型:ct值小于32;tm值:61.03±0.99℃,单峰。
相对于现有技术,本发明的有益效果为:本发明采用“多重不对称pcr技术”进行扩增,再通过熔解曲线分析,根据熔解曲线特定的tm值进行基因分型,可在单管pcr体系中同时完成mthfr基因(rs1801133,c677t)多态性位点、mthfr基因(rs1801131,a1298c)多态性位点和mtrr基因(rs1801394,a66g)多态性位点三个位点的基因分型,操作简单方便,特异性强,灵敏度高,准确性高,闭管操作,有效防止产物污染,结果易于判读。可从分子水平评估个体对叶酸的利用能力,根据相关酶的活性程度实现个性化补充叶酸,并指导个体性用药,并可预测心脑血管疾病发生风险。
附图说明
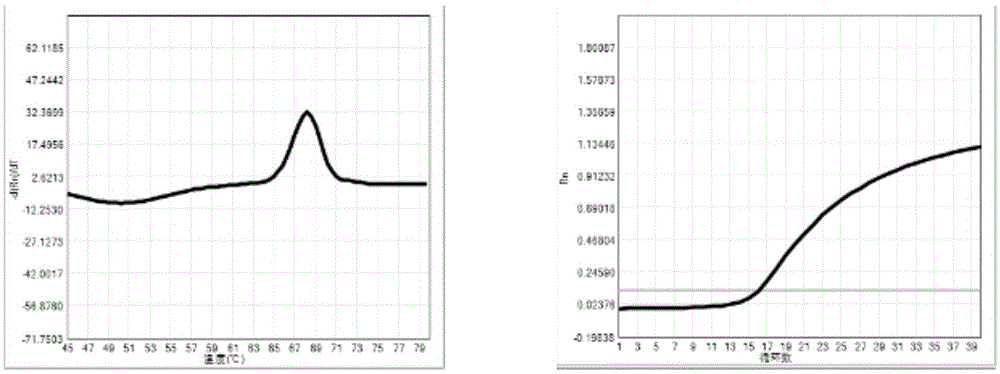
图1为本发明试剂盒对mthfr基因(rs1801133,c677t)多态性位点野生型样本的检测结果图;
图2为本发明试剂盒对mthfr基因(rs1801133,c677t)多态性位点杂合突变型样本的检测结果图;
图3为本发明试剂盒对mthfr基因(rs1801133,c677t)多态性位点纯合突变型样本的检测结果图;
图4为本发明试剂盒mthfr基因(rs1801131,a1298c)多态性位点野生型样本的检测结果图;
图5为本发明试剂盒mthfr基因(rs1801131,a1298c)多态性位点杂合突变型样本的检测结果图;
图6为本发明试剂盒对mthfr基因(rs1801131,a1298c)多态性位点纯合突变型样本的检测结果图;
图7为本发明试剂盒mtrr基因(rs1801394,a66g)多态性位点野生型样本的检测结果图;
图8为本发明试剂盒mtrr基因(rs1801394,a66g)多态性位点杂合突变型样本的检测结果图;
图9为本发明试剂盒对mtrr基因(rs1801394,a66g)多态性位点纯合突变型样本的检测结果图。
具体实施方式
为了便于理解本发明,下面将对本发明进行更全面的描述。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
实施例1
本发明叶酸代谢基因多态性检测试剂盒的一种实施例,包括以下引物:
(1)针对mthfr基因(rs1801133,c677t)多态性位点的检测引物:如seqidno.1所示的上游引物、seqidno.2所示的下游引物和seqidno.3所示的探针;
(2)针对mthfr基因(rs1801131,a1298c)多态性位点的检测引物:如seqidno.4所示的上游引物、seqidno.5所示的下游引物和seqidno.6所示的探针;
(3)针对mtrr基因(rs1801394,a66g)多态性位点的检测引物:如seqidno.7所示的上游引物、seqidno.8所示的下游引物和seqidno.9所示的探针;
所述seqidno.3所示的探针5’端连接的荧光报告基团为rox,3’端连接的荧光猝灭基团为bhq2;
所述seqidno.6所示的探针5’端连接的荧光报告基团为hex,3’端连接的荧光猝灭基团为bhq1;
所述seqidno.9所示的探针5’端连接的荧光报告基团为fam,3’端连接的荧光猝灭基团为bhq1。
seqidno.1:5’-agtccctgtggtctcttc-3’;
seqidno.2:5’-atgtgtcagcctcaaagaa-3’;
seqidno.3:5’rox-aggtgtctgcgggagccgatttcatca-bhq23’;
seqidno.4:5’-tgaaggactactacctctt-3’;
seqidno.5:5’-ccagcatcactcactttg-3’;
seqidno.6:5’hex-agctgaccagtgaagcaagtgtctttgaagtc-bhq13’;
seqidno.7:5’-ttcactgttacatgccttga-3’;
seqidno.8:5’-ctatgtggtggtattagtgt-3’;
seqidno.9:5’fam-gcagaagaaatgtgtgagcaagc-bhq13’。
所述引物由生物公司合成,按说明书进行配置。
实施例2
本实施例利用实施例1所述试剂盒对叶酸代谢基因多态性进行检测。
1、反应体系配置
按表1所示的组分和组分终浓度配置反应体系:
表1反应体系
所述dna模板为从患者外周血细胞中提取的dna。
2、反应程序
pcr反应程序如表2所示:
表2反应程序
3、结果判断标准
本发明试剂盒可在单管pcr体系中同时完成mthfr基因(rs1801133,c677t)多态性位点、mthfr基因(rs1801131,a1298c)多态性位点和mtrr基因(rs1801394,a66g)多态性位点三个位点的基因分型检测,检测结果判断标准如下:
(1)mthfr基因(rs1801133,c677t)多态性位点野生型:ct值小于32;tm值:68.08±0.99℃,单峰;
(2)mthfr基因(rs1801133,c677t)多态性位点杂合突变型:ct值小于32;tm值:(68.08±0.99℃)/(61.77±0.99℃),双峰;
(3)mthfr基因(rs1801133,c677t)多态性位点纯合突变型:ct值小于32;tm值:61.77±0.99℃,单峰;
(4)mthfr基因(rs1801131,a1298c)多态性位点野生型:ct值小于32;tm值:65.81±0.99℃,单峰;
(5)mthfr基因(rs1801131,a1298c)多态性位点杂合突变型:ct值小于32;tm值:(65.81±0.99℃)/(72.99±0.99℃),双峰;
(6)mthfr基因(rs1801131,a1298c)多态性位点纯合突变型:ct值小于32;tm值:72.99±0.99℃,单峰;
(7)mtrr基因(rs1801394,a66g)多态性位点野生型:ct值小于32;tm值:54.47±0.99℃,单峰;
(8)mtrr基因(rs1801394,a66g)多态性位点杂合突变型:ct值小于32;tm值:(54.47±0.99℃)/(61.03±0.99℃),双峰;
(9)mtrr基因(rs1801394,a66g)多态性位点纯合突变型:ct值小于32;tm值:61.03±0.99℃,单峰。
4、检测结果
本实施例对样本的检测结果如下:
mthfr基因(rs1801133,c677t)多态性位点野生型检测结果如图1所示:扩增曲线平滑、呈“s”型,ct值为16.08;tm值:68.14℃,单峰;判断为mthfr基因(rs1801133,c677t)多态性位点野生型(cc),检测结果与一代测序结果符合;
mthfr基因(rs1801133,c677t)多态性位点杂合突变型检测结果如图2所示:扩增曲线平滑、呈“s”型,ct值为16.09;tm值:68.08℃/61.76℃,双峰;判断为mthfr(c677t)rs1801133多态性位点杂合突变型(ct),检测结果与一代测序结果符合;
mthfr基因(rs1801133,c677t)多态性位点纯合突变型检测结果如图3所示:扩增曲线平滑、呈“s”型,ct值为16.67;tm值:61.81℃,单峰;判断为mthfr(c677t)rs1801133多态性位点纯合突变型(tt),检测结果与一代测序结果符合;
mthfr基因(rs1801131,a1298c)多态性位点野生型检测结果如图4所示:扩增曲线平滑、呈“s”型,ct值为14.80;tm值:65.85℃,单峰;判断为mthfr基因(rs1801131,a1298c)多态性位点野生型(aa),检测结果与一代测序结果符合;
mthfr基因(rs1801131,a1298c)多态性位点杂合突变型检测结果如图5所示:扩增曲线平滑、呈“s”型,ct值为14.57;tm值:65.65℃/72.98℃,双峰;判断为mthfr基因(rs1801131,a1298c)多态性位点杂合突变型(ac),检测结果与一代测序结果符合;
mthfr基因(rs1801131,a1298c)多态性位点纯合突变型检测结果如图6所示:扩增曲线平滑、呈“s”型,ct值为14.79;tm值:72.82℃,单峰;判断为mthfr基因(rs1801131,a1298c)多态性位点纯合突变型(cc),检测结果与一代测序结果符合;
mtrr基因(rs1801394,a66g)多态性位点野生型检测结果如图7所示:扩增曲线平滑、呈“s”型,ct值为16.73;tm值:54.45℃,单峰;mtrr基因(rs1801394,a66g)多态性位点野生型(aa),检测结果与一代测序结果符合;
mtrr基因(rs1801394,a66g)多态性位点杂合突变型检测结果如图8所示:扩增曲线平滑、呈“s”型,ct值为15.85;tm值:54.22℃/61.13℃,双峰;判断为mtrr基因(rs1801394,a66g)多态性位点杂合突变型(ag),检测结果与一代测序结果符合;
mtrr基因(rs1801394,a66g)多态性位点纯合突变型检测结果如图9所示:扩增曲线平滑、呈“s”型,ct值为15.31;tm值:60.81℃,单峰;判断为mtrr基因(rs1801394,a66g)多态性位点纯合突变型(gg),检测结果与一代测序结果符合。
实施例3
本实施例对10例临床样本的叶酸代谢基因多态性进行检测。取待测者外周血样本,提取dna后利用实施例1所述试剂盒,按照实施例2所述检测方法进行检测,同时对样本进行一代测序。检测结果如表3所示:
表3检测结果
上述结果表明,本发明试剂盒在用于叶酸代谢基因多态性检测时具有很好的准确性,检测结果与测序结果完全一致。
实施例4
本实施例研究反应体系中mg2+终浓度对检测结果的影响。
pcr反应体系其他组分的终浓度同表4,反应程序同表5,进行不同mg2+终浓度的检测。分别配置以下mg2+终浓度的反应体系:1.875mmol/l、2.5mmol/l、3.125mmol/l、3.75mmol/l、4.375mmol/l和5.0mmol/l。结果表明,当mg2+在反应体系中的终浓度在1.875~5.0mmol/l时均能实现检测,其中,当mg2+在反应体系中的终浓度为3.75mmol/l时,检测结果最佳。
表4mg2+终浓度优化反应体系
表5反应体系优化过程的反应程序
实施例5
本实施例研究反应体系中dntps终浓度对检测结果的影响。
pcr反应体系其他组分的终浓度同表6,反应程序同表5,进行不同dntps终浓度的检测。分别配置以下dntps终浓度的反应体系:0.1875mmol/l、0.25mmol/l、0.3125mmol/l、0.375mmol/l、0.4375mmol/l和0.5mmol/l。结果表明,当dntps在反应体系中的终浓度在0.1875~0.5mmol/l时均能实现检测,其中,当dntps在反应体系中的终浓度为0.25mmol/l时,检测结果最佳。
表6dntps终浓度优化反应体系
实施例6
本实施例以mthfr基因(rs1801133,c677t)多态性位点为例,研究反应体系中上、下游引物比例对检测结果的影响。
pcr反应体系其他组分的终浓度同表7,反应程序同表5,进行不同上、下游引物终浓度比例的检测。分别配置以下mthfr基因(rs1801133,c677t)多态性位点的上、下游引物终浓度比例的反应体系(上游引物:下游引物):(0.167:0.5)umol/l、(0.125:0.5)umol/l、(0.1:0.5)umol/l、(0.05:0.5)umol/l、(0.025:0.5)umol/l和(0.0125:0.5)umol/l。结果表明,当mthfr基因(rs1801133,c677t)多态性位点的上、下游引物在反应体系中的终浓度在(0.167:0.5)-(0.0125:0.5)umol/l时均能实现检测,其中,当mthfr基因(rs1801133,c677t)多态性位点的上、下游引物在反应体系中的终浓度比例为(0.025:0.5)umol/l时,检测结果最佳。
mthfr基因(rs1801131,a1298c)多态性位点和mtrr基因(rs1801394,a66g)多态性位点的上、下游引物在反应体系中的终浓度比例对检测结果的影响实验结果与本实施例相似,具体数据省略。
表7上、下游引物比例优化反应体系
实施例7
本实施例以mthfr基因(rs1801133,c677t)多态性位点为例,研究反应体系中上、下游引物终浓度对检测结果的影响。
pcr反应体系其他组分的终浓度同表8,反应程序同表5,进行不同上、下游引物终浓度的检测。分别配置以下mthfr基因(rs1801133,c677t)多态性位点的上、下游引物终浓度的反应体系(上游引物:下游引物):(0.0125:0.25)umol/l、(0.025:0.5)umol/l、(0.0375:0.75)umol/l、(0.05:1.0)umol/l、(0.0625:1.25)umol/l、(0.075:1.5)umol/l和(0.1:2.0)umol/l。结果表明,当mthfr基因(rs1801133,c677t)多态性位点的上、下游引物在反应体系中的终浓度在(0.0125:0.25)-(0.1:2.0)umol/l时均能实现检测,其中,当mthfr基因(rs1801133,c677t)多态性位点的上、下游引物在反应体系中的终浓度为(0.025:0.5)umol/l时,检测结果最佳。
mthfr基因(rs1801131,a1298c)多态性位点和mtrr基因(rs1801394,a66g)多态性位点的上、下游引物在反应体系中的终浓度对检测结果的影响实验结果与本实施例相似,具体数据省略。
表8上、下游引物中浓度优化反应体系
实施例8
本实施例以mthfr基因(rs1801133,c677t)多态性位点的探针在反应体系中的终浓度为例,研究反应体系中探针终浓度对检测结果的影响。
pcr反应体系其他组分的终浓度同表9,反应程序同表5,进行不同探针终浓度的检测。分别配置以下mthfr基因(rs1801133,c677t)多态性位点的探针终浓度的反应体系:0.025umol/l、0.05umol/l、0.1umol/l、0.15umol/l、0.2umol/l、0.25umol/l和0.3umol/l。结果表明,当mthfr基因(rs1801133,c677t)多态性位点的探针在反应体系中的终浓度在0.025-0.3umol/l时均能实现检测,其中,当mthfr基因(rs1801133,c677t)多态性位点的探针在反应体系中的终浓度为0.05umol/l时,检测结果最佳。
mthfr基因(rs1801131,a1298c)多态性位点和mtrr基因(rs1801394,a66g)多态性位点的探针在反应体系中的终浓度对检测结果的影响实验结果与本实施例相似,具体数据省略。
表9探针终浓度优化反应体系
实施例9
本实施例以mthfr基因(rs1801133,c677t)多态性位点上、下游引物与探针在反应体系中的终浓度比值为例,研究反应体系中上、下游引物与探针终浓度比值对检测结果的影响。
pcr反应体系其他组分的终浓度同表10,反应程序同表5,进行不同上、下游引物与探针终浓度比值的检测。分别配置以下mthfr基因(rs1801133,c677t)多态性位点上、下游引物与探针终浓度比值的反应体系(上游引物:下游引物:探针):(0.0125:0.25:0.05)umol/l、(0.0125:0.25:0.1)umol/l、(0.025:0.5:0.05)umol/l、(0.025:0.5:0.1)umol/l、(0.0375:0.75:0.05)umol/l和(0.0375:0.75:0.1)umol/l。结果表明,当反应体系中mthfr基因(rs1801133,c677t)多态性位点上、下游引物与探针终浓度比值为(0.0375:0.75:0.05)时,检测结果最佳。
mthfr基因(rs1801131,a1298c)多态性位点和mtrr基因(rs1801394,a66g)多态性位点的上、下游引物与探针终浓度在反应体系中的终浓度比值对检测结果的影响实验结果与本实施例相似,具体数据省略。
表10上、下游引物与探针终浓度优化反应体系
表11多重pcr反应体系上、下游引物与探针终浓度优化反应体系
实施例10
本实施例研究多重pcr反应体系(3个多态性位点)中上、下游引物与探针终浓度对检测结果的影响。
pcr反应体系其他组分的终浓度同表11,反应程序同表5,进行多重pcr反应体系(3个多态性位点)中上、下游引物与探针终浓度的检测。结果表明,当反应体系中mthfr基因(rs1801133,c677t)多态性位点的上、下游引物与探针终浓度比值(上游引物:下游引物:探针)为(0.0125:0.25:0.05)umol/l,mthfr基因(rs1801131,a1298c)多态性位点的上、下游引物与探针终浓度比值(上游引物:下游引物:探针)为(0.05:0.5:0.15)umol/l,mtrr基因(rs1801394,a66g)多态性位点的上、下游引物与探针终浓度比值(上游引物:下游引物:探针)为(0.0375:0.75:0.05)umol/l时,检测结果最佳。
实施例11
本实施例研究反应体系中dna聚合酶终浓度对检测结果的影响。
pcr反应体系其他组分的终浓度同表12,反应程序同表5,进行不同dna聚合酶终浓度的检测。分别配置以下dna聚合酶终浓度的反应体系:0.025u/ul、0.05u/ul、0.075u/ul、0.1u/ul和0.125u/ul。结果表明,当dna聚合酶在反应体系中的终浓度在0.025-0.125u/ul时均能实现检测,其中,当dna聚合酶在反应体系中的终浓度为0.05u/ul时,检测结果最佳。
表12dna聚合酶终浓度优化反应体系
实施例12
本实施例研究反应程序中步骤2退火温度对检测结果的影响。
pcr反应程序其他步骤同表5,反应体系同表1,进行反应程序中不同步骤2退火温度的检测。分别设置以下步骤2退火温度的反应程序:64℃、62℃、60℃和58℃。结果表明,当步骤2退火温度在58~64℃时均能实现检测,其中,当步骤2退火温度为60℃时,检测结果最佳。
实施例13
本实施例研究反应程序中步骤3退火温度对检测结果的影响。
pcr反应程序其他步骤同表13,反应体系同表1,进行反应程序中不同步骤3退火温度的检测。分别设置以下步骤3退火温度的反应程序:53℃、54℃、55℃、56℃和57℃。结果表明,当步骤3退火温度在53~57℃时均能实现检测,其中,当步骤3退火温度为55℃时,检测结果最佳。
表13pcr反应程序中步骤3退火温度优化
实施例14
本实施例研究反应程序中步骤4退火温度对检测结果的影响。
其他反应程序同表14,反应体系同表1,进行反应程序中不同步骤4退火温度的检测。分别设置以下步骤4退火温度的反应程序:45℃、46℃、47℃和48℃。结果表明,当步骤4退火温度在45~48℃时均能实现检测,其中,当步骤4退火温度为45℃时,检测结果最佳。
表14pcr反应程序中步骤4退火温度优化
因此,综合分析实施例4至实施例14的结果,pcr反应体系各个组分的最优终浓度如表1,pcr反应最优程序如表2。
另外,本发明是通过溶解曲线的tm值判断基因型,因而tm值是否稳定对本试剂盒的性能是最为关键的要素。通过以上优化实验发现,在10*pcrbuffer(缓冲液)成分固定的条件下,反应体系中对溶解曲线tm值影响最大的三个试剂成分分别是:镁离子、dntps和dna聚合酶。因此,试剂配制前应特别关注镁离子、dntps和dna聚合酶。再者,除非是操作失误、pcr成分有问题或检测仪器有故障等问题而导致的体系扩增失败,否则本发明的扩增曲线均可以扩增出s型曲线,即本发明的扩增曲线可以作为“内参照”而不再需要多增加一个管家基因作为扩增体系的“内参照”。
最后应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
sequencelisting
<110>江门市妇幼保健
<120>一种叶酸代谢基因多态性检测引物及试剂盒
<130>2018.9.27
<160>9
<170>patentinversion3.3
<210>1
<211>18
<212>dna
<213>人工合成
<400>1
agtccctgtggtctcttc18
<210>2
<211>19
<212>dna
<213>人工合成
<400>2
atgtgtcagcctcaaagaa19
<210>3
<211>35
<212>dna
<213>人工合成
<400>3
aggtgtctgcgggagccgatttcatca27
<210>4
<211>19
<212>dna
<213>人工合成
<400>4
tgaaggactactacctctt19
<210>5
<211>18
<212>dna
<213>人工合成
<400>5
ccagcatcactcactttg18
<210>6
<211>37
<212>dna
<213>人工合成
<400>6
agctgaccagtgaagcaagtgtctttgaagtc32
<210>7
<211>20
<212>dna
<213>人工合成
<400>7
ttcactgttacatgccttga20
<210>8
<211>20
<212>dna
<213>人工合成
<400>8
ctatgtggtggtattagtgt20
<210>9
<211>36
<212>dna
<213>人工合成
<400>9
gcagaagaaatgtgtgagcaagc23
- 还没有人留言评论。精彩留言会获得点赞!