一类偕二氟烷基硼酸酯类化合物及其制备方法和应用与流程
本发明属于有机化学及药物化学领域,更具体地,涉及一类偕二氟烷基硼酸酯类化合物及其制备方法和应用。
背景技术:
有机氟化物在医药,农药及工业材料上有着广泛的应用。而偕二氟基团因其具有特殊的空间结构及电性使其在药物化学上具有重要的应用价值,比如偕二氟基团可作为醇、硫醇及其他极性官能团的生物电子等排体,具有调节生物利用度,亲脂性和提高亲和力等作用。因此,关于偕二氟类化合物的研究也受到越来越多的重视。
众所周知,有机硼化物在现代有机化学中有着举足轻重的重要性,并且近几年以含硼基团作为重要药效团的药物也越来越多。
因此,以含偕二氟基团的烷基硼化物作为合成含氟化合物的合成子将具有重要的意义。
技术实现要素:
本发明的目的在于提供一类偕二氟烷基硼酸酯类化合物。本发明利用sp3杂化的mida硼具有独特的稳定性及活性,设计合成了一类偕二氟烷基硼酸酯类化合物。所述化合物的结构稳定,可作为原料,更简单、方便、快捷的制备在医药学上具有高价值的化合物。
本发明的另一目的在于提供所述偕二氟烷基硼酸酯类化合物的制备方法。
本发明的再一目的在于提供所述偕二氟烷基硼酸酯类化合物的应用。
本发明的上述目的是通过以下方案予以实现的:
一类偕二氟烷基硼酸酯类化合物,所述化合物的结构如式(ⅰ)所示:
其中,r为
优选地,所述化合物的结构如式(ⅱ)或式(ⅲ)所示:
其中,r1为氢、苯基、单取代苯基、多取代苯基、联苯基或噻吩;所述单取代苯基或多取代苯基中的取代基为烷基、卤代烷基、氰基取代烷基、烷氧基、卤素、氰基、酯基、苯基或羟基;
r2为氢、卤素、羟基、c1~4烷基、c1~4烷氧基、苯基和取代苯基;所述取代苯基中的取代基为卤素、羟基、氰基、c1~4烷基、c1~4烷氧基;
r3为苄苯基、单取代苄基或多取代苄基;所述单取代苄基或多取代苄基中的取代基为c1~4烷基、c1~4烷氧基、卤素、苯基、氰基或羟基。
所述取代苯基可以是单取代苯基也可以是多取代苯基,单取代苯基是指苯基中的一个氢被其他基团取代;多取代苯基是指苯基中至少2个氢被其他基团所取代,可以是相同的基团,也可以是不同的基团。
优选地,所述r1为氢、苯基、单取代苯基、多取代苯基、联苯基或噻吩;所述单取代苯基或多取代苯基中的取代基为氟、氯、溴、氰基、氰甲基、c1~4烷基、c1~4烷卤基、c1~4烷氧基、c1~4酯基或苯基;
r2为氢、卤素、c1~2烷基、c1~2烷氧基或苯基;
r3为苄基、单取代苄基或多取代苄基,所述单取代苄基或多取代苄基中的取代基为氟、氯、溴、氰基、c1~4烷基、c1~4烷氧基或苯基。
优选地,r1为氢、苯基、2-苯甲基、3-苯甲基、3-氟苯基、3-氯苯基、3-溴苯基、3-氟苯甲基、3-三氟苯甲基、3-苯甲酸甲酯基、4-氟苯基、4-氯苯基、4-溴苯基、4-苯甲基、4-苯-丙基、4-氰甲基取代苯基、4-苯基取代苯基、4-甲氧基苯基、2,4-二甲基-苯基、联苯基或噻吩;
r2为氢、甲基或苯基;
r3为苄基、4-甲基苄基、4-氟苄基、4-氯苄基、4-溴苄基、4-异丙基苄基、4-苯基苄基、3-甲基苄基或3-氟-4-甲基苄基。
本发明同时还保护所述偕二氟烷基硼酸酯类化合物的制备方法,所述方法包括如下步骤:取代或非取代芳基乙烯基mida硼类化合物和高价碘化物在氟试剂存在条件下发生反应即可得到目标产物。
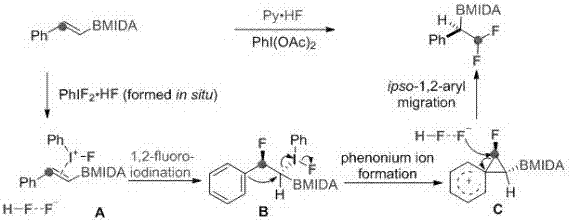
以乙烯基mida硼类化合物为例,其与高价碘化物在氟试剂存在条件下,发生反应,所述高价碘化物与双键配位,所述氟化氢亲核进攻芳香端双键,芳基迁移至硼所在碳原子,同时另一分子氟化氢进攻另一双键碳原子即得到偕二氟烷基硼酸酯类产物。反应原理及过程如图1所示。
所述反应在有机溶剂体系中反应,所述有机溶剂为二氯甲烷、1,2-二氯乙烷、甲苯、苯或各种取代苯溶剂。
优选地,所述取代或非取代芳基乙烯基mida硼类化合物的结构如式(ⅳ)或式(ⅴ)所示:
其中,r4为苯基、取代苯基或噻吩;r5为苯基或取代苯基。
优选地,所述r4为苯基、单取代苯基、多取代苯基、联苯基或噻吩;所述单取代苯基或多取代苯基中的取代基为烷基、烷氧基、卤素、苯基、氰基或羟基;
r5为苯基、单取代苯基或多取代苯基;所述单取代苯基或多取代苯基中的取代基为烷基、烷氧基、卤素、苯基、氰基或羟基。
优选地,所述高价碘化物为碘苯二乙酸,[双(三氟乙酰氧基)碘]苯,亚碘酰苯,[羟基(甲烷磺酰氧基)碘代]苯,羟基甲苯磺酰碘苯,双(叔丁基羰基氧)碘苯,[双(三氟乙酰氧基)碘代]取代芳基或碘代取代芳基二乙酸酯;所述的氟试剂为氟化氢吡啶或氟化氢吡啶络合盐。
优选地,所述高价碘化物与取代或非取代芳基乙烯基mida硼类化合物的反应摩尔比大于1:10。
优选地,所述氟试剂与取代或非取代芳基乙烯基mida硼类化合物的反应摩尔比不小于1:1。
所述偕二氟烷基硼酸酯类化合物作为原料在制备式(ⅵ)或式(ⅶ)所示化合物中的应用也在本发明的保护范围内;所述式(ⅵ)或式(ⅶ)化合物的通式如下:
其中,r6为苯基、取代苯基、芳香杂环或取代芳香杂环;r7为羟基、氨基、取代氨基、卤素、烷基、取代烷基、烯基、取代烯基或三氟硼酸盐。
与现有技术相比,本发明具有以下有益效果:
本发明所述化合物结构稳定,同时具有二氟烷基和硼酸酯基,可以作为反应原料,更简单、方便、快捷的制备在医药学上具有高价值的化合物。此外,所述化合物的制备方法简单,制备方法的反应底物适用性广,可制备多种偕二氟烷基硼酸酯类化合物;同时,所述方法的反应条件温和,无需金属试剂,无需高温或高压,无需酸或碱添加剂,且反应时间短,操作简便,后处理简单,是一种高效合成偕二氟烷基硼酸酯类化合物的方法。
附图说明
图1为乙烯基mida硼类化合物与高价碘化物在氟试剂存在条件下发生的化学反应的原理示意图。
具体实施方式
下面结合具体实施例对本发明做出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
实施例1化合物2a的合成
向支管中依次加入(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮(0.2mmol,1.0equiv),碘苯二乙酸(0.3mmol,1.5equiv),2.0ml二氯甲烷溶剂,25℃剧烈搅拌下一次加入氟化氢吡啶(8.0mmol,40.0equiv),搅拌1分钟至原料反应完全,用二氯甲烷稀释,水洗涤,水相再次用二氯甲烷萃取。合并有机相,用饱和食盐水洗涤,无水硫酸钠干燥。真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为72%。
化合物2a为2-(2,2-difluoro-1-phenylethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物2a进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,acetone-d6)δ7.39(d,j=7.4hz,2h),7.30(t,j=7.4hz,2h),7.23(t,j=7.3hz,1h),6.22(td,j=57.0,4.8hz,1h),4.29(d,j=17.0hz,1h),4.22(d,j=17.0hz,1h),4.08(d,j=16.9hz,1h),3.57(d,j=17.0hz,1h),3.12(s,3h),2.98(m,1h).
13cnmr(126mhz,acetone-d6)δ167.50,136.55(d,j=6.3hz),130.47,128.31,126.40,119.32(dd,j=241.9,239.7hz),62.74,62.29,46.22.
19fnmr(376mhz,acetone-d6)δ-112.26(d,j=273.2hz),-114.91(d,j=273.2hz).
esi-ms:calcdforc13h14bf2no4na[m+na]+:320.0889,found:320.0879.
实施例2化合物2b的合成
制备过程如实施例1,不同之处在于以(e)-6-甲基-2-(3-甲基苯乙烯基)-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮。最后经分离得到化合物2b,为白色固体,收率为80%。
化合物2b为2-(2,2-difluoro-1-(m-tolyl)ethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物2b进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,acetone-d6)δ7.23–7.14(m,3h),7.05(s,1h),6.21(td,j=57.0,4.8hz,1h),4.27(d,j=17.0hz,1h),4.19(d,j=17.0hz,1h),4.06(d,j=17.0hz,1h),3.53(d,j=16.9hz,1h),3.12(s,3h),2.93(m,1h),2.29(s,3h)
13cnmr(126mhz,acetone-d6)δ167.51,167.43,137.68,136.44(d,j=8.3hz),131.15,128.21,127.44,127.07,119.40(dd,j=242.1,239.9hz),62.75,62.30,46.15,20.61.
19fnmr(471mhz,acetone-d6)δ-112.16(d,j=273.0hz),-114.61(d,j=273.0hz).
esi-ms:calcdforc14h16bf2no4na[m+na]+:334.1026,found:334.1035.
实施例3化合物2c的合成
制备过程如实施例1,不同之处在于以(e)-2-(3-氟苯乙烯基)-6-甲基-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮,氟化氢吡啶的用量为20.0mmol(100.0equiv),分离得到化合物2c,为白色固体,收率为46%。
化合物2c为2-(2,2-difluoro-1-(3-fluorophenyl)ethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物2c进行核磁共振和高分辨表征,其结果如下:
1hnmr(500mhz,acetone-d6)δ7.34(dd,j=14.5,7.6hz,1h),7.21(d,j=7.7hz,1h),7.18(d,j=10.5hz,1h),7.00(td,j=8.6,2.0hz,1h),6.25(td,j=56.7,4.7hz,1h),4.31(d,j=16.8hz,1h),4.27(d,j=17.2hz,1h),4.10(d,j=17.0hz,1h),3.73(d,j=17.1hz,1h),3.15(s,3h),3.13–3.03(m,1h).
13cnmr(126mhz,acetone-d6)δ167.44,167.27,162.66(d,j=243.3hz),139.89–138.90(m),129.91(d,j=8.6hz),126.46(d,j=2.6hz),119.04(dd,j=241.9,239.7hz),117.09(d,j=21.8hz),113.09(d,j=21.0hz),62.80,62.31,46.39.
19fnmr(471mhz,acetone-d6)δ-112.65(d,j=274.1hz),-114.95,-115.20(d,j=274.1hz).
esi-ms:calcdforc13h13bf3no4na[m+na]+:338.0778,found:338.0784.
实施例4化合物2d的合成
制备过程如实施例1,不同之处在于以(e)-2-(3-氯苯乙烯基)-6-甲基-1,3,6,2-dioxazaborocane-4,8-二酮(0.2mmol,1.0equiv)替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮,氟化氢吡啶的用量为20.0mmol(100.0equiv),分离得到化合物2d,为白色固体,收率为57%。
化合物2d为2-(1-(3-chlorophenyl)-2,2-difluoroethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物2d进行核磁共振和高分辨表征,其结果如下:
1hnmr(500mhz,acetone-d6)δ7.46–7.40(m,1h),7.33(m,1h),7.27(d,j=7.0hz,1h),6.25(td,j=56.7,4.9hz,1h),4.35–4.25(m,2h),4.10(d,j=17.0hz,1h),3.79(d,j=17.1hz,1h),3.17(s,3h),3.13–3.01(m,1h).
13cnmr(126mhz,acetone-d6)δ167.44,167.23,139.22(d,j=6.9hz),133.57,130.30,129.84,128.89,126.44,119.11(dd,j=242.3,239.3hz),62.87,62.32,46.46.
19fnmr(471mhz,acetone-d6)δ-112.63(d,j=274.4hz),-115.06(d,j=274.4hz).
esi-ms:calcdforc13h13bf2no4clna[m+na]+:354.0475,found:354.0489.
实施例5化合物2e的合成
制备过程如实施例1,不同之处在于以(e)-2-(3-溴苯乙烯基)-6-甲基-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮,氟化氢吡啶的用量为20.0mmol(100.0equiv),分离得到化合物2e,为白色固体,收率为46%。
化合物2e为2-(1-(3-bromophenyl)-2,2-difluoroethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物2e进行核磁共振和高分辨表征,其结果如下:
1hnmr(500mhz,acetone-d6)δ7.59(s,1h),7.41(dd,j=14.6,7.9hz,2h),7.27(t,j=7.8hz,1h),6.25(td,j=56.7,5.0hz,1h),4.30(t,j=16.9hz,2h),4.10(d,j=16.9hz,1h),3.80(d,j=17.2hz,1h),3.17(s,3h),3.07(m,1h);
13cnmr(126mhz,acetone-d6)δ167.41,167.20,139.55(d,j=6.9hz),133.21,130.13,129.39,129.27,121.87,119.13(dd,j=242.3,239.5hz),62.89,62.32,46.45;
19fnmr(471mhz,acetone-d6)δ-112.61(d,j=274.3hz),-115.02(d,j=274.3hz).
esi-ms:calcdforc13h13no4bf2brna[m+na]+:397.9986,found:397.9984.
实施例6化合物2f的合成
制备过程如实施例1,不同之处在于以(e)-2-(4-叔丁基苯乙烯基)-6-甲基-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮;分离得到化合物2f,为白色固体,收率为75%。
化合物2f为2-(1-(4-(tert-butyl)phenyl)-2,2-difluoroethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物2f进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,acetone-d6)δ7.33(m,4h),6.19(td,j=57.1,4.8hz,1h),4.27(d,j=17.0hz,1h),4.20(d,j=22.0hz,1h),4.06(d,j=17.0hz,1h),3.55(d,j=17.0hz,1h),3.11(s,3h),2.94(m,1h),1.30(s,9h).
13cnmr(126mhz,acetone-d6)δ167.47,167.43,148.99,133.38(d,j=9.2hz),130.11,125.15,119.44(dd,j=241.6,239.9hz),62.76,62.26,46.20,34.00,30.82.
19fnmr(471mhz,acetone-d6)δ-112.10(d,j=272.8hz),-114.67(d,j=272.7hz).
esi-ms:calcdforc17h22bf2no4na[m+na]+:376.1515,found:376.1505.
实施例7化合物2g的合成
制备过程如实施例1,不同之处在于以(e)-2-(4-乙氰苯乙烯基)-6-甲基-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮;分离得到化合物2g,为白色固体,收率为68%。
化合物2g为2-(4-(2,2-difluoro-1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)ethyl)phenyl)acetonitrile,其结构如下所示:
对化合物2g进行核磁共振和高分辨表征,其结果如下:
1hnmr(500mhz,acetone-d6)δ7.42(d,j=8.0hz,2h),7.33(d,j=8.0hz,2h),6.23(td,j=56.9,4.8hz,1h),4.29(d,j=16.9hz,1h),4.24(d,j=17.1hz,1h),4.09(d,j=17.0hz,1h),3.92(s,2h),3.66(d,j=17.1hz,1h),3.13(s,3h),3.09–2.98(m,1h).
13cnmr(126mhz,acetone-d6)δ167.50,167.41,136.27(d,j=7.9hz),131.03,129.51,128.04,119.24(dd,j=241.9,239.7hz),118.37,62.79,62.30,46.34,22.13.
19fnmr(471mhz,acetone-d6)δ-112.42(d,j=273.6hz),-115.01(d,j=273.4hz).
esi-ms:calcdforc15h15bf2n2o4na[m+na]+:359.1000,found:359.0988.
实施例8化合物2h的合成
制备过程如实施例1,不同之处在于以(e)-2-联苯乙烯基-6-甲基-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮;分离得到化合物2h,为白色固体,收率为81%。
化合物2h为2-(1-([1,1'-biphenyl]-4-yl)-2,2-difluoroethyl)-6-methyl-1,3,6,2dioxazaborocane-4,8-dione,其结构如下所示:
对化合物2h进行核磁共振和高分辨表征,其结果如下:
1hnmr(500mhz,acetone-d6)δ7.66(d,j=7.2hz,2h),7.61(d,j=8.3hz,2h),7.51–7.42(m,4h),7.34(t,j=7.4hz,1h),6.27(td,j=57.0,4.8hz,1h),4.31(d,j=17.2hz,1h),4.25(d,j=17.0hz,1h),4.11(d,j=17.0hz,1h),3.66(d,j=17.0hz,1h),3.16(s,3h),3.06(m,1h).;
13cnmr(126mhz,acetone-d6)δ167.47,167.40,140.59,139.02,135.81(d,j=8.0hz),130.98,128.81,127.19,126.73,126.69,119.32(dd,j=241.7,239.9hz),62.81,62.34,46.32.;
19fnmr(471mhz,acetone-d6)δ-112.20(d,j=273.2hz),-114.80(d,j=273.2hz).
esi-ms:calcdforc19h18bf2no4na[m+na]+:396.1189,found:396.1193.
实施例9化合物2i的合成
制备过程如实施例1,不同之处在于以(e)-2-(4-甲氧基苯乙烯基)-6-甲基-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮;分离得到化合物2i,为白色固体,收率为63%。
化合物2i为2-(2,2-difluoro-1-(4-methoxyphenyl)ethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物2i进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,acetone-d6)δ7.30(d,j=8.6hz,2h),6.87(d,j=8.6hz,2h),6.17(td,j=57.2,4.4hz,1h),4.27(d,j=17.0hz,1h),4.19(d,j=16.9hz,1h),4.07(d,j=17.0hz,1h),3.77(s,3h),3.53(d,j=16.9hz,1h),3.09(s,3h),2.97–2.84(m,1h).
13cnmr(126mhz,acetone-d6)δ167.50,167.42,158.54,131.48,127.93(d,j=7.9hz),119.20(t,j=240.9hz),113.76,62.69,62.29,54.52,46.13.
19fnmr(376mhz,acetone-d6)δ-112.33(d,j=272.5hz),-115.34(d,j=272.5hz).
esi-ms:calcdforc14h16bf2no5na[m+na]+:350.0988,found:350.0984.
实施例10化合物2j的合成
制备过程如实施例1,不同之处在于以(e)-2-(4-氟苯乙烯基)-6-甲基-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮;分离得到化合物2j,为白色固体,收率为82%。
化合物2j为2-(2,2-difluoro-1-(4-fluorophenyl)ethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物2j进行核磁共振和高分辨表征,其结果如下:
1hnmr(500mhz,acetone-d6)δ7.41(dd,j=8.5,5.6hz,2h),7.10–7.03(m,2h),6.21(td,j=56.9,4.6hz,1h),4.30(d,j=16.9hz,1h),4.24(d,j=17.1hz,1h),4.10(d,j=17.0hz,1h),3.68(d,j=17.1hz,1h),3.12(s,3h),3.04(m,1h).
13cnmr(126mhz,acetone-d6)δ167.44,167.33,161.70(d,j=243.0hz),132.49(d,j=7.4hz),132.20(d,j=7.8hz),119.08(t,j=240.9hz),114.92(d,j=21.1hz),62.76,62.30,46.31.
19fnmr(471mhz,acetone-d6)δ-112.57(d,j=273.5hz),-115.52(d,j=273.6hz),-118.35.
esi-ms:calcdforc13h13bf3no4na[m+na]+:338.0777,found:338.0784.
实施例11化合物2k的合成
制备过程如实施例1,不同之处在于以(e)-2-(4-氯苯乙烯基)-6-甲基-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮;分离得到化合物2k,为白色固体,收率为67%。
化合物2k为2-(1-(4-chlorophenyl)-2,2-difluoroethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物2k进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,acetone-d6)δ7.40(d,j=8.4hz,2h),7.33(d,j=8.5hz,2h),6.23(td,j=56.8,4.6hz,1h),4.30(d,j=17.0hz,1h),4.25(d,j=17.2hz,1h),4.10(d,j=17.0hz,1h),3.72(d,j=17.1hz,1h),3.13(s,3h),3.11–2.97(m,1h).
13cnmr(101mhz,acetone-d6)δ167.40,167.26,135.55(d,j=6.5hz),132.12,131.90,128.28,119.01(dd,j=241.8,239.9hz),62.80,62.33,46.36.
19fnmr(471mhz,acetone-d6)δ-112.57(d,j=273.9hz),-115.36(d,j=273.9hz).
esi-ms:calcdforc13h13bf2no4clna[m+na]+:354.0476,found:354.0489.
实施例12化合物2l的合成
制备过程如实施例1,不同之处在于以(e)-2-(4-溴苯乙烯基)-6-甲基-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮;分离得到化合物2l,为白色固体,收率为47%。
化合物2l为2-(1-(4-bromophenyl)-2,2-difluoroethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物2l进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,acetone-d6)δ7.48(d,j=8.4hz,2h),7.34(d,j=8.4hz,2h),6.23(td,j=56.8,4.7hz,1h),4.30(d,j=17.1hz,1h),4.25(d,j=17.2hz,1h),4.10(d,j=16.9hz,1h),3.73(d,j=17.1hz,1h),3.14(s,3h),3.08–2.97(m,1h).
13cnmr(126mhz,acetone-d6)δ167.44,167.29,136.04(d,j=8.0hz),132.51,131.29,120.01,118.97(dd,j=242.0,239.8hz),62.80,62.34,46.40.
19fnmr(376mhz,acetone-d6)δ-112.53(d,j=274.1hz),-115.26(d,j=274.0hz).
esi-ms:calcdforc13h13bf2no4brna[m+na]+:397.9991,found:397.9984.
实施例13化合物2m的合成
制备过程如实施例1,不同之处在于以((e)-6-甲基-2-(2-甲基苯乙烯)-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮;分离得到化合物2m,为白色固体,收率为70%。
化合物2m为2-(2,2-difluoro-1-(o-tolyl)ethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物2m进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,acetone-d6)δ7.47(d,j=7.3hz,1h),7.14(m,3h),6.23(td,j=57.1,5.6hz,1h),4.30(d,j=5.6hz,1h),4.26(d,j=5.8hz,1h),4.07(d,j=16.9hz,1h),3.80(d,j=17.2hz,1h),3.31–3.17(m,1h),3.13(s,3h),2.37(s,3h).
13cnmr(101mhz,acetone-d6)δ167.53,167.23,137.20,135.44(d,j=9.0hz),130.45,128.77,126.21,125.88,120.34(dd,j=242.9,238.2hz),63.20,62.45,46.18,19.78.
19fnmr(376mhz,acetone-d6)δ-111.95(d,j=273.8hz),-114.65(d,j=274.0hz).
esi-ms:calcdforc14h16bf2no4na[m+na]+:334.1018,found:334.1035.
实施例14化合物2n的合成
制备过程如实施例1,不同之处在于以(e)-2-(2,4-二甲基苯乙烯)-6-甲基-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮;分离得到化合物2n,为白色固体,收率为50%。
化合物2n为2-(1-(2,4-dimethylphenyl)-2,2-difluoroethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物2n进行核磁共振和高分辨表征,其结果如下:
1hnmr(500mhz,acetone-d6-d6)δ7.34(d,j=7.9hz,1h),7.09–6.90(m,2h),6.20(td,j=57.2,5.6hz,1h),4.37–4.22(m,2h),4.07(d,j=16.8hz,1h),3.76(d,j=17.2hz,1h),3.25–3.13(m,1h),3.10(s,3h),2.32(s,3h),2.25(s,3h).
13cnmr(126mhz,acetone-d6)δ167.60,167.34,137.02,135.46,132.18(d,j=7.9hz),131.24,128.70,126.60,120.30(dd,j=242.5,238.4hz),63.17,62.46(d,j=3.1hz),46.14(d,j=2.6hz),20.04,19.75.
19fnmr(471mhz,acetone-d6)δ-111.92(d,j=273.1hz),-114.77(d,j=273.4hz).
esi-ms:calcdforc15h18no4bf2na[m+na]+:348.1201,found:348.1192.
实施例15化合物2o的合成
制备过程如实施例1,不同之处在于以(e)-6-甲基-2-(2-萘乙烯基)-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮;分离得到化合物2o,为白色固体,收率为41%。
化合物2o为2-(2,2-difluoro-1-(naphthalen-1-yl)ethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物2o进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,acetone-d6)δ8.35(d,j=8.4hz,1h),7.92(d,j=7.8hz,1h),7.82(d,j=8.2hz,1h),7.78(d,j=7.1hz,1h),7.56–7.44(m,3h),6.38(td,j=57.1,5.0hz,1h),4.33(d,j=16.9hz,1h),4.25(d,j=17.2hz,1h),4.14(d,j=17.0hz,1h),4.07–3.94(m,1h),3.72(d,j=17.2hz,1h),3.05(s,3h).
13cnmr(126mhz,acetone-d6)δ167.55,167.37,134.35,133.27,132.96(d,j=8.3hz),128.94,127.18,127.08,126.09,125.34,125.31,123.78,120.00(dd,j=242.8,239.6hz),62.99,62.53,46.42.
19fnmr(376mhz,acetone-d6)δ-111.59(d,j=273.0hz),-114.48(d,j=273.0hz).
esi-ms:calcdforc17h16bf2no4na[m+na]+:370.1038,found:370.1036.
实施例16化合物2p的合成
制备过程如实施例1,不同之处在于以(e)-6-甲基-2-(2-噻吩乙烯基)-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮;分离得到化合物2p,为白色固体,收率为23%。
化合物2p为2-(2,2-difluoro-1-(thiophen-2-yl)ethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物2p进行核磁共振和高分辨表征,其结果如下:
1hnmr(500mhz,acetone-d6)δ7.35(d,j=5.1hz,1h),7.04(d,j=3.3hz,1h),7.02–6.98(m,1h),6.18(td,j=57.1,3.0hz,1h),4.33(d,j=17.1hz,1h),4.23(d,j=16.9hz,1h),4.14(d,j=17.1hz,1h),3.55(d,j=16.9hz,1h),3.36(m,1h),3.09(s,3h).
13cnmr(126mhz,acetone-d6)δ167.37,136.38(d,j=6.4hz),127.92,126.85,124.98,117.39(t,j=241.9hz),62.73,62.45,46.10.
19fnmr(471mhz,acetone-d6)δ-112.96(d,j=271.8hz),-116.76(d,j=274.0hz).
esi-ms:calcdforc11h12bf2no4sna[m+na]+:326.0426,found:326.0442.
实施例17化合物2q的合成
制备过程如实施例1,不同之处在于以(e)-6-甲基-2-(2-苯基-1-丙烯基)-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮;分离得到化合物2q,为白色固体,收率为81%。
化合物2q为2-(2,2-difluoro-1-phenylpropyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物2q进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,acetone-d6)δ7.41(d,j=7.4hz,2h),7.30(t,j=7.3hz,2h),7.24(t,j=7.2hz,1h),4.19(t,j=17.1hz,2h),4.02(d,j=16.9hz,1h),3.51(d,j=17.0hz,1h),3.11(s,3h),3.09–2.99(m,1h),1.58(t,j=19.1hz,3h);
13cnmr(101mhz,acetone-d6)δ167.69,167.42,138.33(t,j=5.7hz),131.03,128.12,126.52(t,j=240.8hz),126.39,62.85,62.07,45.88,23.48(t,j=28.6hz);
19fnmr(376mhz,acetone-d6)δ-81.12(d,j=240.1hz),-83.78(d,j=240.0hz).
esi-ms:calcdforc14h16bf2no4na[m+na]+:334.1029,found:334.1035.
实施例18化合物2r的合成
制备过程如实施例1,不同之处在于以(e)-6-甲基-2-(2-对甲苯基-1-丙烯基)-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮;分离得到化合物2r,为白色固体,收率为89%。
化合物2r为2-(2,2-difluoro-1-(p-tolyl)propyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物2r进行核磁共振和高分辨表征,其结果如下:
1hnmr(500mhz,acetone-d6)δ7.29(d,j=7.9hz,2h),7.11(d,j=7.9hz,2h),4.19(d,j=16.8hz,1h),4.14(d,j=16.9hz,1h),4.00(d,j=16.8hz,1h),3.47(d,j=16.9hz,1h),3.10(s,3h),2.98(t,j=16.2hz,1h),2.29(s,3h),1.57(t,j=19.0hz,3h);
13cnmr(126mhz,acetone-d6)δ167.54,167.35,135.76,135.12(t,j=5.6hz),130.89,128.77,126.47(t,j=240.6hz),62.84,62.10,45.81,23.43(t,j=28.6hz),20.09;
19fnmr(376mhz,acetone-d6)δ-81.24(d,j=239.6hz),-83.63(d,j=239.7hz).
esi-ms:calcdforc15h18bf2no4na[m+na]+:348.1174,found:348.1192.
实施例19化合物2s的合成
制备过程如实施例1,不同之处在于以(e)-6-甲基-2-(2-对丙基苯基-1-丙烯基)-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮;分离得到化合物2s,为白色固体,收率为66%。
化合物2s为2-(2,2-difluoro-1-(4-propylphenyl)propyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物2s进行核磁共振和高分辨表征,其结果如下:
1hnmr(500mhz,acetone-d6)δ7.31(d,j=7.9hz,2h),7.13(d,j=7.9hz,2h),4.19(dd,j=23.2,16.9hz,2h),4.01(d,j=16.8hz,1h),3.47(d,j=16.9hz,1h),3.11(s,3h),3.00(t,j=16.6hz,1h),2.64–2.48(m,2h),1.70–1.50(m,5h),0.92(t,j=7.4hz,3h).
13cnmr(126mhz,acetone-d6)δ167.64,167.42,140.60,135.40(t,j=5.8hz),130.89,128.17,126.54(t,j=240.6hz),62.82,62.06,45.82,37.28,24.38,23.43(t,j=28.6hz),13.21.
19fnmr(471mhz,acetone-d6)δ-81.19(d,j=240.5hz),-83.62(d,j=239.6hz).
esi-ms:calcdforc17h22no4bf2na[m+na]+:376.1490,found:376.1505.
实施例20化合物2t的合成
制备过程如实施例1,不同之处在于以(e)-2-(2-对氯苯基-1-丙烯基)-6-甲基-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮;分离得到化合物2t,为白色固体,收率为60%。
化合物2t为2-(1-(4-chlorophenyl)-2,2-difluoropropyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物2t进行核磁共振和高分辨表征,其结果如下:
1hnmr(500mhz,acetone-d6)δ7.41(d,j=8.4hz,2h),7.33(d,j=8.6hz,2h),4.27–4.18(m,2h),4.03(d,j=16.8hz,1h),3.68(d,j=17.1hz,1h),3.14(s,3h),3.11–3.03(m,1h),1.58(t,j=19.1hz,3h).;
13cnmr(126mhz,acetone-d6)δ167.56,167.13,137.37(t,j=5.8hz),132.62,131.91,128.09,126.30(dd,j=241.6,240.0hz),62.99,62.11,46.04,23.39(t,j=28.5hz);
19fnmr(376mhz,acetone-d6)δ-81.28(d,j=241.1hz),-84.22(d,j=241.1hz).
esi-ms:calcdforc14h15bf2no4clna[m+na]+:368.0639,found:368.0646.
实施例21化合物2u的合成
制备过程如实施例1,不同之处在于以(e)-2-(2-(4-氟苯基)-1-丙烯基)-6-甲基-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮;分离得到化合物2u,为白色固体,收率为62%。
化合物2u为2-(2,2-difluoro-1-(4-fluorophenyl)propyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物2u进行核磁共振和高分辨表征,其结果如下:
1hnmr(500mhz,acetone-d6)δ7.42(dd,j=8.0,5.8hz,2h),7.06(t,j=8.8hz,2h),4.23(m,2h),4.03(d,j=16.8hz,1h),3.65(d,j=17.1hz,1h),3.14(s,3h),3.11–3.03(m,1h),1.57(t,j=19.1hz,3h);
13cnmr(126mhz,acetone-d6)δ167.64,167.24,161.68(d,j=243.0hz),134.42(d,j=3.3hz),132.68(d,j=7.6hz),126.43(t,j=240.8hz),114.71(d,j=21.1hz),62.96,62.10,46.00,23.36(t,j=28.6hz);
19fnmr(471mhz,acetone-d6)δ-81.48(d,j=240.6hz),-84.35(d,j=240.6hz),-118.32..
esi-ms:calcdforc14h15bf3no4na[m+na]+:352.0937,found:352.0941.
实施例22化合物2v的合成
制备过程如实施例1,不同之处在于以2-(2,2-二苯乙烯基)-6-甲基-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮;分离得到化合物2v,为白色固体,收率为59%。
化合物2v为2-(2,2-difluoro-1,2-diphenylethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物2v进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,acetone-d6)δ7.33–6.97(m,10h),4.28–4.17(m,2h),4.09(d,j=16.9hz,1h),3.58(d,j=17.0hz,1h),3.35(dd,j=28.6,8.2hz,1h),3.21(s,3h).
13cnmr(126mhz,dmso-d6)δ169.24,168.74,138.25(t,j=27.5hz),137.59(d,j=9.7hz),131.41,129.63,128.26(d,j=71.8hz),128.21(d,j=4.4hz),126.59,125.59(t,j=6.0hz),125.31(dd,j=249.1,242.3hz),62.98,62.20,46.71;
19fnmr(376mhz,acetone-d6)δ-82.49(d,j=244.1hz),-96.90(d,j=244.0hz).
esi-ms:calcdforc19h18bf2no4na[m+na]+:396.1198,found:396.1193.
实施例23化合物2w的合成
制备过程如实施例1,不同之处在于以(z)-6-甲基-2-(1-phenylprop-1-en-2-yl)-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮;氟化氢吡啶的用量为20.0mmol(100.0equiv)分离得到化合物2w,为白色固体,收率为53%。
化合物2w为2-(1,1-difluoro-2-phenylpropan-2-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物2w进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,acetone-d6)δ7.56(d,j=7.8hz,2h),7.36(m,2h),7.25(t,j=7.3hz,1h),6.33(t,j=56.4hz,1h),4.21(d,j=17.1hz,1h),4.15(d,j=16.9hz,1h),3.90(d,j=17.1hz,1h),3.49(d,j=16.9hz,1h),2.67(s,3h),1.53(s,3h).
13cnmr(101mhz,acetone-d6)δ167.44,167.34,140.66(t,j=3.9hz),128.45,127.57,126.24,121.22(t,j=245.4hz),63.19,63.10,46.28,13.96(t,j=6.6hz).
19fnmr(376mhz,acetone-d6)δ-122.45(d,j=268.8hz),-123.23(d,j=270.2hz).
esi-ms:calcdforc14h16bf2no4na[m+na]+:334.1033,found:334.1035.
实施例24化合物2x的合成
向支管中依次加入methyl(e)-3-(2-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)vinyl)benzoate(0.2mmol,1.0equiv),碘苯二乙酸(0.3mmol,1.5equiv),2.0ml二氯甲烷溶剂,25℃剧烈搅拌下一次加入氟化氢吡啶(8.0mmol,40.0equiv),搅拌1分钟至原料反应完全,用二氯甲烷稀释,水洗涤,水相再次用二氯甲烷萃取。合并有机相,用饱和食盐水洗涤,无水硫酸钠干燥。真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为40%。
化合物2x为methyl3-(2,2-difluoro-1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)ethyl)benzoate,其结构如下所示:
对化合物2x进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,acetone-d6)δ8.03(s,1h),7.89(dt,j=7.7,1.5hz,1h),7.67(dt,j=7.6,1.6hz,1h),7.46(t,j=7.7hz,1h),6.27(td,j=56.8,5.1hz,1h),4.29(d,j=17.0hz,2h),4.13(dd,j=17.0,0.8hz,1h),3.88(s,3h),3.81(d,j=17.2hz,1h),3.24–3.05(m,4h).
13cnmr(101mhz,acetone)δ167.46,167.28,166.38,137.47(d,j=9.2hz),134.83,131.45,130.35,128.48,127.41,119.32(dd,j=242.0,239.2hz),62.89,62.31(d,j=2.5hz),51.43,46.48(d,j=2.6hz).
19fnmr(376mhz,acetone-d6)δ-112.52(d,j=274.2hz),-115.03(d,j=274.2hz).
esi-ms:calcdforc15h17no6bf2[m+h]+:356.1120,found:356.1114
实施例25化合物2y的合成
向支管中依次加入(e)-6-methyl-2-(3-(trifluoromethyl)styryl)-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),碘苯二乙酸(0.3mmol,1.5equiv),2.0ml二氯甲烷溶剂,25℃剧烈搅拌下一次加入氟化氢吡啶(8.0mmol,40.0equiv),搅拌1分钟至原料反应完全,用二氯甲烷稀释,水洗涤,水相再次用二氯甲烷萃取。合并有机相,用饱和食盐水洗涤,无水硫酸钠干燥。真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为43%。
化合物2y为2-(2,2-difluoro-1-(3-(trifluoromethyl)phenyl)ethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物2y进行核磁共振和高分辨表征,其结果如下:
1hnmr(500mhz,acetone-d6)δ7.79–7.66(m,2h),7.57(dt,j=15.3,7.8hz,2h),6.30(td,j=56.7,5.0hz,1h),4.32(t,j=17.4hz,2h),4.13(d,j=16.9hz,1h),3.82(d,j=17.2hz,1h),3.32–3.22(m,1h),3.19(s,3h).
13cnmr(126mhz,acetone-d6)δ167.39,167.18,138.29(d,j=8.5hz),134.22,129.97(d,j=31.5hz),129.10,126.98(d,j=4.0hz),123.43(t,j=271.5hz),123.17(d,j=3.9hz),119.14(dd,j=242.3,239.2hz),62.90,62.32(d,j=2.3hz),46.49(d,j=2.7hz).
19fnmr(471mhz,acetone-d6)δ-62.94,-112.71(d,j=274.6hz),-115.25(d,j=274.7hz).
esi-ms:calcdforc14h13no4bf5na[m+na]+:388.0757,found:388.0753.
实施例26化合物6a的合成
制备过程如实施例1,不同之处在于以6-甲基-2-(1-(苯基)乙烯基)-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮;氟化氢吡啶的用量为20.0mmol(100.0equiv)分离得到化合物6a,为白色固体,收率为39%。
化合物6a为2-(1,1-difluoro-2-phenylethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物6a进行核磁共振和高分辨表征,其结果如下:
1hnmr(500mhz,acetone-d6)δ7.41–6.97(m,5h),4.44(d,j=17.0hz,2h),4.19(d,j=17.0hz,2h),3.25(s,3h),3.17(t,j=21.9hz,2h);
13cnmr(126mhz,acetone-d6)δ167.38,133.12(t,j=4.3hz),130.99,127.83,126.69,62.74,46.67(t,j=4.1hz),40.42(t,j=21.3hz);
19fnmr(471mhz,acetone-d6)δ-119.58.
esi-ms:calcdforc13h14bf2no4na[m+na]+:320.0875,found:320.0879.
实施例27化合物6b的合成
制备过程如实施例1,不同之处在于以6-甲基-2-(1-(4-甲基苯)乙烯基)-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮;氟化氢吡啶的用量为20.0mmol(100.0equiv)分离得到化合物6b,为白色固体,收率为67%。
化合物6b为2-(1,1-difluoro-2-(p-tolyl)ethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物6b进行核磁共振和高分辨表征,其结果如下:
1hnmr(500mhz,acetone-d6)δ7.17(d,j=7.4hz,2h),7.12(d,j=7.4hz,2h),4.43(d,j=17.0hz,2h),4.18(d,j=17.0hz,2h),3.25(s,3h),3.12(t,j=21.9hz,2h),2.30(s,3h);
13cnmr(126mhz,acetone-d6)δ167.36,136.02,130.85,129.95(t,j=4.3hz),128.48,62.71,46.65,40.02(t,j=21.4hz),20.19;
19fnmr(471mhz,acetone-d6)δ-119.61.
esi-ms:calcdforc14h16bf2no4na[m+na]+:334.1023,found:334.1035.
实施例28化合物6c的合成
制备过程如实施例1,不同之处在于以2-(1-(4-氟苯基)乙烯基)-6-甲基-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮;氟化氢吡啶的用量为20.0mmol(100.0equiv)分离得到化合物6c,为白色固体,收率为64%。
化合物6c为2-(1,1-difluoro-2-(4-fluorophenyl)ethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物6c进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,acetone-d6)δ7.33(dd,j=8.4,5.7hz,2h),7.15–6.93(m,2h),4.44(d,j=17.0hz,2h),4.19(d,j=17.0hz,2h),3.26(s,3h),3.17(t,j=21.7hz,2h).
13cnmr(101mhz,acetone-d6)δ167.37,162.02(d,j=242.6hz),132.70(d,j=8.1hz),129.18(t,j=4.5hz),114.49(d,j=21.3hz),62.72,46.68(t,j=4.2hz),39.61(t,j=21.3hz).
19fnmr(376mhz,acetone-d6)δ-118.06,-119.70.
esi-ms:calcdforc13h13bf3no4na[m+na]+:338.0769,found:338.0784.
实施例29化合物6d的合成
制备过程如实施例1,不同之处在于以2-(1-(4-氯苯基)乙烯基)-6-甲基-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮;氟化氢吡啶的用量为20.0mmol(100.0equiv)分离得到化合物6d,为白色固体,收率为51%。
化合物6d为2-(2-(4-chlorophenyl)-1,1-difluoroethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物6d进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,acetone-d6)δ7.41–7.26(m,4h),4.45(d,j=17.0hz,2h),4.20(d,j=17.0hz,2h),3.26(s,3h),3.18(t,j=21.7hz,2h).
13cnmr(101mhz,acetone-d6)δ167.33,132.65,132.28,132.11(t,j=4.5hz),127.88,62.72,46.68(t,j=4.2hz),39.78(t,j=21.4hz).
19fnmr(376mhz,acetone-d6)δ-119.55.
esi-ms:calcdforc13h13no4bf2clna[m+na]+:354.0485,found:354.0489.
实施例30化合物6e的合成
制备过程如实施例1,不同之处在于以2-(1-(4-叔丁基苯基)乙烯基)-6-甲基-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮;氟化氢吡啶的用量为20.0mmol(100.0equiv)分离得到化合物6e,为白色固体,收率为80%。
化合物6e为2-(2-(4-(tert-butyl)phenyl)-1,1-difluoroethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物6e进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,acetone-d6)δ7.36(d,j=7.9hz,2h),7.22(d,j=7.9hz,2h),4.44(d,j=17.1hz,2h),4.19(d,j=17.1hz,2h),3.25(s,3h),3.14(t,j=22.1hz,2h),1.31(s,9h).
13cnmr(101mhz,acetone-d6)δ167.35,149.32,130.70,130.01(t,j=4.2hz),124.69,62.76,46.68(t,j=4.3hz),39.84(t,j=21.3hz),34.03,30.79.
19fnmr(376mhz,acetone-d6)δ-119.72.
esi-ms:calcdforc17h22no4bf2na[m+na]+:376.1503,found:376.1505.
实施例31化合物6f的合成
制备过程如实施例1,不同之处在于以2-(1-(联苯)乙烯基)-6-甲基-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮;氟化氢吡啶的用量为20.0mmol(100.0equiv)分离得到化合物6f,为白色固体,收率为60%。
化合物6f为2-(2-([1,1'-biphenyl]-4-yl)-1,1-difluoroethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物6f进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,acetone-d6)δ7.71–7.65(m,2h),7.63–7.58(m,2h),7.46(t,j=7.6hz,2h),7.40(d,j=8.1hz,2h),7.38–7.31(m,1h),4.46(d,j=17.0hz,2h),4.21(d,j=17.0hz,2h),3.32–3.12(m,5h).
13cnmr(101mhz,acetone-d6)δ167.39,140.82,139.48,132.38(t,j=7.0hz),131.55,128.83,127.19,126.78,126.38,62.76,46.71(t,j=4.18hz),40.06(t,j=21.1hz).
19fnmr(376mhz,acetone-d6)δ-119.49.
esi-ms:calcdforc19h18bf2no4na[m+na]+:396.1181,found:396.1193.
实施例32化合物6g的合成
制备过程如实施例1,不同之处在于以6-甲基-2-(1-(m-苯基)乙烯基)-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮;氟化氢吡啶的用量为20.0mmol(100.0equiv)分离得到化合物6g,为白色固体,收率为63%。
化合物6g为2-(1,1-difluoro-2-(m-tolyl)ethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物6g进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,acetone-d6)δ7.19(t,j=7.5hz,1h),7.14–7.05(m,3h),4.43(d,j=17.0hz,2h),4.18(d,j=17.0hz,2h),3.25(s,3h),3.13(t,j=22.0hz,2h),2.32(s,3h).
13cnmr(101mhz,acetone-d6)δ167.40,137.12,132.96(t,j=4.3hz),131.72,128.06,127.74,127.36,62.73,46.67(t,j=4.3hz),40.32(t,j=21.3hz),20.48.
19fnmr(376mhz,acetone-d6)δ-119.48.
esi-ms:calcdforc14h16no4bf2na[m+na]+:334.1023,found:334.1035.
实施例33化合物6h的合成
制备过程如实施例1,不同之处在于以2-(1-(3-氟-4-甲苯基)乙烯基)-6-甲基-1,3,6,2-dioxazaborocane-4,8-二酮替代(e)-6-甲基-2-苯乙烯基-1,3,6,2-dioxazaborocane-4,8-二酮;氟化氢吡啶的用量为20.0mmol(100.0equiv)分离得到化合物6h,为白色固体,收率为65%。
化合物6h为2-(1,1-difluoro-2-(3-fluoro-4-methylphenyl)ethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物6h进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,acetone-d6)δ7.19(t,j=7.8hz,1h),7.01(d,j=9.3hz,2h),4.45(d,j=17.1hz,2h),4.20(d,j=17.0hz,2h),3.27(s,3h),3.16(t,j=21.7hz,2h),2.24(s,3h).
13cnmr(101mhz,acetone-d6)δ167.35,160.81(d,j=241.9hz),132.96(t,j=3.5hz),130.85(d,j=5.4hz),126.72(d,j=3.3hz),122.76(d,j=17.0hz),117.19(d,j=22.5hz),62.72,46.67(t,j=4.3hz),39.81(t,j=20.9hz),13.27(d,j=3.5hz).
19fnmr(376mhz,acetone-d6)δ-119.53,-120.33.
esi-ms:calcdforc14h15no4bf3na[m+na]+:352.0929,found:352.0941.
应用实施例
实施例34以化合物2a为原料制备化合物8a
向支管中依次加入2a化合物,即2-(2,2-difluoro-1-phenylethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),1.5ml四氢呋喃溶剂,0℃滴加0.4mlof10%naohand0.2mlof30%h2o2的混合溶液,25℃搅拌1小时至原料反应完全,用二氯甲烷稀释,水洗涤,水相再次用二氯甲烷萃取。合并有机相,用饱和食盐水洗涤,无水硫酸钠干燥。真空旋干溶剂,用硅胶柱层析纯化得产品,为无色液体,收率为70%。
化合物8a为2,2-difluoro-1-phenylethan-1-ol,其结构如下所示:
对化合物8a进行核磁共振和高分辨表征,其结果如下:
1hnmr(500mhz,chloroform-d)δ7.50–7.26(m,5h),5.69(td,j=56.0,4.7hz,1h),4.75(ddd,j=10.3,7.7,4.2hz,1h),2.39(d,j=3.5hz,1h).
13cnmr(126mhz,cdcl3)δ134.80(t,j=3.2hz),128.03,127.67,126.06,114.80(t,j=245.5hz),72.66(t,j=24.6hz).
19fnmr(471mhz,cdcl3)δ-127.24(d,j=283.8hz),-127.92(d,j=285.6hz).
实施例35以化合物2h为原料制备化合物8h
向支管中依次加入2h化合物,即2-(1-([1,1'-biphenyl]-4-yl)-2,2-difluoroethyl)-6-methyl-1,3,6,2dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),1.5ml四氢呋喃溶剂,0℃滴加0.4mlof10%naohand0.2mlof30%h2o2的混合溶液,25℃搅拌1小时至原料反应完全,用二氯甲烷稀释,水洗涤,水相再次用二氯甲烷萃取。合并有机相,用饱和食盐水洗涤,无水硫酸钠干燥。真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为61%。
化合物8h为1-([1,1'-biphenyl]-4-yl)-2,2-difluoroethan-1-ol,其结构如下所示:
对化合物8h进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,chloroform-d)δ7.64(dd,j=16.1,7.8hz,4h),7.58–7.45(m,4h),7.39(t,j=7.3hz,1h),5.84(td,j=56.0,4.8hz,1h),4.91(tt,j=9.7,4.3hz,1h),2.45(d,j=3.8hz,1h).
13cnmr(101mhz,cdcl3)δ142.03,140.50,134.78(t,j=3.3hz),128.87,127.62,127.56,127.45,127.18,115.84(t,j=245.6hz),73.51(t,j=24.5hz).
19fnmr(376mhz,cdcl3)δ-127.40,-127.42.
ei-ms:calcdforc14h12of2:234.0856,found:234.0864.
实施例36以化合物2a为原料制备化合物9
先将化合物2a转换成为三氟硼化钾盐(2,2-difluoro-1-phenylethyl)trifluoro-l4-borane,potassiumsalt,然后取0.2mmol的三氟硼化钾盐(1.0equiv),1ml水,1ml四氢呋喃溶剂,三溴化吡啶(0.6mmol),25℃搅拌12小时至原料反应完全,用二氯甲烷稀释,水洗涤,水相再次用二氯甲烷萃取。合并有机相,用饱和食盐水洗涤,无水硫酸钠干燥。真空旋干溶剂,用硅胶柱层析纯化得产品,为无色液体,收率为65%。
化合物9为(1-bromo-2,2-difluoroethyl)benzene,其结构如下所示:
对化合物9进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,chloroform-d)δ7.52–7.34(m,5h),6.03(td,j=55.7,4.3hz,1h),4.98(td,j=11.6,4.3hz,1h).
13cnmr(101mhz,cdcl3)δ134.07(t,j=2.7hz),129.60,128.98,128.94,114.19(t,j=246.9hz),49.95(t,j=24.8hz).
19fnmr(471mhz,chloroform-d)δ-117.38(t,j=276.34hz),-118.04(t,j=275.69hz).
ei-ms:calcdforc8h7f2br:219.9699,found:219.9706.
实施例37以化合物9为原料制备化合物10
向耐压支管中依次加入化合物9,即(1-溴-2,2-二氟乙基)苯(0.2mmol,1.0equiv),cucl(2mg,0.02mmol),2,2’-联吡啶(6.3mg,0.04mmol),苯乙烯(83.2mg,0.8mmol)1,2-二氯苯(0.8ml),氮气保护下,180℃回流24小时至原料反应完全,用二氯甲烷稀释,水洗涤,水相再次用二氯甲烷萃取。合并有机相,用饱和食盐水洗涤,无水硫酸钠干燥。真空旋干溶剂,用硅胶柱层析纯化得产品,为无色液体,收率为61%。
化合物10为(e)-(4,4-difluorobut-1-ene-1,3-diyl)dibenzene,其结构如下所示:
对化合物10进行核磁共振和高分辨表征,其结果如下:
1hnmr(500mhz,chloroform-d)δ7.42–7.28(m,9h),7.23(d,j=7.4hz,1h),6.54(d,j=16.0hz,1h),6.45(dd,j=16.0,7.5hz,1h),6.02(td,j=56.3,3.9hz,1h),4.00–3.84(m,1h).
13cnmr(101mhz,cdcl3)δ136.58,136.17(t,j=3.7hz),134.50,128.92,128.86,128.60,127.89,127.77,126.45,124.19(t,j=4.5hz),116.93(t,j=245.3hz),53.18(t,j=20.5hz).
19fnmr(471mhz,chloroform-d)δ-118.34(d,j=277.4hz),-120.86(d,j=277.5hz).
ei-ms:calcdforc16h14f2:244.1064,found:244.1066.
实施例38以化合物9为原料制备化合物11
向支管中依次加入化合物9,即(1-溴-2,2-二氟乙基)苯(0.2mmol,1.0equiv),nan3(0.3mmol),dmf(2ml),氮气保护下,64℃搅拌15小时至原料反应完全,用二氯甲烷稀释,水洗涤,水相再次用二氯甲烷萃取。合并有机相,用饱和食盐水洗涤,无水硫酸钠干燥。真空旋干溶剂,用硅胶柱层析纯化得产品,为无色液体,收率为82%。
化合物11为(1-azido-2,2-difluoroethyl)benzene,其结构如下所示:
对化合物11进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,chloroform-d)δ7.41–7.26(m,5h),5.73(td,j=55.4,4.7hz,1h),4.64(ddd,j=12.0,9.8,4.7hz,1h).
13cnmr(101mhz,acetone)δ126.82(dd,j=4.0,2.3hz),124.38,123.86,122.88,109.79(t,j=246.83),60.92(dd,j=25.1,22.6hz).
19fnmr(376mhz,chloroform-d)δ-122.87(d,j=282.4hz),-124.24(d,j=282.6hz).
ei-ms:calcdforc8h7n3f2:183.0608,found:183.0609.
实施例39以化合物9为原料制备化合物12
向支管中依次加入化合物9,即(1-溴-2,2-二氟乙基)苯(0.2mmol,1.0equiv),对氨基苯甲醚(1.0mmol)碳酸钾(0.3mmol),dmf(2ml),100℃搅拌12小时至原料反应完全,用二氯甲烷稀释,水洗涤,水相再次用二氯甲烷萃取。合并有机相,用饱和食盐水洗涤,无水硫酸钠干燥。真空旋干溶剂,用硅胶柱层析纯化得产品,为无色液体,收率为48%。
化合物12为n-(2,2-difluoro-1-phenylethyl)-4-methoxyaniline,其结构如下所示:
对化合物12进行核磁共振和高分辨表征,其结果如下:
1hnmr(500mhz,chloroform-d)δ7.42-7.31(m,5h),6.71(d,j=8.4hz,2h),6.56(d,j=8.4hz,2h),5.97(t,j=55.2hz,1h),4.62(t,j=12.6hz,1h),4.14(s,1h),3.70(s,3h).
13cnmr(126mhz,cdcl3)δ152.92,139.98,135.59,128.87,128.55,127.81,115.94(t,j=247.0hz),115.50,114.81,61.20(t,j=21.7hz),55.67.
19fnmr(471mhz,chloroform-d)δ-125.29(d,j=279.2hz),-126.59(d,j=279.2hz).
ei-ms:calcdforc15h15nof2:263.1122,found:263.1127.
实施例40以化合物9为原料制备化合物13
向支管中依次加入化合物9(1-溴-2,2-二氟乙基)苯(0.2mmol,1.0equiv),苯酚(1.0mmol)碳酸钾(0.3mmol),dmf(2ml),75℃搅拌11小时至原料反应完全,用二氯甲烷稀释,水洗涤,水相再次用二氯甲烷萃取。合并有机相,用饱和食盐水洗涤,无水硫酸钠干燥。真空旋干溶剂,用硅胶柱层析纯化得产品,为无色液体,收率为49%。
化合物13为(2,2-difluoro-1-phenoxyethyl)benzene,其结构如下所示:
对化合物13进行核磁共振和高分辨表征,其结果如下:
1hnmr(500mhz,chloroform-d)δ7.49(d,j=7.3hz,2h),7.45–7.37(m,3h),7.24(t,j=7.7hz,2h),6.97(t,j=7.4hz,1h),6.91(d,j=8.1hz,2h),6.02(td,j=55.6,4.4hz,1h),5.28(td,j=10.2,4.2hz,1h).
13cnmr(126mhz,cdcl3)δ155.98,132.60,128.48,128.10,127.75,126.50,120.83,114.93,113.52(dd,j=247.3,244.9hz),78.02(t,j=25.1hz).
19fnmr(471mhz,chloroform-d)δ-124.91(d,j=285.2hz),-128.33(d,j=285.2hz).
ei-ms:calcdforc14h12of2:234.0856,found:234.0860.
实施例41以化合物2a为原料制备化合物14
向支管中依次加入2a化合物,即2-(2,2-difluoro-1-phenylethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.3mmol,1.0equiv),3ml甲醇溶剂,khf2(10m,3.0mmol)水溶液60℃搅拌3小时至原料反应完全,反应液旋干,加入丙酮通过硅藻土过滤,滤液旋干,所得粗产品复溶于少量乙腈加入乙醚析出白色固体产品,收率为59%。
化合物14为(2,2-difluoro-1-phenylethyl)trifluoro-l4-borane,potassiumsalt,其结构如下所示:
对化合物14进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,acetone-d6)δ7.26(d,j=7.6hz,2h),7.12(t,j=7.5hz,2h),7.01(t,j=7.3hz,1h),6.10(td,j=58.4,5.2hz,1h),2.21(d,j=29.5hz,1h).
13cnmr(126mhz,acetone)δ141.76(d,j=8.7hz),129.96,127.04,123.98,121.56(t,j=238.8hz).
19fnmr(376mhz,acetone-d6)δ-110.94(d,j=266.2hz),-113.09(d,j=266.4hz),-142.13(dd,j=107.0,49.6hz).
esi-ms:calcdforc8h7bf5[m-k]-:209.0559,found:209.0568.
实施例42以化合物6a为原料制备化合物15
向支管中依次加入6a化合物,即2-(1,1-difluoro-2-(p-tolyl)ethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.3mmol,1.0equiv),3ml甲醇溶剂,khf2(10m,3.0mmol)水溶液60℃搅拌3小时至原料反应完全,反应液旋干,加入丙酮通过硅藻土过滤,滤液旋干,所得粗产品复溶于少量乙腈加入乙醚析出白色固体产品,收率为35%。
化合物15为(2-([1,1'-biphenyl]-4-yl)-1,1-difluoroethyl)trifluoro-l4-borane,potassiumsalt,其结构如下所示:
对化合物15进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,dmso-d6)δ7.70–7.59(m,2h),7.56–7.50(m,2h),7.45(t,j=7.6hz,2h),7.38–7.29(m,1h),7.26(d,j=7.9hz,2h),2.92(t,j=21.5hz,2h).
19fnmr(376mhz,dmso-d6)δ-117.34,-148.15–-148.28(m).
13cnmr(101mhz,dmso)δ140.87,138.01,136.55,131.74,129.35,127.52,126.96,126.26,40.85(thesplitofthiscarboniscoveredbydmso).
esi-ms:calcdforc14h11bf5[m-k]-:285.0873,found:285.0882.
实施例43化合物[d]-2a(氘代化合物2a)的合成
向支管中依次加入(e)-6-甲基-2-(2-苯乙烯基-1-氘)-1,3,6,2-dioxazaborocane-4,8-二酮,碘苯二乙酸(0.3mmol,1.5equiv),2.0ml二氯甲烷溶剂,25℃剧烈搅拌下一次加入氟化氢吡啶(8.0mmol,40.0equiv),搅拌1分钟至原料反应完全,用二氯甲烷稀释,水洗涤,水相再次用二氯甲烷萃取。合并有机相,用饱和食盐水洗涤,无水硫酸钠干燥。真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为73%。
化合物[d]-2a为2-(2,2-difluoro-1-phenylethyl-1-d)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione,其结构如下所示:
对化合物[d]-2a进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,acetone-d6)δ7.39(d,j=7.6hz,2h),7.30(t,j=7.5hz,2h),7.23(t,j=7.3hz,1h),6.22(t,j=57.0hz,1h),4.29(d,j=17.0hz,1h),4.21(d,j=17.0hz,1h),4.08(d,j=16.9hz,1h),3.57(d,j=17.0hz,1h),3.12(s,3h).
13cnmr(101mhz,acetone)δ167.41(d,j=1.3hz),136.53(d,j=7.3hz),130.44,128.29,126.37,119.30(t,j=241.1),62.73,62.30(d,j=1.9hz),46.21(d,j=1.7hz).
19fnmr(376mhz,acetone-d6)δ-112.37(d,j=273.4hz),-115.12(d,j=273.7hz).
esi-ms:calcdforc13h13dbf2no4na[m+na]+:321.0929,found:321.0941.
实施例44以化合物2a为原料制备化合物16的合成
向支管中依次加入2a2-(2,2-difluoro-1-phenylethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.3mmol,1.0equiv),频哪醇(1.2mmol,4.0equiv),3ml四氢呋喃溶剂,2mh2so4(1.2mmol,4.0equiv)水溶液50℃搅拌12小时至原料反应完全,用乙酸乙酯稀释,水洗涤,水相再次用乙酸乙酯萃取。合并有机相,用饱和食盐水洗涤,无水硫酸钠干燥。真空旋干溶剂,用硅胶柱层析纯化得产品,为无色油状液体,收率为60%。
化合物16为2-(2,2-difluoro-1-phenylethyl)-4,4,5,5-tetramethyl-1,3,2-dioxaborolane,其结构如下所示:
对化合物16进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,chloroform-d)δ7.47–6.98(m,5h),6.08(ddd,j=57.8,56.2,6.4hz,1h),3.13–2.74(m,1h),1.24(d,j=12.3hz,12h).
13cnmr(101mhz,chloroform-d)δ134.12(dd,j=8.7,3.2hz),129.68,128.72,126.95,118.19(dd,j=243.7,240.4hz),84.26,24.60,24.52.
19fnmr(376mhz,chloroform-d)δ-111.73(d,j=272.5hz),-113.36(d,j=272.4hz).
11bnmr(128mhz,chloroform-d)δ31.49.
ei-ms:calcdforc14h19o2f210b:267.1482,found:267.1486.
实施例45以化合物6b为原料制备化合物17的合成
向支管中依次加入6b2-(1,1-difluoro-2-(p-tolyl)ethyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.3mmol,1.0equiv),频哪醇(0.3mmol,1.0equiv),3ml四氢呋喃溶剂,2mh2so4(1.2mmol,4.0equiv)水溶液50℃搅拌12小时至原料反应完全,用乙醚稀释,水洗涤,水相再次用乙醚萃取。合并有机相,用饱和食盐水洗涤,无水硫酸钠干燥。真空旋干溶剂得产物为黄色油状液体,收率为99%。
化合物17为2-(1,1-difluoro-2-(p-tolyl)ethyl)-4,4,5,5-tetramethyl-1,3,2-dioxaborolane,其结构如下所示:
对化合物17进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,chloroform-d)δ7.10(d,j=7.8hz,2h),7.02(d,j=7.8hz,2h),3.08(t,j=19.6hz,2h),2.23(s,3h),1.11(s,12h).
13cnmr(101mhz,chloroform-d)δ135.89,129.38,128.27(t,j=6.4hz),128.01,84.56,41.46(t,j=22.2hz),23.52,20.02.
19fnmr(376mhz,chloroform-d)δ-110.36.
11bnmr(128mhz,chloroform-d)δ27.86.
ei-ms:calcdforc15h21bf2o2:282.1603,found:282.1605.
实施例46以化合物6b为原料制备化合物18的合成
先按照实施例45利用原料制备化合物17,然后向支管中依次加入17,即2-(1,1-difluoro-2-(p-tolyl)ethyl)-4,4,5,5-tetramethyl-1,3,2-dioxaborolane(0.2mmol,1.0eq.),氧化银(0.4mmol,2.0eq.),甲醇钠(0.2mmol,1.0eq.),苯(2.0ml)和水(40μl),氮气保护下搅拌36小时至原料反应完全,反应液拌入硅胶旋干过硅胶柱,收率为54%。
化合物18为1-(2,2-difluoro-2-phenylethyl)-4-methylbenzene,其结构如下所示:
对化合物18进行核磁共振和高分辨表征,其结果如下:
1hnmr(500mhz,chloroform-d)δ7.43–7.31(m,5h),7.05(d,j=7.7hz,2h),6.98(d,j=7.7hz,2h),3.36(t,j=15.9hz,2h),2.31(s,3h).
13cnmr(126mhz,chloroform-d)δ136.97(t,j=26.4hz),136.88,130.49,129.59,129.55,128.88,128.17,125.23(t,j=6.2hz),121.97(t,j=243.7hz),45.44(t,j=28.5hz),21.11.
19fnmr(471mhz,chloroform-d)δ-95.03.
ei-ms:calcdforc15h14f2:232.1064,found:232.1060.
实施例47以化合物6b为原料制备化合物19的合成
先按照实施例45利用原料制备化合物17,然后向支管中依次加入17,即2-(1,1-difluoro-2-(p-tolyl)ethyl)-4,4,5,5-tetramethyl-1,3,2-dioxaborolane(0.2mmol,1.0eq.),氧化银(0.4mmol,2.0eq.),甲醇钠(0.2mmol,1.0eq.),噻吩(2.0ml)和水(40μl),氮气保护下搅拌36小时至原料反应完全,反应液拌入硅胶旋干过硅胶柱,收率为34%。
化合物19为2-(1,1-difluoro-2-(p-tolyl)ethyl)thiophene,其结构如下所示:
对化合物19进行核磁共振和高分辨表征,其结果如下:
1hnmr(500mhz,chloroform-d)δ7.37(d,j=5.0hz,1h),7.12(s,5h),7.05–6.95(m,1h),3.50(t,j=15.7hz,2h),2.35(s,3h).
13cnmr(126mhz,chloroform-d)δ138.93(t,j=31.5hz),137.12,130.45,129.28(t,j=3.8hz),128.99,126.89,126.75,126.47(t,j=5.4hz),120.30(t,j=241.5hz),45.38(t,j=28.1hz),21.13.
19fnmr(376mhz,chloroform-d)δ-83.32.
ei-ms:calcdforc13h12f2s:238.0628,found:238.0629.
实施例48以化合物6b为原料制备化合物20的合成
先按照实施例45利用原料制备化合物17,然后向支管中依次加入17,即2-(1,1-difluoro-2-(p-tolyl)ethyl)-4,4,5,5-tetramethyl-1,3,2-dioxaborolane(0.2mmol,1.0eq.),氧化银(0.4mmol,2.0eq.),甲醇钠(0.2mmol,1.0eq.),吡啶(2.0ml)和水(40μl),氮气保护下搅拌36小时至原料反应完全,反应液拌入硅胶旋干过硅胶柱,收率为41%。
化合物20为2-(1,1-difluoro-2-(p-tolyl)ethyl)pyridine,其结构如下所示:
对化合物20进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,chloroform-d)δ8.70(d,j=4.7hz,1h),7.69(td,j=7.8,1.7hz,1h),7.43(d,j=7.9hz,1h),7.33(dd,j=7.7,4.8hz,1h),7.04(s,4h),3.60(t,j=16.6hz,2h),2.29(s,3h).
13cnmr(101mhz,chloroform-d)δ154.58(t,j=29.0hz),149.32,136.85,136.79,130.50,129.55(t,j=4.0hz),128.91,124.58,120.60(t,j=243.4hz),120.29(t,j=4.6hz),42.35(t,j=26.1hz),21.08.
19fnmr(376mhz,chloroform-d)δ-98.81.
ei-ms:calcdforc14h13nf2:233.1016,found:233.1013.
实施例49以化合物6b为原料制备化合物21的合成
先按照实施例45利用原料制备化合物17,然后向支管中依次加入17,即2-(1,1-difluoro-2-(p-tolyl)ethyl)-4,4,5,5-tetramethyl-1,3,2-dioxaborolane(0.2mmol,1.0eq.),氧化银(0.4mmol,2.0eq.),甲醇钠(0.2mmol,1.0eq.),[2.2]二聚对二甲苯(1.0mmol,5.0eq.),1,2-二氯乙烷(2.0ml)and水(40μl),氮气保护下搅拌36小时至原料反应完全,反应液拌入硅胶旋干过硅胶柱,收率为37%。
化合物21为12-(1,1-difluoro-2-(p-tolyl)ethyl)-1,4(1,4)-dibenzenacyclohexaphane,其结构如下所示:
对化合物21进行核磁共振和高分辨表征,其结果如下:
1hnmr(500mhz,chloroform-d)δ7.02(d,j=7.8hz,2h),6.92(d,j=7.8hz,2h),6.60(d,j=5.6hz,2h),6.55–6.43(m,4h),6.40(dd,j=7.9,1.7hz,1h),3.42–3.32(m,1h),3.24–3.05(m,6h),3.03–2.91(m,2h),2.86(dddd,j=12.9,9.9,6.6,3.0hz,1h),2.29(s,3h).
13cnmr(101mhz,chloroform-d)δ139.08,138.55,138.30,135.86,135.76,135.66,133.40,132.79(t,j=23.3hz),132.32(d,j=2.3hz),131.64,131.11,129.44,128.63(t,j=3.6hz),128.36(d,j=6.5hz),128.25(d,j=6.6hz),127.68,121.14(t,j=246.3hz),45.09(t,j=28.4hz),34.92(d,j=2.2hz),34.35(d,j=4.8hz),34.26,34.18,20.05.
19fnmr(471mhz,chloroform-d)δ-92.84(d,j=243.7hz),-97.51(d,j=243.7hz).
ei-ms:calcdforc25h24f2:362.1846,found:362.1851.
实施例50以化合物6b为原料制备化合物22的合成
先按照实施例45利用原料制备化合物17,然后向支管中依次加入17,即2-(1,1-difluoro-2-(p-tolyl)ethyl)-4,4,5,5-tetramethyl-1,3,2-dioxaborolane(0.2mmol,1.0eq.),氧化银(0.4mmol,2.0eq.),甲醇钠(0.2mmol,1.0eq.),n-([1,1'-biphenyl]-2-yl)methanimine(1.0mmol,5.0eq.),1,2-二氯乙烷(2.0ml)and水(40μl),氮气保护下搅拌36小时至原料反应完全,反应液拌入硅胶旋干过硅胶柱,收率为40%。
化合物22为6-(1,1-difluoro-2-(p-tolyl)ethyl)phenanthridine,其结构如下所示:
对化合物22进行核磁共振和高分辨表征,其结果如下:
1hnmr(500mhz,chloroform-d)δ8.67(d,j=8.3hz,1h),8.63(d,j=8.3hz,1h),8.60(d,j=7.8hz,1h),8.25(d,j=8.9hz,1h),7.86(t,j=7.5hz,1h),7.82–7.71(m,2h),7.69(t,j=7.7hz,1h),7.42(d,j=7.8hz,2h),7.17(d,j=7.8hz,2h),4.03(t,j=18.3hz,2h),2.36(s,3h).
13cnmr(126mhz,chloroform-d)δ151.63(t,j=30.7hz),140.86,135.67,132.87,130.17,129.69,129.64,129.30(t,j=3.0hz),127.84,127.81,127.33,126.44,126.35(t,j=6.6hz),123.73,121.89,121.38(t,j=242.8hz),121.24,120.98,40.27(t,j=24.0hz),20.09.
19fnmr(471mhz,chloroform-d)δ-90.23.
ei-ms:calcdforc22h17nf2:333.1329,found:333.1325.
实施例51以化合物2a为原料制备化合物23的合成
先按照实施例41制备化合物14,然后向支管中依次加入cu(otf)2(18mg,0.0504mmol),1,10-二氮杂菲(9mg,0.054mmol)和1,2-二氯乙烷(dce,1ml),氮气保护下,60℃搅拌2小时,冷却至室温,迅速加入化合物14(2,2-difluoro-1-phenylethyl)trifluoro-l4-borane,potassiumsalt(62mg,0.252mmol),二氧化锰(65mg,0.756mmol),1,1-二苯乙烯(dpe)(86mg,0.504mmol)和1,2-二氯乙烷(1.52ml).置换氩气两分钟,60℃加热48h至原料反应完全,反应液拌入硅胶旋干过硅胶柱,收率为31%.
化合物23为(4,4-difluorobut-1-ene-1,1,3-triyl)tribenzene,其结构如下所示:
对化合物23进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,chloroform-d)δ7.45–7.18(m,13h),7.11(dd,j=7.4,2.0hz,2h),6.43(d,j=10.5hz,1h),5.91(td,j=56.5,3.6hz,1h),3.88(dddd,j=17.4,14.1,10.5,3.6hz,1h).
13cnmr(126mhz,chloroform-d)δ146.05,141.68,139.12,137.25(t,j=2.18hz),129.67,128.85,128.64,128.41,128.23,127.74,127.59,127.56,127.45,122.31(t,j=4.6hz),117.11(t,j=245.7hz),49.79(t,j=20.5hz).
19fnmr(376mhz,chloroform-d)δ-118.41(d,j=276.4hz),-121.21(d,j=276.4hz).
ei-ms:calcdforc22h18f2:320.1377,found:320.1380.
实施例52以化合物6b为原料制备化合物24的合成
先按照实施例45利用原料制备化合物17,然后向支管中依次加入17,即2-(1,1-difluoro-2-(p-tolyl)ethyl)-4,4,5,5-tetramethyl-1,3,2-dioxaborolane(56.4mg,0.2mmol),cubr2(134mg,0.6mmol)和四氢呋喃/水(1ml/1ml),氩气条件下,50℃搅拌18小时.反应完全后向反应管中加入饱和nacl水溶液(5ml),乙醚(10ml×3)萃取.有机层无水硫酸钠干燥后,拌硅胶真空旋蒸,低沸石油醚过柱,收率为41%。
化合物24为1-(2-bromo-2,2-difluoroethyl)-4-methylbenzene,其结构如下所示:
对化合物24进行核磁共振和高分辨表征,其结果如下:
1hnmr(500mhz,chloroform-d)δ7.22(q,j=8.0hz,4h),3.64(t,j=14.1hz,2h),2.39(s,3h).
13cnmr(126mhz,chloroform-d)δ138.04,130.48,129.30,128.34(t,j=3.0hz),121.94(t,j=305.9hz),49.96(t,j=22.3hz),21.19.
19fnmr(471mhz,chloroform-d)δ-44.72.
ei-ms:calcdforc9h9f2br:233.9856,found:233.9852.
实施例53化合物25的合成
在手套箱中向光反应管加入对溴苯甲酸甲酯(0.2mmol,2equiv),(1-(4-(tert-butyl)phenyl)-2,2-difluoroethyl)trifluoro-borane(化合物2f衍生的三氟硼酸钾盐)(0.1mmol,1equiv),和ir(dfcf3ppy)2(bpy)pf6(0.0030g,0.0030mmol)。另一反应瓶加入nibr2·dme(0.009g,0.03mmol),2,2′-双[(4s)-4-苄基-2-噁唑啉](0.014g,0.045mmol)和1.0ml1,4-二氧六环,剧烈振摇至完全溶解,将溶液转移入光反应管,再加入2,6-二甲基吡啶(0.3mmol,3equiv),拧紧瓶盖,迅速转移出手套箱,置于26w×2的紧凑型荧光灯下,室温搅拌48小时后,拌硅胶真空旋蒸,收率为42%。
化合物25为methyl4-(1-(4-(tert-butyl)phenyl)-2,2-difluoroethyl)benzoate,其结构如下所示:
对化合物25进行核磁共振和高分辨表征,其结果如下:
1hnmr(400mhz,chloroform-d)δ7.93(d,j=8.4hz,2h),7.31(dd,j=13.5,8.4hz,4h),7.14(d,j=8.4hz,2h),6.24(td,j=55.6,4.3hz,1h),4.37(td,j=15.8,4.3hz,1h),3.83(s,3h),1.23(s,9h).
13cnmr(101mhz,cdcl3)δ165.74,149.65,141.26,132.20(t,j=3.5hz),128.84,128.23,128.15,127.55,124.75,115.60(t,j=244.0hz),53.54(t,j=20.9hz),51.13,33.47,30.24.
19fnmr(471mhz,chloroform-d)δ-117.51(d,j=279.5hz),-118.63(d,j=279.6hz).
ei-ms:calcdforc20h22f2o2:332.1588,found:332.1560.
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,对于本领域的普通技术人员来说,在上述说明及思路的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!