miR-129及其靶基因在检测肺腺癌中的应用的制作方法
本发明涉及分子诊断领域,具体涉及mir-129及其靶基因在检测肺腺癌中的应用。
背景技术:
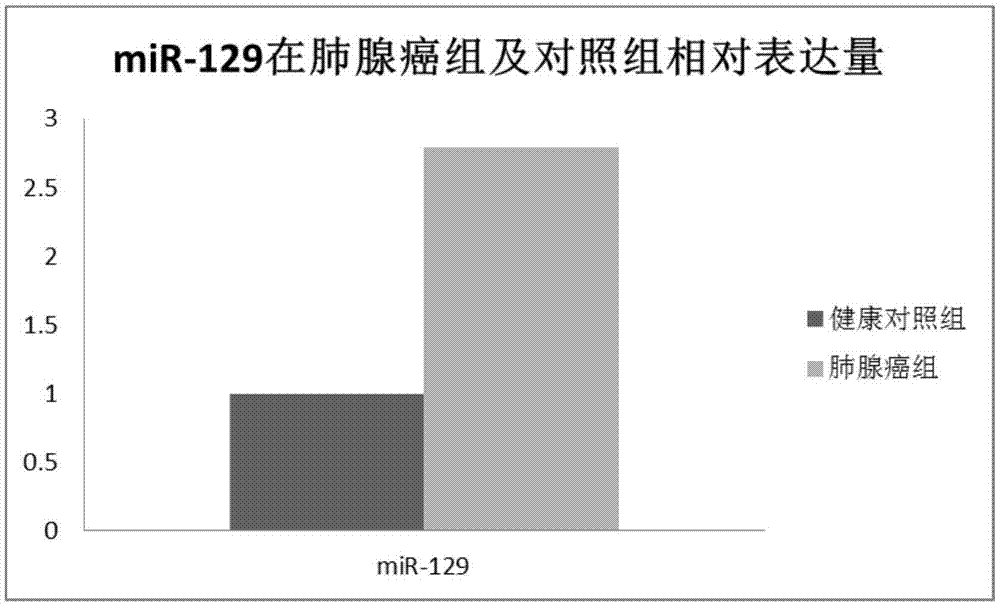
:mirna是一段大约由19到25个核苷酸组成的非编码小rna,通过对其靶mrna的翻译抑制或者降解在动植物体内发挥重要的调节作用。mirna是多细胞生物体内众多基因调控分子的重要组成部分之一,同时很可能影响着许多蛋白编码基因的表达输出。mirna按照其在肿瘤的发生发展中的调控作用可分为致癌mirna和抑癌mirna,调控癌细胞的增殖、侵袭、凋亡及血管生成情况。mir-129在多种常见肿瘤中呈现高表达,如胃癌和肺癌,或低表达,如乳腺癌和食管鳞状细胞癌,而且这种异常表达与肿瘤的发生发展有密切联系。mir-129通过作用于性别决定区y框蛋白4、细胞周期蛋白依赖激酶6、含缬酪肽蛋白和磷脂酰肌醇蛋白聚糖-3等多种靶基因而在肿瘤发生、发展过程中起着重要作用。但其与肺腺癌的关系未见于报道。肺腺癌是非小细胞肺癌(nsclc)中发病率较高的一种,目前nsclc的治疗主要采用手术为主,结合放疗、化疗、生物免疫治疗等治疗手段的综合治疗,虽然治疗手段不断改进,但nsclc的五年生存率仍很低,仅为15%左右。寻找新型肺腺癌诊断相关的肿瘤标记物或新的治疗策略对于肺腺癌的控制显得至关重要。本发明基于高通量测序方法,对6例肺腺癌患者的癌组织及癌旁组织进行二代测序,获得其mirna和mrna的表达数据,同时,结合生物信息学分析和文献调研,从候选的mirna中挑选出mir-129及其靶基因mfap3l和rph3a进行rt-pcr验证及数据库验证,结果显示mir-129及其靶基因和肺腺癌具有很好的相关性,本发明为临床提供新的肺腺癌基因诊断和治疗的重要靶点。技术实现要素:本发明的目的在于提供一种肺腺癌诊断试剂,所述肺腺癌诊断试剂能够检测样本中mir-129和/或其前体的转录情况,或者检测样本中mir-129调控的靶基因的转录情况,所述靶基因为mfap3l或rph3a。所述mir-129序列为seqidno1:5’-cuuuuugcggucugggcuugc-3’。mir-129前体序列为seqidno2(mir-129-1):5’-ggaucuuuuugcggucugggcuugcuguuccucucaacaguagucaggaagcccuuaccccaaaaaguaucu-3’;或seqidno3(mir-129-2):5’-ugcccuucgcgaaucuuuuugcggucugggcuugcuguacauaacucaauagccggaagcccuuaccccaaaaagcauuugcggagggcg-3’。所述的样本为肿瘤组织或外周血。进一步,肺腺癌诊断试剂是采用高通量测序方法和/或定量pcr方法和/或探针杂交方法检测样本中mir-129和/或其前体的转录。进一步,肺腺癌诊断试剂是采用高通量测序方法和/或定量pcr方法和/或探针杂交方法检测样本中mir-129的靶基因的转录或采用免疫方法检测样本中其mir-129调控的靶基因的表达情况的试剂。优选的,靶基因为mfap3l或rph3a。优选采用northern杂交方法、mirna表达谱芯片、核酶保护分析技术、rake法、原位杂交、基于微球的流式细胞术检测样本中mir-129和/或其前体的转录。优选采用northern杂交方法、核酶保护分析技术、rake法、原位杂交、基于微球的流式细胞术检测样本中mir-129调控的靶基因的转录。优选的,靶基因为mfap3l或rph3a。优选的,所述的定量pcr方法包括特异性扩增mir-129和/或其前体的引物;所述的基于探针杂交方法包括与mir-129和/或其前体的核酸序列杂交的探针。优选的,所述的定量pcr方法包括特异性扩增mir-129调控的靶基因的引物;所述的基于探针杂交方法包括与mir-129调控的靶基因的核酸序列杂交的探针。优选的,靶基因为mfap3l或rph3a。进一步,扩增mir-129的引物为序列seqidno4。进一步,扩增mfap3l的引物序列为seqidno5和seqidno6。进一步,扩增rph3a的引物序列为seqidno7和seqidno8。本发明的目的还在于提供上述肺腺癌诊断试剂在制备肺腺癌诊断制剂中的应用。本发明的目的在于提供一种治疗肺腺癌药物组合物,其特征在于,所述药物组合物包含:(a)化合物或组合物,所述化合物下调mir-129的转录和/或抑制mir-129的活性;(b)药剂学上能接受的载体。进一步,采用反义寡核苷酸、antagomirs、mirna海绵、mirnaerasers、targetmasking和/或多靶点反义寡核苷酸的方法下调mir-129的转录和/或阻断mir-129的活性。mir-129抑制剂在制备治疗肺腺癌药物中的应用。mfap3l或rph3a的促进剂在制备治疗肺腺癌药物中的应用。定义:现阶段检测mirna的表达水平的方法主要包括基于高通量测序技术、基于核苷酸杂交和基于pcr的mirna检测方法。基于探针杂交技术的mirna检测方法是一种直接检测法,不需要对样本rna进行预扩增,包括northern杂交方法、mirna表达谱芯片、核酶保护分析技术、rake法、原位杂交、基于微球的流式细胞术等技术。(1)northern杂交又称rna印迹技术为最经典的检测真核生物rna大小,估计其丰度的实验方法。基本原理如下:首先在载体(如硅片、微球或膜等)上固定mirna样本,再与经过标记的探针杂交,洗涤多余的杂交探针后进行信号检测;也可以在载体上先固定与靶mirna序列互补的dna探针,然后与经过标记的样本mirna杂交,再进行信号检测。信号标记的方法包括同位素标记、荧光标记和纳米金标记等。(2)mirna表达谱芯片原理同样是使用标记探针检测固相支持物上的目标分子。通过设计芯片上mirna基因及内参序列,可精确分析出样品中相应mirna的表达水平。基因芯片具有高通量的优点,可以一次在同一样本中检测出几百个基因的全部表达。luminex公司研制的液相芯片(liquidchip)又称多功能悬浮点阵(multianalytesuspensionarray,masa),是出的新一代生物芯片技术。液相芯片体系由许多小球体为主要基质构成,每种小球体上固定有不同的探针分子,为了区分不同的探针,每一种用于标记探针的球形基质都带有一个独特的色彩编号,将这些小球体悬浮于一个液相体系中,就构成了液相芯片系统。该系统可以对同一个微量样本中的多个不同分子同时进行快速的定性、定量分析,这种检测技术被称为fmap(flexiblemultianalyteprofiling)技术。分子杂交在悬浮溶液中进行,检测速度极快。(3)核酶保护分析技术(rpa)mirna的检测还可以采用核酶保护分析技术,将标记好的探针和待测rna样本混合,热变性后杂交,未杂交的rna和多余的探针用单链核酸酶消化,热失活核酸酶后纯化受保护的rna分子,最后通过变性page电泳分离探针,显色。这种基于液相杂交的新方法简单快速,灵敏度高,但也只能用于分析已知mirna。(4)rake法rake法(rnaprimedarraybasedklenowemzyme)是在mirnamicroarray的基础上利用dna聚合酶i的klenow片段,使mirna与固定的dna探针杂交的方法。rake可以敏感特异地检测mirna,适用于大量快速的筛选所有己知的mirna。能够在特定的细胞和肿瘤中检测mirna表达谱情况。不仅如此,rake法还可以从由福尔马林固定了的石蜡包埋的组织中分离出mirna并对其进行分析,为从存档标本中分析mirna开启了希望之门。(5)原位杂交(insituhybridization)原位杂交技术可直观了解mirna表达方式,是观测mirna时空表达的一种较简便的方法,常标记方式包括地高辛、生物素、荧光标记等。锁定核酸基础上的原位杂交(lockednucleicacid(lna)basedinsituhybridization(lna-ish))是当前应用较多的探针方式。(6)基于微球的流式细胞术(bead-basedflowcytometry)是一种液相芯片技术,该方法将流式细胞检测与芯片技术有机地结合起来,兼有通量大、检测速度快、灵敏度高和特异性好等特点。(7)实时荧光定量pcr技术(real-timepcr,rt-pcr)荧光检测pcr仪可对整个pcr过程中扩增序列的累积速率绘制动态变化曲线。在反应混合体系中靶序列的起始浓度越大,要求获得扩增产物某特定产量的pcr循环数(一般用特定阈值循环数ct来表达)越少。由于mirna长度仅为22nt,传统的qrt-pcr不适合扩增如此短的片段。现今有几种用于mirna的实时定量pcr方法,如加尾法、颈环法等。颈环法是一种理想的mirna检测qrt-pcr方法:首先设计特殊的茎环结构引物,以待测mirna为模板逆转录合成cdna第一链,该cdna一端为茎环状引物,茎环状结构被打开便增加了cdna的长度,随后以合成的cdna为模板设计引物进行实时定量pcr扩增。qrt-pcr具有特异性高、灵敏度好、快速简单等多种优点。(8)测序法大部分已知的mirna都是通过cdna克隆测序发现和鉴定的。该法需要先构建mirna的cdna文库,再进行pcr扩增,扩增产物随后克隆到表达载体上测序。takada开发了一种改进的扩增克隆法(mirnaamplificationprofiling,mrap),mrap法先在mirna的3’端连上接头,然后用与接头互补的反转录引物反转录。因为特定的反转录酶具有末端脱氧核苷酸酶活性,一些核苷酸(主要是脱氧胞苷酸)会连接到反转录出的cdna链的3’末端。当5’端接头与cdna链的poly(c)粘性末端退火后,加入一对共用引物即可实现对cdna的pcr扩增。由于mrap高度灵敏,可以直接用克隆和测序技术检测少量组织中mirna的表达量。标签序列克隆法是一种在在基因表达系列分析(sage)技术的基础上发展了检测效率更高的mirage(mirnasage)克隆法,该法通过生成大的串联子,通过单个测序反应可检测多个mirna,明显提高了检测效率。高通量测序(high-throughputsequencing)又称下一代测序技术(nextgenerationsequencing)是对传统测序一次革命性的改变,一次对几十万到几百万条dna分子进行序列测定,极大提高了测序效率。这类大规模测序技术极大的提高了多个物种遗传信息的解读速度,为获取所有mirna的序列信息,解密mirna图谱提供了保证。同时高通量测序使得对一个物种的转录组和基因组进行细致全貌的分析成为可能,所以又被称为深度测序(deepsequencing)。高通量测序平台的代表是罗氏公司(roche)的454测序仪(rochgsflxsequencer),illumina公司的solexa基因组分析仪(illuminagenomeanalyzer)和abi的solid测序仪(abisolidsequencer)。基于rna的microrna功能获得性技术即通过外源性补充mirnas合成的前体物质来升高mirnas的水平。例如,可以人工合成与内源性mirna序列一致的短发夹样rna(shorthairpinrna,shrna),由聚合酶ii或iii做启动子,以病毒为载体转染细胞,被dicer酶修饰后载入risc发挥作用,相当于升高pre-mirna的水平,作用效果稳定而持久。基因特异性mirmimics技术该技术避免了mirna与基因的非特异性作用。这种人工合成的与靶基因3’utr互补结合的特异性寡核苷酸链,能够起到与mirna相同的转录后调节作用。包含在本发明的药剂学组合物的药剂学上许可的载体为在制剂时通常利用的载体,该载体包含乳糖(lactose)、右旋糖(dextrose)、蔗糖(sucrose)、山梨醇(sorbitol)、甘露醇(mannitol)、淀粉、阿拉伯橡胶、磷酸钙、藻酸盐(alginate)、凝胶(gelatin)、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮(polyvinylpyrrolidone)、纤维素(cellulose)、水、糖浆、甲基纤维素(methylcellulose)、羟基苯甲酸甲酯(methylhydroxybenzoate)、丙基羟基苯甲酸丙酯(propylhydroxybenzoate)、滑石、硬脂酸镁(stearicacidmagnesium)及矿物油(mineraloil)等,但并非局限于此。本发明的药剂学组合物根据本发明所属
技术领域:
的普通技术人员可以容易实施的方法,利用药剂学上能接受的载体和/或赋形剂来进行制剂化,从而能够以单位用量形态制备或者内装在多容量容器内来制备。此时,剂型是油性或者水性介质中的溶液、悬浮液或乳化液形态,或者也可以是浸膏剂、粉末剂、颗粒剂、片剂或者胶囊剂形态,还可以包括分散剂或者稳定剂。附图说明图1是mir-129在肺腺癌组及对照组相对表达量图图2是mfap3l、rph3a在肺腺癌组及对照组相对表达量图图3是mfap3l诊断肺腺癌的roc曲线图图4是rph3a诊断肺腺癌的roc曲线图图5是mfap3l、rph3a联合诊断肺腺癌的roc曲线图具体实施方式下面结合具体实施例,进一步阐述本发明,仅用于解释本发明,而不能理解为对本发明的限制。本领域的普通技术人员可以理解:在不脱离本发明的原理和宗旨的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由权利要求及其等同物限定。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照厂商所建议的条件实施检测。实施例1样本收集6例肺腺癌组织及癌旁组织均来自医院手术切除的标本,所有标本均在离体10分钟以内放入液氮罐中,随后转移至-80℃冰箱中储存。实施例2总rna提取1提取方法1)取80mg组织块,加入800μllysis/binding缓冲液,使用匀浆器对组织块进行匀浆。匀浆的过程中样品要置于冰上保持低温状态。2)再加入1/10体积homogenateadditive到上述已经匀浆的组织样品中,冰上放置10min。3)加入与lysis/binding缓冲液等量体积的水饱和酚,震荡45s,10000×g室温离心5min。4)小心取出上清到新的试管中,加入1.25倍体积的无水乙醇,混匀后,移入纯化柱中,10,000×g,离心15s,倒掉收集管中的液体。由于柱子的最大的体积只有700μl,因此重复此步操作,直到所有的上清都过滤完成。5)向离心柱子中加入700μlmirna洗脱液1,室温,10000×g,离心15s,倒掉收集液,换用新的收集管。6)再用500μl洗脱液2/3加入离心柱中,10000×g,离心10s,重复这一步骤一次。7)离心1min,10000×g,弃去多余的液体。8)将上述液体转移到新的离心管,加100μl95℃预热的depc处理30s,10000×g,离心。9)使用nanodrop测定rna浓度和260nm/280nm的比值。10)得到的rna保存于-80℃冰箱。2提取标准测定rna浓度和260nm/280nm的比值:总rna的纯度要求是od260/od280值应在1.8至2.2之间;rna完整性的检测:用1%琼脂糖凝胶电泳检测rna的完整性;根据测序公司的要求,小rna测序总量3μg以上,浓度在300ng/μl以上。实施例3测序及数据分析由测序公司进行测序文库的建立及上机测序,所使用的测序仪为illumina公司的hiseq2000测序仪。根据测序公司提供的数据进行统计学分析,fdr<0.001,log2(fc)绝对值>1,两组count平均值之差大于100。对差异表达mirna人为挑选过滤中差异表达明显的mirna,与肺腺癌相关性非常好的分子标志物mir-129进入我们的研究范围,mir-129在肺腺癌癌组织中的表达量高于癌旁组织。识别mirna靶基因是研究特定组织和细胞mirna功能的非常重要的步骤。利用包括rna22,miranda,mirdb,mirwalk,pictar2及targetscan这些算法预测差异表达mir-129的靶基因,结合测序中mrna差异表达的结果,从靶向且负相关的差异表达mrna中挑选了效果较为突出的mfap3l、rph3a进行后续的验证。实施例4real-timepcr检测肺腺癌外周血样本中mirna及其靶基因的表达1样品采集:26例肺腺癌病人外周血样本和30例健康对照外周血样本均来医院,患病组均是经过病理检测确诊。2总rna提取:相关实验物品的去rnase的处理:①将所有玻璃器皿应用前均用depc冲洗侵泡,120℃高压20min,180℃高温烤干2小时以上。②将塑料器皿(如:ep管/枪头)使用前需用0.1%depc水侵泡过夜,后控干液体,120℃高压20min,烤箱烤干备用。白细胞分离(1)取2m1抗凝外周血(采血时间不超过3h);(2)加入等体积无菌pbs于外周血中充分混合,形成细胞悬液;(3)加入4m1淋巴细胞分离液于另一离心管;(4)吸取4m1细胞悬液沿管壁轻轻加入到淋巴细胞分离液表面(注意勿与淋巴细胞分离液混合)。离心1500rpm20min;(5)用吸管轻轻吸出界面层(白膜)入另一离心管中。无菌冷pbs洗2次,最后1次洗涤可以将细胞悬液移入ep管中,离心去上清,用于提取rna。采用reagent进行样本rna提取,实验操作按产品说明书进行,具体操作见说明书。rna质量判定标准:rna样本的od260/od280值为1.7-2.2之间;总rna电泳图谱有清晰的28s、18s条带;70℃水浴保温1小时后的电泳图谱与水浴保温前的图谱无明显差异。3mirna逆转录表1rt体系组分浓度体积(μl)totalrna-1μgmiscripthispecbuffer5×4nucleicsmix10×2miscriptreversetranscriptasemix-2nuclease-freeh2o-补平至20abi9700型pcr仪上37℃保温60min使逆转录反应完全后,95℃5min终止反应。加入80μlnuclease-freeh2o稀释至100μl储存在-20℃冰箱,用于后续实验。4荧光定量pcr表2rt-pcr体系mirnas的表达检测每次设置3个平行管反应,microrna-specificprimer引物见表3,以通用的snrnau6作为内参。表3microrna-specificprimer引物引物名称编号序列mir-129引物seqidno4ctttttgcggtctgggcttgcpcr程序:95℃10min;40个循环(95℃10s,60℃30s)。循环结束后利用熔解曲线检测产物特异性:从60℃缓慢升温至97℃,每℃采集5次荧光信号。5rt-pcr检测mfap3l、rph3a的表达逆转录采用iiireversetranscriptase(invitrogen,货号18080-044)进行cdna反转录。使用逆转录试剂盒,用逆转录缓冲液对lμg总rna进行逆反录合成cdna。rt体系的配制:5×逆转录缓冲液5μl,10mmol/ldntp1.25μl,0.1mmol/ldtt2.5μl,30μmmol/loligodt2μl,200u/μlmmlv1.25μl,模板rna1μg,加入灭菌水至总体系25μl。42℃孵育1小时,72℃10分钟,短暂离心。cdna保存放-20℃冰箱备用rna。荧光定量pcr根据genbank提供的序列设计引物,送公司进行合成。mfap3l(nm_001009554.3):上游引物:5’-tagttacgaggcttgttat-3’(seqidno5)下游引物:5’-cactcaatcagacaggta-3’(seqidno6)扩增产物164bprph3a(nm_001143854.1):上游引物:5’-tctctctgtctctctttg-3’(seqidno7)下游引物:5’-tctctactgttccatagc-3’(seqidno8)扩增产物97bp表4mrna的rt-pcr体系的配制反应体系:用powergreenpcrmastermix(invitrogen,货号4367659)进行扩增,内参选gapdh,实验操作按产品说明书进行。扩增程序为:95℃10min,(95℃15sec,55℃60sec)×35个循环。5统计学分析采用originpro8.1软件进行分析。统计方法均数间比较采用t检验,p<0.05(差异显著)和p<0.01(差异非常显著)定为有统计学意义。结果显示与健康对照相比,肺腺癌组mir-129显著升高,为对照组的2.8倍(见图1),而mfap3l、rph3a在肺腺癌组中相对低表达,分别为对照组的0.24倍和0.28倍(见图2)。rt-pcr结果与高通量数据分析结果一致,显示本发明中的mir-129、mfap3l、rph3a是非常好的肺腺癌诊断标志物,具有很好的临床应用前景。实施例5诊断效能的评价分析对于单个分子或是诊断模型的效能评价的方法为建立受试者工作特征(receiveroperatingcharacteristic,roc)曲线,通过计算曲线下面积(areaundercurve)来判断诊断的能力。roc曲线下的面积值在1.0和0.5之间,在auc>0.5的情况下,auc越接近于1,说明诊断效果越好,auc在0.5-0.7时有较低准确性,auc在0.7-0.9时有一定准确性,auc在0.9以上时具有较高准确性。我们将tcga数据库中有关肺腺癌的数据下载,获得数据集(515例患者的mrna数据),进而进行分析,结果显示,mfap3l、rph3a诊断肺腺癌的auc为0.924和0.838(见图3和图4),二者联合诊断肺腺癌的auc为0.926(见图5),联合诊断肺腺癌具有一定叠加效果。序列表<110>四川大学华西医院<120>mir-129及其靶基因在检测肺腺癌中的应用<160>8<170>siposequencelisting1.0<210>1<211>21<212>rna<213>人工序列(artificialsequence)<400>1cuuuuugcggucugggcuugc21<210>2<211>72<212>rna<213>人工序列(artificialsequence)<400>2ggaucuuuuugcggucugggcuugcuguuccucucaacaguagucaggaagcccuuaccc60caaaaaguaucu72<210>3<211>90<212>rna<213>人工序列(artificialsequence)<400>3ugcccuucgcgaaucuuuuugcggucugggcuugcuguacauaacucaauagccggaagc60ccuuaccccaaaaagcauuugcggagggcg90<210>4<211>21<212>dna<213>人工序列(artificialsequence)<400>4ctttttgcggtctgggcttgc21<210>5<211>19<212>dna<213>人工序列(artificialsequence)<400>5tagttacgaggcttgttat19<210>6<211>18<212>dna<213>人工序列(artificialsequence)<400>6cactcaatcagacaggta18<210>7<211>18<212>dna<213>人工序列(artificialsequence)<400>7tctctctgtctctctttg18<210>8<211>18<212>dna<213>人工序列(artificialsequence)<400>8tctctactgttccatagc18当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1