一种耐药异质性循环肿瘤细胞捕获与基因分析的试剂、装置和方法与流程
本发明涉及生物检测领域,特别一种基于微孔芯片的核酸适体修饰的磁珠组合及其用于耐药异质性循环肿瘤细胞的捕获与基因分析的方法。
背景技术:
肺癌是发病率和死亡率增长最快,对人类健康和生命威胁最大的恶性肿瘤之一。其中,非小细胞肺癌分为鳞癌,腺癌和大细胞癌,占肺癌总数比例的85%。目前,非小细胞肺癌的治疗方法主要是手术切除,化疗和放疗。由于肿瘤容易复发和转移,采取治疗手段后实时监测肿瘤进程,才能及时修改治疗方案,有效提高患者的生存率。
循环肿瘤细胞是从肿瘤原发病灶或转移灶中脱落并进入血液循环系统的肿瘤细胞。通过计数外周血中循环肿瘤细胞的数目可以实时监测癌症的发展进程,评估患者的预后,尤其适用于手术切除肿瘤病灶的患者无法提供病理切片的情况。但是,循环肿瘤细胞的数目是非常稀少的,1ml血液中仅仅有1-10个循环肿瘤细胞,同时,白细胞的数目为106-107左右。另外,循环肿瘤细胞存在异质性,造成不同患者,同一患者不同部位的肿瘤细胞,甚至同一部位不同肿瘤细胞之间的大小,蛋白表达量等均有不同。同时,肿瘤细胞异质性也是细胞产生耐药性的主要原因之一,还有可能导致化疗后肿瘤细胞产生基因突变。此时,仅仅依靠计数无法获得有关基因层面更详细的信息,也就无法确定如何进行针对性的治疗。虽然,循环肿瘤细胞单细胞基因分析为全面准确地获得肿瘤“实时切片”提供了机会。然而,在不受白细胞干扰的前提下,从病人血样中获得完整的异质性循环肿瘤细胞,并进行基因层面的分析仍是挑战。
目前,核酸适体或抗体结合纳米颗粒、微流芯片或者纳米结构基底等策略已被大量用于循环肿瘤细胞的分离和表征。但是,由于已有的大部分方法忽略了循环肿瘤细胞的异质性,仅采用一种抗体对循环肿瘤细胞进行捕获,造成了循环肿瘤细胞的损失,也使后续的基因分析存在一定的片面性。虽然有少数报道将多种抗体用于识别,但由于抗体高成本,靶标范围受限和合成复杂等缺点,使得这些方法无法进行大范围的临床普及。核酸适体是经指数富集配体系统进化技术筛选出的能特异性结合细胞、细菌、蛋白质或其他小分子的寡聚核苷酸片段。与抗体相比,核酸适体更加容易合成和保存,并且对靶标有很强的特异性,被称为“化学抗体”。通过将核酸适体连接在磁珠上,可以实现对循环肿瘤细胞的捕获,同时易于分离,并且保证了细胞的完整性,方便实现后续的基因分析。虽然,已有一些研究采用核酸适体修饰的磁珠对循环肿瘤细胞进行捕获,但在这些方法中均未实现对异质性循环肿瘤细胞的捕获。另外,目前还未见报道针对耐药异质性循环肿瘤细胞的捕获。除此之外,由于血液组分的复杂性,已有的基于核酸适体修饰磁珠的捕获方法都不可避免的受到白细胞的干扰而未能实现从病人血样中捕获循环肿瘤细胞进行单细胞水平的基因分析。因此,开发高效的对异质性循环肿瘤细胞的分离分析技术仍需进一步的探索。
技术实现要素:
为解决上述问题,一种对顺铂耐药的循环肿瘤细胞具有高亲和力的核酸适体以及所述核酸适体修饰的磁珠。本发明所述核酸适体或磁珠与现有技术已知的其它核酸适体或磁珠组合使用可提高循环肿瘤细胞的捕获效率,进一步利用微孔芯片二次纯化可提高循环肿瘤细胞的纯度,满足基因分析的要求。还特别提供了一种高效捕获耐药异质性非小细胞肺癌循环肿瘤细胞、进行基因分析的方法及试剂。利用本发明中的核酸适体修饰的磁珠组合可以捕获耐药异质性非小细胞肺癌的循环肿瘤细胞,并通过外加磁场进行分离,后通过ck和cd45抗体染色,分别标记循环肿瘤细胞和非特异性捕获下来的白细胞,然后将分离得到的细胞放置在微孔芯片上进行二次纯化,在荧光显微镜下寻找到含有循环肿瘤细胞的微孔,利用显微操作将循环肿瘤细胞从微孔中取出,并完成基因突变等方面的基因分析。利用本发明提出的方法,可实现非小细胞肺癌患者在化疗耐药后的循环肿瘤细胞高效捕获和基因分析。
一方面,本发明提供一种与顺铂耐药的循环肿瘤细胞具有高亲和力的核酸适体,其特征在于所述核酸适体为ap2,其碱基序列如seqidno:2所示。
第二方面,本发明提供一种用于循环肿瘤细胞捕获的磁珠,其特征在于所述磁珠连接有本发明所述核酸适体ap2。
本发明所述磁珠,其中通过核酸适体上标记的生物素与磁珠表面标记的链霉亲和素之间的相互结合实现核酸适体与磁珠的连接,优选磁珠的直径为200±30nm。
第三方面,本发明提供一种核酸适体组,其至少包含两种核酸适体,其中至少一种核酸适体与顺铂耐药循环肿瘤细胞具有高亲和力,并且至少一种核酸适体与非耐药循环肿瘤细胞具有高亲和力。
本发明所述核酸适体组,其中所述与顺铂耐药循环肿瘤细胞具有高亲和力的核酸适体为ap2,其碱基序列如seqidno:2所示。
本发明所述核酸适体组,其中所述与非耐药循环肿瘤细胞具有高亲和力的核酸适体为ap1,其碱基序列如seqidno:1所示。
第四方面,本发明提供一种磁珠组,其特征在于至少包含两种磁珠,其中至少一种磁珠连接有与顺铂耐药循环肿瘤细胞具有高亲和力的核酸适体,并且至少一种磁珠连接有与非耐药循环肿瘤细胞具有高亲和力的核酸适体。
本发明所述磁珠组,其中连接到磁珠上与顺铂耐药循环肿瘤细胞具有高亲和力的核酸适体为ap2,其碱基序列如seqidno:2所示。
本发明所述磁珠组,其中连接到磁珠上与非耐药循环肿瘤细胞具有高亲和力的核酸适体为ap1,其碱基序列如seqidno:1所示。
本发明所述磁珠,其中通过核酸适体上标记的生物素与磁珠表面标记的链霉亲和素之间的相互结合实现核酸适体与磁珠的连接,优选磁珠的直径为200±30nm。
第五方面,本发明提供一种核酸适体的衍生物,其可替代本发明所述核酸适体用于核酸适体组、磁珠、磁珠组。
所述核酸适体衍生物是将所述核酸适体进行如下修饰或改造得到的:
a)将所述核酸适体删除部分或增加部分互补的核苷酸,得到的与所述核酸适体具有相同功能的核酸适体的衍生物。
b)将所述核酸适体进行核苷酸取代或部分修饰,得到的与所述核酸适体具有相同功能的核酸适体的衍生物。
c)将所述核酸适体的骨架改造为硫代磷酸酯骨架,得到的与所述核酸适体具有相同功能的核酸适体的衍生物。
d)将核酸适体改造为肽核酸,得到的与所述核酸适体具有相同功能的核酸适体的衍生物。
e)将所述核酸适体连接上荧光、放射性和治疗性物质后,得到的与所述核酸适体具有相同功能的核酸适体的衍生物。
第六方面,本发明提供一种循环肿瘤细胞捕获试剂盒,其包含本发明所述核酸适体、磁珠、核酸适体组、磁珠组。
本发明所述循环肿瘤细胞捕获试剂盒,其特征在于还包括用于对循环肿瘤细胞进行二次纯化的微孔芯片。
本发明所述循环肿瘤细胞捕获试剂盒,其特征在于所述微孔芯片是以硅片为模板,由聚二甲基硅氧烷材料制成;每cm2微孔芯片上以55×55的方式均匀排列着3025个圆柱形微孔,每个微孔深200μm、直径150μm,并与相邻微孔间隔30μm。
本发明所述循环肿瘤细胞捕获试剂盒,其特征在于还包括对特定位点进行扩增及测序分析的试剂。
本发明所述循环肿瘤细胞捕获试剂盒,其特征在于所述进行扩增及测序分析的位点包括kras位点、egfr位点。
本发明所述循环肿瘤细胞捕获试剂盒,其特征在于对特定位点进行扩增的试剂包括seqidno:3-4、seqidno:5-6、和/或seqidno:7-8。
第七方面,本发明还提供一种利用本发明所述试剂盒进行循环肿瘤细胞捕获及基因分析的方法,其包括:
(1)利用核酸适体修饰的磁珠组捕获离体血液样本中耐药异质性的循环肿瘤细胞,磁场分离,初步纯化;
(2)将含有循环肿瘤细胞和其他血液细胞的混合体系标记后,经微孔芯片二次纯化,通过显微操作取出单个循环肿瘤细胞;
(3)将单个循环肿瘤细胞进行全基因组扩增和特定位点扩增及测序分析。
本发明所述的方法,其特征在于所述血液样本是已被确诊为顺铂耐药异质性非小细胞肺癌患者的循环血液。
与现有技术相比,本发明的技术方案具有以下优点:
(1)与顺铂耐药循环肿瘤细胞具有高亲和力。通常耐药性患者循环血中的循环肿瘤细胞大部分仍为非耐药的,然而耐药肿瘤细胞的含量虽然少但检测意义非常重要。并且由于耐药肿瘤细胞形态结构均会发生变化以逃避药物的作用因而通常情况下核酸适体对耐药肿瘤细胞的亲和力低于对非耐药肿瘤细胞的亲和力。与现有技术通常设计的核酸适体相反,本发明制备的核酸适体ap2对顺铂耐药循环肿瘤细胞的亲和力更高,从而能够更有效的对具有耐药性的循环肿瘤细胞捕获富集。
(2)对循环肿瘤细胞的富集更全面,适合耐药异质性循环肿瘤细胞的捕获。本发明提供的核酸适体组、磁珠组中既包含了对顺铂耐药性循环肿瘤细胞具有高亲和力的核酸适体,也包含了对非耐药循环肿瘤细胞具有高亲和力的核酸适体,二者协同能够更准确的分析耐药性循环肿瘤细胞在全部循环肿瘤细胞中所占的比例,这对于后续分析疾病进程、发展和转归意义重大。
(3)磁珠和微孔芯片的组合应用,能够直接进行单细胞全基因扩增。不仅提高了循环肿瘤细胞的浓度,还极大提高了循环肿瘤细胞的纯度,从而能够进行基因分析,特别是能够实现定量分析,提高了检测的灵敏度和准确性,降低了检测背景。
附图说明
通过阅读下文优选实施方式的详细描述,各种其他的优点和益处对于本领域普通技术人员将变得清楚明了。附图仅用于示出优选实施方式的目的,而并不认为是对本发明的限制。而且在整个附图中,用相同的参考符号表示相同的部件。在附图中:
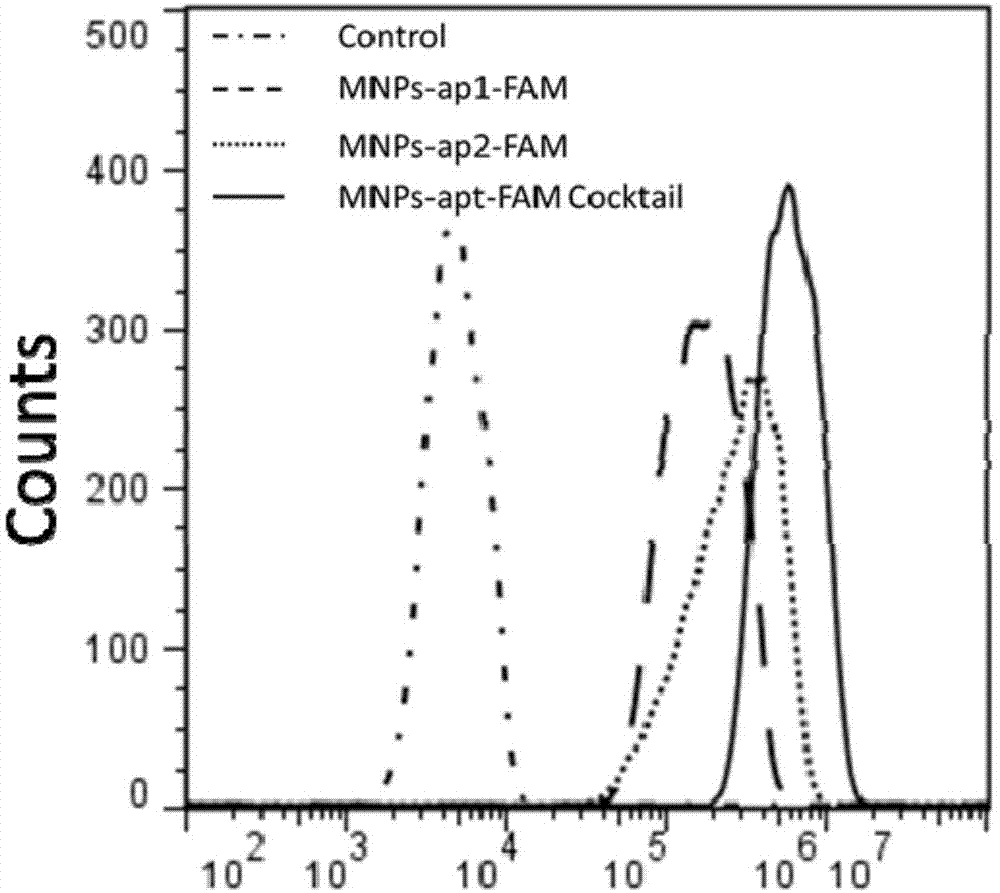
图1为采用本发明中核酸适体修饰的磁珠结合耐药异质性循环肿瘤细胞的流式对比图。
control为荧光标记的阴性核酸适体修饰的磁珠;
mnps-ap1-fam为荧光标记核酸适体ap1修饰的磁珠;
mnps-ap2-fam为荧光标记核酸适体ap2修饰的磁珠;
mnps-ap-famcocktail为两种磁珠的组合。
图2为采用本发明中核酸适体修饰的磁珠分别在缓冲液,jurkat细胞和健康人外周血单核细胞(pbmc)中捕获耐药异质性循环肿瘤细胞的捕获效率。
mnps-ap1为核酸适体ap1修饰的磁珠;
mnps-ap2为核酸适体ap2修饰的磁珠;
mnps-ap-famcocktail为两种磁珠的组合。
图3为核酸适体ap1修饰的磁珠、核酸适体ap2修饰的磁珠分别结合非顺铂耐药a549的流式对比图。
control为荧光标记的阴性核酸适体修饰的磁珠;
mnps-ap1-fam为荧光标记核酸适体ap1修饰的磁珠;
mnps-ap2-fam为荧光标记核酸适体ap2修饰的磁珠。
图4为核酸适体ap1修饰的磁珠、核酸适体ap2修饰的磁珠分别结合顺铂耐药a549的流式对比图。
control为荧光标记的阴性核酸适体修饰的磁珠;
mnps-ap1-fam为荧光标记核酸适体ap1修饰的磁珠;
mnps-ap2-fam为荧光标记核酸适体ap2修饰的磁珠。
图5为本发明中微孔芯片的结构设计示意图。
图6为使用本发明中微孔芯片进行纯化前后循环肿瘤细胞的纯度对比图。
图7为采用本发明中的方法将捕获的a549分别进行全基因扩增和kras,egfr19号外显子上e746_a750del和egfr21号外显子上l858r位点扩增的电泳图。
具体实施方式
下面将参照附图更详细地描述本公开的示例性实施方式。虽然附图中显示了本公开的示例性实施方式,然而应当理解,可以以各种形式实现本公开而不应被这里阐述的实施方式所限制。相反,提供这些实施方式是为了能够更透彻地理解本公开,并且能够将本公开的范围完整的传达给本领域的技术人员。
实施例1:核酸适体修饰的磁珠捕获及微孔芯片纯化循环肿瘤细胞
步骤1:制备核酸适体修饰的磁珠;
步骤1.1:采用两种生物素修饰的核酸适体分别与链霉亲和素修饰的磁珠孵育,孵育条件为25℃,150rpm,30分钟;
所述核酸适体ap1序列如下:
5'-tttatgggtgggtggggggttttt-3'(seqidno:1)
所述核酸适体ap2序列如下:
5'-ggttggttggggttgggttgtttttggggtgatatgggggttgga-3'
(seqidno:2)
步骤1.2:向步骤1.1中加入10ul浓度为10%的牛血清蛋白,25℃,150rpm,30分钟;
步骤1.3:将步骤1.2中的混合溶液在外加磁场下进行分离,清洗。
经过以上3个步骤即得到核酸适体修饰的磁珠。
步骤2:循环肿瘤细胞的捕获;
步骤2.1:将步骤1中制备的两种核酸适体修饰的磁珠以体积比1:1的比例混合,同时与只加一种核酸适体修饰的磁珠做对比,分别在缓冲液,jurkat细胞和健康人pbmc中捕获加入的a549和a549-d,4℃,100rpm,孵育30分钟;
步骤2.2:将步骤2.1中的混合溶液在外加磁场下进行分离,清洗3次;
步骤2.3:将在缓冲液中与细胞结合的核酸适体修饰的磁珠进行流式分析,并将在缓冲液,jurkat细胞或健康人pbmc中捕获的循环肿瘤细胞进行人工计数,计算捕获效率。
流式结果如图1所示,与一种核酸适体修饰的磁珠相比,两种核酸适体修饰的磁珠组合结合a549和顺铂耐药a549更多。从捕获效率(图2)看,分别在缓冲液,jurkat细胞或健康人pbmc中捕获循环肿瘤细胞,均为两种核酸适体修饰的磁珠组合捕获效率更高。综上流式与捕获效率的结果,可以充分说明,核酸适体修饰的磁珠组合捕获耐药异质性循环肿瘤细胞的效率更高。这主要是由于核酸适体ap1和ap2分别结合非耐药细胞和顺铂耐药的肿瘤细胞更强,如图3和图4所示,因此,此二者的组合才能实现耐药异质性循环肿瘤细胞的高效捕获。
步骤3:微孔芯片的制备。
微孔芯片的制备为采用常规的方法,以硅片为模板,采用聚二甲基硅氧烷材料制成,微孔芯片的结构如图5所示;
步骤4:循环肿瘤细胞的纯化。
步骤4.1:将步骤2中捕获到的循环肿瘤细胞与血液细胞的混合物用4%的多聚甲醛室温固定10分钟,再加入0.2%的tritonx-100破膜10分钟,后用磁场分离;
步骤4.2:将步骤4.1中的细胞加入磷酸盐缓冲液配制的浓度为1%的牛血清蛋白,室温封闭30分钟;
步骤4.3:将步骤4.2中的细胞混合液加入鼠源anti-ck抗体和兔源anti-cd45抗体,4℃,孵育2小时;
步骤4.4:将步骤4.3中的细胞混合液在磁场下分离,清洗;
步骤4.5:将荧光标记的二抗(含有alexa488-山羊抗鼠抗体和alexa555-山羊抗兔抗体)和细胞核染料hoechst33258加入到步骤4.4中的细胞混合液,4℃,孵育1小时;
步骤4.6:将步骤4.5中的细胞混合液在磁场下分离,清洗;
步骤4.7:将步骤4.6中的细胞混合液加入微孔芯片中,在微孔芯片下放置磁铁,从而将结合磁珠的细胞吸引至微孔底部,完成纯化步骤。
由图6所示,经微孔芯片纯化后循环肿瘤细胞的纯度有大幅度的提升,并且达到了基因分析的要求。
上述实施例1中采用酸适体修饰的磁珠捕获及微孔芯片纯化循环肿瘤细胞,此方法不仅适用于在缓冲液,jurkat细胞及健康人pbmc模拟样本中对循环肿瘤细胞捕获与纯化,更进一步地可以将此方法用于非小细胞肺癌患者血液样本中循环肿瘤细胞的捕获和纯化。
实施例2:循环肿瘤细胞的基因分析
步骤1:对于实施例1中捕获并纯化的循环肿瘤细胞,在荧光显微镜下,通过显微操作将单个循环肿瘤细胞(hoechst33258+/ck+/cd45-)提取出来;
步骤2:采用单细胞全基因扩增试剂盒(sigma)将提取出的循环肿瘤细胞进行全基因扩增,详细步骤参照该试剂盒说明书;
步骤3:将步骤2中扩增得到的序列进行电泳分析,结果如图7a;
步骤4:以步骤2中扩增得到的序列为模板,对特定位点进行扩增,电泳分析结果如图7b和图7c;
引物序列(5’-3’):
kras-forwardaaggtactggtggagtatttg(seqidno:3)
kras-reversegtactcatgaaaatggtcagag(seqidno:4)
egfr19-forwardgtgcatcgctggtaacatcc(seqidno:5)
egfr19-reversetgtggagatgagcagggtct(seqidno:6)
egfr21-forwardgctcagagcctggcatgaa(seqidno:7)
egfr21-reversecatcctcccctgcatgtgt(seqidno:8)
其中egfr19对应egfre746_a750del缺失,egfr21对应egfrl858r突变。
步骤5:将步骤4中的扩增产物进行测序。
经与组织学测序结果对比,病人样本中捕获到的循环肿瘤细胞确实为kras突变,说明本方法的可靠性。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
序列表
<110>申请人名称中国科学院化学研究所
<120>一种耐药异质性循环肿瘤细胞捕获与基因分析的试剂、装置和方法
<130>无
<160>8
<170>patentinversion3.5
<210>1
<211>24
<212>dna
<213>人工序列
<400>1
tttatgggtgggtggggggttttt24
<210>2
<211>45
<212>dna
<213>人工序列
<400>2
ggttggttggggttgggttgtttttggggtgatatgggggttgga45
<210>3
<211>21
<212>dna
<213>人工序列
<400>3
aaggtactggtggagtatttg21
<210>4
<211>22
<212>dna
<213>人工序列
<400>4
gtactcatgaaaatggtcagag22
<210>5
<211>20
<212>dna
<213>人工序列
<400>5
gtgcatcgctggtaacatcc20
<210>6
<211>20
<212>dna
<213>人工序列
<400>6
tgtggagatgagcagggtct20
<210>7
<211>19
<212>dna
<213>人工序列
<400>7
gctcagagcctggcatgaa19
<210>8
<211>19
<212>dna
<213>人工序列
<400>8
catcctcccctgcatgtgt19
- 还没有人留言评论。精彩留言会获得点赞!