一种诱导型启动子、其重组载体、转化体以及诱导基因表达的方法及其应用与流程
本发明涉及的是一种基因工程技术领域的基因启动子,具体是一种诱导型启动子、其重组载体、转化体以及诱导基因表达的方法及其应用。
背景技术:
由于西瓜栽培周期短、经济效益高,从而具有较大的市场潜力。近年来随着栽培技术的完善和设施条件的改善,西瓜生产得到进一步发展。据统计,2015年我国西瓜播种面积约为1.78×106hm2,总产量约6.95×107t,面积和产量均居世界第一。黄瓜绿斑驳花叶病毒(cucumbergreenmottlemosaicvirus,cgmmv)属于芜菁花叶病毒科(tymoviridae)烟草花叶病毒属(tobamovirus)成员,是侵染葫芦科作物的重要病毒,对西瓜生产造成了巨大的威胁。cgmmv发病广,难控制,不仅在我国危害严重,而且已在世界30多个国家和地区蔓延,但是目前存在的物理和化学防治手段效果都存在明显的不足,尽快分离cgmmv的抗病基因,利用转基因手段培育西瓜cgmmv抗病品种将是最为经济有效的防治措施。
褪黑素(又名n-乙酰-5-甲氧基色胺,n-acetyl-5-methoxytryptamine)是一种在生物体中广泛存在的吲哚胺类化合物,在人和动物中具有调节昼夜节律、提高免疫力和抗衰老的作用,也是一种对人类健康有益的保健佳品。现已发现褪黑素在高等植物中也广泛存在,内源褪黑素的含量主要是由褪黑素合成酶基因的表达所调控的,植物褪黑素合成基因一般包括:l-色氨酸脱羧酶(tdc)、色氨酸羟化酶(t5h)、5-羟色胺-n-乙酰转移酶(snat)、n-乙酰-5-羟色胺甲基转移酶(asmt)/羟基吲哚-o-甲基转移酶(comt)。snat作为褪黑素合成过程中的倒数第二种关键酶,在植物中一般都是单拷贝,从蓝藻细菌到高等植物中都十分保守。snat基因的表达很可能在褪黑素合成过程中发挥着至关重要的作用。
基因的表达和响应模式主要受到启动子的调控。按照功能及作用方式,启动子可分为组成型表达启动子、组织特异性表达启动子和诱导型表达启动子。在转基因技术中采用的启动子往往是像camv35s一样的组成型表达启动子,此类启动子在转基因植物的生长中造成了很多能源浪费和表型紊乱,而组织特异性表达启动子只能在一定的组织中才能进行有效的表达,相比之下,诱导型表达启动子则为作物的抗逆研究提供了更加安全有效的技术手段。鉴于目前能应用于作物抗病育种的诱导型启动子非常少,对于病原菌诱导型的新的启动子的分离和应用将弥补利用转基因技术获取抗病品种中的一大弊端。
技术实现要素:
本发明的目的是提供一种新的西瓜褪黑素合成酶基因启动子,该启动子强烈响应cgmmv的侵染。本发明的又一目的是提供cgmmv诱导型启动子在利用转基因技术改良作物抗性中的应用。本发明的目的是从西瓜中克隆受黄瓜绿斑驳花叶病毒病诱导的启动子proclsnat,并将proclsnat启动子连接到带有gus的重组表达载体,侵染到西瓜子叶中,cgmmv侵染能够明显诱导proclsnat驱使gus基因在西瓜中的表达,该cgmmv诱导启动子的分离和利用为利用抗性基因改良西瓜cgmmv病害抗性提供了技术支持。
本发明的技术方案如下:
一种诱导型启动子,其特征在于,包括5-羟色胺-n-乙酰转移酶基因的启动子,且所述5-羟色胺-n-乙酰转移酶基因的启动子受cgmmv诱导。
所述5-羟色胺-n-乙酰转移酶基因的启动子包含2个干旱诱导的myb结合元件mbs、1个厌氧反应相关元件are、2个高温响应相关元件hse、1个真菌诱导响应元件box-w1、2个meja响应元件cgtca-motif、一个aba响应元件abre、两个生长素响应元件tga-box和auxrr-core、4个胚乳表达所需的顺式调控元件skn-1_motif、包括1个ae-box、1个sp1、2个g-box、2个gt1-motif的6个光响应元件。
2个干旱诱导的myb结合元件mbs分别序列正向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的1343个脱氧核苷酸位置和第1408脱氧核苷酸位置;
1个厌氧反应相关元件are序列正向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第26个脱氧核苷酸位置;
2个高温响应相关元件hse分别序列反向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第161个脱氧核苷酸位置和第1157脱氧核苷酸位置;
1个真菌诱导响应元件box-w1序列反向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第862个脱氧核苷酸位置;
2个meja响应元件cgtca-motif:一个序列反向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第1008个脱氧核苷酸位置,另一个序列正向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第1489脱氧核苷酸位置;
1个aba响应元件abre序列正向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第1010脱氧核苷酸位置;
2个生长素响应元件tga-box和auxrr-core分别序列正向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第1008个脱氧核苷酸位置和第1335脱氧核苷酸位置;
4个胚乳表达所需的顺式调控元件skn-1_motif分别序列正向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第1259个脱氧核苷酸位置、第1410脱氧核苷酸位置、第1345个脱氧核苷酸位置、第1490脱氧核苷酸位置;
6个光响应元件:所述ae-box序列正向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第279个脱氧核苷酸位置;
所述sp1序列反向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第758个脱氧核苷酸位置;
1个g-box序列正向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第1008个脱氧核苷酸位置、另1个g-box序列反向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第1009个脱氧核苷酸位置;
1个gt1-motif序列反向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第400个脱氧核苷酸位置、另1个gt1-motif序列正向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第1028个脱氧核苷酸位置。
所述5-羟色胺-n-乙酰转移酶基因的启动子为西瓜的5-羟色胺-n-乙酰转移酶基因的启动子proclsnat,其序列如seqidno.1所示。
一种诱导表达基因的重组载体,其特征在于,所述重组表达载体的启动子区域装载有权利要求1-4任一所述的诱导型启动子。
所述重组载体为启动子区域装载有西瓜的5-羟色胺-n-乙酰转移酶基因的启动子proclsnat序列的pbi101载体;
优选地,所述重组载体上还装载有基因序列;更优选地,所述基因选自gus基因、gfp基因、yfp基因、rfp基因;优选gus基因;
进一步优选地,所述重组载体为proclsnat::gus-egfp-pbi101质粒。
一种可诱导宿主表达转基因的转化体,其特征在于,所述转化体内转化有权利要求5或6所述的重组载体。
所述转化体为转化有所述重组载体的大肠杆菌、或农杆菌;优选农杆菌;更优选地,所述农杆菌为农杆菌gv3101菌株。
一种诱导表达基因的方法,其特征在于,采用权利要求1-4任一所述的诱导型启动子,并采用cgmmv进行诱导。
所述诱导包括:将所述诱导型启动子通过构建表达载体与所述基因连接,并构建重组表达载体,将所述重组表达载体转化宿主细胞获得转化体,再用所述转化体和所述cgmmv共同侵染生物材料;
优选地,所述基因选自:报告基因;所述表达载体选自:pbi101载体;所述宿主细胞为农杆菌;所述生物材料为西瓜;所述诱导型启动子构建表达载体时使用的上下游引物如seqidno.2和seqidno.3所示。
所述报告基因选自gus基因、gfp基因、yfp基因、rfp基因;优选gus基因;
所述农杆菌为农杆菌gv3101菌株;所述生物材料为西瓜的子叶。
所述的诱导型启动子在诱导表达西瓜中的转基因方面的应用。
所述转基因为转入西瓜中的西瓜抗性基因。
本领域公知,如果一个启动子具有启动活力,理论上该启动子可以诱导所有基因的表达,理论上只要把该启动子与任意功能基因构建到同一表达载体上,都可以诱导该基因表达。因此,本领域的任何被证明有启动活力的启动子理论上可以启动所有基因的表达,无论是报告基因还是功能基因,而能够证明该启动子能启动某一种具体的基因(例如,某一报告基因或某一功能基因)的表达,也能毫无疑义地得到该启动子同样能启动其它基因的表达,这是本领域的公知常识。本发明启动子的启动活力与该启动子启动的gus蛋白的表达呈正相关,也就是说,gus蛋白表达产生的蓝色区域的大小和深度与启动子活力呈正相关,本发明的图4显示的结果证明本发明的启动子具备启动活力(图4下行单独的启动子也能启动gus基因表达生成蓝色产物),而本发明的启动子在经cgmmv诱导后活力更强(图4上行相比下行,经cgmmv诱导的启动子比单独的启动子能更快更强地启动gus基因表达生成蓝色产物)。因此,本发明的启动子可启动包括gus基因在内的任何基因,并且在cgmmv诱导下,本发明的启动子能更快更强地启动包括gus基因在内的任何基因。
一种从西瓜中分离的受到cgmmv诱导的西瓜褪黑素合成关键酶基因的启动子proclsnat,其特征在于,该启动子的序列是以下序列之一:
(1)序列表中seqid:1所述核苷酸序列。
(2)对上述(1)所示dna序列进行一个或多个碱基的取代、缺失和/或增加且具有相同启动子功能的核苷酸序列。
根据权利要求1所述的启动子proclsnat,其特征在于,该启动子来源于西瓜,调控褪黑素合成基因的表达,且受到cgmmv的强烈诱导表达。
如权利要求1所述启动子proclsnat的制备方法,其特征在于,包括以下步骤:
(1)采用植物基因组dna的快速提取法提取西瓜基因组dna;(2)利用seqidno.2和seqidno.3所示的引物序列,通过pcr技术从西瓜基因组dna中克隆获得所述启动子的核苷酸序列。
含有上述启动子的表达盒、载体、工程菌、转基因组织或植株等均属于本发明的保护范围。
本发明所述西瓜的一个受cgmmv诱导的启动子proclsnat在植物抗病基因研究或抗病基因工程育种中的应用。
如权利要求4所述应用的方法是:利用所述启动子为cgmmv诱导型启动子,将该启动子与报告基因gus融合构建植物表达载体;利用农杆菌介导将重组质粒与cgmmv侵染性克隆载体导入西瓜子叶并进行培育,实现所述启动子在西瓜中的诱导型高表达。
本发明涉及一种受cgmmv诱导的西瓜褪黑素合成酶基因启动子proclsnat,该启动子来自于西瓜高代自交系品种‘jjz-m’基因组中cla012046基因转录起始位点上游2094bp的dna,该启动子的核苷酸序列如序列表seqidno:1所示。
所述的一种分离的dna分子,其启动子区)包含有一个干旱诱导的myb结合元件mbs、一个厌氧反应相关元件are、两个热应答元件hse、一个真菌诱导响应元件、两个meja响应元件cgtca-motif、一个aba响应元件abre、生长素响应元件tga-box等;各具体元件及其位置和序列如下表所示:
表1.clsnat基因启动子区顺式作用元件分析
所述基因启动子proclsnat克隆引物如下:上游引物是gctctagatacaagggaagagcaaggtc(seqidno.2),引入xbai酶切位点;下游引物是tcccccgggaactaagaggaaaggcgaag(seqidno.3),引入smai酶切位点,扩增2094bp的dna序列片段。
本发明还提供一种植物表达载体,所述植物表达载体的制备方法,具体步骤为:
(1)本研究所用的西瓜高代自交系‘jjz-m’,将西瓜种子浸种催芽后播种于基质(草炭:蛭石:珍珠岩=3:2:1)中,置于光照培养箱中培养,光照强度为300μmolm-2s-1、光周期为16h/8h,温周期为28℃/23℃。挑选出3周大小、长势健壮的西瓜植株提取dna,dna提取采用omega公司植物dna提取试剂盒提取。
(2)以西瓜dna为模板,设计特异性引物prosnat-s和prosnat-a,利用高保真酶对该启动子序列进行扩增。
(3)在上述扩增序列两端引入xbai和smai限制性酶切位点,将pcr产物用1%的琼脂糖凝胶电泳分离并进行纯化,将纯化的pcr产物和pbi101载体用xbai和smai内切酶进行酶切,将酶切产物纯化后利用fermenta公司的t4连接酶16℃连接过夜,将连接产物转化进入dh5α感受态中,待长出单菌落后进行菌液pcr检测和测序验证,获得构建正确的proclsnat::gus-egfp-pbi101质粒。
本发明还提供所述的西瓜褪黑素合成酶基因启动子或所述的植物表达载体在植物的cgmmv抗性改良中的应用。
本发明属于植物分子生物学技术领域,提供了一种自西瓜中分离出的,受到黄瓜绿斑驳花叶病毒病(cgmmv)诱导表达的褪黑素合成关键酶基因启动子proclsnat。该启动子的核苷酸序列如seqidno.1所示。本发明还公开了所述启动子proclsnat在抗病基因研究或抗病基因工程育种中的应用,是采用农杆菌介导的遗传转化,以启动表达gus基因的方式进行启动子活性功能验证,对于揭示西瓜褪黑素合成机理,生物调控西瓜内源褪黑素含量具有重要意义。同时,实验验证在cgmmv侵染后,所述启动子西瓜子叶中的启动的报告基因gus的表达活性比对照显著提高,表明启动子proclsnat是一个受cgmmv强烈诱导的启动子,预示启动子proclsnat在西瓜基因工程抗病育种研究中具有重要的应用价值。
本研究从西瓜中成功克隆到一种控制西瓜褪黑素合成关键酶基因表达,同时受到cgmmv诱导的启动子,命名为启动子proclsnat。从该基因启动子中分离到了包括干旱、高温以及真菌诱导响应等逆境相关的顺式作用元件。该启动子的特征预示了它在cgmmv抗病育种中具有重要价值,利用该启动子驱动抗性基因的表达,将为改良西瓜cgmmv抗性提供了一个很好的选择。目前尚未发现有关植物褪黑素合成酶基因启动子在作物抗病中的应用研究。
附图说明
图1.proclsnat启动子pcr产物。
图2.带有proclsnat::gus的质粒构建模式图。
图3.利用荧光定量pcr(qrt-pcr)检测clsnat对cgmmv侵染的响应模式。
图4.西瓜clsnat基因启动子proclsnat的活性分析。利用gus活性检测分析cgmmv对西瓜clsnat启动子表达的影响。
具体实施方式
下面结合附图下面实施例中所用方法如无特别说明均为常规方法。
第1组实施例、本发明的诱导型启动子
本组实施例提供一种诱导型启动子,其特征在于,包括5-羟色胺-n-乙酰转移酶基因的启动子,且所述5-羟色胺-n-乙酰转移酶基因的启动子受cgmmv诱导。
在一些实施例中,所述5-羟色胺-n-乙酰转移酶基因的启动子包含2个干旱诱导的myb结合元件mbs、1个厌氧反应相关元件are、2个高温响应相关元件hse、1个真菌诱导响应元件box-w1、2个meja响应元件cgtca-motif、一个aba响应元件abre、两个生长素响应元件tga-box和auxrr-core、4个胚乳表达所需的顺式调控元件skn-1_motif、包括1个ae-box、1个sp1、2个g-box、2个gt1-motif的6个光响应元件。
在具体的实施例中,2个干旱诱导的myb结合元件mbs分别序列正向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的1343个脱氧核苷酸位置和第1408脱氧核苷酸位置;
1个厌氧反应相关元件are序列正向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第26个脱氧核苷酸位置;
2个高温响应相关元件hse分别序列反向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第161个脱氧核苷酸位置和第1157脱氧核苷酸位置;
1个真菌诱导响应元件box-w1序列反向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第862个脱氧核苷酸位置;
2个meja响应元件cgtca-motif:一个序列反向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第1008个脱氧核苷酸位置,另一个序列正向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第1489脱氧核苷酸位置;
1个aba响应元件abre序列正向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第1010脱氧核苷酸位置;
2个生长素响应元件tga-box和auxrr-core分别序列正向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第1008个脱氧核苷酸位置和第1335脱氧核苷酸位置;
4个胚乳表达所需的顺式调控元件skn-1_motif分别序列正向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第1259个脱氧核苷酸位置、第1410脱氧核苷酸位置、第1345个脱氧核苷酸位置、第1490脱氧核苷酸位置;
6个光响应元件:所述ae-box序列正向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第279个脱氧核苷酸位置;
所述sp1序列反向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第758个脱氧核苷酸位置;
1个g-box序列正向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第1008个脱氧核苷酸位置、另1个g-box序列反向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第1009个脱氧核苷酸位置;
1个gt1-motif序列反向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第400个脱氧核苷酸位置、另1个gt1-motif序列正向地位于所述5-羟色胺-n-乙酰转移酶基因的起始密码子上游的第1028个脱氧核苷酸位置。
在优选的实施例中,所述5-羟色胺-n-乙酰转移酶基因的启动子为西瓜的5-羟色胺-n-乙酰转移酶基因的启动子proclsnat,其序列如seqidno.1所示。
第2组实施例、本发明的重组载体
本组实施例提供一种诱导表达基因的重组载体。本组所有的实施例都具备如下共同特征:所述重组表达载体的启动子区域装载有第1组实施例任一所述的诱导型启动子。
在一些具体的实施例中,所述重组载体为启动子区域装载有西瓜的5-羟色胺-n-乙酰转移酶基因的启动子proclsnat序列的pbi101、pbi121、pcambia1302、pbgwfs7.0等植物双元表达载体。
优选地,所述重组载体上还装载有基因序列;更优选地,所述基因选自gus基因、gfp基因、yfp基因、rfp基因;优选gus基因。
在进一步的实施例中,所述重组载体为proclsnat::gus-egfp-pbi101质粒。
第3组实施例、本发明的转化体
本组实施例提供一种可诱导宿主表达转基因的转化体。本组所有的实施例都具备如下共同特征:所述转化体内转化有第2组实施例任一所述的重组载体。
在一些实施例中,所述转化体为转化有所述重组载体的大肠杆菌、或农杆菌;优选农杆菌;更优选地,所述农杆菌为根癌农杆菌gv3101、eha105、lba4404等菌株。
第4组实施例、本发明的方法
本组实施例提供一种诱导表达基因的方法。本组所有的实施例都具备如下共同特征:采用第1组实施例任一所述的诱导型启动子,并采用cgmmv进行诱导。
在具体的实施例中,所述诱导包括:将所述诱导型启动子通过构建表达载体与所述基因连接,并构建重组表达载体,将所述重组表达载体转化宿主细胞获得转化体,再用所述转化体和所述cgmmv共同侵染生物材料;
在优选的实施例中,所述基因选自:报告基因;所述表达载体选自:pbi101载体;所述宿主细胞为农杆菌;所述生物材料为西瓜;所述诱导型启动子构建表达载体时使用的上下游引物如seqidno.2和seqidno.3所示。
在另一些实施例中,所述报告基因选自gus基因、gfp基因、yfp基因、rfp基因;优选gus基因;
所述农杆菌为农杆菌gv3101菌株;所述生物材料为西瓜的子叶。
第5组实施例、本发明诱导型启动子的应用
本组实施例提供所述的诱导型启动子在诱导表达西瓜中的转基因方面的应用。
在具体的实施例中,所述诱导型启动子为第1组实施例任一所述的诱导型启动子。
在一些实施例中,所述应用为采用第4组实施例任一所述的方法进行的应用。
优选地,所述转基因为转入西瓜内的西瓜抗性基因。
实验例、本发明的具体实验操作
(一)实验方法
1.1总rna的提取、反转录及荧光定量pcr(qrt-pcr)分析
采用omega公司植物rna提取试剂盒提取西瓜总rna,提取后置于-75℃保存备用。利用紫外分光光度计检测rna样品的浓度后,用1%琼脂糖凝胶电泳检测rna样品的质量。cdna第一链的合成参照takala公司的反转录试剂盒(smarttmpcrcdnasynthesiskit)的说明书进行。
选取clsnat基因的特异性序列设计qrt-pcr引物qrtsnat-s和qrtsnat-a;以西瓜β-actin(cla007792)作为内参基因,设计特异引物β-actin-s和β-actin-a,所有引物按照引物合成说明进行稀释。反应体系参照takara公司sybrpremixextaq试剂盒说明书,在cfx96realtimesysterm(bio-rad,usa)仪器上进行反应。每次实验设置3次技术重复和3次生物学重复,数据处理按照2-δδct方法进行处理和分析。
1.2启动子序列顺式作用元件的预测
在葫芦科作物基因组数据库中获得clsnat基因上游的2000bp序列,输入到plantcare(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)网站预测启动子的顺式作用元件。
1.3proclsnat启动子载体构建
目的是获得启动子proclsnat驱动葡萄糖苷酸酶报告基因(gus)表达的载体,同时获得含有该载体的农杆菌,为后续的应用研究做准备。
以西瓜dna为模板,设计特异性引物prosnat-s和prosnat-a,利用高保真酶对该启动子序列进行扩增,命名为proclsnat,同时在序列两端引入xbai和smai限制性酶切位点,将pcr产物用1%的琼脂糖凝胶电泳分离并进行纯化,将纯化的pcr产物和pbi101载体用xbai和smai内切酶进行酶切,将酶切产物纯化后利用ferment公司的t4连接酶16℃连接过夜。
1.4质粒转化大肠杆菌及阳性菌落的筛选
将连接产物转化到大肠杆菌dh5α感受态细胞中,操作如下:从-70℃冰箱中取出感受态细胞,置于冰上解冻;吸取100μl感受态细胞于新的1.5ml离心管中,加入10μl连接产物,缓慢吸打混匀,冰浴30min;将离心管置于42℃金属浴中热击90s,之后迅速放回冰上,冰浴3-5min;于超净台上向离心管中加入1ml液体lb培养基(0.5%酵母提取物、1%蛋白胨、1%nacl,ph=7.5),吸打混匀之后于37℃摇床中,200rpm震荡培养1h;菌液于室温下6000rpm离心1min以收集菌体;于超净台上弃掉部分上清,留取约100μl菌液,用移液器将沉淀与上清吸打混匀;将菌液均匀涂布于含有100mg·l-1kan抗生素的固体lb培养基倒制的筛选平板上;37℃恒温箱中倒置培养至长出单菌落;于超净台上挑取单菌落至含有100mg·l-1kan抗生素的1ml液体lb培养基中;37℃摇床中200rpm震荡培养4-5h;进行菌液pcr检测;含有目的条带的菌液送杭州擎科梓熙生物技术有限公司测序。
1.5质粒转化农杆菌
将构建正确的载体质粒利用冻融法转化到农杆菌gv3101菌株中。具体步骤如下:取2μg纯化的载体质粒加入到100μl农杆菌gv3101感受态细胞中,用移液枪轻轻吸打混匀,冰浴10min,立即放入液氮中5min,然后在超净工作台上加入1ml不含抗生素的液体lb培养基,28℃,200rpm振荡培养4~5h;室温下,5000rpm离心1min,弃上清,剩余约100μl的沉淀,轻轻吸打混匀,将混匀后的菌液在含有50mg·l-1rif,50mg·l-1kan和50mg·l-1str的固体lb筛选平板上涂布均匀,28℃倒置暗培养36~48h至有单菌落长出。挑取单菌落至1.5ml含有50mg·l-1rif,50mg·l-1kan和50mg·l-1str抗生素的液体lb培养基中。在28℃,200rpm振荡培养12h,以摇好的菌液为模板,进行pcr鉴定筛选出阳性单克隆。
1.6cgmmv侵染后对proclsnat启动子活性的gus染色分析
选一周大小长势良好的西瓜植株,将含有目的质粒的农杆菌菌液和含有cgmmv侵染性克隆的菌液同时注射到西瓜子叶背面中共表达,在注射后24、48和72h,剪取侵染后的子叶,进行gus染色,并利用95%的乙醇脱色,观察记录clsnat启动子启动gus蛋白表达信号的强度以及cgmmv的侵染对该启动子表达强度的影响。
(二)结果分析
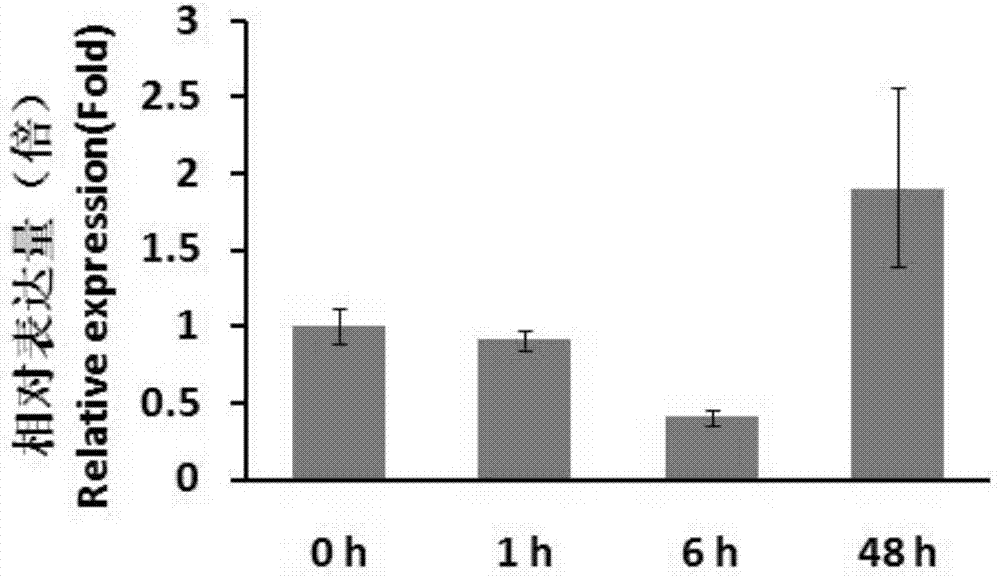
通过plantcare网站分析发现proclsnat启动子包含多种激素和逆境响应相关的顺式作用元件。利用荧光定量pcr检测发现,在接种cgmmv后6h,西瓜clsnat的表达被抑制到初始水平的0.41倍,而在48h,其表达量上升到1.89倍;利用特异引物扩增得到proclsnat启动子序列,并将扩增产物克隆到pbi101载体上,通过侵染西瓜子叶细胞与gus蛋白融合表达发现,proclsnat能够启动gus蛋白的表达,具备启动活性;同时将proclsnat::gus与cgmmv侵染性克隆同时注射到西瓜子叶细胞中,发现,在cgmmv侵染后48和72h,西瓜中gus蛋白的表达被强烈诱导。
本实验例的gus基因表达的检测方法采用组织化学法,即,以5-溴-4-氯-3-吲哚-β-葡萄糖苷酸(x-gluc)作为反应底物,将子叶用含有底物的缓冲液浸泡,一定时间后,子叶中表达的gus酶水解x-gluc即可生成蓝色产物,结果如图4所示,cgmmv×proclsnat(有cgmmv诱导的、被含有proclsnat启动子及gus基因表达载体的农杆菌侵染的西瓜子叶)在48h就已经诱导gus蛋白的表达,且蓝色区域非常明显,而单独proclsnat(无cgmmv诱导的、被含有proclsnat启动子及gus基因表达载体的农杆菌侵染的西瓜子叶)没有启动gus蛋白表达,在72h,虽然二者都有gus蛋白表达(蓝色产物生成),但是cgmmv+proclsnat中蓝色区域的大小和深度明显强于单独proclsnat的表达。这说明:在cgmmv的诱导下,proclsnat启动子能比没有cgmmv诱导单独存在的proclsnat启动子更快更强的启动gus基因的表达。
sequencelisting
<110>浙江省农业科学院
<120>一种诱导型启动子、其重组载体、转化体以及诱导基因表达的方法及其应用
<130>p180582/nky
<160>7
<170>patentinversion3.5
<210>1
<211>2094
<212>dna
<213>artificialsequence
<220>
<223>西瓜(citrulluslanatus(thunb.)matsum.etnakai)的5-羟色胺-n-乙酰转移酶基因的启动子proclsnat
<400>1
tacaagggaagagcaaggtccatgcttaagcaagctaggtcaacctccccttcgttgaag60
acttttaaatgatgtccattcacattgaacaccttcccaatatcaaagctcctaatttca120
actgcaccatgaggaaaaatattagtaatttcaaagggacctaaccacttggacttcaac180
ttaccaggcatgaactagaggcaattattgaaaagaaggacttttttgaccaactctgaa240
gtccctcctaatgagcatctagtcgtggaatggcttggtcttttctttatagatttggga300
atcctcataagcttccaacctcaattcctcgagcttttggagctccaacaatctctccta360
attggcttgggctaaattcatgttgcacttcttgacaacccaatatgccttgtgctcaat420
ctctactggcaagggacataccttaccataaacaagcctaaacatggtcaaaccgaatgg480
aataaaaagttatgtttgttttttactcattctgacatcgacgtttggttttgatagaca540
gaatgttgcttttttttttaaaaaaaattaattttttaatgtcaatttgaattattcatt600
aaaaaaaagtattctgtccattttcttggtaccattttcacggtatcggaaaaattgaca660
gaaattttttttttaaaaaaattatttttttaattttaatttgaattattgaaattaaaa720
ttaattattaagtattatgagagttaaaattaatatatatataatgaaaaattaaaaaag780
aaactttattctgtccattttcttggtaagtttagggaaaatgtagtctacggggaaaat840
agaccgaataatttttttttaatttagttttagatttttataataattaataattaattt900
taaccaaatcacaaagtaaaaaaaaagtattacacaaatcacaaagttaagaaaaaaata960
aaaataaatttacgggaaaataggaaggtagtaggaaggaaaggaacaaagaggaaaact1020
taccaggaaggaaaggaatggaagctctctgtcacttttcccgtaaagtttcgaaaagac1080
aaagagcttccttcctggtaagtttcaacttatcgggaaggaatcagttttttgttattt1140
ttctcgtaaaaagttttggtgatgaactttacgggaacacagggagcttccttcctggta1200
aatttcaacttatcgggaaggaattaatctctttgtcactttttccataaagttttgggg1260
agggacttttcaggaaaaaagacaaagagttaattccttccttgtaagttcaaacttatc1320
gggaatgaattaattctctgtgactttccccataaagtggtggtcaaaactttacgggaa1380
aagtaatagagaactcaattcattctcgataagttgaaacttaccaagaaggaaactatc1440
tgtctttttcctgtaaagttcttcaccaaaactttacgggaaaagtaggagtttagttgt1500
acgcatctgacgtggctttaacgccacggttaacaccaattaaaaaattaaaatataaat1560
caagtgtgtcttaacgaagagacacattctaataaagacaaataaaaaaccctatttccc1620
tttttcttttttttttttcaaaataccattttcacctaaatttttttctaaaagtaacct1680
caatcccatggactttgatattgatatatattgatttcaatattcccatatatcataggt1740
atagggggatgcacccaagtcattatgatacatcatcaacccttgtgtacggatatttca1800
accattggttagcggctagctgaagaagaagaagatggaccacggtcatgctgtggagaa1860
ctgaatcttcaactacaacaaatcgcctcttcttcattcctctgctccggtcatttctct1920
gaagctccgatttcgattccaggtctcaaaactattctcactactggacttaatcccggt1980
ccactcatcgtcatccagatatgttgtctcacaaactcttcgccgcctcttctccgttag2040
tactcttcaccttccttccttaaatcttatccatcttcgcctttcctcttagtt2094
<210>2
<211>28
<212>dna
<213>artificialsequence
<220>
<223>引物prosnat-s
<400>2
gctctagatacaagggaagagcaaggtc28
<210>3
<211>29
<212>dna
<213>artificialsequence
<220>
<223>引物prosnat-a
<400>3
tcccccgggaactaagaggaaaggcgaag29
<210>4
<211>18
<212>dna
<213>artificialsequence
<220>
<223>引物qrtsnat-s
<400>4
cgtagaccactgccaaag18
<210>5
<211>19
<212>dna
<213>artificialsequence
<220>
<223>引物qrtsnat-a
<400>5
cacgagccataccaatcag19
<210>6
<211>20
<212>dna
<213>artificialsequence
<220>
<223>引物β-actin-s
<400>6
ccatgtatgttgccatccag20
<210>7
<211>20
<212>dna
<213>artificialsequence
<220>
<223>引物β-actin-a
<400>7
ggatagcatggggtagagca20
- 还没有人留言评论。精彩留言会获得点赞!