水稻二化螟为害诱导型启动子及其应用的制作方法
本发明涉及植物基因工程技术领域,具体涉及一种水稻二化螟为害诱导型启动子及其应用。
背景技术:
水稻在整个生长过程中,无时无刻不遭受着多种害虫的侵害。最重要的害虫如褐飞虱,二化螟和稻纵卷叶螟。水稻每年有10%的产量损失是由虫害造成的(chenh,liny,zhangq.reviewandprospectoftransgenicriceresearch.chinscibull.2009,54:4049–4068)。因此,化学农药成为防治虫害的首选工具,然而,水稻田长期大量施用农药已经显著破坏了稻田生态系统的自然调控功能,害虫产生的抗药性,水稻植株药物残留等各种安全问题也随之而来。之后,又有学者提出采用性诱剂诱杀或释放天敌等方式完成稻田害虫的防治,而性诱剂每次只能用1种诱芯,多个诱芯会有相互干扰的结果,释放天敌方式存在天敌种群的选择,天敌的培育和田间释放等方面问题。渐渐地,生物农药成为害虫防御的新方式,目前已有多种水稻内源抗二化螟基因被挖掘,如:osmpk3,osmpk4,oslrr-rlk1和oshi-xip(wangq,lij,hul,zhangt,zhangg,louy.osmpk3positivelyregulatesthejasignalingpathwayandplantresistancetoachewingherbivoreinrice.plantcellrep.2013,32:1075-84.;liux,lij,xul,wangq,louy.expressingosmpk4impairsplantgrowthbutenhancestheresistanceofricetothestripedstemborerchilosuppressalis.intjmolsci.2018,19:1182.;hul,yem,kuaip,yem,erbm,louy.oslrr-rlk1,anearlyresponsiveleucine-richrepeatreceptor-likekinase,initiatesricedefenseresponsesagainstachewingherbivore.newphytol,2018,219:1097-1111;xinz,wangq,zhaon,huc,lij,xiangc,wangb,louy.overexpressionofaxylanaseinhibitorgene,oshi-xip,enhancesresistanceinricetoherbivores.plantmolbiolrep.2014,32:465-475),外源抗螟虫基因中,被大家所熟知的为bt基因,已有多篇报道显示,bt蛋白转基因水稻对二化螟和稻纵卷叶螟表现出较好的杀虫效果,而驱动抗性基因所使用的工具都是组成型启动子(yangzetal.developmentandcharacterizationoftransgenicriceexpressingtwobacillusthuringiensisgenes.pestmanagsci.2011,67:414-422;tangwetal.developmentofinsect-resistanttransgenicindicaricewithasyntheticcry1c*gene.molbreed.2006,18:1-10;lingetal.developmentofmarker-freeinsect-resistantindicaricebyagrobacteriumtumefaciens-mediatedco-transformation.frontplantsci.2016,7:1608),虽然此方法不会破坏生态环境,但随之而来的新问题是抗性基因在植株整个生长周期内的各个组织中都无时无刻不高效表达,造成能量浪费的同时,给植株的生长及代谢带来很多潜在负担,严重的甚至导致变异或死亡(karlowskiwmetal.theover-expressionofanalfalfaring-h2geneinducespleiotropiceffectsonplantgrowthanddevelopment.plantmolbiol.2003,52:121-33;miyaometal.metabolicconsequencesofoverproductionofphosphoenolpyruvatecarboxylaseinc3plants.archbiochembiophys.2003,414:197-203;durrantweetal.systemicacquiredresistance.annurevphytopathol.2004,42:185-209.)。
为了解决上述问题,希望找到合适的能在特定刺激下,激活下游抗二化螟基因表达的诱导型启动子区段。目前,对于诱导型启动子研究,更多的研究进展集中在非生物胁迫诱导中(mishrarc,grovera.intergenicsequencebetweenarabidopsiscaseinolyticproteaseb-cytoplasmic/heatshockprotein100andcholinekinasegenesfunctionsasaheat-induciblebidirectionalpromoter.plantphysiol.2014,166:1646-58;wangjetal.characterizationofwheattasnrk2.7promoterinarabidopsis.planta.2018;roysetal.functionalanalysisoflight-regulatedpromoterregionofatpolλgene.planta.2012,235:411-32),而生物胁迫诱导又更多集中在植株病害诱导中(linch,chency.thepathogen-induciblepromoterofdefense-relatedlsgrp1genefromliliumfunctioninginphylogeneticallydistinctspeciesofplants.plantsci.2017,254:22-31;
技术实现要素:
本发明的目的在于克服现有技术的不足,提供了一种水稻二化螟为害诱导型启动子及其应用,该启动子是从水稻“中花11”(中国农业科学院作物研究所商业经营品种)基因组中克隆合成绿叶挥发物glvs关键基因即为脂氢过氧化物裂解酶基因oshpl2(loc_os02g12680)的启动子,将该启动子及其衍生的其它启动子融合报告基因β-葡糖醛酸酶基因(gus)导入水稻“中花11”,通过southerblot及潮霉素发芽实验,获得单拷贝纯合家系转基因植株,用于后续gus酶活检测实验,其定出了二化螟取食诱导型启动子phpl2及控制其表达量的核心区域,丰富了二化螟诱导型启动子的种类,同时获得的二化螟取食诱导正调控区域,为水稻抗二化螟基因工程和分子育种提供了新的启动子资源;该启动子可以用于抗虫转基因水稻培育及水稻基因工程改良。
为实现上述目的,本发明所设计一种水稻二化螟为害诱导型启动子phpl2,所述水稻二化螟为害诱导型启动子命名为:phpl2,其长度为2009bp,其核苷酸序列如seqidno:1所示。
进一步地,所述水稻二化螟为害诱导型启动子是截取启动子phpl2核心区1447bp的序列,命名为phpl2-1452,其核苷酸序列如seqidno:2所示。
进一步地,所述水稻二化螟为害诱导型启动子是截取启动子phpl2核心区1207bp的序列,命名为phpl2-1212,其核苷酸序列如seqidno:3所示。
进一步地,所述水稻二化螟为害诱导型启动子是截取启动子phpl2核心区898bp的序列,命名为phpl2-903,其核苷酸序列如seqidno:4所示。
进一步地,所述水稻二化螟为害诱导型启动子是截取启动子phpl2核心区371bp的序列,命名为phpl2-376,其核苷酸序列如seqidno:6所示。
查阅分析得到与绿叶挥发物glvs合成相关的基因,并通过qrt-pcr检测受二化螟取食特异诱导上调且不受褐飞虱取食上调的基因oshpl2,分离其启动子,得到不同长度的启动子片段,命名为:phpl2,phpl2-1452,phpl2-1212,phpl2-903,phpl2-623,phpl2-376和phpl2-175其序列如序列表seqidno:1~seqidno:7,然后进行功能鉴定。融合入转化载体dx2181后,申请人分别将其命名为dx2181-phpl2,dx2181-phpl2-1452,dx2181-phpl2-1212,dx2181-phpl2-903,dx2181-phpl2-623,dx2181-phpl2-376和dx2181-phpl2-175。通过分析该启动子驱动gus报告基因在转基因水稻中表达模式发现:该启动子能在二化螟取食后特异驱动gus报告基因表达,同时,与gus酶活检测与gus组织化学染色结果一致。所述启动子phpl2-1452,phpl2-1212,phpl2-903,phpl2-623,phpl2-376和phpl2-175序列,分别是序列表seqidno:2,seqidno:3,seqidno:4,seqidno:5,seqidno:6,seqidno:7所示的序列。他们分别是由启动子phpl2截断的核心区1447bp,1207bp,898bp,618bp,371bp,170bp的序列。对这六种转基因植株接二化螟后发现有三段区域含二化螟取食正调控元件,该三个调控元件分别位于启动子区域-1452至-1212,-903至-623,-376至-175的三段。
上述克隆的oshpl2启动子能被二化螟取食后特异响应,而对褐飞虱取食没有响应,对该启动子的研究有利于进一步理解二化螟取食后引起的间接防御反应关键基因行使功能的过程;该启动子有利于用于二化螟抗性水稻基因工程的改良。
本发明提供了一种在二化螟为害条件下,提高外源基因在转基因水稻中表达水平的方法,利用上述任意一个启动子序列与外源基因gus融合构建成重组植物表达载体,通过农杆菌介导的遗传转化方法导入水稻,在二化螟取食诱导条件下,该外源基因在转基因水稻中表达量显著上升。本发明的具体步骤如下:
通过qrt-pcr检测二化螟或褐飞虱取食后水稻叶鞘组织中合成glvs关键基因的表达量,序列查询使用的数据库是ncbi(https://www.ncbi.nlm.nih.gov/)和tigr(http://rice.plantbiology.msu.edu/),oshpl2基因共1721bp,序列如seqidno:8所示,以这1721bp的序列设计qrt-pcr引物,用于上述检测,结果显示,oshpl2基因能受二化螟取食特异诱导上调表达,不受褐飞虱取食诱导上调表达。
在此结果上,设计引物,用pcr方法从水稻“中花11”基因组中扩增得到一个被命名为phpl2的启动子候选片段,将其插入启动子功能分析载体dx2181(该载体为华中农业大学作物遗传改良国家重点实验室林拥军教授馈赠)的多克隆位点(载体图及多克隆位点等信息见图2)处,组装成dx2181-phpl2载体(图3),通过农杆菌介导的水稻遗传转化方法,将dx2181-phpl2载体转化入水稻“中花11”,t0代转基因植株通过southernblot方法确定单拷贝家系植株(图4),t0代种子通过潮霉素发芽试验,确定纯合家系植株(图5),获得的单拷贝纯合家系植株用于做后续接虫实验。
通过gus酶活检测及gus组织化学染色,考察上述启动子在水稻叶鞘组织中的表达情况。检测结果显示,该启动子在受到二化螟取食后有表达活性,未处理及机械损伤处理条件都无表达活性(图6)。
采用片段缺失方法,构建了6个来源于dx2181-phpl2的5’端缺失片段,并连入转化载体dx2181(图3),同样方式转化水稻“中花11”,并获得单拷贝纯合家系植株用于实验。片段表达模式显示:启动子区域-1452至-1212,-903至-623,-376至-175存在受二化螟取食特异表达正调控元件(图7);由dx2181-phpl2-376进一步截断到dx2181-phpl2-175则不再具有独立启动基因表达功能。同时,我们对dx2181-phpl2-1452,dx2181-phpl2-903,dx2181-phpl2-376这3种含正调控序列的转基因植株进行褐飞虱取食诱导实验,结果发现,该3种启动子不能激活gus报告基因的表达(图8),通过上述实验,我们发现-1452至-1212,-903至-623,-376至-175含有受二化螟取食特异诱导正调控元件,不含有褐飞虱取食诱导相关元件。
本发明还提供了一种上述任意一个启动子在抗二化螟转基因水稻培育中应用。
本发明的有益效果:
(1)本发明鉴定了二化螟取食诱导型启动子phpl2及控制其表达量的核心区域,丰富了二化螟诱导型启动子的种类。
(2)本发明获得的二化螟取食诱导正调控区域,为水稻抗二化螟的基因工程和分子育种提供了新的启动子资源。
附图说明
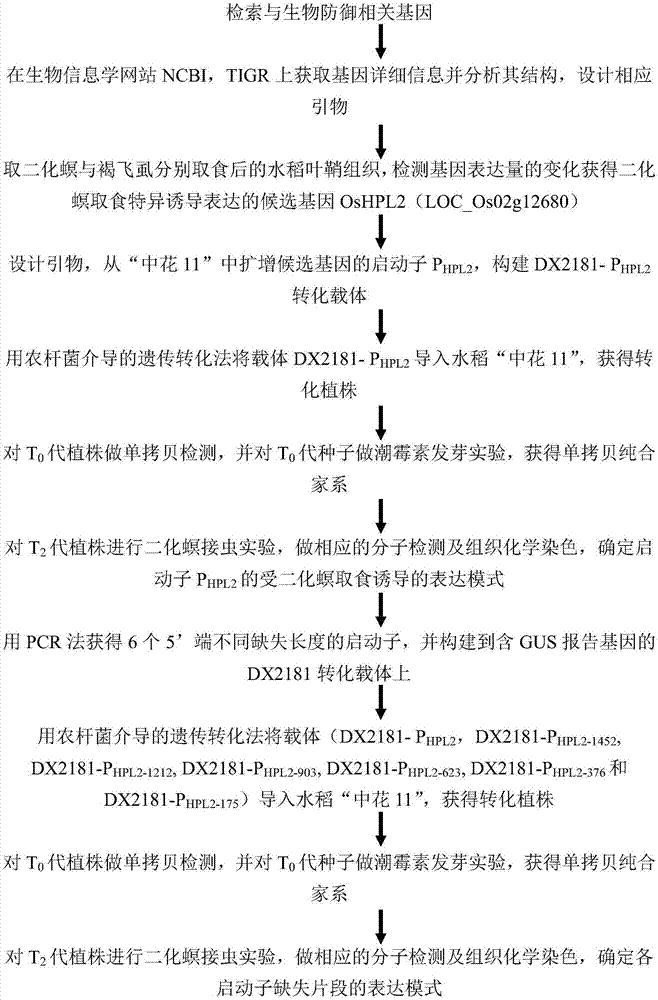
图1:本发明的总体技术路线图。
图2:pdx2181质粒图,本发明使用的转化载体。
图3:phpl2及其系列缺失片段载体示意图。
图4:southerblot检测phpl2t0代植株拷贝数检测。m:代表marker;1-9:分别代表不同转基因植株样品,其中1,2,6,9号孔样品为单拷贝材料。
图5:phpl2t0代种子潮霉素发芽试验。a为阳性纯合家系(发芽率98%);b为阴性纯合家系(发芽率0%)。
图6:phpl2gus组织化学染色。1为二化螟未取食材料;2为二化螟取食材料;3为机械损伤材料。
图7:由phpl2及其系列缺失片段受二化螟取食前后驱动gus基因的转基因植株gus酶活性检测及gus组织化学染色。a为gus酶活检测;b为gus组织化学染色,1为未被二化螟取食材料,2为二化螟取食材料。
图8:二化螟取食诱导正调控序列特异性gus酶活检测。
具体实施方式
下面结合具体实施例对本发明作进一步的详细描述,以便本领域技术人员理解。
实施例1:二化螟取食诱导响应启动子即水稻二化螟为害诱导型启动子phpl2及相应缺失片段的获得
本发明若无特别说明,所使用的参考方法及相应分子生物学基本操作都参考了:j.萨姆布鲁克等,《分子克隆实验指南(第二版)》(中译本),科学出版社1996版的相关信息。抽提水稻“中花11”基因组dna:取分蘖期水稻新鲜叶片3cm,方法参照murray于1980年发表的ctab抽提法(murraymg,thompsonwf.rapidisolationofhighmolecularweightplantdna.nucleicacidsres.1980,8:4321-5),抽提出的dna完全溶解后置于-20℃冰箱保存。
在ncbi和tigr数据库获得oshpl2(loc_os02g12680)基因序列起始密码子atg上游序列,设计特异引物hpl2-f,hpl2-r(表1)并扩增得到二化螟为害诱导型启动子,-2014至-6(起始密码子碱基a为+1)共2009bp,将其命名为phpl2,pcr反应条件:94℃5min,94℃1min,60℃30sec,72℃2min,32个循环,72℃7min,其核酸序列如序列表seqidno:1所示。
取phpl2的pcr产物用0.8%琼脂糖电泳检测。剩余产物用于做ta克隆。使用的试剂盒为北京全式金生物技术公司的peasy-t3载体系统。反应体系为5.0μl,具体操作见试剂盒说明书。待克隆长出后,挑取单克隆用相应抗性lb培养基培养8-10h,抽提质粒,用bamhi和sali双酶切质粒并跑胶检测,将阳性单克隆质粒送南京金斯瑞生物科技公司测序,保留阳性单克隆质粒,用于后续dx2181载体连接。
6个5’端缺失片段与全长启动子共用同一个右引物hpl2-r(表1),左引物根据扩增片段大小不同,分别命名为hpl2-1f,hpl2-2f,hpl2-3f,hpl2-4f,hpl2-5f,hpl2-6f(表1)。pcr模板为测序正确的ta-phpl2质粒。后续操作同构建ta-phpl2的方式进行,即得到六个缺失启动子,分别命名为:phpl2-1452,phpl2-1212,phpl2-903,phpl2-623,phpl2-376和phpl2-175其序列如序列表seqidno:2~seqidno:7,
实施例2:植物表达载体的构建
利用bamhi和sali双酶切载体dx2181,并用天根生化科技有限公司的dna胶回收试剂盒回收载体片段,具体操作见试剂盒说明书,电泳检测其酶切完整性,置于-20℃冰箱保存。
利用bamhi和sali双酶切phpl2及相应缺失片段的ta克隆质粒。用同样方式回收目的片段及检测片段完整性。置于-20℃冰箱保存。
将酶切回收的phpl2片段及相应缺失片段通过酶切位点的粘性末端构建到载体dx2181上(载体图及多克隆位点等信息见图2),电转化入大肠杆菌dh5α。酶切检测与测序后,得到重组表达载体dx2181-phpl2及相应缺失片段载体。通过电转法将载体dx2181-phpl2导入农杆菌菌株eha105,并于-70℃冰箱保存转化菌株,待用于农杆菌介导的遗传转化。
表1本发明中使用的引物序列
表1的说明:a下划线序列表示酶切位点。gtcgac序列表示sali酶切位点,ggatcc序列表示bamhi酶切位点。
实施例3:农杆菌介导的遗传转化
本发明农杆菌介导的遗传转化方法参照华中农业大学作物遗传改良国家重点实验室发表的“农杆菌介导的遗传转化操作手册”所述方法(林拥军等,2002)。转化水稻“中花11”(来源于中国农业科学院作物科学研究所)品种所诱导产生的胚性愈伤组织。分别经过愈伤诱导培养,愈伤继代培养,农杆菌侵染,共培养,筛选得到具有潮霉素抗性的抗性愈伤,再经过分化,生根,炼苗和移栽,得到转基因植株。本发明涉及的农杆菌介导的遗传转化步骤及培养基配方如下所述。
1.试剂和溶液缩写
6-ba(6-苄基腺嘌呤);kt(kinetin,激动素);naa(萘乙酸);iaa(吲哚乙酸);2,4-d(2,4-二氯苯氧乙酸);as(乙酰丁香酮);ch(水解酪蛋白);hn(潮霉素);dmso(二甲基亚砜);n6max(n6大量成分溶液);n6min(n6小量成分溶液);msmax(ms大量成分溶液);msmin(ms小量成分溶液)
2.农杆菌介导的遗传转化
1)诱导愈伤
a.成熟种子去掉颖壳,用75%乙醇浸泡30sec-1min,再用0.15%hgcl2浸泡15-20min,最后用无菌蒸馏水漂洗6~8次,洗净残留hgcl2溶液。
b.每瓶诱导培养基接入8~10粒种子,26℃暗培养35d。
2)愈伤继代
a.提前2-3d准备好继代培养基,使培养基干燥;
b.挑取淡黄色,致密,干燥,活力强的胚性愈伤组织转入继代培养基中,26℃暗培养20d。
3)预培养
挑选近视且相对干燥的胚性愈伤,放于预培养基上黑暗下培养2周,温度25℃。
4)农杆菌培养
a.冰上融化电转化好含转化载体的农杆菌eha105(该菌株来自cambia公司商业化农杆菌菌株),并划线于对应抗性la培养基上,28℃培养2d;
b.将划线培养的农杆菌刮入悬浮培养基(每100ml培养基加入100μlas),28℃,200rpm振荡培养2~3h,然后调整菌液浓度至od600≈0.5。
5)农杆菌侵染
a.将诱导好的愈伤组织收集于灭菌过的瓶内;
b.调节农杆菌的悬浮液至od6000.8-1.0;
c.将愈伤在农杆菌悬浮液中浸泡30min;
d.转移愈伤至灭菌好的滤纸上吸干;放于共培养基上培养3d,温度19-20℃。
6)愈伤水洗与筛选培养
a.灭菌水洗涤愈伤直至看不见农杆菌;
b.浸泡于含400mg/l羧苄青霉素(cn)的灭菌水中30min;
c.转移愈伤至灭菌好的滤纸上吸干;
d.转移愈伤至筛选培养基上培养2周,如此2-3次。
7)愈伤分化
将生长旺盛的抗性愈伤转入分化培养基中,置于光照培养室进行光照培养至分化出再生小苗。
8)生根
待再生小苗的芽长至2-3cm高时即可进行生根。用剪刀和镊子将再生植株生分化培养基上长出的根清除干净,并插入生根培养基中,置于光照培养室培养,直至长出白色新根。
9)炼苗及移栽
待新根生长到2cm左右时,可进行炼苗:揭掉生根培养基封口膜,加入适量自来水,于光照培养室继续培养3d。移栽:洗掉根上残留培养基,将具有良好根系的幼苗转入温室,同时在最初几天保持水分湿润。
3.主要溶液配方
1)n6max母液[10倍浓缩液(10x)]
逐一溶解,然后室温下定容至1000ml。
2)n6min母液[100倍浓缩液(100x)]
室温下溶解并定容至1000ml。
3)铁盐(fe2edta)贮存液(100x)
在一个大三角瓶中加入300ml蒸馏水和硫酸铁(feso4·7h2o)2.78g
在另一个大三角瓶中加入300ml蒸馏水并加热至70℃,然后加入乙二铵四乙酸二钠(na2edta·2h2o)3.73g
在它们都溶解后混合在一起,70℃水浴中保持2小时,定容至1000ml,4℃保存备用。
4)维生素贮存液(100x)
加水定容至1000ml,4℃保存备用。
5)msmax母液(10x)
室温下溶解并定容至1000ml。
6)msmin母液(100x)
室温下溶解并定容至1000ml。
7)2,4-d贮存液(1mg/ml)
2,4-d100mg.
1ml1n氢氧化钾溶解5分钟,然后加10ml蒸馏水溶解完全后定容至100ml,室温保存。
8)6-ba贮存液(1mg/ml)
6-ba100mg.
1ml1n氢氧化钾溶解5分钟,然后加10ml蒸馏水溶解完全后定容至100ml,室温保存。
9)naa贮存液(1mg/ml)
naa100mg.
1ml1n氢氧化钾溶解5分钟,然后加10ml蒸馏水溶解完全后定容至100ml,4℃保存备用。
10)iaa贮存液(1mg/ml)
iaa100mg.
1ml1n氢氧化钾溶解5分钟,然后加10ml蒸馏水溶解完全后定容至100ml,4℃保存备用。
11)葡萄糖贮存液(0.5g/ml)
葡萄糖125g
蒸馏水溶解定容至250ml,灭菌后4℃保存备用。
12)as贮存液
as0.392g
dmso10ml
分装至1.5ml离心管内,4℃保存备用。
13)1n氢氧化钾贮存液
氢氧化钾5.6g
蒸馏水溶解定容至100ml,室温保存备用。
14)kt贮存液(1mg/ml)
kt100mg.
1ml1n氢氧化钾溶解5分钟,然后加10ml蒸馏水溶解完全后定容至100ml,室温保存。
4.培养基配方
1)诱导培养基
加蒸馏水至900ml,1n氢氧化钾调节ph值至5.9,煮沸并定容至1000ml,分装到50ml三角瓶(25ml/瓶),封口灭菌。
2)继代培养基
加蒸馏水至900ml,1n氢氧化钾调节ph值至5.9,煮沸并定容至1000ml,分装到50ml三角瓶(25ml/瓶),封口灭菌。
3)预培养基
加蒸馏水至250ml,1n氢氧化钾调节ph值至5.6,封口灭菌。
使用前加热溶解培养基并加入5ml葡萄糖贮存液和250μlas贮存液,分装倒入培养皿中(25ml/皿)。
4)共培养基
加蒸馏水至250ml,1n氢氧化钾调节ph值至5.6,封口灭菌。
使用前加热溶解培养基并加入5ml葡萄糖贮存液和250μlas贮存液,分装倒入培养皿中(25ml/皿)。
5)悬浮培养基
加蒸馏水至100ml,调节ph值至5.4,分装到两个100ml的三角瓶中,封口灭菌。
使用前加入1ml葡萄糖贮存液和100μlas贮存液。
6)筛选培养基
加蒸馏水至250ml,调节ph值至6.0,封口灭菌。
使用前溶解培养基,加入250μl50mg/ml的hn和400ul250mg/mlcn,分装倒入培养皿中(25ml/皿)。(注:第一次筛选培养基羧苄青霉素浓度为400mg/l,第二次及以后筛选培养基羧苄青霉素浓度为250mg/l)。
7)预分化培养基
加蒸馏水至250ml,1n氢氧化钾调节ph值至5.9,封口灭菌。
使用前溶解培养基,加入250μl50mg/ml的hn和250ul250mg/mlcn,分装倒入培养皿中(25ml/皿)。
8)分化培养基
加蒸馏水至900ml,1n氢氧化钾调节ph值至6.0。
煮沸并定容至1000ml,分装到100ml三角瓶(50ml/瓶),封口灭菌。
9)生根培养基
加蒸馏水至900ml,1n氢氧化钾调节ph值至5.8。
煮沸并定容至1000ml,分装到生根管中(25ml/管),封口灭菌。
10)la培养基(lb培养基不含琼脂粉)
蒸馏水溶解定容至250ml,装于500ml三角瓶,灭菌后室温保存备用。
实施例4:pcr法检测转基因阳性植株
转化苗移入温室后,待其返青,然后分单株取1-2cm幼嫩叶片,抽提其基因组dna为模板,用pcr法检测阳性植株。扩增片段为报告基因gus的部分片段,片段大小为699bp。引物序列为gus-f:gggcgaacagttcctgatta,gus-r:aacgtatccacgccgtattc。pcr反应条件:94℃5min,94℃50sec,57℃30sec,72℃50sec,30个循环,72℃7min。pcr产物经0.8%琼脂糖胶电泳检测。对所有t0代,t1代及t2代植株进行pcr检测,根据结果剔除假阳性转化植株。
利用小量叶片基因组dna抽提方法提取基因组dna:取适量幼嫩叶片,加800μl1.5xctab(1.5xctab配方:1.5%ctab,75mmtris-hcl,15mmedta及1.05mnacl)研磨,转入1.5ml离心管中;65℃水浴30min;加入600μl氯仿/异戊醇(体积比为24:1)上下颠倒数次(约15min),室温下12000r/min离心10min;取500μl上清于一新1.5ml离心管,加入预冷95%乙醇1ml。混匀后置于-20℃,30min;室温下12000r/min离心10min,去上清,用75%乙醇浸洗沉淀,自然干燥;加入100μlddh2o溶解,备用。
实施例5:单拷贝纯合家系植株检测
抽提水稻“中花11”基因组dna:取分蘖期水稻新鲜叶片1g,方法参照murray于1980年发表的ctab抽提法(murraymg,thompsonwf.rapidisolationofhighmolecularweightplantdna.nucleicacidsres.1980,8:4321-5),抽提出的dna完全溶解后置于-20℃冰箱保存,用于southernblot实验。
southernblot探针的制备:用pcr法对探针进行地高辛(dig)标记,以dx2181载体为模板,扩潮霉素基因(hpt)序列作为探针序列,引物序列为hpt-f:agaatctcgtgctttcagcttcga,hpt-r:tcaagaccaatgcggagcatatac。pcr反应条件为:94℃5min,94℃1min,58℃30sec,72℃30sec,32个循环,72℃7min。
水稻基因组酶切,载体dx2181中含有筛选标记基因潮霉素,且不含hindiii酶切位点,因此,选用hindiii对8μg水稻基因组进行完成酶切。对酶切好的dna样品进行30v,24h的1%tae琼脂糖凝胶电泳。用标记好的潮霉素探针与t-dna杂交,具体步骤参见southern1975年发表的方法(southernem.detectionofspecificsequencesamongdnafragmentsseparatedbygelelectrophoresis.j.mol.biol.1975,98:503–517)。dx2181-phpl2单拷贝结果见图4。同样方式对缺失片段转基因植株进行单拷贝检测。
对获得的t0代单拷贝植株进行单株收种,后期单株播种,同时,每个t1代单株独立收种。对获得的种子进行发芽实验,确定其是否为单拷贝纯合家系。具体方法为:成熟种子去掉颖壳,用75%乙醇浸泡30sec-1min,再用0.15%hgcl2浸泡15-20min,最后用无菌蒸馏水漂洗6~8次,洗净残留hgcl2溶液。置于上面所述的含潮霉素的生根培养基中(圆皿),每皿放50粒种子,置于光照培养室培养7天,之后统计发芽率,若是纯合阳性植株则种子发芽率在95%以上,若为杂合阳性植株则种子发芽率在75%左右,若是纯合阴性植株则种子发芽率在0%左右(图5)。
实施例6:gus组织染色法分析phpl2候选片段及相应缺失片段受二化螟取食诱导表达情况
对dx2181-phpl2阳性单拷贝纯合家系植株进行二化螟接虫实验检测,当二化螟取食6小时后,取叶鞘组织进行gus组织化学染色,未接虫水稻作为对照,同时,用机械损伤模拟二化螟造成的物理危害。将叶鞘切成0.5-1cm长度,浸入约400μlgus染液,37℃过夜反应,之后用75%酒精脱色。染色液配方参照jefferson所报道的方法(jeffersonetal.,1987)。结果如图6所示,dx2181-phpl2仅在二化螟取食后有表达,机械损伤与未取食植株都检测不到表达。这一结果证实,phpl2为一个二化螟取食诱导表达启动子。
用同样的办法分析了phpl2系列缺失片段驱动下gus的表达情况(见图7b)。结果表明dx2181-phpl2-1452,dx2181-phpl2-1212,dx2181-phpl2-903,dx2181-phpl2-376均具有被二化螟取食诱导表达的功能,同时发现,当截断到dx2181-phpl2-175后,无论被二化螟取食与否都不在有激活表达功能。
实施例7:启动子phpl2及相应缺失片段受二化螟取食诱导gus酶活检测
用全长或不同缺失片段启动子单拷贝纯合家系植株进行接二化螟实验检测,取二化螟取食植株及未取食植株(对照)叶鞘组织,抽提其总蛋白,测其gus酶活(见图7a)。具体方法参考bradford于1976年报道的方法(bradfordmm.arapidandsensitivemethodforthequantitationofmicrogramquantitiesofproteinutilizingtheprincipleofprotein-dyebinding.analbiochem.1976,72:248-54)。结果表明,dx2181-phpl2-623,dx2181-phpl2-175无论被二化螟取食与否gus酶活都没有变化,而dx2181-phpl2-1452,dx2181-phpl2-1212,dx2181-phpl2-903,dx2181-phpl2-376植株在接二化螟后都比未取食植株有更高显著的表达活性。通过gus酶活结果可知,其中-1452至-1212,-903至-623,-376至-175区间含有受二化螟取食正调控元件存在,并且调控能力显示:-1452至-1212区间,和-903至-623区间有更强的诱导激活表达能力,-376至-175区间诱导激活表达能力较弱。
实施例8:三个诱导正调控区间受二化螟取食诱导专一性检测
上述实验,我们发现-1452至-1212,-903至-623,-376至-175这3个区间含有受二化螟取食诱导表达能力,我们对这3个区域是否受刺吸式口器害虫褐飞虱取食诱导做了特异性检测。利用分别包含这3个区间的转基因植株(dx2181-phpl2-1452,dx2181-phpl2-903,dx2181-phpl2-376)进行褐飞虱取食诱导激活实验,结果如图8所示,褐飞虱取食后,3种转基因植株的gus酶活并没有差异变化,由此可知,该3个区域含有受二化螟取食特异响应正调控元件存在,同时该区域不会被褐飞虱取食诱导激活。
本发明获得了一个水稻二化螟取食诱导型启动子phpl2,为基因工程和分子育种提供了高效的二化螟诱导型启动子资源。
其它未详细说明的部分均为现有技术。尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
序列表
<110>华中农业大学
<120>水稻二化螟为害诱导型启动子及其应用
<141>2018-08-26
<160>8
<170>siposequencelisting1.0
<210>1
<211>2009
<212>dna
<213>水稻(oryzasativa)
<220>
<221>promoter
<222>(1)..(2009)
<400>1
ttgttgccaggtcggggaatagcatggtattatccacagggggaaaaatgttgttaatta60
attagtacgtgttctcgttgtgaccatgcaattagctagtttttttctctttaattagct120
ttgttgctaattattattcaaggttcaagtgtgatatcgatgaatctagtattcaactta180
catggtgctacttgtcagttatatttgtcagcgctcgactaattctcttcttttcgcgtt240
cctcgcgttcggttaatttcgccttccatttactattgactctcgcagaatcaacaggac300
tgatatataggtacaattattttgcgtcttgattatgtacatgtaattccatccatttga360
agaaattactgacaaactaaatttgtacgtaaaatcgtaatttttttacaaagtaagaag420
taagtcaccttaatatgatctatggatcatcgtacctcaaatagtcaaattccacatgca480
gctagatgcatgaattccacggaaatgatgcatgatgttatcgtgcgatcgattgagact540
aattgagaccacatgcagtcttctctatgactgcaagataagaacatacgtggctacgta600
ccttttgttctttcctatagaaggtagaacacgtaagtcgagatgtaatttttttttcca660
gcgtgctctaatcatatctgtgtgcccgaattttgtttggtgatattttttctcaagtga720
aacaccttaatctctcagtaagacatagctgctaattaatcacttttgtgtggctcacgc780
atgcagccattgattgctaaacgggtggatgagatggaagcaacggcaaagtctgccgtt840
gagaccaaaggcagacgatgcagaccccatatatacagtcttttcgttttaaagtataag900
gtattttaattagattgaacacattgatattatatatttagatttatagtgctagaagct960
taggatgtgtcttatctgatcaaataatttttattttaggactgatggagtagtaatttt1020
tctatgtacttagatgtacttttgttcggatatagatttagaaattattatattttgaaa1080
tggaggtggtatttaatttataagctactcctccgtagtatttcggatgatcgatgcaaa1140
tatacatgctcgcgaacttaaatcacacagatatagcccatttaagtggctcatatcagc1200
tcattttaaatggaggtggatatatttttcaccctcagtgatattctctcttttttacaa1260
gtcatccaaaatttcatagttcttttaaaaattaacaagatatattaatatacgatatat1320
cactctaaaaatatgcaaattcaaatttaatatataacatataaataataataaacttga1380
atgtgaaaaatgtgtattatttgcggccagatttattatttattatttctatatttatag1440
gttaaatttgaacttacatgtttgtgacgtgatacatatattgttctatcttattatttt1500
ttagaaaatatttgatgatattttaggcgacatgaaaaacaaaaggatcaacatttcctt1560
aaaagacaaatagattcttctcacttaaaatgacgcgcgcgcgcgtgcacacatatatat1620
agagagtacatgtttatagtcggaaccacatacaagttacattgggatttaaatataaac1680
atgtgtatagtaagtgtatttaatttttacttgtacgtggctccaaccattcatcttatt1740
aaaaaattatataaatatgtaaaagtataagttaaaattatattttatttgatgataaaa1800
caagtcataataaaataaatgatatttatataaaacttttaaataaagggaatgatcaaa1860
tgttatgaaaaaaatctacggcataatatattttgaaatgaacggagtactatttatatc1920
ccaccaaacgaacatcctctcgctcctcgaaccaacccaacacaacacttgcacttgcac1980
tacgtactctcatttcatccgctcccggc2009
<210>2
<211>1447
<212>dna
<213>水稻(oryzasativa)
<220>
<221>promoter
<222>(1)..(1447)
<400>2
ctctatgactgcaagataagaacatacgtggctacgtaccttttgttctttcctatagaa60
ggtagaacacgtaagtcgagatgtaatttttttttccagcgtgctctaatcatatctgtg120
tgcccgaattttgtttggtgatattttttctcaagtgaaacaccttaatctctcagtaag180
acatagctgctaattaatcacttttgtgtggctcacgcatgcagccattgattgctaaac240
gggtggatgagatggaagcaacggcaaagtctgccgttgagaccaaaggcagacgatgca300
gaccccatatatacagtcttttcgttttaaagtataaggtattttaattagattgaacac360
attgatattatatatttagatttatagtgctagaagcttaggatgtgtcttatctgatca420
aataatttttattttaggactgatggagtagtaatttttctatgtacttagatgtacttt480
tgttcggatatagatttagaaattattatattttgaaatggaggtggtatttaatttata540
agctactcctccgtagtatttcggatgatcgatgcaaatatacatgctcgcgaacttaaa600
tcacacagatatagcccatttaagtggctcatatcagctcattttaaatggaggtggata660
tatttttcaccctcagtgatattctctcttttttacaagtcatccaaaatttcatagttc720
ttttaaaaattaacaagatatattaatatacgatatatcactctaaaaatatgcaaattc780
aaatttaatatataacatataaataataataaacttgaatgtgaaaaatgtgtattattt840
gcggccagatttattatttattatttctatatttataggttaaatttgaacttacatgtt900
tgtgacgtgatacatatattgttctatcttattattttttagaaaatatttgatgatatt960
ttaggcgacatgaaaaacaaaaggatcaacatttccttaaaagacaaatagattcttctc1020
acttaaaatgacgcgcgcgcgcgtgcacacatatatatagagagtacatgtttatagtcg1080
gaaccacatacaagttacattgggatttaaatataaacatgtgtatagtaagtgtattta1140
atttttacttgtacgtggctccaaccattcatcttattaaaaaattatataaatatgtaa1200
aagtataagttaaaattatattttatttgatgataaaacaagtcataataaaataaatga1260
tatttatataaaacttttaaataaagggaatgatcaaatgttatgaaaaaaatctacggc1320
ataatatattttgaaatgaacggagtactatttatatcccaccaaacgaacatcctctcg1380
ctcctcgaaccaacccaacacaacacttgcacttgcactacgtactctcatttcatccgc1440
tcccggc1447
<210>3
<211>1207
<212>dna
<213>水稻(oryzasativa)
<220>
<221>promoter
<222>(1)..(1207)
<400>3
gggtggatgagatggaagcaacggcaaagtctgccgttgagaccaaaggcagacgatgca60
gaccccatatatacagtcttttcgttttaaagtataaggtattttaattagattgaacac120
attgatattatatatttagatttatagtgctagaagcttaggatgtgtcttatctgatca180
aataatttttattttaggactgatggagtagtaatttttctatgtacttagatgtacttt240
tgttcggatatagatttagaaattattatattttgaaatggaggtggtatttaatttata300
agctactcctccgtagtatttcggatgatcgatgcaaatatacatgctcgcgaacttaaa360
tcacacagatatagcccatttaagtggctcatatcagctcattttaaatggaggtggata420
tatttttcaccctcagtgatattctctcttttttacaagtcatccaaaatttcatagttc480
ttttaaaaattaacaagatatattaatatacgatatatcactctaaaaatatgcaaattc540
aaatttaatatataacatataaataataataaacttgaatgtgaaaaatgtgtattattt600
gcggccagatttattatttattatttctatatttataggttaaatttgaacttacatgtt660
tgtgacgtgatacatatattgttctatcttattattttttagaaaatatttgatgatatt720
ttaggcgacatgaaaaacaaaaggatcaacatttccttaaaagacaaatagattcttctc780
acttaaaatgacgcgcgcgcgcgtgcacacatatatatagagagtacatgtttatagtcg840
gaaccacatacaagttacattgggatttaaatataaacatgtgtatagtaagtgtattta900
atttttacttgtacgtggctccaaccattcatcttattaaaaaattatataaatatgtaa960
aagtataagttaaaattatattttatttgatgataaaacaagtcataataaaataaatga1020
tatttatataaaacttttaaataaagggaatgatcaaatgttatgaaaaaaatctacggc1080
ataatatattttgaaatgaacggagtactatttatatcccaccaaacgaacatcctctcg1140
ctcctcgaaccaacccaacacaacacttgcacttgcactacgtactctcatttcatccgc1200
tcccggc1207
<210>4
<211>898
<212>dna
<213>水稻(oryzasativa)
<220>
<221>promoter
<222>(1)..(898)
<400>4
tccgtagtatttcggatgatcgatgcaaatatacatgctcgcgaacttaaatcacacaga60
tatagcccatttaagtggctcatatcagctcattttaaatggaggtggatatatttttca120
ccctcagtgatattctctcttttttacaagtcatccaaaatttcatagttcttttaaaaa180
ttaacaagatatattaatatacgatatatcactctaaaaatatgcaaattcaaatttaat240
atataacatataaataataataaacttgaatgtgaaaaatgtgtattatttgcggccaga300
tttattatttattatttctatatttataggttaaatttgaacttacatgtttgtgacgtg360
atacatatattgttctatcttattattttttagaaaatatttgatgatattttaggcgac420
atgaaaaacaaaaggatcaacatttccttaaaagacaaatagattcttctcacttaaaat480
gacgcgcgcgcgcgtgcacacatatatatagagagtacatgtttatagtcggaaccacat540
acaagttacattgggatttaaatataaacatgtgtatagtaagtgtatttaatttttact600
tgtacgtggctccaaccattcatcttattaaaaaattatataaatatgtaaaagtataag660
ttaaaattatattttatttgatgataaaacaagtcataataaaataaatgatatttatat720
aaaacttttaaataaagggaatgatcaaatgttatgaaaaaaatctacggcataatatat780
tttgaaatgaacggagtactatttatatcccaccaaacgaacatcctctcgctcctcgaa840
ccaacccaacacaacacttgcacttgcactacgtactctcatttcatccgctcccggc898
<210>5
<211>618
<212>dna
<213>水稻(oryzasativa)
<220>
<221>promoter
<222>(1)..(618)
<400>5
gtgtattatttgcggccagatttattatttattatttctatatttataggttaaatttga60
acttacatgtttgtgacgtgatacatatattgttctatcttattattttttagaaaatat120
ttgatgatattttaggcgacatgaaaaacaaaaggatcaacatttccttaaaagacaaat180
agattcttctcacttaaaatgacgcgcgcgcgcgtgcacacatatatatagagagtacat240
gtttatagtcggaaccacatacaagttacattgggatttaaatataaacatgtgtatagt300
aagtgtatttaatttttacttgtacgtggctccaaccattcatcttattaaaaaattata360
taaatatgtaaaagtataagttaaaattatattttatttgatgataaaacaagtcataat420
aaaataaatgatatttatataaaacttttaaataaagggaatgatcaaatgttatgaaaa480
aaatctacggcataatatattttgaaatgaacggagtactatttatatcccaccaaacga540
acatcctctcgctcctcgaaccaacccaacacaacacttgcacttgcactacgtactctc600
atttcatccgctcccggc618
<210>6
<211>371
<212>dna
<213>水稻(oryzasativa)
<220>
<221>promoter
<222>(1)..(371)
<400>6
gtcggaaccacatacaagttacattgggatttaaatataaacatgtgtatagtaagtgta60
tttaatttttacttgtacgtggctccaaccattcatcttattaaaaaattatataaatat120
gtaaaagtataagttaaaattatattttatttgatgataaaacaagtcataataaaataa180
atgatatttatataaaacttttaaataaagggaatgatcaaatgttatgaaaaaaatcta240
cggcataatatattttgaaatgaacggagtactatttatatcccaccaaacgaacatcct300
ctcgctcctcgaaccaacccaacacaacacttgcacttgcactacgtactctcatttcat360
ccgctcccggc371
<210>7
<211>170
<212>dna
<213>水稻(oryzasativa)
<220>
<221>promoter
<222>(1)..(170)
<400>7
taaataaagggaatgatcaaatgttatgaaaaaaatctacggcataatatattttgaaat60
gaacggagtactatttatatcccaccaaacgaacatcctctcgctcctcgaaccaaccca120
acacaacacttgcacttgcactacgtactctcatttcatccgctcccggc170
<210>8
<211>1721
<212>dna
<213>水稻(oryzasativa)
<220>
<221>gene
<222>(1)..(1721)
<220>
<221>cds
<222>(73)..(1575)
<400>8
ctcctcgaaccaacccaacacaacacttgcacttgcactacgtactctcatttcatccgc60
tcccggccggcaatggcgccaccgccagtgaactccggcgacgccgccgcc111
metalaproproprovalasnserglyaspalaalaala
1510
gccgccacgggagagaagagcaagctctcgccgtcgggcctccccata159
alaalathrglyglulysserlysleuserproserglyleuproile
152025
cgcgagatacccggcggctacggcgtgcccttcttctcgccgctgcgc207
arggluileproglyglytyrglyvalprophepheserproleuarg
30354045
gaccgcctcgactacttctacttccagggcgccgaggagtacttccga255
aspargleuasptyrphetyrpheglnglyalagluglutyrphearg
505560
tcacgcgtcgcccgccacggcggcgccaccgtgctccgcgtcaacatg303
serargvalalaarghisglyglyalathrvalleuargvalasnmet
657075
ccgcccggccccttcatctccggcaacccccgcgtcgtcgccctcctc351
proproglypropheileserglyasnproargvalvalalaleuleu
808590
gacgcgcgcagcttccgcgtcctcctcgacgactccatggtggacaag399
aspalaargserpheargvalleuleuaspaspsermetvalasplys
95100105
gccgacacgctcgacggcacctacatgccgtcgcgcgcgctcttcggc447
alaaspthrleuaspglythrtyrmetproserargalaleuphegly
110115120125
ggccaccgcccgctcgccttcctcgacgccgccgacccgcgccacgcc495
glyhisargproleualapheleuaspalaalaaspproarghisala
130135140
aagatcaagcgcgtcgtgatgtcgctcgccgccgcgcggatgcaccac543
lysilelysargvalvalmetserleualaalaalaargmethishis
145150155
gtcgcgccggcgttccgcgccgcctttgccgccatgttcgacgccgtc591
valalaproalapheargalaalaphealaalametpheaspalaval
160165170
gaggccggcctcggcgccgccgtcgagttcaacaagctcaacatgagg639
glualaglyleuglyalaalavalglupheasnlysleuasnmetarg
175180185
tacatgctcgacttcacctgcgccgcgctgttcggcggcgagccgccg687
tyrmetleuaspphethrcysalaalaleupheglyglyglupropro
190195200205
agcaaggtggtcggcgacggcgccgtgacgaaggccatggcgtggctc735
serlysvalvalglyaspglyalavalthrlysalametalatrpleu
210215220
gcgttccagctgcacccgatcgcgagcaaggtcgtcaagccatggccg783
alapheglnleuhisproilealaserlysvalvallysprotrppro
225230235
ctcgaggagctactcctgcacaccttctccctgccgccgttcctggtg831
leuglugluleuleuleuhisthrpheserleupropropheleuval
240245250
cggcgtggctacgccgacctgaaggcgtacttcgccgacgccgccgcg879
argargglytyralaaspleulysalatyrphealaaspalaalaala
255260265
gccgtcctcgacgacgccgagaagagccacacgggaatcccgcgcgac927
alavalleuaspaspalaglulysserhisthrglyileproargasp
270275280285
gagctcctcgacaaccttgtgttcgtcgccattttcaacgccttcggc975
gluleuleuaspasnleuvalphevalalailepheasnalaphegly
290295300
ggcttcaagatcttcctgccacacatcgtcaagtggctcgcccgcgcc1023
glyphelysilepheleuprohisilevallystrpleualaargala
305310315
ggcccggagctccacgccaagcttgccaccgaggtccgcgccaccgtg1071
glyprogluleuhisalalysleualathrgluvalargalathrval
320325330
cccaccggcgaggacgacggcatcaccctcgccgccgtcgagcggatg1119
prothrglygluaspaspglyilethrleualaalavalgluargmet
335340345
ccgctggtgaagtcggtggtgtgggaggcgctgcgcatgaacccgccg1167
proleuvallysservalvaltrpglualaleuargmetasnpropro
350355360365
gtggagttccagtacggccacgcgcggcgcgacatggtggtcgagagc1215
valglupheglntyrglyhisalaargargaspmetvalvalgluser
370375380
cacgacgcggcgtacgaggtgcgcaagggggagatgctgttcggctac1263
hisaspalaalatyrgluvalarglysglyglumetleupheglytyr
385390395
cagccgctcgccacccgcgacgagaaggtgttcgaccgcgccggcgag1311
glnproleualathrargaspglulysvalpheaspargalaglyglu
400405410
ttcgtcgccgaccggttcgtcgccggcggcgccgccggcgaccggccg1359
phevalalaaspargphevalalaglyglyalaalaglyaspargpro
415420425
ctgctggagcacgtggtgtggtcgaacgggccggagacgagggcgcca1407
leuleugluhisvalvaltrpserasnglyprogluthrargalapro
430435440445
tcggaggggaacaagcagtgccccgggaaggacatggtggtggcggtg1455
sergluglyasnlysglncysproglylysaspmetvalvalalaval
450455460
gggcggctgatggtggcggagctgttccggcggtacgacacgttcgcc1503
glyargleumetvalalagluleupheargargtyraspthrpheala
465470475
gccgacgtggtggaggcgccggtggagccggtggtgacgttcacgtcg1551
alaaspvalvalglualaprovalgluprovalvalthrphethrser
480485490
ctgacacgggcgtcgtcgggatagcacgcacgtcgacgtcacgtgcgcgccgtg1605
leuthrargalasersergly
495500
ctgtgatttagtactgtactaggttggtggatgttttaattgcgtggttaattattaatc1665
acgcataaagtattaatcatgttttatcatctaacaacaatgaaaatattaatcat1721
- 还没有人留言评论。精彩留言会获得点赞!