一种纳米颗粒的胞吞作用及胞内聚集程度的研究方法与流程
本发明涉及生物技术领域,尤其涉及一种基于暗场显微成像技术的纳米颗粒的胞吞作用及胞内聚集程度的研究方法。
背景技术:
纳米科学技术是近年来迅速发展起来的前沿科技领域,在材料、生命、环境、能源、信息和国家安全等方面具有广阔的应用前景。随着人们逐渐认识纳米科学技术的优点和巨大应用前景的同时,一个新的科学问题-纳米生物效应与安全性,近年来引起了科学界和各国政府的高度重视。
胶体金纳米材料凭借其特殊的光电效应和良好的生物相容性引起了科研工作者的巨大兴趣。近年来,随着合成工艺及其表面功能化修饰技术的日臻成熟,金纳米材料已广泛应用于生物标记、传感成像、分析分离及生物医学等领域。贵金属纳米局域表面等离子体共振(lspr)为光学传感提供了高灵敏、信号可调、易与识别单元偶合的信号转换单元。暗场显微镜又称暗视野显微镜,暗场显微镜是利用斜射照明法阻挡透过标本细节的直射光,以反射光和衍射光来观察样本。普通显微镜下可以看到450nm的细节,而暗场显微镜下能看到4-200nm的极微小物体。基于金属纳米lspr暗场散射成像由于使用设备简单,同时具有良好的空间分辨功能,在生物传感、细胞成像以及医学诊断方面具有明显的优势,成为基于金属纳米lspr光学传感的重要发展方向之一。
纳米尺度的粒子主要通过胞吞作用机制进入细胞,物质在进出细胞的转运过程包括由膜包裹、形成囊泡以及与膜融合或断裂等一系列过程。许多年来人们一直认为纳米颗粒的细胞内化是一个成熟的过程,从一个隔室转移到另一个:这个过程的第一步是早期内涵体(earlyendosome,ee)逐渐成熟变成晚期内涵体(lateendosome,le),最后成为溶酶体,并伴随不同程度的纳米粒子聚集。然而最新的研究结果证明了一个更加复杂的动力学机理,而真实的场景可能是多种机理连续协调的结果。纳米粒子聚集程度影响纳米粒子在细胞内的分布、外排及毒性。为了研究纳米生物效应的机理,我们需要从纳米胞吞发生过程出发,确定纳米材料的吸收、分布、代谢和清除过程及伴随的聚集情况,进而全面地考察和评估其产生的生物效应和安全性。
技术实现要素:
为了弥补现有技术的不足,本发明的目的是提供了一种纳米颗粒的胞吞作用及胞内聚集程度的研究方法。
本发明的目的是通过以下技术方案实现的,一种纳米颗粒的胞吞作用及胞内聚集程度的研究方法,其技术要点是:包括如下步骤:
(1)金纳米颗粒表面单链dna配体修饰:利用柠檬酸还原法制备40nm的金纳米颗粒;
采用3'或5'端修饰巯基的单链dna作为配体(自由伸展,无特殊空间结构),通过au-s键合作用修饰金纳米粒子;
所述金纳米颗粒表面修饰配体的制备方法,包括以下步骤:
dna样品离心管加水之前,预离心3分钟(5000rpm),防止开盖过程中致使dna分子溢出;金纳米颗粒与dna单链浓度的投料比为1:800,混合物室温下避光孵育16-24小时;样品使用之前离心25分钟(5000rpm),除去上清液中未反应的dna分子,样品重分散在无酚红的含1-3%fbs(胎牛血清)的dmem培养基中。
(2)在盖玻片上进行细胞培养:所述细胞为贴壁细胞,将细胞接种在多个盖玻片上,将所述盖玻片放入培养皿中,采用培养基进行培养;
(3)纳米颗粒的细胞内吞作用:移除步骤2)培养皿中的培养基,用无酚红的dmem培养基洗2-3次,加入步骤1)制备的分散在培养基中的金纳米颗粒,将培养皿放回co2培养箱中继续培养12个小时,其间每隔1h从培养皿中取出一个盖玻片,用4%的戊二醛4℃固定6-8h;
(4)通过暗场显微镜观察得到细胞内吞纳米粒子的暗场散射图像,通过图像分析,可以定量纳米颗粒的胞吞过程及由于配体降解导致的不同聚集程度,具体分析方法为:
a.将暗场散射图像由srgb彩色空间转换成l*a*b彩色空间,将得到的所有l*a*b彩色空间图像的像素进行亮度阈值运算,得到非背景像素和背景像素;
b.得到非背景像素采用八连通的洪泛算法进行分割,然后将非背景像素间距离小于或等于给定距离r的子区域合并为同一子区域,得到多个包含单一连续形状的子图像,对于子图像进行色彩比较算法,得到子图像中的非背景像素与给定的金纳米颗粒的特征色彩值的差值小于给定的色彩容差阈值的非背景像素像素点为金纳米颗粒通道,然后将子图像和金纳米颗粒通道分别转换为子图像二值图像和金纳米颗粒通道二值通道;
c.金纳米颗粒通道二值图像,用八连通的洪泛算法对其中的每一非背景像素进行填充,得到单一金纳米颗粒的图像列表,计算单一金纳米颗粒的图像列表中的每一个连续图形的周长和轴比,去掉所述每一个连续图形的周长小于连续图形周长给定值1或所述每一个连续图形的轴比小于连续图形轴比给定值1的图形,将剩余图形作为金纳米颗粒图像。
进一步的,所述40nm纳米金颗粒制备方法为:用柠檬酸钠试剂作还原剂来合成13nm金纳米颗粒,以13nm纳米金粒子作为金种,进一步制备40nm金颗粒。
进一步的,所述金纳米颗粒表面单链dna配体为sh-r36和sh-r36p;
所述sh-r36是36个碱基长度的dna单链(碱基序列为:tcttggagctacatgcctagttacgaccgactgtcc,标记为sh-r36);
所述hs-r36p是具有与sh-r36相同序列的dna单链,但在两端及中间各3个碱基进行硫代修饰(碱基序列为:tcttggagctacatgcctagttacgaccgactgtcc,标记为hs-r36p),硫代修饰可以抑制细胞内酶的降解作用。
进一步的,所述步骤(2)中的贴壁细胞为a549细胞。
进一步的,所述步骤(2)的具体方法为:
(1)盖玻片及载玻片的处理:浓盐酸,双氧水和水按体积比1:1:6配制盐酸双氧水溶液,浸泡玻片1h,再分别用自来水,蒸馏水冲洗,然后在95%乙醇或无水乙醇中浸泡2-6h。用超纯水冲洗干净,用氮气干燥后紫外光照射10分钟,得到洁净的盖玻片和载玻片;
(2)将生长状态良好的a549细胞用胰蛋白酶消化,得到分散的单细胞悬浊液,将a549细胞种在盖玻片上,并加入含有10%fbs的dmem培养基进行培养;a549细胞生长6-8小时后,在明场显微镜下观察细胞覆盖率达60%-80%。
进一步的,所述步骤(3)中固定后的盖玻片用pbs洗2-3次,准备好洁净的载玻片,用甘油将盖玻片封存。
本发明的优点及有益效果为:
本发明方法用dna作为配体,dna碱基进行硫代修饰可以抑制细胞内酶对dna配体的降解作用,进而调控纳米粒子在细胞内的聚集程度。同时,金纳米颗粒局域表面等离子体共振(lspr)光散射的暗场成像,灵密度高,特异性强,操作简单,对纳米颗粒胞吞过程和聚集程度的研究有着重要的意义。
附图说明
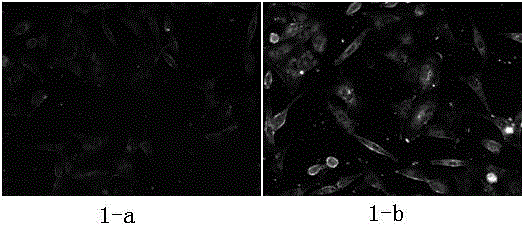
图1为细胞内吞sh-r36和sh-r36p修饰的金纳米颗粒1小时的暗场散射图像;
图1中,1-a为细胞内吞sh-r36修饰的金纳米颗粒1小时的暗场散射图像;1-b为细胞内吞sh-r36p修饰的金纳米颗粒1小时的暗场散射图像;
图2为细胞内吞sh-r36和sh-r36p修饰的金纳米颗粒2小时的暗场散射图像;
图2中,2-a为细胞内吞sh-r36修饰的金纳米颗粒2小时的暗场散射图像;2-b为细胞内吞sh-r36p修饰的金纳米颗粒2小时的暗场散射图像;
图3为细胞内吞sh-r36和sh-r36p修饰的金纳米颗粒4小时的暗场散射图像;
图3中,3-a为细胞内吞sh-r36修饰的金纳米颗粒4小时的暗场散射图像;3-b为细胞内吞sh-r36p修饰的金纳米颗粒4小时的暗场散射图像;
图4为细胞内吞sh-r36和sh-r36p修饰的金纳米颗粒6小时的暗场散射图像;
图4中,4-a为细胞内吞sh-r36修饰的金纳米颗粒6小时的暗场散射图像;4-b为细胞内吞sh-r36p修饰的金纳米颗粒6小时的暗场散射图像;
图5为细胞内吞sh-r36和sh-r36p修饰的金纳米颗粒8小时的暗场散射图像;
图5中,5-a为细胞内吞sh-r36修饰的金纳米颗粒8小时的暗场散射图像;5-b为细胞内吞sh-r36p修饰的金纳米颗粒8小时的暗场散射图像;
图6为细胞内吞sh-r36和sh-r36p修饰的金纳米颗粒10小时的暗场散射图像;
图6中,6-a为细胞内吞sh-r36修饰的金纳米颗粒10小时的暗场散射图像;6-b为细胞内吞sh-r36p修饰的金纳米颗粒10小时的暗场散射图像;
图7为sh-r36和sh-r36p修饰的金纳米颗粒在细胞内聚集程度变化的柱状图;
图7中,7-a为sh-r36修饰的金纳米颗粒在细胞内聚集程度变化的柱状图;7-b为sh-r36p修饰的金纳米颗粒在细胞内聚集程度变化的柱状图;
图8为40nm金颗粒透射电子显微镜表征图像;
图9为40nm金颗粒水合粒径表征图像;
图10为步骤(4)所得的细胞内吞3小时sh-r36修饰的金纳米颗粒图片中细胞的图像;
图11为步骤(4)所得的细胞内吞3小时sh-r36修饰的金纳米颗粒图片中金纳米粒子的图像;
图12为图10和图11merge(共定位)后的图像;
图13为细胞内吞sh-r36修饰的金纳米颗粒3小时的暗场散射图像。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1:
步骤1.分别用sh-r36和sh-r36p修饰金纳米颗粒
(1)13nm金纳米颗粒的制备:取100μm的氯金酸溶液2ml,加入到250ml的圆底烧瓶中,稀释至200ml;加热上述氯金酸溶液直到沸腾,保持磁力搅拌并冷凝回流;待沸腾5min后,加入20ml38.8mm的柠檬酸三钠溶液,观察颜色由浅黄色逐渐变黑,最终变为酒红色;待沸腾15min后,停止加热,等到溶液自然冷却,停止搅拌,收集产物。上述方法制得粒径为13nm的金颗粒,物质的量浓度为15nm,质量浓度为180µg/ml。
(2)40nm金纳米颗粒的制备:取30ml步骤(1)中制备的13nm的金颗粒,270ml的超纯水,3ml的0.2mol/l的nh2oh·hcl,加入到250ml的圆底烧瓶中。室温下充分搅拌,并且逐滴加入25.4mm的氯金酸溶液2.5ml,观察颜色变为深红色,收集产物。上述方法制得粒径为40nm的金颗粒,物质的量浓度为15nm,(见图8,图9)。
(3)分别用sh-r36和sh-r36p修饰金纳米粒子:sh-r36,sh-r36p样品离心管加水之前,预离心3分钟(5000rpm),防止开盖过程中致使dna分子溢出。金纳米颗粒与dna单链浓度的投料比大约为1:800,混合物室温下避光孵育16-24小时。样品使用之前离心25分钟(5000rpm),除去上清液中未反应的dna分子,样品重分散在无酚红的dmem中(含1-3%fbs)。
所述sh-r36是36个碱基长度的dna单链(碱基序列为:tcttggagctacatgcctagttacgaccgactgtcc,标记为sh-r36);
所述hs-r36p是具有与sh-r36相同序列的dna单链,但在两端及中间各3个碱基进行硫代修饰(碱基序列为:tcttggagctacatgcctagttacgaccgactgtcc,标记为hs-r36p),硫代修饰可以抑制细胞内酶的降解作用。
sh-r36和hs-r36p均由生工生物工程(上海)股份有限公司合成。
步骤2.在盖玻片上培养细胞
(1)盖玻片及载玻片的预处理:用盐酸双氧水溶液(浓盐酸,双氧水和水按体积比1:1:6配制)浸泡玻片1h,再分别用自来水,蒸馏水冲洗;然后在95%乙醇或无水乙醇中浸泡2-6h。用超纯水冲洗干净,用氮气干燥后紫外光照射10分钟,得到洁净的盖玻片和载玻片。
(2)将(1)处理的盖玻片铺在24孔板中,接种a549细胞并加入含有10%fbs的dmem培养基进行培养;将生长状态良好的a549细胞用胰蛋白酶进行消化,得到分散的单细胞悬浊液,将a549细胞种在盖玻片上,6-8小时后,显微镜下观察,细胞覆盖率达60%-80%即可,细胞不宜铺满。
步骤3.细胞内吞金纳米颗粒
(1)移除24孔板中的培养基,用无酚红的dmem培养基洗2-3次,分别加入分散在培养基(无酚红dmen+3%fbs)中的不同配体(sh-r36,sh-r36p)修饰的金纳米颗粒,将24孔板放回co2培养箱中继续培养12个小时,其间每隔1h分别从24孔板中各取出一个盖玻片,直至胞吞12个小时,取出的盖玻片用4%的戊二醛4℃固定6-8h。
(2)固定后的盖玻片用pbs(磷酸缓冲盐溶液)洗2-3次,用准备好的载玻片封住并用甘油封边。
步骤4.通过暗场显微镜观察得到暗场散射图像(见图1-图6),并对图像进行亮度和色度分析,观察纳米粒子胞吞情况及由于配体降解导致的不同聚集程度(见图7),具体分析方法如下:
(1)将暗场散射图像由srgb彩色空间转换成l*a*b彩色空间,将得到的所有l*a*b彩色空间图像的像素进行亮度阈值运算,得到非像素背景和背景像素。
(2)得到非背景像素采用八连通的洪泛算法进行分割,然后将非背景像素间距离小于或等于给定距离r的子区域合并为同一子区域,得到多个包含单一连续形状的子图像。对于子图像进行色彩比较算法,得到子图像中的非背景像素与给定的金纳米颗粒的特征色彩值的差值小于给定的色彩容差阈值的非背景像素像素点为金纳米颗粒通道,然后将子图像和金纳米颗粒通道分别转换为子图像二值图像和金纳米颗粒通道二值通道。
(3)金纳米颗粒通道二值图像,用八连通的洪泛算法对其中的每一非背景像素进行填充,得到单一金纳米颗粒的图像列表,计算单一金纳米颗粒的图像列表中的每一个连续图形的周长和轴比,去掉所述每一个连续图形的周长小于连续图形周长给定值1或所述每一个连续图形的轴比小于连续图形轴比给定值1的图形,将剩余图形作为金纳米颗粒图像。
图13为细胞内吞sh-r36修饰的金纳米颗粒3小时的暗场散射图像,经上述方法进行分析,结果见图10和图11,图12为图10和图11merge(共定位)后的图像。
本发明的原理:以dna修饰的金纳米颗粒作为模式材料,利用金纳米颗粒局域表面等离子体共振(lspr)光散射的暗场成像构建传感平台,通过比对金纳米颗粒lspr光散射性质的变化规律,研究纳米颗粒的细胞内吞过程及胞内纳米颗粒聚集程度。
- 还没有人留言评论。精彩留言会获得点赞!