细胞表面微结构3D仿真基质材料及其制备方法与流程
本发明属于细胞生物学与生物物理学应用领域,具体涉及一种细胞表面微结构3d仿真基质材料及其制备方法。
背景技术:
细胞与基质作用研究涉及物质、信号与能量交换等多个方向[chemsocrev43(8):2385-401(2014).]。目前报道较多的是细胞或组织受到二维(two-dimensional,2d)或三维(three-dimensional,3d)材料表面拓扑结构、材料类型、修饰分子以及在外加力学刺激下的细胞相关的功能生物学研究与生物医学应用。由于真实生物体当中的细胞处于一个3d的环境之上,其与周边基质环境和外界力学作用后的生物机能与物质变化与2d基质有明显差别。研究表明,基质材料表面3d结构对诸如细胞粘附、迁移、增殖、信号传导、细胞分化和重编程等细胞功能具有显著调节作用[cell126,677–689(2006);naturematerial.9,82–88(2010);nanoletter.7,2122–2128(2007);cellstemcell5,17–26(2009);natmaterial2013,12:1154-62.;naturecommunication.3,866(2012);naturereview.10,75–82(2009)]。更重要的是,这些功能在诸如组织伤口愈合、组织或细胞重塑、肿瘤生长、细胞分化与再生等广泛的复杂生物学过程中具有紧密相关的影响。例如,一些研究表明细胞所处的3d结构基质材料的生物机械力学特征能帮助调节胚胎干细胞(esc)维持、成体干细胞的自我更新、成体细胞的表观遗传修饰和细胞重编程[chem.soc.rev.,2010,39,354–378.;angew.chem.,int.ed.,2009,48,6465–6468.;adv.mater.,2007,19,3119–3123.;acsnano,2013,7,4785–4798.;nat.nanotechnol.,2008,3,434–439.;nanolett.,2012,12,3881–3886.;curr.opin.cellbiol.,1998,10,566–571.]。另外,3d结构基质材料有助于实施诸如循环肿瘤细胞等稀有细胞的无抗体依赖的粘附性俘获与分离[acsnano,7(1):566-575(2013);bmccancer,16:614(2016).;angew.chem.,int.ed.,2009,48,8970–8973;npgasiamater.,2013,5,e63.;biomaterials,2006,27,6043–6051],促进血小板依赖性粘附收集[angew.chem.,int.ed.,2009,48,6465–6468.;j.am.chem.soc.,2009,131,10467–10472.;small,2005,1,959–963.],协助药学进入细胞[nanolett.,2009,9,716–720.;acsnano,2012,6,7832–7841.]。因此,构建3d的生物介面材料表面可为细胞生物学研究提供一个有利于研究生命新现象,促进细胞相关的功能生物学研究与生物医学应用的研究平台。目前,常用的3d结构包括由一系列材料包括诸如多聚二甲基硅氧烷pdms、ps、聚乳酸聚乙醇酸共聚物(plga)二氧化硅(sio2)、硅晶、石墨、金属钛、金等基质通过人工设计图案进行物理或化学的刻蚀、灌模或由直接沉积、拉伸、挤压等反应构成的包括诸如纤维丝、微球、微管、微簇、微孔、微柱等规则阵列或无规则粗糙表面微结构[chen,adv.mater.,2007,19,3119–3123.;acsnano,2013,7,4785–4798.;angew.chem.,int.ed.,2009,48,6465–6468.;softmatter,2011,7,8642–8649.;chemsocrev,2014,43(8):2385-2401.]。上述各类材料构建的多种3d表面结构实现了与真实生物体内表面结构在微纳尺度上的一致性,但仍然无法实现对细胞或组织所处的真实3d表面的仿真。
技术实现要素:
本发明的目的是提供一种细胞表面微结构3d仿真基质材料及其制备方法,实现对细胞或组织所处的真实3d表面的仿真。
本发明所采用的技术方案为:
细胞表面微结构3d仿真基质材料的制备方法,其特征在于:
该方法以真实细胞为模版,作为模版的真实细胞经固定、硅化、金属镀膜处理,以处理后的模版细胞制备得到的细胞表面微结构仿真3d结构基质材料,保持了真实细胞的排列序列、外表面整体形态轮廓和细胞外表面上的微结构。
具体包括以下步骤:
1)将提供模版的真实细胞种植在玻璃培养皿或载玻片上培养;
2)待细胞密度及形态达到模版细胞要求时进行固定,4℃保存;
3)利用乙腈脱水,随后真空干燥30-60分钟;
4)利用离子溅射仪对模版细胞表面进行金离子溅射镀膜处理10-15分钟;
5)镀金膜处理后的细胞倒置在浓度为0.5%-5%的三氟丙基三氯硅烷或其它硅烷化试剂的丙酮溶液容器之上,自然熏蒸5-30分钟;
6)聚二甲基硅氧烷预聚物与固化剂按质量比为10比0.25、0.5、1、2或3的比例混合,混合物再与丙酮溶液按体积比为10比1或2的比例混合,磁力搅拌30分钟;
7)聚二甲基硅氧烷预聚物与固化剂和丙酮混合物缓慢浇灌于模版细胞表面之上,真空干燥机内抽真空将气压降至500pa以下保持30分钟以上;
8)浇灌之后的模版细胞放置在烘箱内,于50℃-150℃加热固化12小时;
9)固化后聚二甲基硅氧烷连同细胞模版置于无水乙醇当中,从聚二甲基硅氧烷与硅化细胞表面的边缘拉开1毫米缝隙,浸入无水乙醇,置于超声仪内室温超声15-60分钟;
10)待聚二甲基硅氧烷与硅化的模版细胞表面开始松动,用平端捻子轻柔揭起聚二甲基硅氧烷,其间再次使用超声操作及在界面上浸润无水乙醇;
11)剥离下来的拓扑了模版细胞微结构3d仿真表面的聚二甲基硅氧烷基质置于0.01mol/l-0.1mol/l盐酸溶液当中,室温条件下,超声清洗30-60分钟,清洗去除无机杂质;
12)无水乙醇当中,超声清洗,去除仍然残余的镀金膜层,用胶带黏附面反复粘黏直到表面金膜去除,再次置于乙醇中超声清洗,制得凹式仿真3d表面的结构基质材料。
以凹式细胞表面微结构3d仿真基质材料为模版,依次实施步骤3)-11)制得凸式细胞表面微结构3d仿真基质材料。
步骤2)中,固定的方式包括:经磷酸缓冲溶液清洗后,室温条件下用含有3%戊二醛溶液的pbs缓冲溶液对细胞进行固定2小时以上,或用含有4%多聚甲醛的pbs缓冲溶液对细胞进行固定30分钟。
步骤2)对细胞固定后进行硅化处理,再进行清洗;
硅化处理的过程为:加入含有100mmol/l四乙氧基硅烷或正硅酸乙酯的盐酸溶液于室温下100转/分钟摇床上进行硅化处理12小时以上;
清洗的过程为:硅化后的细胞依次用50%、70%、90%和100%的乙醇或甲醇清洗,其中50%、70%和90%的各清洗一次,100%的清洗三次,置于烘箱内200-500℃脱水去有机质12-24小时;
步骤3)中,用50%、70%、90%和100%浓度的乙腈依次脱水,其中50%、70%和90%的各脱水一次,100%的脱水三次,每次15-20分钟。
如所述的方法制得的凹式细胞表面微结构3d仿真基质材料,其特征在于:
具有与真实细胞一致的细胞排列方式和互补的表面微结构。
如所述的方法制得的凸式细胞表面微结构3d仿真基质材料,其特征在于:
具有与真实细胞相同的细胞排列方式和相同的表面微结构。
本发明具有以下优点:
本发明可以通过真实细胞为模版将细胞原有的细胞间排列方式和表面微结构进行3d仿真,作为模版的真实细胞经固定、硅化、金属镀膜处理,处理后的模版细胞可保持真实细胞的排列序列和外表面整体形态轮廓和细胞外表面上的微结构。
本发明建立的一种细胞微结构3d仿真表面具有与真实细胞一致的细胞排列方式,以及一致或互补的表面微结构,同时,用于构建此细胞微结构3d仿真表面的材料具有生物兼容性、机械力可控性、透气性、透光性和表面分子可修饰性,具有适用于后续细胞生物学研究和应用的特征。
附图说明
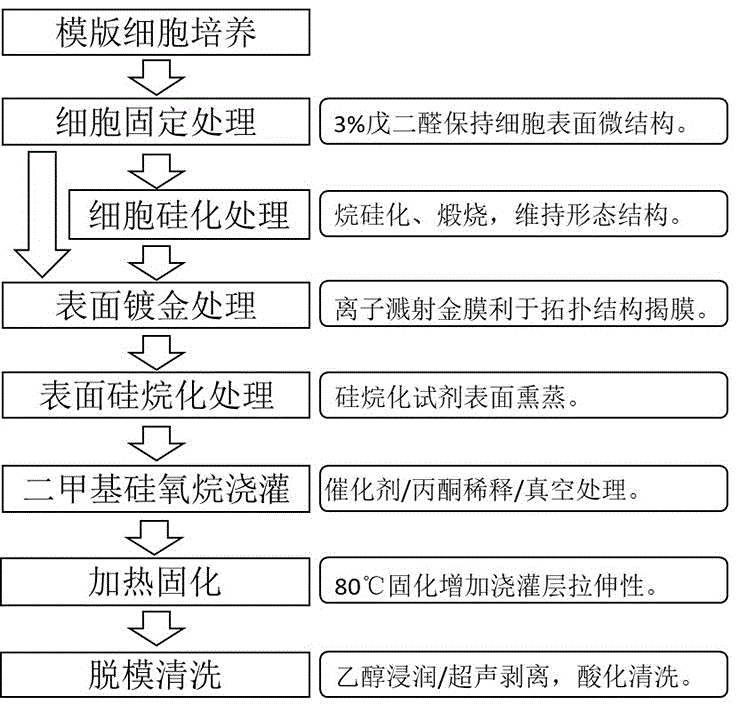
图1为本发明制备流程。
图2为用于本发明制备的模版细胞经化学试剂固定、硅化和表面喷射金膜后的表面形态的扫描电子显微镜分析的代表图。
图3为本发明制备的凹式细胞表面微结构3d仿真表面扫描电子显微镜分析的代表图。
图4为本发明制备的凸式细胞表面微结构3d仿真表面扫描电子显微镜分析的代表图。
具体实施方式
下面结合具体实施方式对本发明进行详细的说明。
本发明涉及一种细胞表面微结构3d仿真基质材料及其制备方法,该方法以真实细胞为模版,作为模版的真实细胞经固定、硅化、金属镀膜处理,处理后的模版细胞作为结构基质材料,保持了真实细胞的排列序列、外表面整体形态轮廓和细胞外表面上的微结构。具体方法包括以下步骤:
1)将作此细胞微结构3d仿真表面提供模版的细胞种植在玻璃培养皿或载玻片上培养;
2)待细胞密度及形态达到模版细胞要求时经磷酸缓冲溶液(pbs)清洗后,室温条件下用含有4%多聚甲醛的pbs缓冲溶液对细胞进行固定30分钟,或用含有3%戊二醛溶液的pbs缓冲溶液对细胞进行固定2小时以上,优选3%戊二醛溶液,4℃保存;
3)细胞固定后加入含有100mmol/l四乙氧基硅烷,或正硅酸乙酯,优选四乙氧基硅烷的盐酸溶液于室温下100转/分钟摇床上进行硅化处理12小时以上,优选24-72小时,
4)硅化后的细胞依次经过0.22微米孔径的滤膜过滤,50%、70%、90%、100%乙醇,或甲醇,优选甲醇清洗,其中50%、70%和90%甲醇各清洗一次,100%甲醇清洗三次,置于烘箱内200-500℃脱水去有机质12-24小时,优选500°c烘干24小时;
5)步骤3)和4)为非必须步骤,优选实施步骤3)和4);
6)用50%,、70%、90%和100%浓度的乙腈依次脱水,其中50%、70%和90%乙腈各脱水一次,100%乙腈脱水三次,每次15-20分钟,随后真空干燥30-60分钟;
7)利用离子溅射仪对模版细胞表面进行金离子溅射镀膜处理10-15分钟;
8)镀金膜处理后的细胞倒置在浓度为0.5%-5%,优选1%的三氟丙基三氯硅烷或其它硅烷化试剂,优选三氟丙基三氯硅烷的丙酮溶液容器之上,自然熏蒸5-30分钟,优选10-15分钟;
9)聚二甲基硅氧烷预聚物与固化剂按质量比为10比0.25、0.5、1、2或3,优选1的比例混合,混合物再与丙酮溶液按体积比为10比1或2,优选1的比例混合,磁力搅拌30分钟;
10)聚二甲基硅氧烷(pdms)预聚物与固化剂和丙酮混合物缓慢浇灌于模版细胞表面之上,真空干燥机内抽真空将气压降至500pa以下保持30分钟以上;
11)浇灌之后的模版细胞放置在烘箱内,于50℃-150℃,优选80℃加热固化12小时;
12)固化后pdms连同细胞模版置于无水乙醇当中,从pdms与硅化细胞表面的边缘拉开1毫米缝隙,置于超声仪内室温超声15-60分钟,优选30分钟;
13)待pdms与硅化的模版细胞表面开始松动,用平端捻子轻柔揭起pdms,其间可再次使用超声操作及在界面上浸润无水乙醇;
14)剥离下来的拓扑了模版细胞微结构3d仿真表面的pdms基质置于0.01mol/l-0.1mol/l盐酸溶液当中,室温条件下,超声清洗30-60分钟,清洗去除二氧化硅等无机杂质;
15)乙醇当中,超声清洗,去除仍然残余的镀金膜层,用胶带黏附面反复粘黏直到表面金膜去除,再次置于乙醇中超声清洗;
16)经上述步骤即制得凹式细胞表面微结构3d仿真表面;
以凹式细胞表面微结构3d仿真表面为模版,依次实施步骤6)-14)可制得凸式细胞表面微结构3d仿真表面为模版。
上述方法制得的凹式细胞表面微结构3d仿真基质材料,具有与真实细胞一致的细胞排列方式和互补的表面微结构。上述方法制得的凸式细胞表面微结构3d仿真基质材料,具有与真实细胞相同的细胞排列方式和相同的表面微结构。所得材料具有生物兼容性、机械力可控性、透气性、透光性和表面分子可修饰性,具有用于后续细胞生物学研究和应用的特征。
具体实施例:
人肾上皮细胞系293t细胞及脐静脉内皮细胞(huvec)经dmem+10%fbs于5cm培养皿中培养至80%以上密度。4mlpbs冲洗3次,3%戊二醛溶液于4℃固定2小时。细胞固定后加入含有100mmol/l四乙氧基硅烷的1mmol/l盐酸溶液于室温下100转/分钟摇床上进行硅化处理24小时。硅化后的细胞依次经过0.22微米孔径的滤膜过滤的50%、70%、90%、100%乙醇,或甲醇,优选甲醇清洗,其中50%、70%和90%甲醇各清洗一次,100%甲醇清洗三次,置于烘箱内200℃烘干24小时。用50%、70%、90%和100%浓度的乙腈依次脱水,其中50%、70%和90%乙腈各脱水一次,100%乙腈脱水三次,每次20分钟,随后真空干燥30分钟。利用离子溅射仪对模版细胞表面进行金离子溅射镀膜处理15分钟。镀金膜处理后的细胞倒置在浓度为0.5%-5%,优选1%的三氟丙基三氯硅烷的丙酮溶液容器之上,熏蒸15分钟。制得用于专利所述的一种细胞表面微结构仿真3d表面的模版细胞。
聚二甲基硅氧烷(pdms)预聚物与固化剂按质量比为10比1比例混合,混合物再与丙酮溶液按体积比为10比1比例混合,磁力搅拌30分钟。pdms预聚物与固化剂和丙酮混合物缓慢浇灌于模版细胞表面之上,真空干燥机内抽真空将气压降至500pa以下保持30分钟以上。浇灌之后的模版细胞放置在烘箱内,于80℃下加热固化12小时。固化后pdms连同细胞模版置于无水乙醇当中,从pdms与硅化细胞表面的边缘拉开1毫米缝隙,置于超声仪内,室温超声30分钟。待pdms与硅化的模版细胞表面开始松动,用平端捻子轻柔揭起pdms,其间可再次使用超声操作及在界面上浸润无水乙醇。剥离下来的拓扑了模版细胞微结构3d仿真表面的pdms基质置于0.01mol/l盐酸溶液当中,室温条件下,超声清洗30分钟,清洗去除二氧化硅等无机杂质。乙醇当中,超声清洗,去除仍然残余的镀金膜层,用胶带黏附面反复粘黏直到表面的金膜去除,再次置于乙醇中超声清洗。制得凹式细胞表面微结构3d仿真基质材料。
以凹式细胞表面微结构3d仿真基质材料为模版,利用离子溅射仪对凹式细胞表面微结构3d仿真基质材料表面进行金离子溅射镀膜处理15分钟。镀金膜处理后的凹式细胞表面微结构3d仿真基质材料倒置在浓度为0.5%~5%,优选1%的三氟丙基三氯硅烷的丙酮溶液容器之上,熏蒸15分钟。聚二甲基硅氧烷(pdms)预聚物与固化剂按质量比为10比1比例混合,混合物再与丙酮溶液按体积比为10比1比例混合,磁力搅拌30分钟。pdms预聚物与固化剂和丙酮混合物缓慢浇灌于用于模版的凹式细胞表面微结构3d仿真基质材料之上,真空干燥机内抽真空将气压降至500pa以下保持30分钟以上。浇灌之后的用于模版的凹式细胞表面微结构3d仿真基质材料放置在烘箱内,于80℃下加热固化12小时。固化后pdms连同细胞模版置于无水乙醇当中,从pdms与镀金模版表面的边缘拉开1毫米缝隙,置于超声仪内,室温超声30分钟。待pdms与凹式细胞表面微结构3d仿真基质材料从镀金膜层表面开始松动,用平端捻子轻柔揭起pdms,其间可再次使用超声操作及在界面上浸润无水乙醇。剥离下来的拓扑了模版细胞微结构3d仿真表面的pdms基质置于0.01mol/l盐酸溶液当中,室温条件下,超声清洗30分钟,清洗去除二氧化硅等无机杂质。乙醇当中,超声清洗,去除仍然残余的镀金膜层,用胶带黏附面反复粘黏直到表面的金膜去除,再次置于乙醇中超声清洗。制得凸式细胞表面微结构3d仿真基质材料。
图1为本发明所述的一种细胞表面微结构3d仿真基质材料制备流程,包括:a.模版细胞培养,将提供模版的真实细胞种植在玻璃培养皿或载玻片上培养;b.细胞固定处理,待细胞密度及形态达到模版细胞要求时进行戊二醛或多聚甲醛固定;c.细胞硅化处理,利用乙腈脱水,随后真空干燥30-60分钟;d.表面镀金处理,利用离子溅射仪对模版细胞表面进行金离子溅射镀膜处理10-15分钟;e.表面硅烷化处理,细胞倒置在0.5%-5%三氟丙基三氯硅烷或其它硅烷化试剂的丙酮溶液上,熏蒸5-30分钟;f.二甲基硅氧烷浇灌,聚二甲基硅氧烷预聚物与固化剂按比例混合,再加入丙酮溶液,搅拌30分钟,缓慢浇灌于模版细胞表面,真空保持30分钟;g.浇灌层加热固化,浇灌之后的模版细胞放置在烘箱内,于50℃-150℃加热固化12小时;h.模版细胞脱模分离与清理,聚二甲基硅氧烷连同细胞模版置于无水乙醇中超声,轻柔揭起聚二甲基硅氧烷,剥离的拓扑了模版细胞微结构3d仿真表面的聚二甲基硅氧烷基质材料置于盐酸溶液超声清洗,用胶带黏附面反复粘黏直到表面金膜去除,再次置于乙醇中超声清洗,制得凹式细胞表面微结构3d仿真基质材料。
图2为用于本发明所述的一种细胞表面微结构3d仿真基质材料制备的模版细胞经化学试剂固定、硅化和表面喷射金膜后的表面形态的扫描电子显微镜分析的代表图。图2a,2b,2c和2d为不同放大倍数下的镀金膜细胞表面的微结构形态和细胞间基质的形态结构。结果表明模版细胞经过固定、硅化和表面喷射金膜等一系列步骤处理后的表面形态仍然与真实状态下的细胞形态保持高度一致。
图3为本发明所述的细胞表面微结构3d仿真基质材料的凹式细胞表面微结构3d仿真基质材料扫描电子显微镜分析的代表图。图3a,3b,3c和3d为不同放大倍数下的凹式细胞表面微结构仿真3d表面结构聚二甲基硅氧烷基质材料表面形态结构。结果表明从模版细胞拓扑下来的凹式细胞表面形态与经过固化、硅化和表面喷金膜等一系统处理后的形态一致。
图4为本发明所述的细胞表面微结构3d仿真基质材料制备的凸式细胞表面微结构3d仿真基质材料的扫描电子显微镜分析的代表图。图4a,4b,4c和4d为不同放大倍数下的凸式细胞表面微结构仿真3d表面结构聚二甲基硅氧烷基质材料表面形态结构。结果表明从凸式细胞表面微结构仿真3d表面结构聚二甲基硅氧烷基质材料表面形态结构拓扑下来的凸式细胞表面形态与凸式细胞表面微结构3d仿真聚二甲基硅氧烷基质材料表面形态结构互补。
本发明的内容不限于实施例所列举,本领域普通技术人员通过阅读本发明说明书而对本发明技术方案采取的任何等效的变换,均为本发明的权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!