与肝移植术后排斥反应相关的miRNA标志物及其应用的制作方法
本发明涉及一种与肝移植术后排斥反应相关的mirna标志物及其应用,属于医学分子生物学领域。
背景技术:
肝移植已被公认为治疗终末期肝脏疾病的首选治疗方案,而我国是肝病高发区,中国已成为仅次于美国的第二肝移植大国。目前移植后的免疫排斥反应是肝移植病人面临的重要问题,急性排斥反应是最常见的一种移植排斥反应,如果发生急性排斥后治疗效果不佳,移植物会在1年之内完全失去功能。
肝脏具有双重的血液供应系统,且肝窦内皮细胞的间隙大,肝脏kupffer细胞还可以吞噬抗原抗体复合物,因此,在移植器官当中,其具有一定程度的天然免疫耐受性,故尚无明确的针对急性排斥反应早期检测的方法。目前寻找早期检测指标、明确其机制作用,并进行早期诊断和干预已成为该领域研究的焦点。
microrna(mirna)是一类仅18~25个核苷酸的单链非编码小分子rna。成熟的mirna及其二聚体,通过完全或不完全碱基互补配对原则与特定靶基因的mrna的3'或5'utr区结合,起到抑制mrna翻译或直接降解其特定mrna的作用。mirna可以调节自身稳态、参与胚胎发育,也可参与肿瘤、病毒感染、炎症及免疫反应等生物学过程。有研究指出,mirna具有调节免疫细胞的功能,是至关重要的免疫调节因子,也是免疫平衡调节中重要的参与者,近年来mirna在移植领域的研究取得了阶段性的成果。
虽然关于mirna在免疫学领域以及移植领域的研究已经颇为广泛,mirna在肝脏疾病方面的研究也被认为是可能成为肝脏病学走向个性化研究的基础,但mirna作为一种新型生物学标志物,其在肝脏移植领域的相关报道相对其他脏器移植较少。在肝脏移植方面,没有与急性排斥相关mirna的研究。
技术实现要素:
为了解决上述技术问题的至少一种,本发明的一方面提供一种与对象肝移植术后排斥反应相关的mirna标志物,该mirna标志物包括选自mir-3546、mir-3584-3p、mir-199a-3p、mir-203a-3p、mir-331-3p和mir-143-3p中的至少一种mirna,来自对象的样本中如果出现mirna标志物水平升高,则表示对象出现排斥反应或者具有出现排斥反应的风险。
在本发明的一个优选实施方案中,所述mirna标志物为1种,即mir-199a-3p。
在本发明的实施方案中,所述对象为哺乳动物。在本发明的优选实施方案中,所述对象为人。
在本发明的实施方案中,所述样本为血清样本。
本发明的第二方面提供一种用于预测对象肝移植术后排斥反应的试剂盒,包括检测mir-3546、mir-3584-3p、mir-199a-3p、mir-203a-3p、mir-331-3p和mir-143-3p中至少一种mirna的试剂。
在本发明的具体实施方案中,所述试剂为特异性引物,其中用于检测mir-3546的特异性引物序列如seqidno:1所示,用于检测mir-3584-3p的特异性引物序列如seqidno:2所示,用于检测mir-199a-3p的特异性引物序列如seqidno:3所示,用于检测mir-203a-3p的特异性引物序列如seqidno:4所示,用于检测mir-331-3p的特异性引物序列如seqidno:5所示,用于检测mir-143-3p的特异性引物序列如seqidno:6所示。
在本发明的实施方案中,利用定量逆转录pcr(qrt-pcr)或阵列杂交来测定mir-3546、mir-3584-3p、mir-199a-3p、mir-203a-3p、mir-331-3p和mir-143-3p中的水平。
本发明的第三方面提供mirna拮抗剂在制备用于预防或减轻对象肝移植术后排斥反应的药物中的用途,所述mirna拮抗剂为mir-3546拮抗剂、mir-3584-3p拮抗剂、mir-199a-3p拮抗剂、mir-203a-3p拮抗剂、mir-331-3p拮抗剂和mir-143-3p拮抗剂中的至少一种。
在本发明的具体实施方案中,所述mirna拮抗剂为mirnaantagomir,mirnaantagomir为与mirna反向互补的序列,全长经过甲基化修饰,在5'端和3'端分别有2个和4个碱基硫代修饰,并且3'端连接有高亲和性胆固醇修饰。
本发明的有益效果
本发明提供的mirna标志物作为肝移植术后排斥反应的标志物的优越性在于:mirna本身仅有18~25个核苷酸,其成熟体稳定存在于细胞质中,因此在肝移植术后mirna极有可能早于临床表现而出现异常,检测其水平可作为肝移植术后排斥反应尤其是急性排斥反应的生物标记物,并且本发明检测定量精确,能够大大提高排斥反应预测的敏感性和特异性。
附图说明
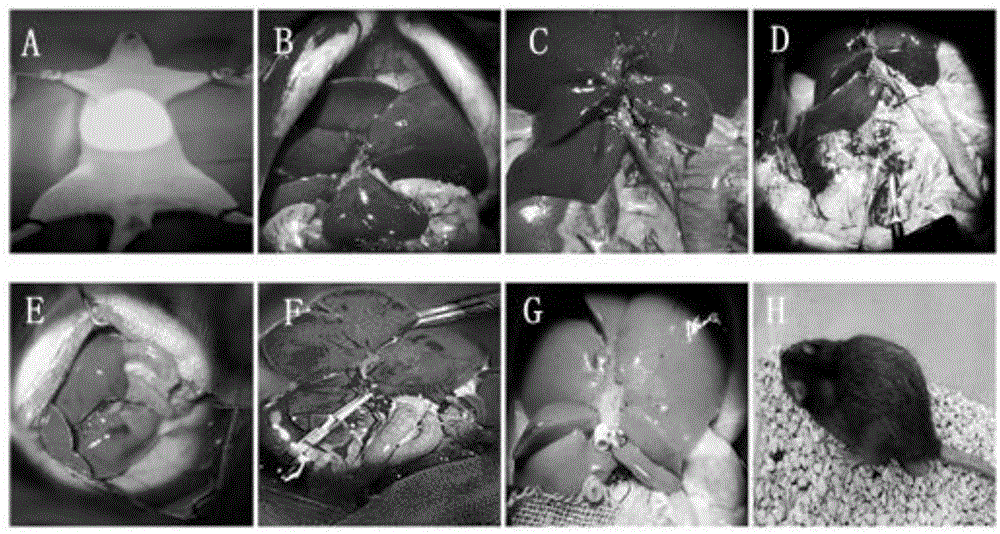
图1示出了大鼠肝脏移植模型建立:a、b、c、d分别是移植模型建立中供体大鼠的手术过程;e、f、g、h为受体大鼠接受肝脏移植并恢复的过程。
图2示出了各实验组大鼠生存率分析图,各组间比较****:p<0.0001。
图3示出了10x肝移植术后第3d肝he染色:a、b分别是it组大鼠肝中央静脉及汇管区;c、d分别是tgf-β1imdc组大鼠肝中央静脉及汇管区;e、f分别为ar组大鼠肝中央静脉及汇管区。
图4示出了10x肝移植术后第7d肝he染色:a、b分别是it组大鼠肝中央静脉及汇管区;c、d分别是tgf-β1imdc组大鼠肝中央静脉及汇管区;e、f分别为ar组大鼠肝中央静脉及汇管区。
图5示出了10x肝移植术后第10d肝he染色:a、b分别是it组大鼠肝中央静脉及汇管区;c、d分别是tgf-β1imdc组大鼠肝中央静脉及汇管区;e、f分别为ar组大鼠肝中央静脉及汇管区。
图6示出了聚类分析各组静脉血差异性mirnas(a)和各组间比较的散点图(b,c,d)。
图7示出了it组与ar组3、7、10d肝组织各组间mirna差异,*:p<0.05;**:p<0.01;ns:p>0.05。
图8示出了it组3d、7d、10d各天间的比较,ns:p>0.05。
图9示出了it组、ar组3、7、10d肝组织各mirna表达趋势。在ar组中:**:p<0.01,3dvs.7d;&&&:p<0.001,3dvs.10d;###:p<0.001,7dvs.10d。
图10示出了mir-199a-3p在tgf-β1imdc组与ar组中的表达差异,**:p<0.001,***:p<0.0001,vs.it组;##:p<0.001,###:p<0.0001,vs.ar组;ns:p>0.05,vs.it组。
图11示出了tgf-β1imdc组和ar组3d、7d、10d各天的相互比较,**:p<0.001,***:p<0.0001,vs.it组;##:p<0.001,###:p<0.0001,vs.ar组;ns:p>0.05,vs.it组。
图12示出了mir-199a-3p表达差异与rai评分的相关性分析。
图13示出了mir-199a-3p在it组3d、7d、10d各天间的比较,ns:p>0.05。
图14示出了mir-199a-3p在tgf-β1imdcs组与ar组中的表达差异,*:p<0.05,**:p<0.001,****:p<0.00001,vs.it组;##:p<0.001,tgf-β1imdcs组vs.ar组;ns:p>0.05。
图15示出了tgf-β1imdcs组和ar组3d、7d、10d各天的相互比较,*:p<0.05,**:p<0.001,****:p<0.00001,vs.it组;##:p<0.001,tgf-β1imdcs组vs.ar组;ns:p>0.05。
具体实施方式
为了使本发明所解决的技术问题、技术方案及有益效果更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。
实施例
以下例子在此用于示范本发明的优选实施方案。本领域内的技术人员会明白,下述例子中披露的技术代表发明人发现的可以用于实施本发明的技术,因此可以视为实施本发明的优选方案。但是本领域内的技术人员根据本说明书应该明白,这里所公开的特定实施例可以做很多修改,仍然能得到相同的或者类似的结果,而非背离本发明的精神或范围。
除非另有定义,所有在此使用的技术和科学的术语,和本发明所属领域内的技术人员所通常理解的意思相同,在此公开引用及他们引用的材料都将以引用的方式被并入。
那些本领域内的技术人员将意识到或者通过常规试验就能了解许多这里所描述的发明的特定实施方案的许多等同技术。这些等同将被包含在权利要求书中。
实施例1
1材料
1.1实验动物及分组
雄性lewis大鼠40只,bn大鼠80只,8-10周龄,体重约200±20g,spf级,5只/笼饲养,12h/12h昼夜节律,两种大鼠均购买于北京维通利华公司。实验动物饲养和手术均在福建医科大学实验动物中心(许可证:no.scxk(min)2012-0001)进行。
lewis大鼠和bn大鼠分别按体重采用随机数字分组法分为lewis移植组、lewis预治疗组、bn对照组(受体)、bn对照组(供体)、bn移植组、bn预治疗组,各组20只。
(1)it组:用bn大鼠作为供、受体进行同种同基因型原位肝移植术;
(2)ar:用lewis作为供体,bn作为受体进行同种异基因型原位肝移植术;
(3)tgf-β1imdcs组:用lewis作为供体,过表达tgf-β1的未成熟树突状细胞(imdcs)预治疗的bn作为受体进行同种异基因型原位肝移植术(移植术5d前对bn预治疗组腹腔一次性注射2×106过表达tgf-β1的imdc细胞)。
1.2microrna上游引物
mir-3546(5'-3'):ataacccgggccaaaagctcac(seqidno.1)
mir-3584-3p(5'-3'):gcccgcatctctggatccc(seqidno.2)
mir-199a-3p(5'-3'):acagtagtctgcacattggtta(seqidno.3)
mir-331-3p(5'-3'):gcccctgggcctatcctagaa(seqidno.4)
mir-143-3p(5'-3'):tgagatgaagcactgtagctca(seqidno.5)
mir-203a-3p(5'-3'):gtgaaatgtttaggaccactag(seqidno.6)
以上引物合成均来自于上海生物工程科技公司。
2方法
2.1大鼠原位肝脏移植动物模型构建
2.1.1动物的选择与准备
(1)动物的选择:选择精神状态佳、毛发光泽好、活动自如、无呼吸道感染的健康大鼠。
(2)动物术前准备:供、受体均禁食12h,自由饮水,这样既保证肝脏处于最佳生理状态,又不至于腹腔过于饱满影响手术。
2.1.2供体手术
(1)将灌注液及保存液均提前备好并储存于4℃冰箱中。(注:灌注液及保存液均为乳酸格林液;保存液放于直径6cm平皿中。)
(2)用2%戊巴比妥钠,按0.3ml/100g腹腔麻醉供体大鼠。
(3)麻醉后,将供鼠用皮筋及胶布固定于手术台,全腹碘伏及酒精消毒2-3遍,铺巾。
(4)用剪刀在大鼠上腹部(剑突以下)做横向切口至腋中线,暴露整个肝脏。
(5)剪断肝脏镰状韧带,暴露肝上下腔静脉及左膈静脉,以4/0缝线靠肝脏端结扎左膈静脉。
(6)游离并剪断肝周韧带,暴露肝尾状叶及盘状乳突叶。
(7)轻轻翻开肝左叶,靠肝脏端结扎食管静脉丛。
(8)将肝脏轻轻往上翻,暴露第二肝门,分离肝固有动脉并以4/0缝线套线,分离并靠门静脉端结扎胃幽门静脉。
(9)进行胆管插管,并将导管固定好后于管口喷撒水生理盐水,防止管腔堵塞。
(10)分离肝下下腔静脉及右肾静脉,并结扎右肾静脉。(注:此处应注意勿将右肾动脉一并结扎。)
(11)分离并结扎右肾上腺静脉丛。
(12)游离出腹腔干以上的腹主动脉,以4/0缝线套线。
(13)在右肾静脉一下水平游离出下腔静脉及腹主动脉,并于下腔静脉注入肝素1ml。
(14)将腹腔干以上腹主动脉结扎。
(15)于下端腹主动脉以150ml/h的速度灌注肝脏,约灌注5ml后将速度改为75ml/h灌注15ml,肝脏外观由红变为白陶土色为佳。
(16)灌注完毕,结扎肝固有动脉。
(17)以“二袖套”法对门静脉及肝下下腔静脉进行套管。
(18)剪断多余连接,取出肝脏,并以生理盐水喷洒后放入保存液中,4℃保存。
2.1.3受体手术
(1)受体大鼠采用自制简易麻醉装置,进行乙醚麻醉,并肌注0.03-0.05mg阿托品,减少呼吸道分泌物。
(2)麻醉后,将受鼠用皮筋及胶布固定于手术托盘中,碘伏及酒精消毒2-3遍,铺巾。
(3)用剪刀在大鼠腹部做纵行切口,上至剑突下,下至腹股沟水平,用拉钩以暴露整个肝脏。
(4)剪断肝脏镰状韧带,暴露肝上下腔静脉及左膈静脉,以4/0缝线靠受体侧结扎左膈静脉。
(5)游离并剪断肝周韧带,暴露肝尾状叶及盘状乳突叶。
(6)轻轻翻开肝左叶,靠肝脏端结扎食管静脉丛。
(7)将肝脏轻轻往上翻,暴露第二肝门,分离肝固有动脉并以4/0缝线结扎。
(8)胆管在靠近分支处上下结扎,并于中间剪断。
(9)分离肝下下腔静脉至右肾静脉水平。
(10)分离右侧肝周韧带,结扎右肾上腺静脉丛。
(11)用动脉夹夹住门静脉及肝下下腔静脉,阻滞血流通过,是大鼠进入无肝期。
(12)于门静脉阻滞上端分叉处,注射5%生理盐水2-3ml,见肝脏大部分变为白陶土色。
(13)阻断钳夹闭肝上下腔静脉,沿肝脏侧剪去肝上下腔静脉。
(14)剪断多余连接,取出肝脏。
(15)将供体肝脏取出,原位放置,并用8/0带针缝线采用单纯连续缝合法吻合受体肝上下腔静脉与供体肝上下腔静脉,缝合接近完成时,喷洒生理盐水,防止气栓形成。
(16)以“二袖套”法套管,先做门静脉套管后,松开阻断钳及动脉夹,恢复肝脏血供,结束无肝期。
(17)再套肝下下腔及做胆管插管。
(18)以生理盐水清洗腹腔,以1/0缝线关腹。
(19)予以10万u/d青霉素肌注,连用3天。
(20)灯照复温2h,2h后饲20%葡萄糖水,24h后自由进食水。
2.2移植后肝脏he染色以及rai评分
(1)移植术后第3、7、10天从移植肝脏中剪取15mm×15mm×1mm的肝组织,置入10%甲醛固定大鼠肝脏标本。
(2)依次经70%-80%-95%-100%乙醇分别脱水6-12h后浸入二甲苯中透明。
(3)浸入已熔化的石蜡中渗透数小时后将标本与石蜡置入包埋槽内制成石蜡组织块后切片进行常规he染色,作组织形态学观察移植肝的病理学变化,根据汇管区炎症、胆管损伤、静脉内膜炎症对各组he切片进行rai计分,再进行总评。
(4)rai评分:根据2003年banff会议的新标准对急性排斥反应的三种特征性病理变化进行半定量评定,即每种病变评分0~3分,生成急性排斥活动指数(rejectionactivityindex,rai),总分为0~9分。美国匹兹堡大学医学院starzl器官移植研究所将rai0~2分定为无排斥,3分为交界性改变,4~5分为轻度排斥,6~7分为中度排斥,8~9分为重度排斥。
2.3移植后生存期的观察与记录
观察大鼠术后的毛发、精神状态、尿色情况及死亡等情况,死亡时解剖大鼠明确其死亡原因并取肝脏组织行病理学检查。
2.4微阵列芯片的mirna的筛选
采用原位肝移植术后于7d大鼠血液样本,并使用mirneasyminikit(qiagen)抽提rna,取200ngtotalrna,使用mirnacompletelabelingandhybkit(agilent)对totalrna进行去磷酸化及标记,与芯片进行杂交反应,agilent芯片扫描仪对杂交后的芯片进行扫描,得到的杂交图片使用agilentfeatureextraction(v10.7)软件进行分析和数据提取。使用agilentgenespring软件对数据进行归一化处理,采用genespring软件进行组间的差异分析筛选出差异性表达的mirna。
ar组和tgf-β1imdcs组分别与it组的mirna谱进行比较,筛选组间差异性较高的mirna,根据fc(abs)值筛选出差异最显著的mirna。
2.5大鼠肝组织的提取
(1)将大鼠乙醚吸入麻醉,固定于手术台,碘伏及75%酒精消毒全腹2-3遍。
(2)在大鼠腹部做“十字”切口,充分暴露肝脏。
(3)用无菌手术剪取下肝脏,置于4℃的rnase-free水中,剪切成小块,装入组织冻存管中并标记组别、编号、采集天数及采集日期,-80℃保存。
(4)留下部分肝组织放入福尔马林溶液保存并标记组别、编号、采集天数及采集日期,制作病理切片。
2.6肝组织中总rna的提取
2.6.1实验前准备
(1)在使用前需按要求在rwtbuffer及rpebuffer中加入96%-100%乙醇。
(2)若rwtbuffer中有结晶,需稍加热使结晶溶解。
(3)将研磨用的磁珠提前用depc水浸泡,于4℃保存备用。
(4)研磨器中装载ep管的研磨部分需在-20℃储存后使用。
(5)预冷离心机4℃。
(6)在以下提取过程中,除去步骤(6),其余步骤均可在15℃-25℃的室温下进行,但速度需快。
2.6.2总rna提取
利用mirneasyminikit(qiagen)提取肝组织总rna。
2.7rna的逆转录(reversetranscriptionpcr,rt-pcr)
(1)定量:根据提取后的rna测量值,将rt-pcr中rna模板定量为100ng。
(2)反应体系如下:
(3)反应条件如下:
(4)反应终产物以1:4加入80ulrnase-freewater稀释后使用,也可于-20℃保存。
2.8实时定量pcr(qrt-pcr)验证microrna
(1)反应体系如下:
(注:10×miscriptprimerassay为内参mir-39-1上游引物,目的基因则为其对应上游引物,加入量需使反应终浓度为500nm。)
(2)反应条件如下:
(注:*此步骤时收集信号)
(3)融解条件如下:
(注:*此步骤时收集信号)
(4)统计学方法
采用2-δδct转化分析,用spss进行统计学分析,所有数据都表示为±sd,用假定值小于0.05被认为具有统计学意义。
2.9大鼠血清的提取
(1)将大鼠乙醚吸入麻醉,固定于手术台,碘伏及75%酒精消毒全腹2-3遍。
(2)在大鼠腹部做“十字”切口,充分暴露肝脏及肝下下腔静脉。
(3)分离肝下下腔静脉,用采血针抽取血液入生化管中,以1000g,4℃,8-10min离心,取上清,-80℃保存。(注:采集时及采集后避免晃动产生溶血现象影响实验结果。)
2.10血清中总rna的提取
2.10.1实验前准备
(1)在使用前需按要求在rwtbuffer及rpebuffer中加入96%-100%乙醇。
(2)若rwtbuffer中有结晶,需稍加热使结晶溶解。
(3)预冷离心机4℃。
(4)在以下提取过程中,除去步骤(6),其余步骤均可在15℃-25℃的室温
2.10.2总rna的提取
同样利用mirneasyminikit(qiagen)提取肝组织总rna。
2.11rna的逆转录(reversetranscriptionpcr,rt-pcr)、实时pcr(real-timepcr)验证mirna方法同前。
2.12增幅计算方法:(ar组2-△ct值)-(it组2-△ct的均数值)/it组2-△ct的均数值,再乘以100%。
3结果
3.1大鼠原位肝脏移植动物模型的构建
本实验利用改良二袖套法以lewis/bn大鼠为供体,bn大鼠为受体成功构建大鼠原位肝脏移植急性排斥反应模型。如图1。
3.2原位肝脏移植后大鼠的生存期观察情况
本实验(包括前期实验)共建立大鼠原位肝脏移植模型157对,除去因急性排斥死亡的大鼠数量,共死亡58对(其中前期实验模型90对,死亡51对;实验模型67对,死亡7对,手术成功率89.6%)。
本实验分别从ar组、it组以及tgf-β1imdcs组中3、7、10d分别各取5只受体大鼠进行样本采集及he切片病理观察,每组各留下5只大鼠进行生存期观察,并以60d作为观察期限。前3d,ar组、it组及tgf-β1imdcs组表现均未出现较大差异;3-7d时,ar组大鼠开始出现精神萎靡、进食减少、尿黄等表现,而it组及tgf-β1imdcs组大鼠未出现不适,精神佳,活动自如;7-10d时,ar组大鼠其中1只大鼠死亡,3只可见腹部彭隆,全组大鼠均出现精神极度萎靡,拒食、呕吐表现,时有稀便,头部常深埋于腹部呈弓形姿势,tgf-β1imdcs组仅1只大鼠出现精神萎靡、稀便等症状,其余大鼠与it组大鼠情况大致相同,未出现明显不适。通过观察发现,ar组大鼠均在8-13d内死亡,tgf-β1imdcs组大鼠在17-25d内死亡,it组大鼠最早一只死亡于第22天,在第60d时仍有一只大鼠存活。具体分析如图2。
3.3移植后肝脏he染色以及rai评分
3.3.1各组肝移植后肝脏he切片观察急性排斥情况
将肝脏移植术后第3、7、10d的大鼠肝脏通过he染色进行病理学分析:(1)it组在第3、7、10d的肝小叶结构排列正常,仅汇管区有少量淋巴细胞浸润;(2)tgf-β1imdcs组各天肝小叶结构基本正常,第3d肝脏仅有少量淋巴细胞浸润,第7d和第10d肝脏汇管区部分扩张,中量淋巴细胞浸润;(3)ar组表现为3d-10d内,随着时间的延长,炎症细胞逐渐增多,以淋巴细胞为主,尤其以第10d最为严重,he切片可见肝脏汇管区重度炎症、重度中央静脉周围炎伴中央静脉周围肝细胞坏死、胆管上皮破坏和肝小叶结构破坏。如图3、4、5分别为第3、7、10天各组肝脏切片。
3.3.2各组肝移植后肝脏rai的评分
he切片显示移植术后第3d时ar组开始出现急性排斥现象,第7d时各组急性排斥反应的特征均开始出现,it组rai评分约为1-3分,属于无排斥或非确定型急性排斥反应;tgf-β1imdcs组约为5-6分,属于轻-中度排斥反应;ar组约7-8分,属于中-重度排斥反应。随着时间延长,在移植后10dtgf-β1imdcs组约7-8分,属于中-重度排斥反应;ar组约为8-9分,属于重度排斥。如表1。
表1各实验组移植后急性排斥反应rai评分
3.4微阵列芯片的mirna的筛选
将芯片数据中ar组和tgf-β1imdcs组分别与it组比较(图6,表2):mir-3546、mir-3584-3p、mir-199a-3p、mir-203a-3p、mir-331-3p、mir-143-3p有明显表达差异,其中以mir-199a-3p的fc(abs)值差异最显著(ar组vsit组:fc(abs)=495,p<0.05;tgf-β1imdcs组vsit组:fc(abs)=27.9,p<0.05)。
表2组间差异性mirnas情况
3.5验证肝组织中急性排斥反应早期变化的mirna
3.5.1it组与ar组中各时间点各mirnas的差异表达情况
在3、7、10d的肝组织中筛选具有肝移植急性排斥反应特异性的mirna,ar组与it组比较发现,mir-3546在第7d有差异性表达,mir-3584-3p和mir-331-3p分别在第3d和第10d有差异性表达,mir-199a-3p在第3、7、10d有差异性表达,且具有统计学差异(p<0.05),如图7。
3.5.2验证mir-199a-3p在各组中的表达情况
3.5.2.1验证mir-199a-3p在it组中的表达情况
通过比较it组mir-199a-3p的表达情况,且mir-199a-3p在it组3d、7d、10d各天中的表达差异没有统计学意义。如图8。
3.5.2.2验证mir-199a-3p在it组和ar组中3d、7d、10d的表达趋势
比较mirnas在ar组3、7、10d各时间点表达量的差异及趋势,mir-199a-3p在3d、7d、10d各时间点的表达均有差异,且逐渐递增,并具有统计学意义(p<0.05),且随时间延长,mir-199a-3p表达量逐渐递增。如图9。
3.5.2.3验证mir-199a-3p在tgf-β1imdcs组和ar组中的表达情况
与it组比较,ar组在第3d、7d、10d均出现了表达差异,并随着时间点的延长,差异越明显,tgf-β1imdcs组在第3d和7d未出现明显表达差异,在第10d出现了表达差异。如图10。
3.5.2.3比较mir-199a-3p在tgf-β1imdcs组和ar组中各天的表达情况
tgf-β1imdcs组第3d和第7d的表达差异无统计学意义,但第3d和第10d以及第7d和第10d出现表达差异;ar组中,第3d、7d和10d的差异均具有统计学意义。如图11。
3.5.3mir-199a-3p表达差异与rai评分的相关性分析
ar组中,移植后mir-199a-3p的表达差异与rai评分进行相关性分析,结果提示随着急排反应越严重,即rai评分越高,mir-199a-3p表达差异越明显。如图12。
3.6验证mir-199a-3p在血清中的表达情况
3.6.1mir-199a-3p在it组中的表达情况
通过比较it组mir-199a-3p的表达情况,mir-199a-3p在it组3d、7d、10d各天中的表达差异没有统计学意义。如图13。
3.6.2mir-199a-3p在tgf-β1imdcs组和ar组中的表达情况
与it组比较,ar组在第3d、7d均出现了表达差异,tgf-β1imdcs组在第7d出现表达差异,而在第3d未出现表达差异。如图14。
3.6.3比较mir-199a-3p在tgf-β1imdcs组和ar组中各天的表达情况
tgf-β1imdcs组和ar组的第3d和第7d、第7d和第10d比较,表达差异均有统计学意义,但第3d和第10d比较差异无统计学意义。如图15。
3.7mir-199a-3p在血清中的预警作用分析
以it组表达量作为基量,比较ar组增幅,在肝脏移植后前7d,当rai值约为3-4分时,属于轻度排斥,此时增幅约为74.72%;当rai值约为7-8时,属于中-重度排斥,此时增幅约为662.85%。肝脏移植后7d内,当增幅越大时,rai值越大,提示急排反应越严重,如表3。
表3移植后7d内ar组的增幅与rai评分
因此,可通过向鼠施用mirna拮抗剂来降低相应mirna水平,常见的拮抗剂为microfftmmirnaantagomir。
microfftmmirnaantagomir是经过特殊化学修饰的mirna拮抗剂,antagomir通过与体内成熟mirna强竞争性结合,从而阻止mirna与其靶基因mrna的互补配对,进而抑制mirna发挥作用。
mirnaantagomir均为mirna成熟链的反向互补序列,全链进行甲基化修饰,在5'端和3'端分别有2个和4个碱基硫代修饰,并在3'端连接有高亲和性胆固醇修饰。与普通抑制剂相比,microfftmmirnaantagomir在动物体内外具有更高的稳定性和抑制效果,更易通过细胞膜、组织间隙,而富集于靶细胞。mirnaantagomir在细胞实验中转染效率更高,甚至不需要转染试剂,从而避免了转染试剂包装过程的复杂步骤及其对实验的影响。在动物实验中可用全身或局部注射等方法进行给药,作用效果持续时间可长达6周。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!