一种microRNA-181c-5p促进人源iPS定向分化为胰岛β细胞的方法与流程
本发明属于生物技术领域,尤其涉及一种microrna-181c-5p促进人源ips定向分化为胰岛β细胞的方法。
背景技术:
糖尿病已成为全球性的多发病和难治性的代谢性疾病。世界卫生组织最新公布数据显示,2014年全球18岁以上的成年人约有9%罹患糖尿病。在我国,糖尿病患者已达1.1亿,居全球首位。糖尿病可分为i型和ii型,其中i型糖尿病是一种自身免疫性疾病,是由自身免疫细胞过度活化攻击胰岛β细胞,从而导致胰岛β细胞大量死亡、胰岛素分泌不足。传统的药物治疗或重组胰岛素治疗并不能延缓糖尿病的病程进展,仍有很多患者发生急性或慢性并发症。胰岛移植能够有效地改善患者的糖代谢紊乱和生活质量,为胰岛损伤性疾病的治疗带来了新的希望。但是,胰岛供体不足和移植后免疫排斥反应极大地限制了这种治疗的应用。因此,寻找胰岛β细胞替代细胞资源是解决糖尿病治疗的前沿课题。
近年来,干细胞和再生医学等领域的飞速发展,为解决胰岛β细胞再生来源的问题带来了新的希望。干细胞具有在一定条件下自我更新和多向分化潜能,按其来源可分为胚胎干细胞(embryonicstemcells,escs)、成体干细胞(adultstemcells,ascs)和诱导多能干细胞(inducedpluripotentstemcell,ipscs)。将干细胞定向诱导分化为胰岛β细胞已逐渐成为人们寻找胰岛β细胞替代物的新资源。成体干细胞包括胰腺来源的成体干细胞和非胰腺来源的成体干细胞。hao等将纯化的非内分泌胰腺内皮细胞和人胎儿胰腺组织共同移植到免疫缺陷鼠的肾包膜下,发现非内分泌胰腺内皮细胞可分化成胰岛β细胞,证实了胰腺内存在成体干细胞。2011年,nakamura等发现小鼠的胰岛内存在少量非胰岛β细胞来源的胰岛素阳性细胞,这类细胞具有干细胞特征,可进行体外扩增,并能够分化成胰岛β细胞。但是,胰腺来源的成体干细胞数量稀少且缺乏特异性的生物标记,难以纯化和扩增,制约了其进一步的研究与应用。在成体干细胞向胰岛β细胞分化的研究中,间充质干细胞(mesenchymalstemcells,mscs)是使用最广泛的非胰腺组织来源的干细胞。mscs是属于中胚层来源的一类多能干细胞,广泛存在于骨髓基质、脂肪、脐带、皮肤真皮等组织中,取材简便易行,且在适当的环境下可分化为造血细胞、肌细胞、肝细胞以及软骨细胞等细胞。骨髓来源的间充质干细胞(bonemarrowmesenchymalstemcells,bmscs)经分离纯化并诱导后,可在体外分化成胰岛β细胞,表达胰岛β细胞特有的生物标记。近年来,研究发现脐带间充质干细胞(umbilicalcordmesenchymalstemcells,ucmscs)、脂肪间充质干细胞(adipose-derivedmesenchymalstemcells,admscs)和肝干细胞同样具备分化为胰岛β细胞的能力,但分化效率低、细胞来源有限、体外扩增量不足,仍不能满足临床移植需求。胚胎干细胞和诱导多能干细胞具有向胰岛β细胞分化的能力。目前,国内外科学家们通过在体外模拟胰腺胚胎发育微环境,利用小分子化合物和细胞因子等物质将escs和ipscs诱导分化为胰岛β细胞用以治疗糖尿病。2006年d’amour等首次将hescs诱导分化为可分泌胰岛素的细胞,命名为胰岛素分泌细胞(insulinproductioncells,ipcs)。hrvatin等诱导hipscs分化获得表达胰岛β细胞标志分子的细胞,这种细胞在体内外均可分泌少量胰岛素,但却不具有葡萄糖应答能力。随后,多个研究小组模拟胰腺体内发育过程成功将hescs和hipscs诱导分化为胰岛β细胞,移植后可扭转小鼠高血糖症状,但仍不能达到人正常胰岛移植后的效果。2014年pagliuca等优化胰岛前体细胞成熟步骤,将hipscs来源的胰岛β细胞分化效率提高到约38%,移植后给予小鼠不同浓度的葡萄糖刺激,人胰岛素分泌量与其血糖浓度呈正相关。但该细胞在基因表达及表观修饰状态上与人正常胰岛β细胞存在明显差异。2015年russ等将hescs来源的胰岛β细胞分化效率提高到约23%,细胞内胰岛素蛋白总量相当于人正常胰岛β细胞的59%,移植糖尿病小鼠后c-肽释放量约为人正常胰岛的1/5.5。
近年来,多能干细胞体外定向分化的胰岛β细胞用以治疗糖尿病已成为研究热点。其中,人源ips干细胞的细胞来源丰富、免疫原性低、具有在一定条件下分化为胰岛β细胞的潜力,且避免了胚胎干细胞存在的伦理问题,是治疗糖尿病理想的种子细胞之一。但该技术尚未在“功能成熟”和“分化效率”两个关键技术难题上取得突破性进展,严重地制约了其临床应用。因此,解决以上两个关键技术难题已成为胰岛β细胞体外分化技术的突破口。
技术实现要素:
本发明的一个目的是提供microrna-181c-5p、或其编码基因、或表达所述编码基因的重组载体、重组病毒或转基因细胞的用途。
本发明提供microrna-181c-5p、或其编码基因、或表达所述编码基因的重组载体、重组病毒或转基因细胞在促进干细胞定向分化为胰岛β细胞中的应用;
或,本发明提供了microrna-181c-5p、或其编码基因、或表达所述编码基因的重组载体、重组病毒或转基因细胞在制备促进干细胞定向分化为胰岛β细胞产品中的应用。
本发明另一个目的是提供一种使干细胞定向诱导分化为胰岛β细胞的方法。
本发明提供的方法,包括如下步骤:
1)提高离体干细胞中microrna-181c-5p活性和/或表达量,得到转基因细胞;
2)将所述转基因细胞进行诱导分化培养,得到胰岛β细胞。
上述方法中,
所述提高离体干细胞中microrna-181c-5p活性或表达量为使所述离体干细胞过表达microrna-181c-5p;
和/或,所述使离体干细胞过表达microrna-181c-5p为将microrna-181c-5p的编码基因导入离体干细胞中。
上述方法中,
所述microrna-181c-5p的编码基因通过重组病毒导入离体干细胞;
和/或,所述重组病毒为重组慢病毒;
和/或,所述重组慢病毒为将重组载体导入细胞中,包装得到表达microrna-181c-5p的重组病毒;
和/或,所述重组载体为将microrna-181c-5p的编码基因导入表达载体中,得到表达microrna-181c-5p的重组载体。
上述方法中,
所述诱导分化培养包括如下步骤:
1)将所述转基因细胞在第一阶段诱导培养液中诱导培养,实现分化为限定性内胚层细胞,得到第一阶段诱导分化后细胞;
2)将所述第一阶段诱导分化后细胞在第二阶段诱导培养液中诱导培养,实现分化为前肠管内胚层细胞,得到第二阶段诱导分化后细胞;
3)将所述第二阶段诱导分化后细胞在第三阶段诱导培养液中诱导培养,实现分化为胰腺祖细胞,得到第三阶段诱导分化后细胞;
4)将所述第三阶段诱导分化后细胞在第四阶段诱导培养液中诱导培养,实现分化为胰岛β细胞,得到第四阶段诱导分化后细胞,即得到胰岛β细胞;
所述第一阶段诱导培养液含有如下诱导因子:n2-supplement、b27-supplement、activina(激活素a)和wortmannin;
所述第二阶段诱导培养液含有如下诱导因子:its-supplement、b27-supplement、ra(retinoicacid,全反式维甲酸)、kgf(角质细胞生长因子)和noggin;
所述第三阶段诱导培养液含有如下诱导因子:its-supplement、n2-supplement、ra(retinoicacid,全反式维甲酸)、kgf(角质细胞生长因子)和egf(表皮生长因子);
所述第四阶段诱导培养液含有如下诱导因子:its-supplement、bmp4(骨形成蛋白-4)、bfgf(basicfibroblastgrowthfactor,碱性纤维母细胞生长因子)、nicotinamide(尼克酰胺)和exendin-4(肠促胰岛素类似物)。
上述方法中,
所述在第一阶段诱导培养液中诱导培养时间为4天;
所述在第二阶段诱导培养液中诱导培养时间为6天;
所述在第三阶段诱导培养液中诱导培养时间为5天;
所述在第四阶段诱导培养液中诱导培养时间为7-15天。
上述方法中,所述第一阶段诱导培养液含有如下诱导因子:0.5倍稀释n2-supplement、0.5倍稀释b27-supplement、100ng/mlactivina和1μmwortmannin;
所述第二阶段诱导培养液含有如下诱导因子:0.5倍稀释its-supplement、0.5倍稀释b27-supplement、2μmra、20ng/mlkgf和100ng/mlnoggin;
所述第三阶段诱导培养液含有如下诱导因子:1倍稀释its-supplement、1倍稀释n2-supplement、100nmra、20ng/mlkgf和50ng/mlegf;
所述第四阶段诱导培养液含有如下诱导因子:1倍稀释its-supplement、10ng/mlbmp4、10ng/mlbfgf、10mmnicotinamide和50ng/mlexendin-4。
上述方法中,所述各个阶段诱导培养液为将该诱导液中的诱导因子按照浓度添加基础培养基中得到;
和/或,所述第一阶段诱导培养液为将该诱导液中的诱导因子按照浓度添加到含有体积百分含量0.2%bsa的dmem/f12培养基中;
和/或,所述第二阶段诱导培养液为将该诱导液中的诱导因子按照浓度添加到含有体积百分含量0.5%bsa的f12/imdm(f12和imdm按照体积比1:1混合)培养基中;
和/或,所述第三阶段诱导培养液为将该诱导液中的诱导因子按照浓度添加到含有体积百分含量0.5%bsa的dmem/h培养基中;
和/或,所述第四阶段诱导培养液为将该诱导液中的诱导因子按照浓度添加到dmem/f12培养基中。
由上述的方法制备的胰岛β细胞也是本发明保护的范围。
或,由上述的方法制备的转基因细胞也是本发明保护的范围。
本发明第3个目的是提供一种使干细胞定向诱导分化为胰岛β细胞的试剂盒。
本发明提供的试剂盒,包括诱导因子和培养基组;
所述诱导因子为如下1)-3)中任一种:
1)microrna-181c-5p;
2)microrna-181c-5p的编码基因;
3)表达microrna-181c-5p的重组载体、重组病毒或转基因细胞;
所述培养基组由上述的第一阶段诱导培养液、所述第二阶段诱导培养液、所述第三阶段诱导培养液和所述在第四阶段诱导培养液组成。
上述试剂盒在诱导干细胞定向分化为胰岛β细胞中的应用也是本发明保护的范围;
或上述试剂盒在制备诱导干细胞定向分化为胰岛β细胞产品中的应用也是本发明保护的范围。
上述中,
所述干细胞为胚胎干细胞或诱导多能干细胞;
和/或,所述诱导多能干细胞来自人或哺乳动物;
和/或,所述哺乳动物具体为大鼠、小鼠、猴、狗、猫、牛、兔、马或猪。
上述中,所述microrna-181c-5p的核苷酸序列为序列2。
所述microrna-181c-5p编码基因的核苷酸序列为序列1或序列2的编码基因。
所述人源干细胞为正常人皮肤成纤维细胞来源的ips细胞;
本发明的优势在于:1、采用过表达microrna-181c-5p的方式,大幅度提高了microrna-181c-5p的表达水平,上调约14.8倍;2、本发明体外定向诱导人源ips分化为胰岛β细胞过程中,microrna-181c-5p呈现逐渐上调表达的趋势,能够促进胰岛β细胞分化;3、采用过表达microrna-181c-5p的方式,大幅度提高了体外定向诱导人源ips分化的效率,本发明中限定性内胚层细胞的分化效率高达99.3%;4.采用过表达microrna-181c-5p的方式,大幅度提高了体外定向诱导人源ips分化的效率,本发明中胰腺祖细胞的分化效率达71.8%;5.采用过表达microrna-181c-5p的方式,大幅度提高了体外定向诱导人源ips分化的效率,本发明中胰岛β细胞的分化效率达35.8%;6.本发明中获得的胰岛β细胞在高糖刺激下胰岛素和c-肽的分泌水平相当于人正常胰岛β细胞的1/6;7.采用过表达microrna-181c-5p的方式,本发明中限定性内胚层标志基因、胰腺祖细胞标志基因和胰岛β细胞标志基因的表达量显著提高。
附图说明
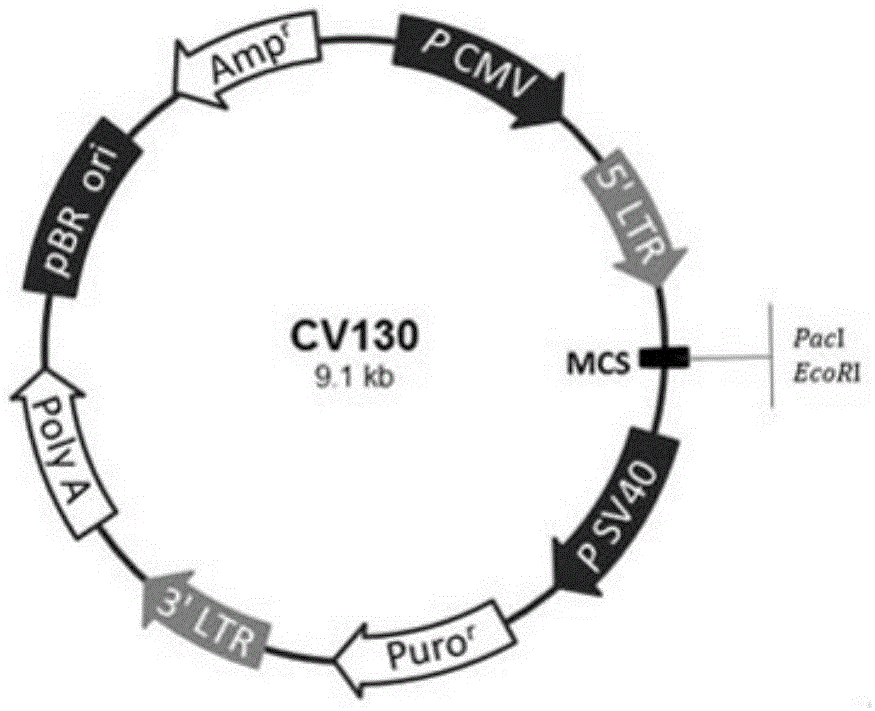
图1为cv-130载体图谱。
图2为real-timepcr鉴定microrna-181c-5p在胰岛β细胞分化过程中表达差异。
图3为real-timepcr鉴定microrna-181c-5p过表达效率。
图4为免疫荧光检测限定性内胚层标志基因表达水平。
图5为流式细胞术检测限定性内胚层分化效率。
图6为免疫荧光检测胰腺祖细胞标志基因表达水平。
图7为流式细胞术检测胰腺祖细胞分化效率。
图8为免疫荧光检测胰岛β细胞标志基因表达水平。
图9为流式细胞术检测胰岛β细胞分化效率。
图10为real-timepcr检测限定性内胚层阶段、胰腺祖细胞阶段、胰岛β细胞阶段标志基因表达水平。
图11为elisa检测葡萄糖刺激下胰岛素和c-肽释放量。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
部分材料如下:
人源ips细胞系购买于中国科学院广州生物医药与健康研究院。
microrna-181c-5p过表达慢病毒原液由上海吉凯基因化学技术有限公司制备。
人源ips细胞培养基mtesrtm1购买自加拿大stemcelltechnologies公司。
人源ips细胞冻存液mfresrtm购买自加拿大stemcelltechnologies公司。
人源ips细胞分离液relesrtm购买自加拿大stemcelltechnologies公司。
胰岛β细胞分化用基础培养基dmem/f12(含glutamax)、f12(含glutamax)、imdm(含glutamax)、dmem/h(含glutamax)购买自美国gibco公司。
胰岛β细胞分化用添加物its-xsupplement(100×)、b-27supplement(无维生素a,50×)、n2-supplement(100×)购买自美国gibco公司。
胰岛β细胞分化用activina、kgf、noggin、egf、bmp4、bfgf购买自美国peprotech公司。
胰岛β细胞分化用wortmannin、retinoicacid、nicotinamide、exendin-4、bsa购买自美国sigma公司。
s-poly(t)plusmirnaqpcr-assayprimerset、onestepmirnacdnasynthesiscorereagentkit、probepremixhssm-taq购买自深圳市盎然生物技术有限公司。
puromycin购买自法国invivogen公司。
bdcytofix/cytopermfixation/permeabilizationkit购自美国bd公司。
下述实施方式中的统计学处理均采用spss19.0软件进行统计学分析,利用graphpad6.0软件进行图片编辑;采用完全随机设计的单因素方差分析(one-wayanova)和配对样本t检验(pairedtwo-tailedstudent’st-test)进行数据分析,数据用平均值±标准差(means±sd)表示。
实施例1、表达microrna-181c-5p(mir-181c-5p)的人源ips细胞系的建立及鉴定
一、过表达microrna-181c-5p的人源ips细胞系的建立
1、过表达microrna-181c-5p的慢病毒
过表达microrna-181c-5p的慢病毒为将重组表达载体转染293t细胞中,包装得到表达microrna-181c-5p的慢病毒(标记为microrna-181c-5pup),该慢病毒表达microrna-181c-5p(序列2)。
过表达空载体的慢病毒为将cv-130空载体(上海吉凯基因化学技术有限公司,如图1所示)转染293t细胞中,包装得到表达空载体的慢病毒(标记为scramble)。
重组的过表达载体为将microrna-181c-5p前体序列(序列1)插入cv-130载体(上海吉凯基因化学技术有限公司,如图1所示)的paci和ecori位点间的dna片段,得到的载体。
2、慢病毒感染人源ips细胞
(1)人源ips细胞状态良好、分化细胞比例低于20%且细胞融合率达到30%时,可进行慢病毒感染实验;
(2)将上述1得到的表达microrna-181c-5p的慢病毒转染人源ips细胞,感染复数为moi=30,即在ips培养基中加入病毒量为细胞量的30倍,同时加入5μg/ml病毒感染增强剂polybrene;
(3)慢病毒感染24h后,用dmem/f12洗涤细胞3次,更换新鲜培养基;
(4)慢病毒感染72h后,采用1μg/ml嘌呤霉素(puromycin,puro)进行药物筛选5-8天,得到过表达microrna-181c-5p的ips细胞(hipscs-181cup)。
采用同样的方法,用表达空载体的慢病毒干扰人源ips细胞系,得到表达空载体的ips细胞(hipscs-sramble)。
二、过表达microrna-181c-5p的人源ips细胞系的鉴定
以未感染任何病毒的人源ips细胞(hipscs)为空白对照,以感染空载体的人源ips细胞(hipscs-sramble)为慢病毒对照,以过表达microrna-181c-5p人源ips细胞(hipscs-181cup)为实验组,qpcr分析microrna-181c-5p表达水平的变化,具体方法如下:
(1)采用trizol法提取上述2得到的表达microrna-181c-5p的ips细胞(hipscs-181cup)的总rna;
(2)根据s-poly(t)plusmirnaqpcr-assay试剂盒说明书配制一步polya加尾和逆转录反应体系,将总rna反转录得到cdna:
表1为一步polya加尾和逆转录反应
反应条件:37℃30min;42℃30min;75℃5min;冰上放置5min。
(3)配制s-poly(t)plusmirnaqpcr反应体系,以(2)得到的cdna稀释20倍为模板,进行qpcr反应,以snord44作为内参基因(由深圳市盎然生物技术有限公司完成):
表2s-poly(t)plusqpcr反应体系
(4)s-poly(t)plusmirnaqpcr扩增程序如下:
表3s-poly(t)plusqpcr扩增程序
采用△△ct法进行数据分析。
结果如图3所示,与hipscs和hipscs-scramble相比,过表达microrna-181c-5p的ips细胞(hipscs-181cup)中microrna-181c-5p的表达水平显著升高,表明成功构建了过表达microrna-181c-5p的ips细胞系。
未经过过表达的人源ips细胞分化胰岛细胞中各个阶段中的microrna-181c-5p表达水平检测结果如图2所示,注释:hipscs:人源ips细胞;de:限定性内胚层;pf:前肠管内胚层;pp:胰腺祖细胞;ipc:胰岛素分泌细胞,结果表明在人源ips细胞定向分化为胰岛细胞过程中microrna-181c-5p表达量持续升高。
实施例2、过表达microrna-181c-5p(hipscs-181cup)的人源ips细胞系体外定向诱导分化为胰岛β细胞
一、过表达microrna-181c-5p(hipscs-181cup)的人源ips细胞系定向诱导分化为胰岛β细胞的方法
下面方法中主要试剂的配置如下:
(1)人源ips完全培养基配制:4℃冰箱过夜溶解mtesrtm1试剂组分2(5×添加物),加入基础培养基mtesrtm1试剂组分1(基础培养基basicmedium)中,充分混合均匀并分装。4℃冰箱内短期储存可存放2周,-20℃冰箱内长期储存可存放6个月。
(2)0.1%bsa水溶液:称取0.01gbsa干粉溶解于10ml无菌ddh2o,0.22μmpvdf滤膜过滤后4℃保存。
(3)0.1%bsapbs溶液:称取0.01gbsa干粉溶解于10ml无菌pbs,0.22μmpvdf滤膜过滤后4℃保存。
(4)0.1%bsa5mmhcl:称取0.01gbsa干粉溶解于10ml5mmhcl,0.22μmpvdf滤膜过滤后4℃保存。
(5)activina储存溶液配制:将10μgactivina无菌冻干粉溶解于100μl0.1%bsa水溶液中,配制成浓度为0.1mg/ml的溶液,置于-80℃冰箱内可储存1年。
(6)wortmannin储存溶液配制:将1mgwortmannin无菌冻干粉溶解于0.2334mldmso中,配制成浓度为10mm的溶液,置于-80℃冰箱内可储存1年。
(7)retinoicacid储存溶液配制:将50mgretinoicacid干粉溶解于16.642mldmso中,配制成浓度为10mm的溶液,置于-80℃冰箱内可储存1个月。
(8)kgf储存溶液配制:将10μgkgf无菌冻干粉溶解于100μl0.1%bsapbs溶液,配制成浓度为0.1mg/ml的溶液,置于-80℃冰箱内可储存3个月。
(9)noggin储存溶液配制:将100μgnoggin无菌冻干粉溶解于500μl0.1%bsa水溶液,配制成浓度为0.2mg/ml的溶液,置于-80℃冰箱内可储存3个月。
(10)egf储存溶液配制:取50μgegf无菌冻干粉溶解于500μl0.1%bsa水溶液中,配制成浓度为0.1mg/ml的溶液,置于-80℃冰箱内可储存1年。
(11)bfgf储存溶液配制:将50μgbfgf无菌冻干粉溶解于500μl0.1%bsa水溶液中,配制成浓度为0.1mg/ml的溶液,置于-80℃冰箱内可储存1年。
(12)nicotinamide储存溶液配制:称取1.55gnicotinamide干粉,溶解于6.25mlddh2o中,配制成浓度为2m的溶液,0.22μmpvdf滤膜过滤,置于-80℃冰箱内可储存6个月。
(13)exendin-4储存溶液配制:将0.1mgexendin-4无菌冻干粉溶解于500μl灭菌ddh2o中,配制成浓度为0.2mg/ml的溶液,置于-80℃冰箱内可储存6个月。
(14)bmp4储存溶液配制:将10μgbmp4无菌冻干粉溶解于100μl0.1%bsa5mmhcl中,配制成浓度为0.1mg/ml的溶液,置于-80℃冰箱内可储存1年。
1、诱导分化第一阶段
将实施例1制备的过表达microrna-181c-5p的ips细胞传代培养后,待细胞融合率达60%左右,开始进行诱导分化:六孔板加入2ml/孔诱导分化第一阶段诱导液,将细胞融合率达60%的过表达microrna-181c-5p的ips细胞在诱导分化第一阶段诱导液中连续诱导培养4天,每天更换诱导培养基,得到第一阶段诱导分化后细胞;
诱导分化第一阶段诱导液:按需配制含体积百分含量0.2%bsa的dmem/f12培养基(含1xglutamax),0.22μmpvdf滤膜过滤除菌后,添加0.5×n2-supplement,0.5×b27-supplement,100ng/mlactivina,1μmwortmannin,移液器轻柔吹打混合均匀,得到诱导分化第一阶段诱导液;
2、诱导分化第二阶段
六孔板加入2ml/孔诱导分化第二阶段诱导液,将1得到的第一阶段诱导分化后细胞在诱导分化第二阶段诱导液中连续诱导培养6天,每天更换诱导培养基,得到第二阶段诱导分化后细胞;
诱导分化第二阶段诱导液:按需配制含0.5%bsa的f12/imdm培养基(含1xglutamax,f12与imdm以1:1比例均匀混合),0.22μmpvdf滤膜过滤除菌后,添加0.5×its-supplement,0.5×b27-supplement,2μmra,20ng/mlkgf,100ng/mlnoggin,移液器轻柔吹打混合均匀。
3、诱导分化第三阶段:
六孔板加入2ml/孔诱导分化第三阶段诱导液,将上述2得到第二阶段诱导分化后细胞在诱导分化第三阶段诱导液中连续诱导培养5天,每天更换诱导培养基,得到三阶段诱导分化后细胞;
诱导分化第三阶段诱导液:按需配制含0.5%bsa的dmem/h培养基(含1xglutamax),0.22μmpvdf滤膜过滤除菌后,添加1×its-supplement,1×n2-supplement,100nmra,20ng/mlkgf,50ng/mlegf,移液器轻柔吹打混合均匀;
4、诱导分化第四阶段:
六孔板加入2ml/孔诱导分化第四阶段诱导液,将上述3得到第三阶段诱导分化后细胞在诱导分化第四阶段诱导液中连续诱导培养15天,每天更换诱导培养基,得到第四阶段诱导分化后细胞(含有胰岛β细胞);
诱导分化第四阶段诱导液:dmem/f12培养基(含1xglutamax)中添加1×its-supplement,10ng/mlbmp4,10ng/mlbfgf,10mmnicotinamide,50ng/mlexendin-4,移液器轻柔吹打混合均匀,六孔板加入2ml/孔。
二、胰岛β细胞的分化效率的鉴定
下面方法中用的主要试剂的配置如下:
(1)4%多聚甲醛:称量2g多聚甲醛,用50mlpbs充分溶解,4℃保存。
(2)0.1%tritonx-100:使用pbs将tritonx-100稀释成0.1%tritonx-100,4℃保存。
(3)1×perm/washbuffer:将5ml10×perm/washbuffer浓缩液加入到45ml灭菌ddh2o至中,充分混匀,现配现用。
1、免疫荧光鉴定诱导分化后细胞中相关蛋白的表达和定位
(1)37℃水浴锅预热pbs和4%多聚甲醛;
(2)0.1%tritonx-100平衡到室温;
(3)移液枪吸出六孔板内培养基上清,pbs缓冲液洗涤3次;
(4)细胞固定:向上述一得到的第一阶段诱导分化后细胞、第三阶段诱导分化后细胞和第四阶段诱导分化后细胞的六孔板中加入4%多聚甲醛室温下固定20min,之后pbs缓冲液洗涤3次,每次5min;
(5)细胞透膜:加入0.1%tritonx-100室温下透膜15min,之后pbs缓冲液洗涤3次,每次5min;
(6)封闭:加入5%检测用驴血清室温封闭1h;
(7)孵育一抗:弃掉封闭液,直接加入一抗,4℃冰箱孵育过夜;
(8)孵育一抗后,pbs洗涤3次,每次5min;
(9)用封闭液稀释荧光标记的二抗,室温避光孵育1h;
(10)孵育二抗后,pbs洗涤3次,每次5min;
(11)用1μg/mldapi染核10min,pbs洗涤3次,每次5min;
(12)荧光显微镜下观察并拍照。
以hipscs-sramble为对照。
第一阶段诱导分化后细胞的免疫荧光鉴定结果如图4所示(所用一抗为humanfoxa2抗体(r&d公司,af2400);humansox17抗体(abcam公司,ab84990),二抗为donkeyanti-mousealexa488(thermo,a21202)和donkeyanti-goatalexa594(thermo,a32758),过表达microrna-181c-5p(hipscs-181cup)的细胞分化的细胞中标志基因foxa2和sox17表达的阳性细胞显著多于对照组细胞(hipscs-scramble)分化的细胞,表明过表达microrna-181c-5p能够促进人源ips细胞分化为限定性内胚层细胞。
第三阶段诱导分化后细胞的免疫荧光鉴定结果如图6所示(所用一抗为humanpdx1抗体(r&d公司,af2419);humannkx6.1抗体(dshb公司,f64a6b4),二抗为donkeyanti-mousealexa488(thermo,a21202)和donkeyanti-goatalexa594(thermo,a32758),过表达microrna-181c-5p(hipscs-181cup)的细胞分化的细胞中标志基因pdx1的阳性细胞比例与对照细胞(hipscs-scramble)没有明显差异,但胰腺祖细胞标志基因nkx6.1的阳性细胞显著多于对照组细胞(hipscs-scramble),表明过表达microrna-181c-5p能够促进人源ips细胞分化为胰腺祖细胞。
第四阶段诱导分化后细胞的免疫荧光鉴定结果如图8所示(所用一抗为humaninsulin抗体(abcam公司,ab7842);二抗为goatanti-guineapigalexa568(thermo,a11075),过表达microrna-181c-5p(hipscs-181cup)的细胞分化的细胞中胰岛β细胞标志基因insulin的阳性细胞显著多于对照组细胞(hipscs-scramble),表明过表达microrna-181c-5p能够促进人源ips细胞分化为胰岛β细胞。
2、流式细胞术鉴定诱导分化效率
(1)使用0.25%胰酶(不含edta),37℃培养箱内消化2-3min后,用含10%fbs的dmem:f12培养基终止消化;
(2)将上述一得到的第一阶段诱导分化后细胞、第三阶段诱导分化后细胞和第四阶段诱导分化的细胞制备成单细胞悬液转移至15ml离心管中,离心力400g,离心5min;
(3)弃掉上清,使用pbs缓冲液洗涤细胞,离心力400g,离心5min;
(4)弃掉pbs缓冲液,加入cytofix/cytoperm通透/破膜液500μl,移液枪轻轻吹打混匀细胞,室温下避光固定、破膜30min,离心力400g,离心5min;
(5)弃掉cytofix/cytoperm通透/破膜液,使用1×perm/washbuffer重悬细胞,室温下孵育10min,离心力400g,离心5min;
(6)弃掉1×perm/washbuffer,使用1×perm/washbuffer稀释流式抗体,小心吹打混匀,室温避光孵育1h,离心力400g,离心5min,弃掉上清液;
(7)使用1×perm/washbuffer洗涤细胞,离心力400g,离心5min,弃掉上清液;
(8)用pbs缓冲液重悬细胞,尼龙膜过滤细胞悬液,流式细胞分析仪检测分化效率。
以hipscs-sramble为对照。
第一阶段诱导分化后为限定性内胚层细胞,流式细胞术结果如图5所示,过表达microrna-181c-5p(hipscs-181cup)的细胞限定性内胚层细胞标志基因sox17和cxcr4双阳性细胞比例由对照组(hipscs-scramble)的85.3%上升至99.3%,表明过表达microrna-181c-5p能够促进人源ips细胞分化为限定性内胚层细胞。
第三阶段诱导分化后为胰腺祖细胞,流式细胞术如图7所示,过表达microrna-181c-5p(hipscs-181cup)的细胞胰腺祖细胞标志基因pdx1和nkx6.1双阳性细胞比例由对照组(hipscs-scramble)的52.7%上升至71.8%,表明过表达microrna-181c-5p能够促进人源ips细胞分化为胰腺祖细胞。
第四阶段诱导分化后为胰岛β细胞,流式细胞术如图9所示,过表达microrna-181c-5p(hipscs-181cup)的细胞胰岛β细胞标志基因insulin的阳性细胞比例由对照组(hipscs-scramble)的22.1%上升至35.8%,表明过表达microrna-181c-5p能够促进人源ips细胞分化为胰岛β细胞。
3、real-timepcr检测分化细胞标志基因的表达水平
1)总rna的提取
(1)在6孔板中加入1mltrizol裂解上述一得到第一阶段诱导分化后细胞、第三阶段诱导分化后细胞和第四阶段诱导分化的细胞,转移到1.5mlep管中,反复吹打,使形成匀浆后室温放置10min,充分裂解细胞;
(2)充分裂解细胞后,加入200μl氯仿,剧烈震荡15sec后室温孵育10min;
(3)将ep管放入4℃离心机,12000g,离心15min;
(4)小心取出ep管,垂直放置在ep管板架上,小心吸出上层水相,勿吸到中间层和下层有机层;
(5)加入与上一步上清液等体积的异丙醇,颠倒震荡混匀;
(6)-20℃冰箱静置2h以利于rna沉淀;
(7)将ep管放入4℃离心机,12000g,离心15min,离心后一般可见白色沉淀物;
(8)小心吸掉液体,尽量勿触碰沉淀物,加入1ml预冷的depc水配置的75%酒精,清洗沉淀,12000g,离心5min,吸出液体后再清洗沉淀一次;
(9)将ep管放入4度离心机,12000g,4℃,离心5min,小心取出ep管,弃掉上清;
(10)室温风干3min-5min,待沉淀边缘呈现半透明状;
(11)溶解rna:根据沉淀大小,加入30μl-80μldepc水,反复轻柔吹打,完全地溶解rna;
(12)测定rna浓度和纯度:利用超微量分光光度计检测,测定吸光度a260/a280为1.8~2.0说明纯度理想。
2)rna逆转录成cdna
(1)根据primescripttmrtreagenkit试剂盒说明书配制反应体系:
表4去除基因组dna体系
去除基因组dna反应条件:42℃,2min;4℃,∞。
(2)配制反转录体系:
表5反转录体系
逆转录反应条件:37℃,15min;85℃,5sec;4℃,∞。
2)real-timepcr检测方法
(1)根据sybrpremixextaqtmii试剂盒说明书配制real-timepcr反应体系:
表6real-timepcr反应体系
(2)real-timepcr两步法扩增程序如下表:
表7两步法pcr扩增标准程序
采用相对标准曲线法进行数据分析。
3)基因名称及引物序列如下:
表8基因名称及引物序列
以hipscs-sramble(图10中标记为hipscs-neg)为对照。
第一阶段诱导分化后为限定性内胚层细胞,结果如图10a所示,过表达microrna-181c-5p(hipscs-181cup)的细胞限定性内胚层细胞标志基因sox17、foxa2和cxcr4的基因表达水平显著高于对照组(hipscs-neg),表明过表达microrna-181c-5p能够促进人源ips细胞分化为限定性内胚层细胞。
第三阶段诱导分化后为胰腺祖细胞,结果如图10b所示,过表达microrna-181c-5p(hipscs-181cup)的细胞胰腺祖细胞标志基因pdx1和nkx6.1的基因表达水平显著高于对照组(hipscs-neg),hnf6的基因表达水平没有显著差异,表明过表达microrna-181c-5p能够促进人源ips细胞分化为胰腺祖细胞。
第四阶段诱导分化后为胰岛β细胞,结果如图10c所示,过表达microrna-181c-5p(hipscs-181cup)的细胞胰腺祖细胞标志基因pdx1和nkx6.1,以及胰岛β细胞标志基因insulin和mafa的基因表达水平显著高于对照组(hipscs-neg),表明过表达microrna-181c-5p能够促进人源ips细胞分化为胰岛β细胞。
4、体外葡萄糖刺激实验检测胰岛素和c-肽释放量
下面方法采用的主要试剂的配置
(1)1×krebsringerbuffer配制:在无菌环境下,吸取20ml10×krebsringerbuffer浓缩液,加入到180ml灭菌ddh2o中,充分混合均匀后进行分装保存。
(2)2.8mm葡萄糖溶液:称取0.01gd-glucose干粉溶于20ml1×krebsringerbuffer,0.22μm微孔滤膜过滤后4℃保存。
(3)16.7mm葡萄糖溶液:称取0.06gd-glucose干粉溶于20ml1×krebsringerbuffer,0.22μm微孔滤膜过滤后4℃保存。
体外葡萄糖刺激实验方法具体如下:
(1)上述一得到的第四阶段诱导分化后细胞(含有胰岛β细胞)弃掉诱导培养基,加入1×krebsringerbuffer缓冲液洗涤细胞3次;
(2)加入含有2.8mm葡萄糖的krebsringerbuffer缓冲液37℃培养箱内培养1h;
(3)收集上清,加入含有16.7mm葡萄糖的krebsringerbuffer缓冲液37℃培养箱内刺激1h,收集上清液;
(4)根据humaninsulin/c-peptideelisa试剂盒说明书检测上述(3)得到的上清液中胰岛素和c-肽的分泌水平;
(5)酶标仪检测od450的吸光光度值,并计算出胰岛素和c-肽的浓度。
结果如图11所示,第四阶段诱导分化后为胰岛β细胞,过表达microrna-181c-5p(hipscs-181cup)的细胞胰岛素和c-肽的分泌量显著高于对照组(hipscs-neg),表明过表达microrna-181c-5p能够提高ips来源的胰岛β细胞胰岛素的分泌能力。
序列表
<110>深圳市人民医院
<120>一种microrna-181c-5p促进人源ips定向分化为胰岛β细胞的方法
<160>2
<170>patentinversion3.5
<210>1
<211>110
<212>dna
<213>人工序列
<400>1
cggaaaatttgccaagggtttgggggaacattcaacctgtcggtgagtttgggcagctca60
ggcaaaccatcgaccgttgagtggaccctgaggcctggaattgccatcct110
<210>2
<211>22
<212>rna
<213>人工序列
<400>2
aacauucaaccugucggugagu22
- 还没有人留言评论。精彩留言会获得点赞!