一种制备16α-18F-17β-雌二醇的方法与流程
本发明涉及放射化学药物合成技术领域,具体涉及一种制备16α-18f-17β-雌二醇的方法。
背景技术:
乳腺癌是女性最常见的肿瘤,并呈现出数量逐年上升且年轻化的趋势,严重影响妇女身心健康。约75%乳腺癌肿瘤雌激素受体(er)表达阳性,er的表达状态是乳腺癌重要的预后指标,er阳性者乳腺癌内分泌治疗有效。临床上常采用免疫组化法检测组织标本的er表达,免疫组化法特异度强、敏感度高,但该检测方法的缺点是有创、离体测定,其反映的只是病灶样本的er表达,不能全面地反映该部肿瘤的er生物活性,更不能反映全身的情况。
16α-18f-17β-雌二醇(简称18f-fes)是雌二醇的环戊烷多氢菲结构d环16位的氢被18f所替代而形成,是雌二醇的类似物,属于特异性的er分子显像剂;而现有技术中,18f-fes正电子发射计算机断层显像pet/ct显像具有灵敏、准确、定量、无创伤的特点,原发病灶及转移病灶同时显像,可以直观地了解er的活动情况,对疾病的评估、治疗方案的确定及预后等有重要作用,同时也可以对受体水平进行定量分析。因此,临床上对这种新型pet显像剂的需求日益迫切,18f-fes需要得到大剂量、高质量、快捷的合成,而采用现有的制备工艺合成的18f-fes,存在量少、纯度偏低、失败率较高等弊端,这对18f-fes的制备工艺提出了一些新的要求。
技术实现要素:
本发明的目的在于提供一种制备16α-18f-17β-雌二醇的方法,不仅能够大剂量化、高纯度的制备16α-18f-17β-雌二醇,而且可以有效降低失败率。
本发明所采用的技术方案是:
一种制备16α-18f-17β-雌二醇的方法,包括如下步骤:
利用前体mmse
向所述中间产物加入盐酸进行水解反应,获得水解产物
将所述水解产物通过半制备hplc进行分离纯化,获得16α-18f-17β-雌二醇;
其中,所述半制备hplc,以乙腈、乙醇以及水为流动相出峰时间为7~8min。
一种优选的方案中,具体的工艺流程为:
步骤1、qma捕获:使带有18f-的靶水通过qma柱,并使18f-吸附在qma柱上;
优选的,所述步骤1中,对氮气施加正压,通过氮气挤压带有18f-的靶水,使靶水通过qma柱。
步骤2、18f-的释放:使k222与k2co3的混合溶液通过qma柱,并在通过的过程中将qma柱上的18f-淋洗到反应瓶中;
步骤3、第一次干燥:对所述反应瓶进行加热,加热温度为100℃,用于蒸发掉k222与k2co3的混合溶液中的水;
步骤4、乙腈的加入:向所述反应瓶中加入适量无水乙腈;
优选的,所述无水乙腈的量为0.5ml。
步骤5、第二次干燥:再次对所述反应瓶进行加热,以便蒸发掉反应瓶中的水;
步骤6、前体的加入:向所述反应瓶中加入前体mmse溶液;
优选的,将前体mmse溶解在无水乙腈中,获得所述前体mmse溶液。
一种优选的方案中,所述前体mmse溶液的配制方法为:将2mg前体mmse溶解在1ml的无水乙腈中,获得所述前体mmse溶液。
步骤7、氟化:密闭所述反应瓶,并对所述反应瓶进行加热,使得反应瓶中的所述前体mmse溶液与18f-进行亲核取代反应,生成中间产物;
优选的,所述步骤7中,将反应瓶加热至115℃,加热时间为15分钟。
步骤8、盐酸的加入:向所述反应瓶中加入适量一定浓度的盐酸;
优选的,所述步骤8中,所述盐酸的浓度为2m,加入所述反应瓶中的盐酸的量为1.5ml。
步骤9、水解:对所述反应瓶进行加热,使得反应瓶中的所述中间产物与所述盐酸进行水解反应,并获得水解产物;
优选的,所述步骤9中,将反应瓶加热至120℃,加热时间为200秒。
步骤10、调节ph值:向所述反应瓶中加入一定量的碳酸氢钠溶液,以调节反应瓶中液体的ph值;
优选的,所述碳酸氢钠溶液的质量分数为5.6%。
步骤11、进样:将所述反应瓶中的溶液转移到半制备液相的进样器中,并从所述进样器中将所述溶液吸入到注射器中,实现进样;
步骤12、hplc分离纯化:所述半制备液相的分离条件是:采用ymc-pack-ods-am半制备型色谱柱;乙腈、乙醇以及水的体积比为30:30:40,流速4.0ml/min,紫外波长为280nm;当液相色谱曲线刚要出现放射性峰时,开始收集16α-18f-17β-雌二醇,并通过管道将所收集到的16α-18f-17β-雌二醇输入旋蒸瓶,当液相色谱曲线的放射性峰降为基线时,停止收集16α-18f-17β-雌二醇;
步骤13、冲洗:采用乙醇冲洗所述管道,使得残留在管道中的16α-18f-17β-雌二醇被冲洗到所述旋蒸瓶中;
步骤14、悬蒸:将所述旋蒸瓶加热到180℃,并进行旋蒸,旋蒸用于去除乙醇;
步骤15、产品收集:向所述旋蒸瓶中注入含乙醇的生理盐水,并使溶有16α-18f-17β-雌二醇的所述含乙醇的生理盐水通过滤膜进行过滤,并收集滤液。滤液即为合成好的16α-18f-17β-雌二醇。
进一步的,所述含乙醇的生理盐水中乙醇的含量为10%。
优选的,所述滤膜为0.22um的无菌滤膜。
优选的,所述制备16α-18f-17β-雌二醇的工艺过程是在cfn-mps-200合成模块上进行的。
优选的,所述步骤2中18f-的释放、步骤4中乙腈的加入、步骤6中前体的加入以及步骤8中盐酸的加入均采用负压吸入的方式实现。
优选的,所述步骤1,对氮气施加正压,通过氮气挤压带有18f-的靶水,使靶水通过qma柱;和/或,所述步骤11中,对氮气施加正压,通过氮气挤压将反应瓶中的溶液全部转移到所述进样器中。
一种用于合成16α-18f-17β-雌二醇的系统,包括靶水收集瓶、1号试剂瓶、2号试剂瓶、3号试剂瓶、4号试剂瓶、5号试剂瓶、卡套、qma柱、反应瓶、第一温度控制器、真空泵、高效液相色谱仪以及控制器,其中,
所述靶水收集瓶用于盛装带有18f-的靶水,所述1号试剂瓶用于盛装k222与k2co3的混合溶液,所述2号试剂瓶用于盛装无水乙腈,所述3号试剂瓶用于盛装前体mmse溶液,所述4号试剂瓶用于盛装盐酸,所述5号试剂瓶用于盛装碳酸氢钠溶液;
所述卡套上设置有管网和若干阀门,所述阀门分别设置于所述管网,所述靶水收集瓶、1号试剂瓶、2号试剂瓶、3号试剂瓶、4号试剂瓶以及5号试剂瓶分别通过管路与所述管网相连通;
所述qma柱的两端分别通过管路与所述管网相连通,qma柱用于捕获靶水中的18f-;
所述反应瓶通过管路与所述管网相连通,反应瓶用于进行反应;
所述真空泵通过管路与所述管网相连通,并与所述控制器相连,真空泵用于在控制器的控制下产生负压,以便进行负压输送;
所述高效液相色谱仪的进样器通过管路与所述管网相连通,所述高效液相色谱仪用于对收集的产品进行分离纯化;
所述第一温度控制器设置于所述反应瓶处,并与所述控制器相连,用于在控制器的控制下调节反应瓶的温度;
所述管路上设置有阀门,所述控制器用于控制各阀门的通/断,并实现靶水收集瓶、1号试剂瓶、2号试剂瓶、3号试剂瓶、4号试剂瓶以及5号试剂瓶与所述反应瓶依次连通。
进一步的,还包括悬蒸瓶、6号试剂瓶、过滤器以及产品收集瓶,其中,所述悬蒸瓶通过管路与所述高效液相色谱仪的输出端相连,所述产品收集瓶及6号试剂瓶分别通过管路与所述悬蒸瓶相连,所述过滤器设置于悬蒸瓶与产品收集瓶之间的管路上,6号试剂瓶用于盛装含乙醇的生理盐水,并将所述含乙醇的生理盐水输送给所述悬蒸瓶,过滤器用于进行过滤,并使滤液进入所述产品收集瓶中。
优选的,所述6号试剂瓶中,所述含乙醇的生理盐水中乙醇的含量为10%,含乙醇的生理盐水的量为10ml。
进一步的,还包括7号试剂瓶和第二温度控制器,所述7号试剂瓶通过三通阀与连通悬蒸瓶及高效液相色谱仪的管路相连通,7号试剂瓶用于盛装乙醇,所述第二温度控制器设置于所述悬蒸瓶处,并与所述控制器相连,用于在控制器的控制下加热悬蒸瓶。
进一步的,所述第一温度控制器和第二温度控制器分别包括温度传感器,所述温度传感器用于检测反应瓶及悬蒸瓶的温度,并传输给控制器。
进一步的,还包括靶水回收瓶,所述靶水回收瓶通过管路与所述管网相连通,用于在控制器的控制下与所述qma柱相连通,并用于收集失去18f-后的靶水。
进一步的,还包括输送泵,所述输送泵分别通过管路与所述靶水收集瓶、靶水回收瓶、6号试剂瓶、7号试剂瓶以及悬蒸瓶相连通,输送泵与所述控制器相连,输送泵用于在控制器的控制下输入具有一定压力的氮气,以便对试剂进行压力输送。
进一步的,还包括放射性探头,所述放射性探头分别设置于所述qma柱及所述反应瓶处,并分别与所述控制器相连,设置于qma柱处的放射性探头用于探测靶水中的18f-是否全部吸附在qma柱上,设置于反应瓶处的放射性探头用于探测qma柱上的18f-是否全部淋洗到反应瓶中。
进一步的,还包括显示器和摄像头,所述摄像头分别设置于所述反应瓶、高效液相色谱仪的进样器、以及所述悬蒸瓶处,所述显示器和各摄像头分别与所述控制器相连,摄像头分别用于采集反应瓶、进样器以及悬蒸瓶的影像信息,并利用显示器进行显示。
优选的,所述卡套上的阀门为三通阀门。
一种优选的方案中,所述管网包括17个端口,其中,端口一与端口十通过第一管线相连通,端口二通过第二管线及三通阀一与所述第一管线相连通,端口九与端口十五通过第三管线相连通,端口三通过第四管线及三通阀六与所述第三管线相连通,端口四通过第五管线及三通阀二与所述第四管线相连通,端口五通过第六管线及三通阀三与所述第四管线相连通,端口七通过第七管线及三通阀四与所述第四管线相连通,端口六通过第八管线及三通阀五与所述第七管线相连通,端口八通过第九管线及三通阀七与所述第三管线相连通,端口十一通过第十管线及三通阀八与所述第一管线相连通,端口十三通过第十一管线与端口十四相连通,端口十二通过第十二管线及三通阀九与所述第十一管线相连通,端口十六通过第十三管线与端口十七相连通,且所述第十三管线上设置有阀门,第十四管线的一端与所述第四管线相连通,另一端通过三通阀十与所述第十一管线相连通。
进一步的,所述卡套还包括底板,所述底板上设置有若干卡子,所述卡子分别用于固定所述管网中的各条管线。
一种优选的方案中,所述底板为矩形平板结构。
优选的,所述卡子的设置方向分为两类,一类卡子沿所述底板的长度方向设置于底板,另一类卡子沿所述底板的宽度方向设置于底板。
进一步的,所述底板上还设置有若干槽口,所述槽口用于实现底板的固定。
与现有技术相比,使用本发明提供的一种制备16α-18f-17β-雌二醇的方法,工艺过程简洁,操作方便,不仅能够大剂量化、高纯度的制备16α-18f-17β-雌二醇,而且可以有效降低失败率。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
附图
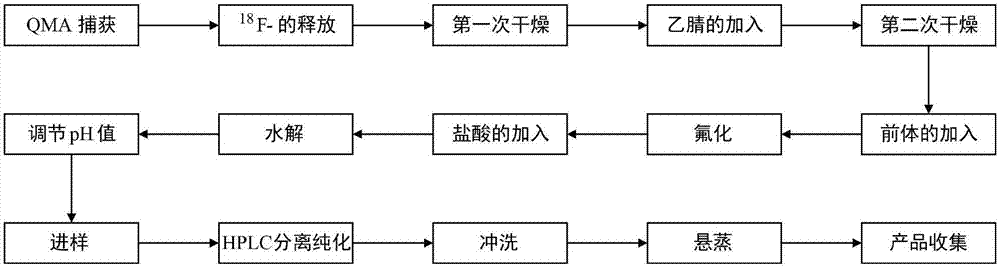
图1为本发明实施例1中提供的一种制备16α-18f-17β-雌二醇的工艺流程框图。
图2为在制备过程中,粗产品在半制备hplc上分离纯化的出峰图。
图3为产品标准品(即16α-18f-17β-雌二醇)在分析hplc上的紫外图谱。
图4为采用实施例1所提供的方法制备的产品(即16α-18f-17β-雌二醇)在分析hplc上的放射图谱。
图5为采用实施例1所提供的方法制备的产品(即16α-18f-17β-雌二醇)在分析hplc上的紫外图谱。
图6为本发明实施例3中提供的一种用于合成16α-18f-17β-雌二醇的系统的结构示意图。
图中标记说明
靶水收集瓶101,1号试剂瓶102,2号试剂瓶103,3号试剂瓶104,4号试剂瓶105,5号试剂瓶106,卡套107,qma柱108,反应瓶109,第一温度控制器110,真空泵111,高效液相色谱仪112,阀门113,
悬蒸瓶201,6号试剂瓶202,过滤器203,产品收集瓶204,
7号试剂瓶301,第二温度控制器302,三通阀303,
输送泵401,靶水回收瓶402,放射性探头403,
端口一1,端口二2,端口三3,端口四4,端口五5,端口六6,端口七7,端口八8,端口九9,端口十10,端口十一11,端口十二12,端口十三13,端口十四14,端口十五15,端口十六16,端口十七17,
第一管线501,第二管线502,第三管线503,第四管线504,第五管线505,第六管线506,第七管线507,第八管线508,第九管线509,第十管线510,第十一管线511,第十二管线512,第十三管线513,
三通阀一601,三通阀二602,三通阀三603,三通阀四604,三通阀五605,三通阀六606,三通阀七607,三通阀八608,三通阀九609,三通阀十610。
具体实施方式
下面将结合本发明实施例中附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。通常在此处附图中描述和示出的本发明实施例的组件可以以各种不同的配置来布置和设计。因此,以下对在附图中提供的本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明的实施例,本领域技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
本实施例中提供了一种制备16α-18f-17β-雌二醇的方法,包括如下步骤:
首先,利用前体mmse
然后,向所述中间产物加入盐酸进行水解反应,获得水解产物
最后,将所述水解产物通过半制备hplc进行分离纯化,从而可以获得纯度较高的18f-fes产品;
其中,所述半制备hplc,以乙腈、乙醇以及水为流动相,出峰时间为7~8min。
本实施例所提供的制备方法简单、高效,采用本方法制备16α-18f-17β-雌二醇,不仅可以大剂量化、高纯度的制备16α-18f-17β-雌二醇,而且可以有效降低制备过程中的失败率。
如图1所示,具体而言,在本实施例所提供的一种优选的方案中,具体的制备16α-18f-17β-雌二醇的工艺流程为:
步骤1、qma捕获:使带有18f-的靶水通过qma柱108,并使18f-吸附在qma柱108上。
优选的方案中,所述步骤1中,可以对氮气施加正压,通过氮气挤压带有18f-的靶水,使靶水通过qma柱108,在靶水通过qma柱108的过程中,靶水中的18f-可以吸附在qma柱108上,从而将18f-从靶水中分离出来。
步骤2、18f-的释放:使k222与k2co3的混合溶液通过qma柱108,并在通过的过程中将qma柱108上的18f-淋洗到反应瓶109中;从而可以将qma柱108上的18f-转移到反应瓶109中;
在本步骤中,k222与k2co3的混合溶液是将k222溶液与k2co3溶液进行混合后所得的溶液,其中,k222溶液的量可以为0.7ml,k2co3溶液的量可以为0.2ml。
在优选的方案中,k222溶液的配制方法可以是:将220mgk222粉末溶于7ml无水乙腈中,从而获得k222溶液;k2co3溶液的配制方法是:将58.5mgk2co3粉末溶于2ml水中,从而可以获得k2co3溶液。
步骤3、第一次干燥:对所述反应瓶109进行加热,加热温度为100℃,以便通过加热蒸发掉k222与k2co3的混合溶液中的水;
在本实施例中,可以将氮气通过反应瓶109的一端压入到反应瓶109中形成正压,同时,反应瓶109另一端接真空泵111形成负压,然后再对反应瓶109进行加热,在这个过程中,加热所蒸发的水分可以方便的随着压力降的方向移动,从而从反应瓶109中排出。
步骤4、乙腈的加入:向所述反应瓶109中加入适量无水乙腈。
优选的,本步骤中,所述无水乙腈的量可以为0.5ml。
步骤5、第二次干燥:再次对所述反应瓶109进行加热,以便蒸发掉反应瓶109中的水。
优选的,本步骤中,加热的温度可以优先采用95℃,以便彻底除去反应瓶109中的水,确保下一步反应的正常进行。
步骤6、前体的加入:向所述反应瓶109中加入前体mmse溶液。
优选的方案中,将前体mmse溶解在无水乙腈中,可以获得所述前体mmse溶液。
本实施例所提供的一种优选的方案中,所述前体mmse溶液的配制方法为:将2mg前体mmse溶解在1ml的无水乙腈中,从而可以获得所述前体mmse溶液。
在本实施例中,可以优先采用德国abx公司生产的前体mmse,前体mmse的化学结构如下:
步骤7、氟化:密闭所述反应瓶109,并对所述反应瓶109进行加热,使得反应瓶109中的所述前体mmse溶液与18f-进行亲核取代反应,生成中间产物
优选的,在本步骤中,可以将反应瓶109加热至115℃,加热时间为15分钟,以确保反应的正常进行,反应原理如下:
步骤8、盐酸的加入:向所述反应瓶109中加入适量一定浓度的盐酸。
优选的,在本步骤中,所述盐酸的浓度可以为2m,加入所述反应瓶109中的盐酸的量可以为1.5ml。
步骤9、水解:对所述反应瓶109进行加热,使得反应瓶109中的所述中间产物与所述盐酸进行水解反应,并获得水解产物
优选的,在本步骤中,需要将反应瓶109加热至120℃,加热时间为200秒,从而确保反反应的正常进行,具体的反应过程如下:
此时,所得到的16α-18f-17β-雌二醇为粗产品,还需要进行进一步的处理。
步骤10、调节ph值:向所述反应瓶109中加入一定量的碳酸氢钠溶液,以调节反应瓶109中液体的ph值。
优选的,在本实施例中,所述碳酸氢钠溶液的质量分数可以为5.6%,碳酸氢钠溶液的量可以为1.5ml。
步骤11、进样:将所述反应瓶109中的溶液转移到半制备液相的进样器中,并从所述进样器中将所述溶液吸入到注射器中,实现进样;
在本步骤中,可以将氮气压入反应瓶109中,并给予正压,从而可以方便的使反应瓶109中的粗产品全部转移到半制备液相的进样器中;然后通过注射器将粗产品注入半制备液相中,从而完成进样工作。
步骤12、hplc分离纯化:所述半制备液相的分离条件是:采用ymc-pack-ods-am半制备型色谱柱;乙腈、乙醇以及水的体积比为30:30:40,流速4.0ml/min,紫外波长为280nm;当液相色谱曲线刚要出现放射性峰时(即液相色谱曲线开始上升时),开始收集18f-fes,并通过管道将所收集到的18f-fes输入旋蒸瓶,当液相色谱曲线的放射性峰降为基线时,停止收集18f-fes,如图2所示,经过该步骤后,可以获得放射化学纯度较高的产品(18f-fes),如图3、图4以及图5所示,通过对比图3、图4以及图5可知,采用本方法所提供的工艺,不仅可以有效的制备16α-18f-17β-雌二醇产品,而且所制备的16α-18f-17β-雌二醇的放射化学纯度很高,非常有利于显像;
本领域的技术人员非常清楚hplc分离纯化的过程及操作,这里不再进行赘述。
步骤13、冲洗:采用乙醇冲洗所述管道,使得残留在管道中的18f-fes被冲洗到所述旋蒸瓶中;
通常需要采用管道将经过hplc分离纯化后的产品转移到旋蒸瓶中,管道中必然会残留部分产品,造成浪费,故在本步骤中,利用乙醇冲洗管道,可以最大限度的降低产品的损失,使得附着在管道壁上的产品可以全部进入旋蒸瓶中。
步骤14、悬蒸:将所述旋蒸瓶加热到180℃,并进行旋蒸,旋蒸用于去除用于冲洗管道的乙醇,实现对产品的净化。
步骤15、产品收集:向所述旋蒸瓶中注入含乙醇的生理盐水,并使溶有18f-fes的所述含乙醇的生理盐水通过滤膜进行过滤,并收集滤液,滤液即为合成好的18f-fes;经过本步骤,有利于获得纯度更高的16α-18f-17β-雌二醇。
可以理解,18f-fes可以溶于含乙醇的生理盐水,作为举例,所述含乙醇的生理盐水中乙醇的含量为10%,作为举例,含乙醇的生理盐水的量可以为10ml,而在本实施例所提供的优选方案中,所述滤膜可以优先采用0.22um的无菌滤膜。
进一步的,在本实施例所提供的优化方案中,所述步骤2中18f-的释放、步骤4中乙腈的加入、步骤6中前体的加入以及步骤8中盐酸的加入均可以采用负压吸入的方式实现,即采用负压吸入的方式将所需试剂加入反应瓶109中,非常的方便。
实施例2
上述实施例1中所提供的一种制备16α-18f-17β-雌二醇的方法,其工艺过程可以是在cfn-mps-200合成模块上进行的。
cfn-mps-200合成模块对一些新型的正电子放射性显像剂(包括16α-18f-17β-雌二醇)进行合成,在合成工艺上具有一些新的优势,主要包括:
第一,该合成模块采用新型的卡套技术,将合成管线集中在较小的卡套107内,气密性好,既避免气体在管线中的路线过长发生堵塞,又避免了试剂在管线中的大量残留。
第二,合成模块中配套有自检程序,即在合成之前会对各个合成线路进行气体流量和气密性检查,只有通过了气流量和气密性检查,才会进入到合成步骤;这样,在合成之前就排除了管线堵塞或者漏气的可能,提供更好的合成环境。
利用cfn-mps-200合成模块,再配合实施例1中所述的方法,不仅可以大剂量、高纯度的实现16α-18f-17β-雌二醇的制备,而且可以自动化的制备16α-18f-17β-雌二醇,非常方便、高效,事实证明,采用cfn-mps-200合成模块制备16α-18f-17β-雌二醇,产量能够达到数百mci,且能够得到放化纯较高的16α-18f-17β-雌二醇。
实施例3
本实施例3根据实施例1中所提供的一种制备16α-18f-17β-雌二醇的方法,提供了一种用于合成16α-18f-17β-雌二醇的系统;
该系统主要包括靶水收集瓶101、1号试剂瓶102、2号试剂瓶103、3号试剂瓶104、4号试剂瓶105、5号试剂瓶106、卡套107、qma柱108、反应瓶109、第一温度控制器110、真空泵111、高效液相色谱仪112以及控制器,如图6所示,其中,
所述靶水收集瓶101用于盛装带有18f-的靶水,所述1号试剂瓶102用于盛装k222与k2co3的混合溶液,所述2号试剂瓶103用于盛装无水乙腈,所述3号试剂瓶104用于盛装前体mmse溶液,所述4号试剂瓶105用于盛装盐酸,所述5号试剂瓶106用于盛装碳酸氢钠溶液;
所述卡套107上设置有管网和若干阀门,所述阀门分别设置于所述管网,所述靶水收集瓶101、1号试剂瓶102、2号试剂瓶103、3号试剂瓶104、4号试剂瓶105以及5号试剂瓶106分别通过管路与所述管网相连通;
所述qma柱108的两端分别通过管路与所述管网相连通,qma柱108用于捕获靶水中的18f-;
所述反应瓶109通过管路与所述管网相连通,反应瓶109用于进行反应;
所述真空泵111通过管路与所述管网相连通,并与所述控制器相连,真空泵111用于在控制器的控制下产生负压,以便利用负压进行输送,即利用负压输送各试剂;
所述高效液相色谱仪112的进样器通过管路与所述管网相连通,所述高效液相色谱仪112用于对收集的产品进行分离纯化;利用高效液相色谱仪112,可以采用半制备的高效液相色谱法(highperformanceliquidchromatography,简称hplc)对产品进行分离纯化。
所述第一温度控制器110设置于所述反应瓶109处,并与所述控制器相连,用于在控制器的控制下调节反应瓶109的温度;例如对反应瓶109进行加热,使得反应瓶109的温度保持在某一温度等。
所述管路上设置有阀门113,所述控制器用于控制各阀门(包括卡套上的阀门和管路上的阀门)的通/断,并实现靶水收集瓶101、1号试剂瓶102、2号试剂瓶103、3号试剂瓶104、4号试剂瓶105以及5号试剂瓶106与所述反应瓶109依次连通;以便按照实施例1中所提供的方法中的步骤进行16α-18f-17β-雌二醇的合成或自动合成,从而可以获得纯度比较高的16α-18f-17β-雌二醇。
如图6所示,本实施例所提供的进一步方案中,还包括悬蒸瓶201、6号试剂瓶202、过滤器203以及产品收集瓶204,其中,所述悬蒸瓶201通过管路与所述高效液相色谱仪112的输出端相连,所述产品收集瓶204及6号试剂瓶202分别通过管路与所述悬蒸瓶201相连,所述过滤器203设置于悬蒸瓶201与产品收集瓶204之间的管路上,6号试剂瓶202用于盛装含乙醇的生理盐水,并将含乙醇的生理盐水输送给所述悬蒸瓶201,过滤器203用于进行过滤,并使滤液进入所述产品收集瓶204中;产品收集瓶204中所收集的产品的损耗更低,产品纯度更高,从而有利于通过该系统获得大剂量化、高纯度的16α-18f-17β-雌二醇。
作为举例,在本实施例中,6号试剂瓶202中的含乙醇的生理盐水的量可以为10ml,且含乙醇的生理盐水中乙醇的含量可以为10%,含乙醇的生理盐水主要用于溶解16α-18f-17β-雌二醇。
如图6所示,在本实施例所提供的进一步方案中,还包括7号试剂瓶301和第二温度控制器302,所述7号试剂瓶301通过三通阀303与连通悬蒸瓶201及高效液相色谱仪112的管路相连通,7号试剂瓶301用于盛装乙醇,所述乙醇用于冲洗管路,所述第二温度控制器302设置于所述悬蒸瓶201处,用于在控制器的控制下加热悬蒸瓶201。
三通阀可以在控制器的控制器实现开/闭,可以实现7号试剂瓶301与悬蒸瓶201的连通,以便将7号试剂瓶301中的乙醇输入悬蒸瓶201,并在输送的过程中,实现对管路的冲洗。
进一步的,所述第一温度控制器110和第二温度控制器302分别包括温度传感器,所述温度传感器用于检测反应瓶109及悬蒸瓶201的温度,并传输给控制器,以便控制器进行温度调节;作为举例,第一温度控制器110和第二温度控制器302还分别包括加热器,以便进行加热。
如图6所示,进一步的,还包括靶水回收瓶402,所述靶水回收瓶402通过管路与所述管网相连通,用于在控制器的控制下与所述qma柱108相连通,并用于收集失去18f-后的靶水。
如图6所示,进一步的,还包括输送泵401,所述输送泵401分别通过管路与所述靶水收集瓶101、靶水回收瓶402、6号试剂瓶202、7号试剂瓶301以及悬蒸瓶201相连通,输送泵401与所述控制器相连,输送泵401用于在控制器的控制下输入具有一定压力的氮气,以便对试剂进行压力输送。
如图6所示,进一步的,还包括放射性探头403,所述放射性探头403分别设置于所述qma柱108及所述反应瓶109处,并分别与所述控制器相连,设置于qma柱108处的放射性探头403用于探测靶水中的18f-是否全部吸附在qma柱108上,设置于反应瓶109处的放射性探头403用于探测qma柱108上的18f-是否全部淋洗到反应瓶109中。
进一步的,还包括显示器和摄像头,所述摄像头分别设置于所述反应瓶109、高效液相色谱仪112的进样器、以及所述悬蒸瓶201处,所述显示器和各摄像头分别与所述控制器相连,摄像头分别用于采集反应瓶109、进样器以及悬蒸瓶201的影像信息,并利用显示器进行显示。从而方便操作人员进行远程监控,以便严格控制合成的过程,例如,可以通过摄像头查看试剂是否加入到反应瓶109中、反应瓶109是否蒸干、放射性探头403的数值是否不再增加等,而操作人员可以在通过摄像头观察并确定情况后,再进入到下一步,从而可以确保每一步都顺利进行,进而可以大大降低了合成失败的概率。
在本实施例中,卡套107上的阀门可以为三通阀门。
具体而言,在本实施例所提供的一种优选的方案中,卡套107中的管网包括17个端口,其中,端口一1与端口十10通过第一管线501相连通,端口二2通过第二管线502及三通阀一601与所述第一管线501相连通,端口九9与端口十五15通过第三管线503相连通,端口三3通过第四管线504及三通阀六606与所述第三管线503相连通,端口四4通过第五管线505及三通阀二602与所述第四管线504相连通,端口五5通过第六管线506及三通阀三603与所述第四管线504相连通,端口七7通过第七管线507及三通阀四604与所述第四管线504相连通,端口六6通过第八管线508及三通阀五605与所述第七管线507相连通,端口八8通过第九管线509及三通阀七607与所述第三管线503相连通,端口十一11通过第十管线510及三通阀八608与所述第一管线501相连通,端口十三13通过第十一管线511与端口十四14相连通,端口十二12通过第十二管线512及三通阀九609与所述第十一管线511相连通,端口十六16通过第十三管线513与端口十七17相连通,且所述第十三管线513上设置有阀门(也可以是三通阀),第十四管线的一端与所述第四管线504相连通,另一端通过三通阀十610与所述第十一管线511相连通。
利用本系统,并按照实施例1中所提供的方法制备16α-18f-17β-雌二醇的过程中,控制器可以通过控制系统中各阀门113及卡套107中各三通阀(即三通阀一601、三通阀二602、……、三通阀十610)的通/断,使得合成过程可以顺利、方便、准确的运行,不仅能够大剂量化、高纯度的制备16α-18f-17β-雌二醇,而且可以有效降低合成的失败率;作为举例,在实施例1所提供的步骤1中,要求将带有18f-的靶水通过qma柱108,并使18f-吸附在qma柱108上;利用本系统,控制器可以通过控制三通阀一601、三通阀八608、三通阀九609以及三通阀十610,使得靶水收集瓶101、qma柱108以及反应瓶109依次连通,然后控制系统中的阀门113,使得输送泵401与靶水收集瓶101连通、反应瓶109与真空泵111连通,最后通过输送泵401输送带有压力的氮气,通过真空泵111产生负压,从而可以使得靶水收集瓶101中的靶水通过qma柱108,使得靶水中的18f-吸附在qma柱108上,进而方便、高效的完成步骤1,其余步骤都可以通过控制器进行严格的控制,从而完成16α-18f-17β-雌二醇的制备,这里不再一一列举。
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!