丙酮酸氧化酶的固定化方法与流程
本发明属于生物工程技术领域,具体涉及丙酮酸氧化酶的固定化方法。
背景技术:
丙酮酸氧化酶(pyruvateoxidase,ec:1.2.3.3)是一种焦磷酸硫胺素(thiaminepyrophosphate,thpp)依赖型的氧化酶。当无机磷酸和氧分子存在时,在辅酶thpp、fad和mg2+的参与下,丙酮酸氧化酶能催化丙酮酸氧化脱羧生成乙酰磷酸、co2和h2o2。在过氧化物酶的共同作用下,丙酮酸氧化酶可以用于人体血液中丙氨酸氨基转移酶和天冬氨酸氨基转移酶的测定,同时,还可用于河水和废水中磷酸根离子含量的测定。丙酮酸氧化酶作为一种酶生物催化剂在生化检验中发挥着非常重要的作用,包括临床生化检验、环境检测及生物传感器中用于即时在线检测发酵生产中重要的中间产物丙酮酸以及血液中的丙酮酸含量。目前,商品化的丙酮酸氧化酶(pyod)几乎都来源于野生型的植物乳杆菌和绿色气球菌。利用重组大肠杆菌异源表达丙酮酸氧化酶具有十分重要的研究价值与意义。
丙酮酸作为一种重要的工业原料,在工业、农业、医药、日化、检测领域都有重要的应用意义,目前工业级丙酮酸国内价格为5-6万元/吨,随着丙酮酸盐应用领域的不断拓展,未来五年市场总量预计可超过30亿元,中国年产量预计在2020年达到2000t。丙酮酸的检测方法在过去数十年以来一直以传统的比色法和高效液相色谱法为主要检测方法,但此类方法存在过程繁琐,预处理周期长,滞后性以及干扰性较大,成本代价高等各类缺点,而新兴的酶生物传感器法就是以固定化丙酮酸氧化酶为核心元件,旨在解决发酵组分丙酮酸的实时在线监测和人体血液中丙酮酸的微量级检测,具有实时便捷,灵敏度高,专一性强等优点。因此,寻找一种较优的固定化丙酮酸氧化酶的方法迫在眉睫。
丙酮酸氧化酶作为一种常温酶,其天然酶稳定性差、易失活、不能重复使用,并且反应后混入产品,纯化困难,使其难以在传感器中更为广泛的应用。
技术实现要素:
本发明的目的在于克服现有技术的缺陷,提供一种丙酮酸氧化酶的固定化方法。
本发明的目的可通过如下技术方案实现:
一种丙酮酸氧化酶的固定化方法,包括如下步骤:
1)采用层层滴涂的修饰方法,将清洁的pb电极置于硝酸和重铬酸钾的混合溶液中,利用循环伏安法扫描一圈,进行电化学氧化处理;
2)在步骤1)获取的电极上固定碳二亚胺edc;
3)将固定edc的电极置于聚赖氨酸溶液中,edc和聚赖氨酸交联反应生成修饰膜;
4)将步骤3)获取的修饰电极在常温下干燥,之后将丙酮酸氧化酶酶液与edc溶液混合后滴定于电极表面。
作为本发明的进一步改进,所述步骤1)中,将清洁的pb电极置于质量浓度10%的硝酸和质量浓度2.5%的重铬酸钾的混合溶液中,进行电化学氧化处理。
所述步骤2)中,修饰方式为,取edc溶液滴定于经电化学氧化处理的pb电极表面,完成固定,进一步的,所述edc溶液浓度为30mmol/l。
作为本发明的进一步改进,所述聚赖氨酸质量浓度为0.06%~0.3%。优选所述聚赖氨酸质量浓度为0.18%。
作为本发明的进一步改进,所述丙酮酸氧化酶酶液的获取方式如下:
1)将丙酮酸氧化酶基因序列连接至表达质粒,得到重组质粒;
2)将重组质粒转化至宿主菌,得到丙酮酸氧化酶生产菌;
3)将丙酮酸氧化酶生产菌接种于lb液体培养基中,培养过夜;培养液转接入lb液体培养基中发酵培养,再加入乳糖或异丙基-β-d-硫代吡喃半乳糖苷诱导表达,离心收集菌体;
4)用pbs缓冲液洗涤步骤3)得到的菌体,离心,超声破碎,收集上清液,即为丙酮酸氧化酶粗酶液,纯化粗酶液获取丙酮酸氧化酶酶液。
进一步的,所述的表达质粒为pet-28a;所述宿主菌为大肠杆菌escherichiacolibl21(de3)。
所述丙酮酸氧化酶粗酶液的纯化方法为:将得到的丙酮酸氧化酶粗酶液连接蠕动泵,通过ni柱,用除杂溶液洗脱杂蛋白,收集洗脱液在超滤管中离心,得到纯化的丙酮酸氧化酶酶液。
本发明采用聚赖氨酸作为载体进行丙酮酸氧化酶固定化,获得的固定化丙酮酸氧化酶酶活高,对ph、温度的耐受性好,对后续生物传感器的开发与应用具有重要的指导意义。
附图说明
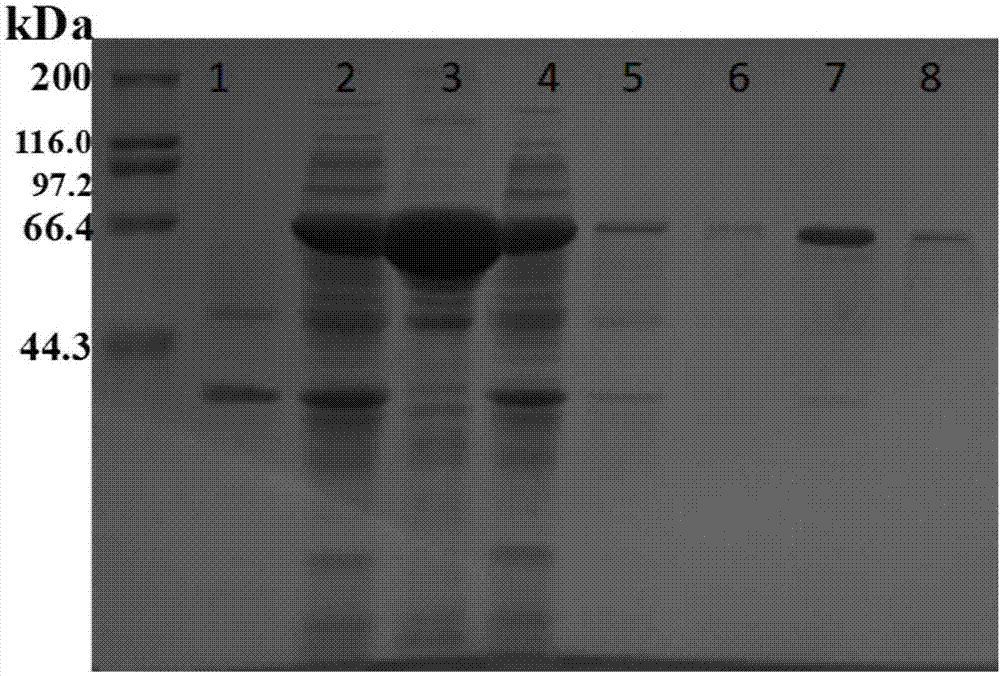
图1是丙酮酸氧化酶基因工程诱导表达sds-page图,泳道1:空pet-28a(+)对照;泳道2:基因工程菌发酵液上清;泳道3:基因工程菌发酵液沉淀;泳道4:基因工程菌洗脱液;泳道5:50mm咪唑洗脱液;泳道6:100mm咪唑洗脱液;泳道7:200mm咪唑洗脱液;泳道8:250mm咪唑洗脱液;
图2是聚赖氨酸固定化丙酮酸氧化酶与游离酶酶学性质比较图;
图3是戊二醛,多巴胺、壳聚糖、聚赖氨酸浓度梯度对固定化丙酮酸氧化酶酶活影响图。
具体实施方式
根据下述实施例,可以更好地理解本发明。然而,本领域的技术人员容易理解,实施例所描述的内容仅用于说明本发明,而不应当也不会限制权利要求书中所详细描述的本发明。
所用试剂戊二醛,多巴胺,壳聚糖购自sigma公司,聚赖氨酸由南京工业大学徐虹实验室提供。
实施例1:丙酮酸氧化酶基因的表达纯化
根据genbank上已报道的来源于绿色气球菌基因的序列(序列idef017806.1),送去金斯瑞公司合成目的基因,克隆载体为pet-28a,酶切位点为ecor1,xho1。
将含有丙酮酸氧化酶目的基因的pet-28a(+)重组质粒转化到表达宿主菌e.colibl21(de3)(nbe,catno.c2527h)获得重组微生物e.colibl21(de3)-pet-28a(+),将重组微生物涂布在含有50mg/l卡那霉素和24mg/liptg的平板上,经37℃培养16-20h后,挑取单菌落转点进行菌落pcr,经测序验证基因序列无误。
将得到的阳性克隆子在lb培养基中37℃培养至od600nm在0.5-0.6之间,加iptg至浓度0.2mm,18℃继续培养24h。收集菌体用磷酸缓冲液(ph7.0)重悬后,用超声处理破碎菌体细胞,20000g离心15min,所得上清即为丙酮酸氧化酶粗酶液。
将得到的丙酮酸氧化酶粗酶液连接蠕动泵,通过2个串联的5mlni柱,分别用50mm咪唑-250mm咪唑洗脱再将得到的洗脱液,用50kda的超滤管,5500rpm,30min离心,上层即为浓缩液。通过sds-page检测,结果如图1所示,全细胞,上清中均有相应大小的特征蛋白,穿透液和洗杂液中没有,洗脱液中也有特征蛋白,且量非常大,浓缩液中更加明显,因此该酶可通过ni柱吸附和超滤管浓缩两种方式中的任一种进行纯化。
实施例2:丙酮酸氧化酶固定化
(1)将实施例1得到的丙酮酸氧化酶纯酶测量酶活,分装并确保每管为1u的丙酮酸氧化酶酶活,冷冻于-20℃保存以备后用。
(2)采用层层滴涂的修饰方法,将处理干净的pb电极置于质量浓度10%的hno3和2.5%的k2cr2o7,利用循环伏安法扫描一圈,进行电化学氧化处理;
(3)取6µl新鲜配制的30mmol/l的碳二亚胺溶液(edc,n-(3-dimethylaminopropyl)-n-ethylcarbodiimidehydrochloride)滴定于经氧化处理的pb电极表面,把edc固定在电极表面,常温干燥;
(4)将配制好的质量浓度为0.18%的聚赖氨酸溶液分别滴定6µl于pb电极上,在edc与聚赖氨酸起交联作用,使聚赖氨酸在电极上形成牢固的修饰膜。
(5)修饰电极在室温下干燥24h后,将酶活为1u的丙酮酸氧化酶与30mmol/ledc溶液混合后用滴定法滴定在电极表面,然后将电极置于室温通风处干燥18h,用蒸馏水洗涤电极表面后测试酶活。
如图2所示,将本实施例的方法获取的固定化丙酮酸氧化酶和丙酮酸氧化酶游离酶在不同ph、温度下的酶学性质进行比较,测量过程如下:
(1)ph值对丙酮酸氧化酶酶活力的影响:将聚赖氨酸固定化的丙酮酸氧化酶及丙酮酸氧化酶游离酶分别在ph值为3.0,4.0,5.0,6.0,7.0,8.0,9.0的测活体系下37℃反应5min,测定最适反应ph值。定义最适反应ph值下测得的酶活力为100%(图2a)。
(2)温度对丙酮酸氧化酶酶活力的影响:将聚赖氨酸固定化的丙酮酸氧化酶及丙酮酸氧化酶游离酶分别在温度为25℃,35℃,45℃,55℃的测活体系下反应5min,测定最适反应温度。定义最适反应温度下测得的酶活力为100%(图2c)。
(3)丙酮酸氧化酶的ph稳定性实验:将聚赖氨酸固定化的丙酮酸氧化酶及丙酮酸氧化酶游离酶置于37℃、ph值分别为3.0,4.0,5.0,6.0,7.0,8.0,9.0的条件下保温2h,后取样于最适反应ph值和温度下测定丙酮酸氧化酶的残余活力。定义未处理的丙酮酸氧化酶酶活力为100%(图2b)。
(4)丙酮酸氧化酶的温度稳定性实验:将聚赖氨酸固定化的丙酮酸氧化酶及丙酮酸氧化酶游离酶置于不同温度(25℃,35℃,45℃,55℃)的水浴锅中保温2h,后取样于最适反应ph值和温度下测定丙酮酸氧化酶的残余活力。定义未处理的丙酮酸氧化酶酶活力为100%(图2d)。
结果表明,利用聚赖氨酸固定化的丙酮酸氧化酶所应用的ph条件范围相比游离酶有了明显提升,提高了丙酮酸氧化酶约20%活力,由于聚赖氨酸具有很好的化学稳定性和耐热性、以及较强的机械性能,固定化丙酮酸氧化酶在35℃温度以上的高温耐受性有了明显提升,未见明显酶活力损失,游离酶仅为初始酶活的40%,提升明显。
实施例3
本实施例以戊二醛,多巴胺、壳聚糖载体为对比例,说明丙酮酸氧化酶固定化的技术效果。
(1)将得到的丙酮酸氧化酶纯酶测量酶活,分装并确保每管为1u的丙酮酸氧化酶酶活,将酶溶液分别与不同浓度的戊二醛溶液(0.125%,0.25%,0.375%,0.5%,0.625%)按照1:1稀释比例混合,并用滴定法滴定在pb电极表面,然后将电极置于室温通风处干燥18h,用蒸馏水洗涤电极表面后测试酶活。
(2)将得到的丙酮酸氧化酶纯酶测量酶活,分装并确保每管为1u的丙酮酸氧化酶酶活,将酶溶液分别于不同浓度的tris-hcl缓冲溶液配制的多巴胺溶液(2g/l,4g/l,6g/l,8g/l,10g/l,ph7.5)混合,滴加于普鲁士蓝修饰的pb电极表面,然后将电极置于室温通风处干燥18h,用蒸馏水洗涤电极表面后测试酶活。
(3)将得到的丙酮酸氧化酶纯酶测量酶活,分装并确保每管为1u的丙酮酸氧化酶酶活,将壳聚糖溶解在1%冰乙酸溶液中,调节ph至5,室温超声至壳聚糖全部溶解至溶液澄清。将普鲁士蓝修饰的pb电极分别置于不同浓度(0.25%,0.5%,0.75%,1%,1.25%)壳聚糖溶液中,采用循环伏安法,在–1.2~1.0v电位下电沉积循环20次,有壳聚糖密膜产生,取出干燥,将丙酮酸氧化酶用滴定法滴定在电极表面,然后将电极置于室温通风处干燥18h,用蒸馏水洗涤电极表面后测试酶活。
(4)采用实施例2的方法制备聚赖氨酸固定化丙酮酸氧化酶电极,基于不同聚赖氨酸浓度分为五个实验组,包括0.06%,0.12%,0.18%,0.24%,0.3%五种不同质量浓度,将不同浓度的聚赖氨酸溶液分别滴定于pb电极上于edc交联形成牢固的修饰膜,之后滴定丙酮酸氧化酶和edc的混合溶液,获取聚赖氨酸固定化丙酮酸氧化酶电极,用蒸馏水洗涤电极表面后测试酶活。
酶活测试结果如图3所示,定义游离酶酶活力为100%。可以看出,壳聚糖和聚赖氨酸对丙酮酸氧化酶都有良好的固定效果,但相比较壳聚糖,聚赖氨酸法固定化丙酮酸氧化酶的稳定性更强。聚赖氨酸可以促进生物酶或蛋白质的直接电子传递,并提高生物酶的催化效率,且聚赖氨酸本身具有很好的化学稳定性和耐热性、以及较强的机械性能,能增强生物分子或细胞与电极表面间的吸附力。聚赖氨酸分子中存在着游离氨基,对各种蛋白质的亲和力非常高,不但易与酶形成共价结合,又可以结合各种金属离子,使酶免受金属离子的抑制,实验表明,聚赖氨酸适宜于丙酮酸氧化酶固定,是一个良好的载体材料。
- 还没有人留言评论。精彩留言会获得点赞!