Mhp非特异性核酸酶及其编码基因与应用的制作方法
本发明涉及生物技术领域,具体地说,涉及mhp非特异性核酸酶及其编码基因与应用。
背景技术:
核酸酶是一种可以降解核酸底物、催化磷酸二酯键水解的一类酶,可以分为dna酶、rna酶和非特异性核酸酶三类。其中非特异性核酸酶是一类高活性的水解酶,能非特异性地降解几乎所有形式的核酸,包括单链、双链、线状、环状和超螺旋形式的dna和rna,且对核酸的序列没有要求。非特异性核酸酶具有许多重要功能,例如,参与dna复制、重组和修复,rna的剪接、成熟、降解和干扰,细胞的营养生长、细胞凋亡、炎性反应、血管血栓及宿主防御等过程,因而在癌症等疾病的诊断和治疗方面具有重要的应用价值;作为基因杀手用于控制改造微生物有机体的自行毁灭;用于清除重组蛋白药物中的外源核酸,减少过敏反应和致癌风险,提高生物制品的安全性;用于pcr、lamp等核酸扩增产物的降解,以避免扩增产物对核酸扩增实验室或操作台的污染,减少或消除非特异性扩增;用于研制新型的环保生物消毒剂,其能作用于细菌和病毒的遗传物质,裂解dna或rna,从而达到杀灭细菌和病毒的目的,与化学消毒剂相比,在理论上对机体无任何毒副作用,不污染环境,是一种理想的潜在的绿色环保抗病毒制剂。
目前,国内外使用的非特异性核酸酶主要来源于merck公司的benzonaseendonuclease,benzonase核酸酶是来自serratiamarcescens,经基因工程改进的核酸内切酶,在广泛条件范围下都能保持很高的活性:在ph6-10及0-42℃保持较高的活性;在1.0mmpmsf、1.0mmedta及尿素中保持活性。但该重组蛋白具有信号肽,部分以包涵体形式存在,复性困难,导致其价格昂贵,使其大规模应用受到限制。因此有必要开发新型的非特异性核酸酶并建立相配套的生产工艺。
技术实现要素:
本发明的目的是提供mhp非特异性核酸酶及其编码基因与应用。
为了实现本发明目的,第一方面,本发明提供一种来源于猪肺炎支原体(mycoplasmahyopneumoniae)(简称mhp)的mhp非特异性核酸酶,所述mhp非特异性核酸酶为:
(a)由seqidno:2所示的氨基酸序列组成的蛋白质;或
(b)seqidno:2所示序列经取代、缺失或添加一个或几个氨基酸且具有同等功能的由(a)衍生的蛋白质。
由于氨基酸序列的特殊性,任何含有seqidno:2所示氨基酸序列的多肽的片段或其变体,如其保守性变体、生物活性片段或衍生物,只要该多肽的片段或多肽变体与前述氨基酸序列同源性在95%以上,均属于本发明保护范围之列。具体的,所述改变可包括氨基酸序列中氨基酸的缺失、插入或替换;其中,对于变体的保守性改变,所替换的氨基酸具有与原氨基酸相似的结构或化学性质,如用亮氨酸替换异亮氨酸,变体也可具有非保守性改变,如用色氨酸替换甘氨酸。
第二方面,本发明提供编码所述mhp非特异性核酸酶的基因。核苷酸序列为:
i)seqidno:1所示的核苷酸序列;
ii)seqidno:1所示的核苷酸序列经取代、缺失和/或增加一个或多个核苷酸且表达相同功能蛋白质的核苷酸序列;
iii)在严格条件下与seqidno:1所示序列杂交且表达相同功能蛋白质的核苷酸序列,所述严格条件为在含0.1%sds的0.1×sspe或含0.1%sds的0.1×ssc溶液中,在65℃下杂交,并用该溶液洗膜;或
iv)与i)、ii)或iii)的核苷酸序列具有90%以上同源性且表达相同功能蛋白质的核苷酸序列。
第三方面,本发明提供含有所述mhp非特异性核酸酶编码基因的生物材料,所述生物材料包括但不限于重组dna、表达盒、转座子、质粒载体、噬菌体载体、病毒载体或工程菌。
进一步地,本发明提供含有所述mhp非特异性核酸酶编码基因的重组表达载体,所述重组表达载体的出发载体是可以在真核表达系统、或原核表达系统中表达目的蛋白的载体。
优选所述出发载体选自pet系列、puc系列或pbr322载体等。
更优选所述重组表达载体是在质粒pet28a的ncoi和xhoi酶切位点之间插入所述mhp非特异性核酸酶的编码基因得到的重组表达载体pet28a-nuc。
进一步地,本发明提供一种重组基因工程菌,所述工程菌为大肠杆菌,并携带表达所述mhp非特异性核酸酶的表达载体。
在本发明的一个具体实施方式中,所述重组基因工程菌是用重组表达载体pet28a-nuc转化大肠杆菌得到的工程菌,命名为大肠埃希氏菌(escherichiacoli)bl21/mhp-nuc,现已保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101,保藏编号为cgmccno.16353,保藏日期2018年8月29日。
第四方面,本发明提供mhp非特异性核酸酶的截短蛋白,所述截短蛋白为:
(a)由seqidno:3所示的氨基酸序列组成的蛋白质;或
(b)seqidno:3所示序列经取代、缺失或添加一个或几个氨基酸且具有同等功能的由(a)衍生的蛋白质。
第五方面,本发明提供所述mhp非特异性核酸酶、编码所述mhp非特异性核酸酶的基因、含有所述基因的生物材料或所述mhp非特异性核酸酶的截短蛋白的以下任一应用:
1)在降解核酸中的应用;
2)在制备核酸降解剂中的应用。
其中,所述核酸包括但不限于双链dna、单链dna、质粒dna、rna或反义rna/dna。
第六方面,本发明提供一种核酸降解剂,其有效成分为所述mhp非特异性核酸酶、所述mhp非特异性核酸酶的截短蛋白和/或它们n端c端连接标签得到的融合蛋白。
进一步地,本发明提供所述mhp非特异性核酸酶编码基因在制备mhp非特异性核酸酶中的应用,所述应用为:构建含有所述mhp非特异性核酸酶基因的重组载体,将所述重组载体转化至大肠杆菌中,获得的重组基因工程菌进行诱导培养(以iptg为诱导剂),培养液分离得到含有mhp非特异性核酸酶的菌体细胞。
本发明所述mhp非特异性核酸酶核苷酸序列的获取及高产菌株的构建,具体包括以下步骤:
(1)利用已知猪肺炎支原体非特异性核酸酶基因设计引物,以mhp基因组为模板,通过pcr技术扩增出mhp非特异性核酸酶的基因片段,连接克隆载体进行测序。因为tga密码子在猪肺炎支原体中表达色氨酸,而在大肠杆菌表达系统中为终止密码子,因此通过设计突变引物,采用重叠延伸pcr的方法将mhp非特异性核酸酶基因内部的tga密码子突变成tgg,得到mhp非特异性核酸酶的核苷酸序列,如seqidno:1所示。突变后的基因序列对应的氨基酸序列如seqidno:2所示。
(2)将mhp非特异性核酸酶基因用ncoi和xhoi进行双酶切,并与同样双酶切的pet28a(+)连接,转化至大肠杆菌e.colitransetta(de3)表达载体,构建基因工程菌,在培养基中加入iptg诱导表达重组蛋白,即得产mhp非特异性核酸酶的菌体细胞。
本发明所述mhp非特异性核酸酶的酶学性质研究主要包括:用ni-ntaresin亲和层析分离纯化mhp非特异性核酸酶,以双链dna、单链dna、质粒dna和rna为底物,研究mhp非特异性核酸酶的底物特异性、降解时间、最适温度、不同离子温度对其活性的影响。研究结果表明:mhp非特异性核酸酶无底物特异性,可降解各种核酸底物,且解降解反应极为迅速,混匀即可完成降解反应;酶活性极强,192ngmhp非特异性核酸酶即可将1μg核酸底物彻底降;具有耐热性,17-57℃温度范围内均可发挥较强的核酸酶活性;低浓度的钙离子或镁离子即可使该核酸酶发挥活性,其它离子如铜离子,亚铁离子、三价铁离子几乎不能使该核酸酶发挥降解活性。
借由上述技术方案,本发明至少具有下列优点及有益效果:
本发明提供了来源于猪肺炎支原体的非特异性核酸酶及其编码基因,并构建了mhp非特异性核酸酶的高产菌株。mhp非特异性核酸酶不仅具有非特异性,而且具有广泛的适用性,如降解反应迅速、酶活高、耐高温、所需离子浓度低等,可广泛应用于生物制药、生物试剂研发、工业化等领域。
mhp非特异性核酸酶能够有效降解中性粒细胞陷阱,降低中性粒细胞对病原微生物的诱捕和杀伤,下调干扰素表达,增强病原微生物的感染和发病作用,可配合病原用于动物传染病发病模型的建立,也可作为抗原制备疫苗,用于奶牛乳房炎等传染病的免疫预防。
附图说明
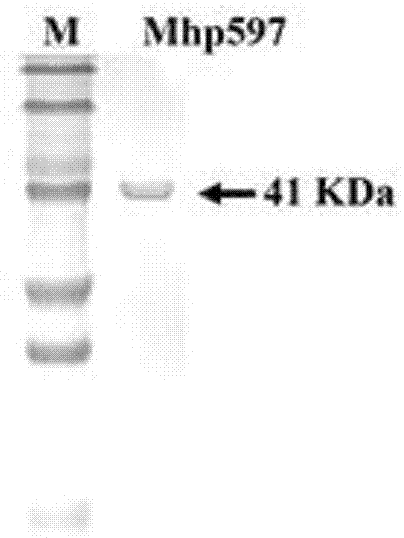
图1为本发明实施例2中mhp非特异性核酸酶sds-page检测结果;其中,m:蛋白marker;mhp597:mhp非特异性核酸酶。
图2为本发明实施例3中mhp非特异性核酸酶活性鉴定结果;其中,a:mhp非特异性核酸酶在不同时间内对dsdna的降解;b:mhp非特异性核酸酶在不同时间内对ssdna的降解;c:mhp非特异性核酸酶在不同时间内对质粒dna的降解;d:mhp非特异性核酸酶在不同时间内对rna的降解;e:不同浓度的mhp非特异性核酸酶对核酸底物的降解;f:不同的温度对mhp非特异性核酸酶核酸酶活性的影响;g:不同浓度的ca2+对mhp非特异性核酸酶核酸酶活性的影响;h:不同浓度的mg2+对mhp非特异性核酸酶核酸酶活性的影响;i:不同浓度的cu2+对mhp非特异性核酸酶核酸酶活性的影响;j:不同浓度的fe2+对mhp非特异性核酸酶核酸酶活性的影响;k:不同浓度的fe3+对mhp非特异性核酸酶核酸酶活性的影响。dsdna为小牛胸腺dna,ssdna为m13phagedna,质粒dna为puc19质粒dna,rna从pk15细胞中提取获得。c:control,核酸底物没做任何处理。
图3为本发明实施例3中rmhp597δtm和rmhp597δ315-377蛋白的核酸酶活性分析结果;其中,a:不同时间内1μgrmhp597δtm对1μgdsdna的降解作用;b:不同时间内1μgrmhmhp597δ315-377对1μgdsdna的降解作用。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例均按照常规实验条件,如sambrook等分子克隆实验手册(sambrookj&russelldw,molecularcloning:alaboratorymanual,2001),或按照制造厂商说明书建议的条件。
实施例1mhp非特异性核酸酶核苷酸序列的获取和点突变
利用已知猪肺炎支原体(mhp)非特异性核酸酶基因(基因登录号为aaz53943.1)设计引物,mhp597-f’(5’-atgaaaattaaaaaattatttcttttt-3’)和mhp597-r’(5’-ttaattctgactgttttggcct-3’),以mhp全基因组为模板,进行pcr扩增,将获得的序列连接克隆载体并送美吉生物科技有限公司测序。将测序结果使用dnastar软件翻译成蛋白序列,找到mhp非特异性核酸酶的基因片段内部的tga终止密码子,通过设计突变引物,突变引物列表如表1,采用重叠延伸pcr的方法进行点突变,将基因内部的tga突变成tgg,即得到mhp非特异性核酸酶的核苷酸序列,结果如seqidno:1所示,其对应的氨基酸序列如seqidno:2所示。
pcr扩增体系及条件如下:
25μlpcr反应体系为:dna模板2.0μl,10μm上游引物0.5μl,10μm下游引物0.5μl,2×taqpcrstarmix12.5μl,ddh2o9.5μl。
pcr循环程序:94℃预变性5.0min;94℃变性30sec,56℃退火30sec,72℃延伸1min,共35个循环;72℃延伸5.0min。
表1mhp597突变引物
实施例2表达mhp非特异性核酸酶工程菌株的构建
1、mhp非特异性核酸酶基因的扩增
根据修饰后的mhp非特异性核酸酶基因序列特征设计引物,上游引物mhp597-f含ncoi位点mhp597-f(5’-catgccatgggcaccggactcggagcttattt-3’),不扩增原始信号肽(1-18个氨基酸切除,总长为54bp),下游引物mhp597-r含xhoi位点mhp597-r(5’-ccgctcgagattctgactgttttggcct-3’),mhp非特异性核酸酶基因(seqidno:1所示)为模板,进行pcr扩增。pcr扩增体系及条件同实施例1。
2、mhp非特异性核酸酶基因的克隆
采用北京天跟生化科技有限公司的普通琼脂糖凝胶dna回收试剂盒回收步骤(1)pcr扩增产物,连接北京全式金生物技术有限公司的peasy-t1克隆载体,即peasy-t1-nuc。克隆载体的连接及产物转化感受态大肠杆菌trans-t1的方法为:准确吸取peasy-t1cloningvector1μl、基因片段胶回收产物4μl放入pcr反应管中,用小枪头轻轻混匀后将反应管置于pcr仪中25℃反应15min,置于冰上备用;从-80℃取出1管50μl装的trans1-t1大肠杆菌感受态细胞,置于冰上待其融化,大约8min左右感受态细胞融化,将上述反应产物全部加入感受态细胞,手指轻弹混匀,置冰上30min,然后放入42℃水浴锅中热激45s,迅速放在冰上,置2min;加入500μllb无抗性培养基,37℃200rpm摇床中培养1h;取100μl细菌培养液,用灭菌的三角棒均匀涂在氨苄青霉素(amp+)抗性的的lb固体培养基上,37℃倒置16h。用小枪头挑取培养基上的单菌落,培养至氨苄青霉素抗性的液体lb培养基中,37℃200rpm恒温摇床中培养10h。
3、mhp非特异性核酸酶表达载体的构建
将peasy-t1-nuc和pet28a(+)经ncoi和xhoi双酶切,将双酶切得到的mhp非特异性核酸酶基因片段和pet28a(+)载体经t4dna连接酶连接。连接产物转化感受态大肠杆菌transetta(de3)表达菌,将转化菌株接种在含终浓度100μg/ml卡那霉素的lb琼脂平板上,37℃培养过夜,随机挑取单菌落,37℃振摇培养12h,用北京天跟生化科技有限公司的质粒小提试剂盒提取质粒,送美吉生物科技有限公司测序,表明seqidno:1所示核苷酸序列已经重组至表达载体pet28a(+)中,获得含mhp非特异性核酸酶基因的大肠杆菌transetta(de3)。连接产物转化感受态大肠杆菌transetta(de3)的方法为:从-80冰箱取出一管50μl装的transetta(de3)感受态细胞,冰上放置大概8min待其融化,吸取5μl上述连接产物至感受态细胞,轻弹混匀后在冰上放置30min;将感受态细胞放42℃水浴中热激45s,迅速转移到冰上。放置2min;加入500μl无抗性lb培养基,在摇床中37℃200rpm培养1h;吸取100μl菌液放在卡那霉素抗性的lb固体培养基上,用灭菌的三角棒涂抹均匀,在37℃培养箱中倒置培养16h。用灭菌小枪头挑取6个长势均匀的单菌落,接种于含卡那霉素抗性的lb液体培养基中,每管5ml,37℃200rpm培养10h。
4、mhp非特异性核酸酶的诱导表达
将步骤3中序列鉴定正确(即含seqidno:1所示核苷酸序列)的菌体接种至lb液体培养基,37℃振荡培养至od600约为4h时,加入终浓度1.0mm的iptg,37℃继续振荡培养12h,离心(4℃,8000rpm,5min),收集沉淀,获得含seqidno:1所示核苷酸序列编码mhp非特异性核酸酶的菌体细胞,命名为大肠埃希氏菌(escherichiacoli)bl21/mhp-nuc。送至中国微生物菌种保藏管理委员会普通微生物中心进行保藏,保藏编号为cgmccno.16353。
5、mhp非特异性核酸酶的分离纯化
将上述表达菌用80mlpbs重悬,使用超声破碎仪破碎处理40min;4℃12000rpm离心10min,收集上清,加入饱和硫酸铵至终饱和度为40%,轻轻吹吸混匀,室温放置20min;4℃12000rpm离心10min,收集上清,加入饱和硫酸铵至终饱和度为55%,室温放置20min;4℃12000rpm离心10min,收集沉淀,用80mlpbs重悬沉淀,彻底溶解后放入透析袋,将透析袋在3lpbs中透析去除,6h换液一次,24h后将蛋白液取出用于ni柱亲和层析。
取样进行12%聚丙烯酰胺凝胶电泳分析发现ni柱亲和层析可以纯化得到非常纯净的核酸酶蛋白(图1)。
实施例3mhp非特异性核酸酶的酶学性质研究
1、mhp非特异性核酸酶对不同核酸底物的降解作用
将dsdna(小牛胸腺dna)、ssdna、plasmiddna、rna作为底物,加入1μgmhp597蛋白,放入含有10mmca2+、100mmmg2+的缓冲液中(表2),分别反应0.25min、1min、2min、3min、4min、5min,然后将反应体系跑1%的琼脂糖凝胶电泳。结果表明1μgmhp非特异性核酸酶可彻底降解1μg双链dna(dsdna)、单链dna(ssdna)、质粒dna和rna,且降解反应时间极短,混匀即可完成降解反应(图2a,图2b,图2c,图2d)。
表2mhp非特异性核酸酶对不同核酸底物的降解
2、蛋白浓度对mhp非特异性核酸酶活性的影响
为了探究不同浓度的mhp非特异性核酸酶对底物降解作用的影响,分别取终浓度为12ng/ml、24ng/ml、48ng/ml、96ng/ml、192ng/ml的mhp非特异性核酸酶用于核酸降解实验,反应体系见表3,然后将反应体系跑1%的琼脂糖凝胶电泳,检测结果。结果表明mhp非特异性核酸酶具有很强的核酸酶活性,彻底降解1μgdsdna所需蛋白浓度192ng/ml,即ng级的蛋白量即可发挥强大的核酸降解能力,说明rmhp597蛋白是一种极为高效的核酸酶(图2e)。
表3蛋白浓度对mhp非特异性核酸酶活性的影响
3、反应温度对mhp非特异性核酸酶活性影响
温度条件对酶活性具有重要影响,为了探究温度对mhp非特异性核酸酶核酸降解活性的影响,按照反应体系配好核酸底物和反应buffer的混合液,将此混合液和重组mhp非特异性核酸酶同时分别放入17℃、27℃、37℃、47℃、57℃、67℃的金属浴中孵育5min,然后将1μgmhp非特异性核酸酶加入混合液中,反应30min,见表4,然后将反应体系跑1%的琼脂糖凝胶电泳,检测结果。结果表明mhp非特异性核酸酶是耐热核酸酶,当温度达到57℃时,仍然具有很强的核酸酶活性(图2f)。
表4反应温度对mhp非特异性核酸酶活性的影响
4、金属离子对mhp非特异性核酸酶活性的影响
很多蛋白酶发挥其活性需要金属离子的辅助,为了探究mhp非特异性核酸酶降解核酸底物是否具有金属离子依懒性,将重组mhp非特异性核酸酶、不同浓度的(0.1m、0.2m、0.4m、0.8m、1.6m)金属离子(ca2+、mg2+、cu2+、fe2+、fe3+)及核酸底物按照表5体系混合均匀,置37℃孵育30min,然后将反应体系跑1%的琼脂糖凝胶电泳,检测结果。结果表明在ca2+或mg2+存在的条件下,mhp非特异性核酸酶可发挥核酸酶活性,而在cu2+、fe2+、fe3+存在的条件下,mhp非特异性核酸酶不可发挥核酸酶活性(图2g、图2h、图2i、图2j、图2k)。
表5金属离子对mhp非特异性核酸酶活性的影响
5、mhp非特异性核酸酶的功能区
结构分析发现mhp597n端有一个23aa大小的跨膜区,c端有大小的21aa大小的强碱性极性区,分别截短表达去除这两个特殊肽段的蛋白并分析其生物学功能。结果显示去除n端跨膜区的蛋白(rmhp597δtm)仍然具有极高的核酸酶活性,而去除强碱性极性区的蛋白(rmhp597δ315-377)无核酸酶活性(图3)。
mhp非特异性核酸酶的截短蛋白rmhp597δtm的氨基酸序列如seqidno:3所示。
6、mhp非特异性核酸酶的酸碱稳定性
经测定,mhp非特异性核酸酶在ph6.5-8.5的条件下酶活性稳定。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
序列表
<110>中国农业大学
<120>mhp非特异性核酸酶及其编码基因与应用
<130>khp181115577.6
<160>3
<170>siposequencelisting1.0
<210>1
<211>1077
<212>dna
<213>猪肺炎支原体(mycoplasmahyopneumoniae)
<400>1
accggactcggagcttatttaatttatcaaacatcaacaaataaatcaaattcaacaaca60
gttgcccttaatcaaactgaaaaattaaattcaacaagtaatttagaaaatactaattta120
gttccagatcataaaaaaaattctattcgaattggcttttggaatgttttaaattattca180
aataaatcctcaaaaacaaatacagcaaaaacatatgcagtttcgcaggtaataaactct240
acaaagctggatctagttggcttagcggagataacgcagaccggcgatggatctgatatt300
gttaaggaattaaatacgctaaatcctaatgccgcttggaaagaaataaccactgccgaa360
gagggcaaggtaaatcagaaggaaaaatatacatttttatataagtcttcacttttagaa420
atagctaattttgccagtccatcaaatccttatttgatccaaaaaggtgttaaattagaa480
tgggccagaccgcttgcagccgttaaatttaatactaaaacagaaaggaaagaggatttt540
acttttgtaattggtcattttgatgctccaggagtgcaaaaaaatcgtggggaaattcag600
gataaggaaacatcacaaggttctcaagaagccgcagaagctcgtgatttgataaattta660
ttagttgaaattgataaaaaagacggcgaaaacaaagaaataatttttatggctgatacg720
aatatccgtgccgaaaattctgaaaagttgtttaaatcaacactaaattcctatagatca780
ttgcttgataaagaagaaaaaacttcactttcaaatacttttggcaaatattcaaattcc840
tatgataaaattttttataaaggcaatcttgtcgcaaataacgggcaaaaatttgatatt900
ttttcaatttttaaaaaaaatattgctaatgtagaaaaatatgatgagcttcggaaaaaa960
gatggtcgctcaatgaattataaaattaatcaattaggggaaataaacagaattaaagga1020
atttccgatcatacaatggtttattttgatcttgaattaggccaaaacagtcagaat1077
<210>2
<211>359
<212>prt
<213>猪肺炎支原体(mycoplasmahyopneumoniae)
<400>2
thrglyleuglyalatyrleuiletyrglnthrserthrasnlysser
151015
asnserthrthrvalalaleuasnglnthrglulysleuasnserthr
202530
serasnleugluasnthrasnleuvalproasphislyslysasnser
354045
ileargileglyphetrpasnvalleuasntyrserasnlysserser
505560
lysthrasnthralalysthrtyralavalserglnvalileasnser
65707580
thrlysleuaspleuvalglyleualagluilethrglnthrglyasp
859095
glyseraspilevallysgluleuasnthrleuasnproasnalaala
100105110
trplysgluilethrthralaglugluglylysvalasnglnlysglu
115120125
lystyrthrpheleutyrlysserserleuleugluilealaasnphe
130135140
alaserproserasnprotyrleuileglnlysglyvallysleuglu
145150155160
trpalaargproleualaalavallyspheasnthrlysthrgluarg
165170175
lysgluaspphethrphevalileglyhispheaspalaproglyval
180185190
glnlysasnargglygluileglnasplysgluthrserglnglyser
195200205
glnglualaalaglualaargaspleuileasnleuleuvalgluile
210215220
asplyslysaspglygluasnlysgluileilephemetalaaspthr
225230235240
asnileargalagluasnserglulysleuphelysserthrleuasn
245250255
sertyrargserleuleuasplysgluglulysthrserleuserasn
260265270
thrpheglylystyrserasnsertyrasplysilephetyrlysgly
275280285
asnleuvalalaasnasnglyglnlyspheaspilepheserilephe
290295300
lyslysasnilealaasnvalglulystyraspgluleuarglyslys
305310315320
aspglyargsermetasntyrlysileasnglnleuglygluileasn
325330335
argilelysglyileserasphisthrmetvaltyrpheaspleuglu
340345350
leuglyglnasnserglnasn
355
<210>3
<211>336
<212>prt
<213>猪肺炎支原体(mycoplasmahyopneumoniae)
<400>3
asnglnthrglulysleuasnserthrserasnleugluasnthrasn
151015
leuvalproasphislyslysasnserileargileglyphetrpasn
202530
valleuasntyrserasnlysserserlysthrasnthralalysthr
354045
tyralavalserglnvalileasnserthrlysleuaspleuvalgly
505560
leualagluilethrglnthrglyaspglyseraspilevallysglu
65707580
leuasnthrleuasnproasnalaalatrplysgluilethrthrala
859095
glugluglylysvalasnglnlysglulystyrthrpheleutyrlys
100105110
serserleuleugluilealaasnphealaserproserasnprotyr
115120125
leuileglnlysglyvallysleuglutrpalaargproleualaala
130135140
vallyspheasnthrlysthrgluarglysgluaspphethrpheval
145150155160
ileglyhispheaspalaproglyvalglnlysasnargglygluile
165170175
glnasplysgluthrserglnglyserglnglualaalaglualaarg
180185190
aspleuileasnleuleuvalgluileasplyslysaspglygluasn
195200205
lysgluileilephemetalaaspthrasnileargalagluasnser
210215220
glulysleuphelysserthrleuasnsertyrargserleuleuasp
225230235240
lysgluglulysthrserleuserasnthrpheglylystyrserasn
245250255
sertyrasplysilephetyrlysglyasnleuvalalaasnasngly
260265270
glnlyspheaspilepheserilephelyslysasnilealaasnval
275280285
glulystyraspgluleuarglyslysaspglyargsermetasntyr
290295300
lysileasnglnleuglygluileasnargilelysglyileserasp
305310315320
histhrmetvaltyrpheaspleugluleuglyglnasnserglnasn
325330335
- 还没有人留言评论。精彩留言会获得点赞!
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺