大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制作方法
本发明属于植物基因工程领域,涉及植物FER基因及其编码蛋白和应用,特别涉及大豆bHLH转录因子基因GmFER,其编码蛋白,及其在提高酵母及烟草对镉的耐受性中的应用。
背景技术:
随着社会的日益发展,非农业建设用地迅速扩张,废弃物排放量以及农业化肥使用量增加,土壤重金属污染逐渐成为世界性环境问题。镉(Cd)是一种生物毒性很强的重金属,半衰期非常长,摄入过量会导致肾脏和骨骼的病变(参见Nawrot T.,Plusquin M.,Hogervorst J.,et al.,Environmental exposure to cadmium and risk of cancer:a prospective population-based study[J],Lancet Oncology,2006,7(2):119-126)。
大豆是在农业生产上具有较高经济价值的农作物,含有丰富的蛋白质和油脂,与人类的生活息息相关。但是,大豆极易积累重金属(参见Wolnik K.A.,Fricke F.L.,Capar S.G.,et al.,Elements in major raw agricultural crops in the United States.1.Cadmium and lead in lettuce,peanuts,potatoes,soybeans,sweet corn,and wheat[J],J.Agric.Food Chem.,1983,31(6):1240-1244),重金属在植物体内的大量积累,不仅严重影响植物的生长和发育,而且会通过食物链危及人类的健康。
bHLH(basic/Helix-Loop-Helix,碱性/螺旋-环-螺旋)转录因子是植物转录因子中最大的家族之一。同一bHLH转录因子中的两个α-螺旋之间或者不同bHLH转录因子的α-螺旋之间可以相互作用,形成同源或异源二聚体,与靶基因启动子结合,调控基因的转录(参见Ma P.C.M.,Rould M.A.,Weintraub H.,et al.,Crystal structure of MyoDbHLH domain-DNA complex:Perspectives on DNA recognition and implications for transcriptional activation[J],Cell,1994,77(3):451-459)。bHLH广泛存在于植物的不同组织中,在植物的生长发育调控过程中发挥极为重要的作用。拟南芥bHLH基因(FIT、AtbHLH38和AtbHLH39)参与了植物对Cd胁迫的响应,组成性地启动了一些参与重金属区隔化的基因(如HMA3、MTP3、IREG2和IRT2)的表达,从而将吸收的Cd大部分区隔化在根部,减少了向地上部的转运(参见Wu HL,Chen CL,Du J,et al.,Co-Overexpression FIT with AtbHLH38 or AtbHLH39 inArabidopsis-Enhanced Cadmium Tolerance via IncreasedCadmium Sequestration in Roots and Improved Iron Homeostasis of Shoots[J],Plant Physiology,2012,158:790-800),但至今尚未有报道披露大豆bHLH转录因子基因的相关应用。
技术实现要素:
针对上述情况,本发明根据同源克隆的方法,从栽培大豆的根系中克隆出一种bHLH转录因子基因GmFER,该基因对Cd胁迫有响应。分离与克隆大豆GmFER基因不仅有利于揭示大豆的抗Cd机制,还可以通过基因操作的手段进行微生物或植物的抗Cd分子育种,以便提高抗Cd性。
具体而言,本发明提供了大豆bHLH转录因子基因GmFER,全长972bp,其核苷酸序列如SEQ ID NO:1所示。
本发明还提供了由上述大豆bHLH转录因子基因GmFER编码的蛋白,包含323个氨基酸(其中从N端第129位到第185位的氨基酸序列为bHLH转录因子的保守结构域),其氨基酸序列如SEQ ID NO:2所示。
此外,包含如SEQ ID NO:1所示的核苷酸序列并且编码如SEQ ID NO:2所示的氨基酸序列的多核苷酸序列以及将如SEQ ID NO:2所示的氨基酸序列中的一个或多个(不多于十个)氨基酸残基进行取代和/或缺失和/或添加并且具有转录激活功能、调控植物抗逆性的氨基酸序列也在本发明的保护范围之内。
本发明还提供了包含上述大豆bHLH转录因子基因GmFER的表达载体,所述表达载体通过将上述大豆bHLH转录因子基因GmFER插入载体而得,所述载体选自p424GPD、pBI121、pCXSN、pCAMBIA2301、pCAMBIA1301、pAHC25中的任意一种。
当使用上述大豆bHLH转录因子基因GmFER构建表达载体时,在其转录起始核苷酸前可加上任何一种组成型、组织特异型、诱导型或增强型启动子。为了便于对转基因微生物或植物进行鉴定及筛选,可对所用表达载体进行加工,如加入具有抗性的抗生素标记物(如卡那霉素标记物、潮霉素标记物等)、抗化学试剂标记基因(如抗除草剂bar基因等)或可产生颜色变化的酶或蛋白(如GUS基因、GFP基因等)等。
本发明还提供了包含上述大豆bHLH转录因子基因GmFER的工程菌,所述工程菌中的宿主为大肠杆菌或酵母菌,通过PEG/LiAc介导的方法将上述大豆bHLH转录因子基因GmFER转入。
本发明还提供了包含上述大豆bHLH转录因子基因GmFER的转基因植物细胞系,所述植物为烟草,通过农杆菌介导的方法将上述大豆bHLH转录因子基因GmFER转入。
本发明还提供了一对用于扩增上述大豆bHLH转录因子基因GmFER的引物,其中正向引物的核苷酸序列如SEQ ID NO:3所示,反向引物的核苷酸序列如SEQ ID NO:4所示。
本发明还提供了上述大豆bHLH转录因子基因GmFER及其编码蛋白和包含其的表达载体在提高酵母对Cd的耐受性中的应用。通过将大豆bHLH转录因子基因GmFER导入酵母中,提高了酵母的抗Cd性。此外,上述大豆bHLH转录因子基因GmFER及其编码蛋白和包含其的表达载体在提高植物(优选单子叶和双子叶植物)对Cd的耐受性中的应用也在本发明的保护范围之内。
本发明提供的大豆bHLH转录因子基因GmFER来自大豆(Williams 82品种),半定量PCR检测结果表明GmFER基因主要在大豆的根中表达。在Cd胁迫后,其表达量明显提高,说明该基因受Cd诱导。在酵母中过表达GmFER基因能够提高酵母对Cd的耐受性,并能提高转GmFER基因烟草对Cd的耐受性。因此,GmFER基因可以作为目的基因导入植物(包括单子叶和双子叶植物),从而提高植物对Cd的耐受性,具有较高的应用价值。
附图说明
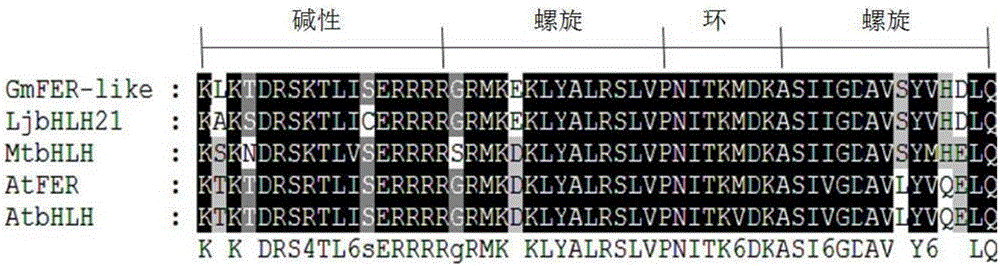
图1为大豆bHLH转录因子基因GmFER编码蛋白与其他植物bHLH结构域的氨基酸序列多重比对结果,其中:GmFER-like来自大豆,LjbHLH21来自百脉根,MtbHLH来自蒺藜苜蓿,AtFER来自拟南芥,AtbHLH来自拟南芥。
图2为GmFER的进化树分析图,其中:GmFER-like(Glycine max,XP_003541980.1);LjbHLH21(Lotus japonicus,ACN21647.1);MtbHLH(Medicago truncatula,XP_003606331.1);AtFER-like(Arabidopsis thaliana,NP_850114.1);AtbHLH(Arabidopsis thaliana,AAM10938.1);VvFER-like(Vitis vinifera,XP_002272647.1);SlbHLH(Solanum lycopersicum,NP_001234654.1);ZmbHLH(Zea mays,DAA38198.1);BnbHLH(Brassica napus,CAD54298.1);VvbHLH35(Vitis vinifera,XP_002263999.1)。
图3为GmFERmRNA在叶、茎和根中表达丰度的半定量PCR检测结果。
图4为采用100μM的CdCl2处理不同时间后对GmFERmRNA表达影响的半定量PCR检测结果。
图5为酵母表达载体的构建示意图,其中:A为p424GPD空载体物理图谱;B为p424GPD::GmFER植物表达载体物理图谱。
图6为GmFER基因对于酵母对Cd的耐受性的影响的检测结果。
图7为pCXSN::GmFER植物表达载体示意图。
图8为转基因烟草在CdCl2胁迫下的根长生长情况,其中:WT表示野生型烟草,T表示转基因烟草。
具体实施方式
以下将结合附图和具体实施例来说明本发明的技术方案。应当理解的是,这些实施例仅用于举例说明本发明,而非以任何方式限制本发明的范围。除非另有说明,下列实施例中所使用的术语具有本领域普通技术人员通常理解的含义,未注明的实验方法均可按照常规方法进行,例如参照J.萨姆布鲁克(Sambrook J.)和D.W.拉塞尔(Russell D.W.)著《分子克隆实验指南》(科学出版社,2005)或者按照生物试剂生产厂商的使用说明中记载的条件。另外,下列实施例中所使用的仪器、材料、试剂均可通过常规商业手段获得。
实施例1:大豆bHLH转录因子基因GmFER的克隆。
利用生物信息学和常规聚合酶链式反应(PCR)相结合的方法克隆大豆GmFER基因的DNA序列,具体方法如下所述:
以Williams 82品种大豆的根系作为实验材料,采用SV Total RNAlysis试剂盒(Promega公司,美国)提取总RNA。按照TaKaRa公司提供的方法,采用PrimeScriptTM逆转录酶合成出cDNA,并以其作为模板进行PCR扩增,PCR扩增过程中使用的一对引物P1(如SEQ ID NO:3所示,由上海生物工程公司合成)和P2(如SEQ ID NO:4所示,由上海生物工程公司合成)则根据NCBI中已知的GmFER序列进行设计与合成:
P1:5’-ATGGATGTTCACGAAGACACACTCA-3’;
P2:5’-TCAAGCAGGAAAAGATGCCACGAAT-3’。
通过RT-PCR方法扩增,获得GmFER基因完整的开放阅读框(ORF)片段。25μlPCR反应体系如下:含MgCl2的10×PCR缓冲液2.5μl,正向、反向引物各1.0μl(10μM),dNTP(10mM)1.0μl,cDNA样品2.0μl,Ex-Taq酶(宝生物工程(大连)有限公司)0.25μl,双蒸水17.5μl。PCR反应条件:95℃预变性5min;95℃变性30s,58℃复性45s,72℃延伸1min,30个循环后,72℃延伸10min。将扩增得到的大约800bp的DNA片段进行琼脂糖凝胶电泳分离,采用凝胶回收试剂盒(杭州爱思进生物技术有限公司)并按照试剂盒中提供的方案进行回收,并克隆到pEASY-T1(Clontech)载体上,进行测序分析(由上海invitrogen公司完成),测序结果和NCBI中的GmFER基因序列完全相同。
实施例2:GmFER转录本的时空分布以及Cd胁迫对GmFER基因表达的影响。
利用半定量PCR的方法,检测GmFER在大豆植株中的组织分布情况,并采取以下措施保证检测结果的可靠性:利用扩增级别DNase I消化提取的总RNA中可能存在的少量的基因组DNA的污染,为了检测基因组DNA是否消除干净,可以取出一部分用DNase I消化的总RNA样品进行常规PCR反应。当发现没有扩增条带产生时,再进行反转录步骤,同时为了进一步验证实时定量PCR扩增的条带是否就是GmFER,将PCR产物切胶回收进行测序。具体方法为:取大豆不同生长时期根、茎、叶、花和荚等材料提取总RNA为模板,半定量PCR的引物为P1和P2。
以大豆激动蛋白(GmActin)cDNA作为内参,半定量PCR引物P3(如SEQ ID NO:5所示,由上海生物工程公司合成)和P4(如SEQ ID NO:6所示,由上海生物工程公司合成)的核苷酸序列如下:
P3(actin-F):5’-CGGTGGTTCTATCTTGGCATC-3’;
P4(actin-R):5’-GTCTTTCGCTTCAATAACCCTA-3’。
先取1μg总RNA,加入扩增级别DNase I(Sigma公司,美国),于室温放置30min以除去基因组DNA的污染,然后加入停止缓冲液(50mM EDTA),于70℃加热10min变性DNase I和RNA,然后采用宝生物工程(大连)有限公司的反转录试剂盒并按照试剂盒中说明书记载的方法进行反转录,每个样品取1μg总RNA,于42℃反应1h,于70℃加热10min后取出,置于冰上,以使反转录酶失活,最后取1μl反转录产物进行半定量PCR扩增,检测结果如图3所示,从中可以看出GmFER基因主要在大豆根系中表达。
为了研究GmFER基因对Cd胁迫的响应,采用半定量PCR的方法检测GmFER基因在Cd胁迫下的表达模式。将三叶期大豆以100μM的CdCl2处理0h、1h、3h和24h,以未做任何处理的三叶期大豆作为对照,然后采用与上述相同的方法检测大豆根系中GmFER基因的表达情况,同样以大豆的actin(激动蛋白)cDNA作为内参,以P1和P2作为引物,检测结果如图4所示,从中可以看出,在Cd胁迫后,大豆根系中GmFER的表达量表现出先下降后上升的趋势。
实施例3:包含GmFER基因的酵母表达载体的构建以及转基因酵母对Cd的耐受性检测。
(1)酵母表达载体的构建:
以GmFERcDNA全长序列为模板,在含有酶切位点的正向引物P5(如SEQ ID NO:7所示,由上海生物工程公司合成)和反向引物P6(如SEQ ID NO:8所示,由上海生物工程公司合成)的引导下,PCR扩增5’端添加BamHI识别位点、3’端添加SmaI识别位点的GmFERcDNA全长序列,引物的核苷酸序列如下:
P5:5′-CGCGGATCCATGGATGTTCACGAAGACACACTCA-3′(带下划线的碱基为限制内切酶BamHI识别位点);
P6:5′-TCCCCCGGGTCAAGCAGGAAAAGATGCCACGAAT-3′(带下划线的碱基为限制内切酶SmaI识别位点)。
反应结束后,对PCR扩增产物进行1.0%琼脂糖凝胶电泳检测,回收并纯化972bp的目的片段,将其用BamHI和SmaI酶切后,与经相同酶双酶切的载体p424GPD采用T4DNA连接酶于4℃连接过夜(20μl反应体系含1×T4DNA连接酶缓冲液,p424GPD片段0.03pmol,GmFER片段0.3pmol,T4DNA连接酶350U)。
将连接产物转化大肠杆菌DH5α感受态细胞(转化方法参照《分子克隆实验指南》第二版,1992,科学出版社,第55~56页),将转化后的大肠杆菌DH5α细胞悬液涂布在含有80mg/L氨苄青霉素的平板上,将对抗氨苄青霉素的阳性克隆进行扩增并提取质粒,采取酶切和测序的方法验证连接的正确性,得到酵母表达载体p424GPD::GmFER(如图5所示)。
(2)PEG/LiAc法介导的酵母转化与筛选鉴定:
采用PEG/LiAc法转化酵母细胞W303B,涂布在缺色氨酸(-Trp)的SD固体培养基上,于30℃培养3d,从培养平板中挑取单克隆进行PCR检测,采用引物P1和P2,25μl PCR反应体系如下:含MgCl2的10×PCR缓冲液2.5μl,正向、反向引物各1.0μl(10μM),dNTP 1.0μl(10mM),基因组DNA模板1.0μl,双蒸水18.5μl,以及Ex-Taq酶(宝生物工程(大连)有限公司)0.25μl。扩增反应条件如下:95℃预变性4min,95℃变性30s,62℃复性50s,72℃延伸1min,35次循环后,72℃延伸min。将扩增产物进行凝胶电泳,在鉴定的9个单克隆中有3个阳性转p424GPD::GmFER的单克隆,得到含有p424GPD::GmFER的酵母菌株。
(3)基因功能分析:
把含有p424GPD::GmFER表达载体的酵母及带有空载体p424GPD的酵母分别以1%的接种量接种于100ml缺色氨酸(-Trp)的SD液体培养基中培养过夜,直至OD600=1,用SD(-Trp)液体培养基进行稀释至OD600=0.1、0.01、0.001,分别滴在含有50μMCdCl2和不含有CdCl2的SD(-Trp)固体培养基上,于30℃培养3d,观察菌落的生长情况,其结果如图6所示。
从图6中可以看出,在含有50μM CdCl2的培养基上,含有p424GPD::GmFER表达载体的酵母明显比带有空载体p424GPD的酵母生长得好,带空载体p424GPD的酵母菌株在含有50μM CdCl2的培养基上几乎不能生长。由此可见,GmFER基因能够提高酵母对Cd的耐受性。将GmFER基因作为目的基因导入植物(包括单子叶和双子叶植物)也可以提高植物对Cd的耐受性,具有较高的应用价值。
实施例4:包含GmFER基因的植物表达载体的构建以及转基因烟草对Cd的耐受性检测。
(1)植物表达载体的构建:
以GmFERcDNA全长序列为模板,通过P和P2进行PCR扩增。反应结束后,对PCR扩增产物进行1.0%琼脂糖凝胶电泳检测,回收并纯化972bp的目的片段,通过TA克隆的方法,把GmFER的ORF连接到植物表达载体pCXSN。
将连接产物转化大肠杆菌DH5α感受态细胞(转化方法参照《分子克隆实验指南》第二版,1992,科学出版社,第55~56页),将转化后的大肠杆菌DH5α细胞悬液涂布在含有80mg/L卡那霉毒的平板上,将卡那霉毒的阳性克隆进行扩增并提取质粒,采取测序的方法验证连接的正确性,得到植物表达载体pCXSN::GmFER(如图7所示)。采用冻融转化法将此载体转化根癌农杆菌EH105,得到含有pCXSN::GmFER的农杆菌菌株。
(2)农杆菌介导的烟草转化与筛选鉴定:
从培养平板中挑取单个农杆菌菌落,在2ml YEB培养基(含有50mg/L卡那霉素、30mg/L利福平)中培养过夜;以1%的接种量接种于100ml YEB培养基(含有50mg/L卡那霉素、30mg/L利福平)中培养过夜,6000rpm离心收集菌体,用侵染培养基重新悬浮,菌液浓度调整至OD600约为0.5,作为侵染菌液。采用叶圆盘转化法,用无菌刀片将无菌烟草试管苗叶片切成4~6mm的叶盘,叶盘外植体在OD600约0.5的pCXSN::GmFER农杆菌侵染溶液中感染10min,取出后用无菌滤纸吸干表面液体,放入含有共培养液(MS基本培养基加6-苄氨基嘌呤1.0mg/L、萘乙酸0.1mg/L、蔗糖30g/L,pH=5.8)的滤纸上黑暗条件下,25℃共培养2天。经共培养2天的叶盘用含有500mg/L的羧苄青霉素水溶液洗涤3次,用无菌滤纸吸干表面液体转入筛选分化培养基中,25℃光照培养。转化体的筛选在筛选分化培养基(MS基本培养基加6-苄氨基嘌呤1.0mg/L、萘乙酸0.1mg/L、卡那霉素80mg/L、羧苄青霉素400mg/L、蔗糖30g/L,pH=5.8)中进行。待叶片边缘长出丛生再生芽至2~3cm时,用解剖刀将再生芽切下,并转入生根培养基(MS基本培养基加卡那霉素50mg/L、蔗糖20g/L,pH=5.8)中培养25天。转化细胞再生的植株具有卡那霉素抗性,为正常绿色植株,获得转基因植株。
提取pCXSN::GmFER转基因烟草基因组DNA,以基因组DNA为模板进行PCR反应。将扩增产物进行凝胶电泳,并回收PCR产物进行测序。为了进一步鉴定转基因植株,提取通过基因组检测为阳性的转pCXSN::GmFER烟草叶片总RNA,用1μg叶片总RNA经反转录试剂盒(宝生物工程(大连)有限公司)按试剂盒的方法反转录得到的cDNA为模板,PCR引物为实例4中的引物P1和P2,25μl PCR反应体系含2.5μl含MgCl2的10×PCR缓冲液、正、反向10μM的引物各1.0μl、1.0μl 10mM的dNTP(脱氧核苷酸混合物)、1.0μl cDNA模板和18.5μl双蒸水,以及0.25μl rTaq酶(宝生物工程(大连)有限公司)。扩增反应条件如下:95℃预变性4min,95℃30s,55℃50s,72℃1min,33次循环,72℃延伸10min。将扩增产物进行凝胶电泳,获得GmFER基因进行正常表达的转基因植株。
(3)基因功能分析:
将转基因烟草T0代种子及野生型种子在滤纸上进行萌发,28℃的光照培养箱中培养,10天后,取出大小生长一致的转GmFER基因阳性烟草苗与对照烟草苗,将其分别转移至含有50μM CdCl2的滤纸上,在28℃的光照培养箱中培养,处理4天后,测量根长,其结果如图8所示。结果显示,GmFER基因在烟草中的过量表达能够提高烟草转基因植株对Cd胁迫的抗性。
- 还没有人留言评论。精彩留言会获得点赞!
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 降低种子重量的白桦AP2基因及其编码蛋白的制造方法与工艺
- 可编码ArtRD蛋白基因及其蛋白和应用的制造方法与工艺
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 甘薯耐逆相关蛋白IbFBA2、编码基因、重组载体与应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 核盘菌凝集素SSL‑6蛋白及其编码基因与应用的制造方法与工艺
- 植物抗病毒相关蛋白GmSN1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 核盘菌凝集素SSL‑6蛋白及其编码基因与应用的制造方法与工艺