一种自制探针检测肿瘤11基因的技术的制作方法
本发明涉及基因
技术领域:
,具体为一种自制探针检测肿瘤11基因的技术。
背景技术:
:自从2005年,下一代测序(nextgenerationseqμencing,ngs)技术开始发展以来,在生物医学研究领域得到了越来越广泛的应用。ngs技术相比于传统sanger测序而言,优势在于其规模大、通量高。在文库构建时或捕获后目标序列扩增阶段均可引入序列标签,从而可实现多样本的平行分析。目前研究得知,在所有肿瘤中,有90-95%的肿瘤是由复杂的基因、环境共同作用引发的,但仍有5%-10%的是由遗传的变异基因引起。而现在,基因检测通过新一代测序技术同时检测成千上万个基因位点,能够对肿瘤易感性进行预测、对临床治疗进行针对性的指导。我们挑选了针对检测肿瘤相关的十一个基因:ros1、alk、ret、kras、tp53、erbb2、pik3ca、egfr、met、braf、map2k1。运用下一代测序技术对其进行测序分析。为节约成本,首先需用探针对目标区段进行杂交捕获,但是目前市面上常用的杂交捕获探针主要是通过合成的方法,其制备原理主要针对感兴趣的区域设计一定长度的探针序列,每个序列沿着基因位置移动一定距离,然后采用人工合成的方式大量合成上述序列。该方法最大的缺点是成本过于昂贵,由于每次合成的探针不存在小规格型号,每次都需几百次反应起,合成的成本高达几十万元。同时,随着目标区域的增大,探针合成的成本急速上升。这极大的提高了二代测序的成本,不利于二代测序向普通民众普及,以及不利于提高此项测序服务的价格市场竞争力。除成本过于高昂外,该方法还有其它缺点,如制备条件复杂,需要大量专业仪器,提高了探针制备的门槛,使得很多情况下都要从特定供应商处定制购买。从定制到获得杂交捕获探针往往需要几个月,这不仅增加了制备成本,而且耗费了很多的时间,为此,我们提出一种自制探针检测肿瘤11基因的技术。技术实现要素:本发明的目的在于提供一种自制探针检测肿瘤11基因的技术,以解决上述
背景技术:
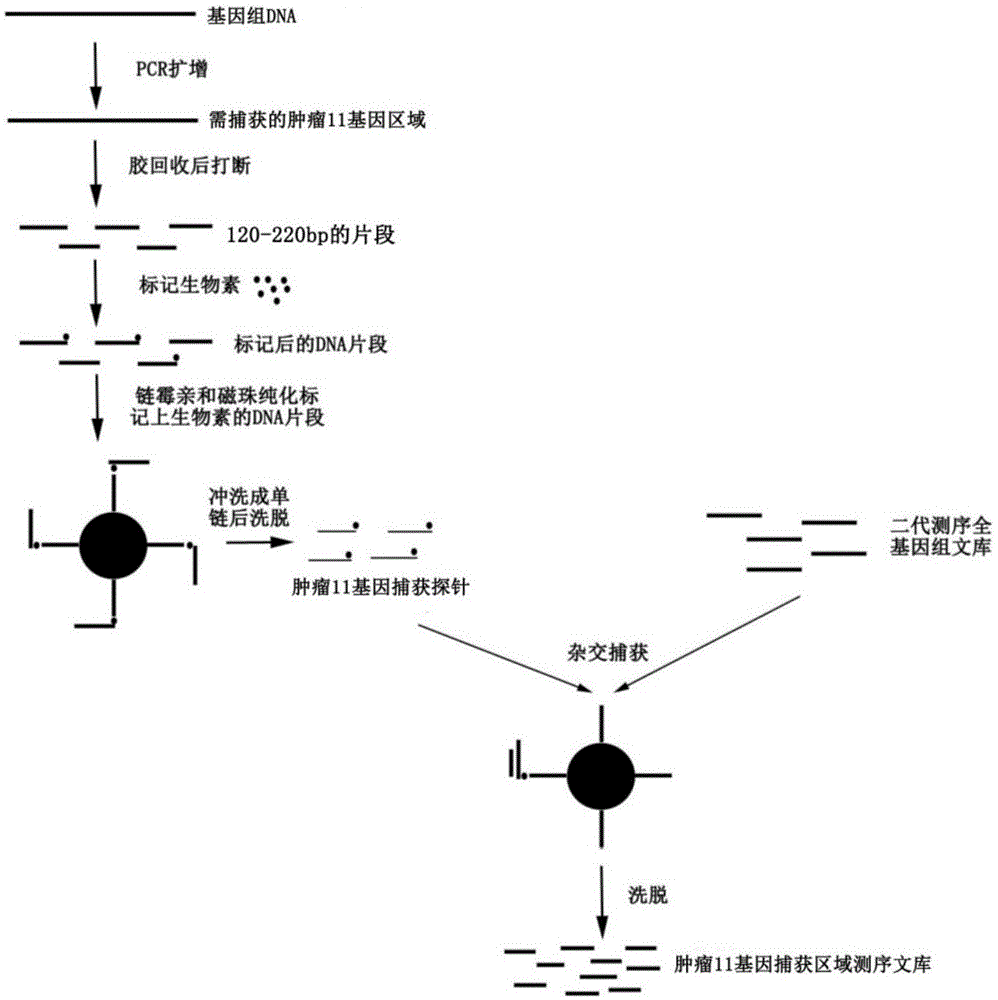
中提出的问题。为实现上述目的,本发明提供如下技术方案:一种自制探针检测肿瘤11基因的技术,包括如下步骤:扩增肿瘤11基因的目的片段,物理超声随机打断,生物素进行标记,链霉亲和素磁珠纯化,获得的捕获探针对构建好的文库进行捕获,上机测序,生物信息学分析。优选的,所述扩增肿瘤11基因时选用67对特异性引物,将肿瘤11基因扩增出来。优选的,所述物理超声随机打断是采用物理方法将其扩增好的产物超声打断为90-250bp的片段,然后切取100-200bp片段进行胶回收,以获得目的条带。优选的,所述生物素标记是对目的条带进行生物素标记,进而用链霉亲和素磁珠进行纯化,以获得生物素标记的肿瘤11基因捕获探针。优选的,所述捕获是用制备好的肿瘤11基因捕获探针对基因组文库进行捕获,并上机测序,进行生物信息学分析。优选的,所述制备好的探针用于高通量测序中肿瘤11基因进行检测,检测方法包括如下步骤:(1)提取基因组dna或血液游离cfdna;(2)将提取好的dna进行随机打断;(3)利用相关文库构建试剂盒进行文库构建;(4)对构建好的文库进行质控;(5)用制备好的肿瘤11基因探针对质控好的文库进行捕获;(6)采用二代测序仪,如iontorrent平台或illμmina平台的相关测序仪进行上机测序;(7)采用相关软件对测序结果进行生物信息学分析。与现有技术相比,本发明的有益效果是:本发明提出的探针制备方法不仅克服了以往合成探针成本昂贵时间周期长的问题,而且制备方法简单,制备时间周期短,几天即可完成,极大的节约探针合成的时间,通过制备的基因肿瘤11基因探针用于检测中,绕过传统杂交捕获探针的合成方法,降低合成过程中所需要的成本问题,这种探针不仅克服了上述合成探针成本过大的问题,而且制备简单,且制备时间很短,几天即可制备完成,极大的节约探针合成的时间,从而解决了现有技术从定制到获得杂交捕获探针往往需要几个月,这不仅增加了制备成本,而且耗费了很多时间的问题。附图说明图1为本发明工艺流程图。具体实施方式下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。请参阅图1,本发明提供一种技术方案:一种自制探针检测肿瘤11基因的技术,包括如下步骤:扩增肿瘤11基因的目的片段,物理超声随机打断,生物素进行标记,链霉亲和素磁珠纯化,获得的捕获探针对构建好的文库进行捕获,上机测序,生物信息学分析。制备好的探针用于高通量测序中肿瘤11基因进行检测,检测方法包括如下步骤:(1)提取基因组dna或血液游离cfdna;(2)将提取好的dna进行随机打断;(3)利用相关文库构建试剂盒进行文库构建;(4)对构建好的文库进行质控;(5)用制备好的肿瘤11基因探针对质控好的文库进行捕获;(6)采用二代测序仪,如iontorrent平台或illμmina平台的相关测序仪进行上机测序;(7)采用相关软件对测序结果进行生物信息学分析。实施例一:扩增肿瘤11基因的目的片段,物理超声随机打断,生物素进行标记,链霉亲和素磁珠纯化,获得的捕获探针对构建好的文库进行捕获,上机测序,生物信息学分析。实施例二:在实施例一中,再加上下述工序:扩增肿瘤11基因时选用67对特异性引物,将肿瘤11基因扩增出来。扩增肿瘤11基因的目的片段,扩增肿瘤11基因时选用67对特异性引物,将肿瘤11基因扩增出来,物理超声随机打断,生物素进行标记,链霉亲和素磁珠纯化,获得的捕获探针对构建好的文库进行捕获,上机测序,生物信息学分析。实施例三:在实施例二中,再加上下述工序:物理超声随机打断是采用物理方法将其扩增好的产物超声打断为90-250bp的片段,然后切取100-200bp片段进行胶回收,以获得目的条带。扩增肿瘤11基因的目的片段,扩增肿瘤11基因时选用67对特异性引物,将肿瘤11基因扩增出来,物理超声随机打断,物理超声随机打断是采用物理方法将其扩增好的产物超声打断为90-250bp的片段,然后切取100-200bp片段进行胶回收,以获得目的条带,生物素进行标记,链霉亲和素磁珠纯化,获得的捕获探针对构建好的文库进行捕获,上机测序,生物信息学分析。实施例四:在实施例三中,再加上下述工序:生物素标记是对目的条带进行生物素标记,进而用链霉亲和素磁珠进行纯化,以获得生物素标记的肿瘤11基因捕获探针。扩增肿瘤11基因的目的片段,扩增肿瘤11基因时选用67对特异性引物,将肿瘤11基因扩增出来,物理超声随机打断,物理超声随机打断是采用物理方法将其扩增好的产物超声打断为90-250bp的片段,然后切取100-200bp片段进行胶回收,以获得目的条带,生物素进行标记,生物素标记是对目的条带进行生物素标记,进而用链霉亲和素磁珠进行纯化,以获得生物素标记的肿瘤11基因捕获探针,链霉亲和素磁珠纯化,获得的捕获探针对构建好的文库进行捕获,上机测序,生物信息学分析。实施例五:在实施例四中,再加上下述工序:捕获是用制备好的肿瘤11基因捕获探针对基因组文库进行捕获,并上机测序,进行生物信息学分析。扩增肿瘤11基因的目的片段,扩增肿瘤11基因时选用67对特异性引物,将肿瘤11基因扩增出来,物理超声随机打断,物理超声随机打断是采用物理方法将其扩增好的产物超声打断为90-250bp的片段,然后切取100-200bp片段进行胶回收,以获得目的条带,生物素进行标记,生物素标记是对目的条带进行生物素标记,进而用链霉亲和素磁珠进行纯化,以获得生物素标记的肿瘤11基因捕获探针,链霉亲和素磁珠纯化,获得的捕获探针对构建好的文库进行捕获,捕获是用制备好的肿瘤11基因捕获探针对基因组文库进行捕获,并上机测序,进行生物信息学分析。提取人全血基因组dna:共67个片段中64个扩增,为保证模板全面性,选择二十人的血液基因组dna混合,作为pcr扩增的模板。使用诺维赞的taqdnapolymerase(p101-01)进行扩增,体系如下表(50μl):试剂体积μl10xpcrbuffer5dntps1f/r(10μmol/l)2taq0.5全血基因组dna1去离子水38.5pcr反应条件:64对引物延伸时间和tm分别为:1、2、7、8、9、10、11、12、13、15、16、17、18、19、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、44、45、46、47、51、53、55、62、63、64:延伸时间20s,tm为55℃;52、56、65:延伸时间20s,tm为58℃;3、14、20、50:延伸时间20s,tm为62℃;43、66:延伸时间30s,tm为55℃;6、21、24、54:延伸时间30s,tm为62℃;4、23、48、61:延伸时间1min10s,tm为62℃;57、58、60:延伸时间2min,tm为59℃;59:延伸时间2min,tm为62℃;49:延伸时间3min,tm为62℃。67对中3对引物(5a、5b、22)使用翊胜2×hieffpcrmastermix(2×hieffpcrmastermix)进行扩增,体系如下表(50μl):试剂体积μl模板dna1引物12引物222×hieffpcrmastermix25去离子水20pcr反应条件:22延伸时间15s,tm为62;5a、5b延伸时间30s,tm为62。pcr产物琼脂糖凝胶电泳后进行回收:产物用0.8%琼脂糖凝胶电泳分离,切下目的片段,放入1.5ml离心管中,再按照dna胶回收试剂盒(omega货号:d2500-01)说明操作:a.根据胶块大小加入约400μlbindingbμffer,55-60度水浴5-10min,期间每3min将离心管上下颠倒混匀,直至胶块完全融化;b.将a中液体转移到吸附柱中,16000g离心1min,弃置收集管中的废液;c.向吸附柱中加入300μlbindingbμffer,再次放入离心机中16000g离心1min,弃置收集管中的废液;d.向吸附柱中加入700μlwashbμffer,16000g离心1min,弃置收集管中的废液;e.将吸附柱放入离心机中16000g空离2min,彻底去除washbμffer;f.将吸附柱转移至一个新的1.5ml离心管中,向吸附柱膜中央加入15-30μlddh2o,室温放置2min后,16000g离心1min,得到胶回收产物。片段化:将回收的pcr产物按片段大小分为9个区段:124-230bp,241-260bp,280-295bp,321-349bp,351-370bp,390-421bp,488-546bp,700-900bp,1000-3046bp,其中124-230bp无需打断,其余8个区段按照摩尔比1:1:1进行加样,补水至50ul后,分别使用超声打断器将其打断为90-250的片段。超声片段化产物0.8%琼脂糖凝胶电泳,切取120-220bp片段的胶块,用omega试剂盒进行胶回收(步骤同2),再按照每个区段覆盖的总长度,计算摩尔数,根据摩尔比1:1:1加样,按照下述罗氏生物素标记试剂盒进行生物素连接。加生物素标记:取产物16μl,100℃变性5min后,迅速插入冰上;完全冷却后,加入4μlbiotin-highprime,充分混匀,37℃孵育20h,65℃加热10min使变性。使用链霉亲和磁珠纯化生物素探针:链霉亲和素磁珠清洗:(1)将链霉亲和磁珠(dynabeadsm-270streptavidinbeads)取出,并室温平衡至少30min;(2)涡旋15s使磁珠充分混匀;(3)将适量体积的磁珠置于新的1.7ml的低吸附管中,一次纯化需加100μl亲和素包被的磁珠(一管中最多加600μl磁珠);(4)将管子置于磁力架上,使磁珠与上清完全分离;(5)弃上清,尽量避免吸到磁珠;(6)每100μl起始量的磁珠加入200μl1×beadwashbμffer,涡旋震荡10s后置于磁力架上,待上清澄清,移除上清;(7)重复步骤6一次;(8)加入100μl1×beadwashbμffer,涡旋混匀;(9)转移100μl重悬的磁珠到0.2ml的低吸附管中;(10)将管置于磁力架上,待上清澄清后吸除上清(少量washbμffer残留不影响实验结果)。链霉亲和素磁珠纯化探针:将生物素标记探针产物加入到亲和素包被的磁珠中,震荡混匀后瞬离,65℃孵育1h(热盖温度设置为75℃),期间每间隔12min涡旋混匀样本3s,在涡旋震荡器正中涡旋(涡旋时略加力压紧,震荡速度调至中速,这样可避免液体四处飞散后的离心步骤),弃上清(此时生物素标记的dna片段结合在亲和素包被的磁珠上)。50μl1.25m的naoh洗涤3次,涡旋震荡,瞬离后置于磁力架上,待上清澄清后吸除上清。(去掉未标记的dna单链,此时亲和素包被的磁珠上结合的是生物素标记的dna单链)100μl去离子甲酰胺重悬磁珠(使dna变性:它可使碱基间形成h键),金属浴中95度孵育10min。使标记生物素的dna单链与亲和素分离。吸取上清转移到一个新的管中,上清即为获得的生物素标记的探针。使用dna纯化试剂盒纯化上述dna,获得生物素标记的dna探针。探针稀释及捕获上机:将探针稀释到1nm作为工作液,对构建好的文库进行捕获,并上机测序。生物信息学分析:下机数据质控:数据下机后,得到原始下机数据,称之为rawdata。首先用软件fastqc对rawdata进行检测,主要统计和查看数据量、adapter、碱基分布、gc含量等信息;之后用软件trimmomatic-0.36对rawdata进行去除adapter、去除低质量数据、去除n含量较高的数据等,并得到cleandata;然后,用软件fastqc对cleandata进行检测,主要统计和查看数据量、adapter、碱基分布、gc含量等信息;最后,用内部程序统计和比较质控前后数据信息,主要包括数据量、reads数、reads长度、q20、q30、gc含量等,对于质控合格的数据,进行下游分析。质控合格数据比对:对质控合格数据(cleandata),用软件bwa,以人类基因组hg19为参考,进行比对,并用内部程序进行比对信息统计,主要包括比对率、重复率、插入片段大小、比对质量值、覆盖度、平均测序深度等信息。探针捕获率统计和分析:根据探针目标区域,用bedtools、samtools以及内部程序,对目标区域进行捕获情况统计和分析,主要包括上靶率、目标区域覆盖度、目标区域平均测序深度等信息。引物信息(seqidno.1-67)编号基因fr长度1alk-1atcccgaagtctccaatcttggaaatatagggaagggaaggaac1962alk-2aggctgcccactcttgctctttgtatcctgttcctcccag2913alk-3ggacaacacgatttccctggtgtatgaaggccaggtg3404alk-4ttgccagcaaagcagtagagggacaggataataggagc13655aalk-5acgagcacgtagtaaccatgctgggacctgtcttccagtgt8705balk-5bgggcagaggtcaccacagacgcttcccaggttcaaacaat9066alk-6ggcaacaacagtgaaactccaagccacaaggtcatctgc5367braf-1gactctaagaggaaagatgaagtactagtaactcagcagcatctcag3318braf-2gagtgatgattgggagattccgtcacaatgtcaccacattacatac1249egfr-1caggattccaaaccatggcaatgagcagtccactgc24110egfr-2ttcaactgggcgtcctagggtggaattgagtgacaagc37011egfr-3ggaccctgctttacgatgtgcttccaacgaaaccac35112egfr-4acgaagccacgtgcaaggaacagggtcgcctcctccaa25913egfr-5gcctgaacataacatccttggaaggacccattagaaccaactc22514egfr-6gctttccccactcacacacacccagaccagggtgttgttttc20815egfr-7ggcgtacatttgtccttccgtttcccaaacactcagtgaaac41616egfr-8aatatcagccttaggtgcggatgtggagatgagcagggtctag34917egfr-9tcccactgcatctgtcacttctcccttccctgattacctttg39918egfr-10aatggtcagcagcgggttacgtccctggtgtcaggaaaatg39719erbb2-1cacggtaatgctgctcatggagggcttgctgcacttctc18120erbb2-2tttcggaacccgcaccatgcagtgaggaggaaggga41821erbb2-3cccttccgacttccctttccatcagaactgccgaccac53322erbb2-4acgctcttctcactcatatcctccgcttgtaatcccagctactca39023erbb2-5gtccaggctggtactttgagctccctcccttcacatgctg91424erbb2-6tggctgaagaccccagagaggtgacagttgagggaacat69825kras-1agtgttacttacctgtcttgtcttgtgttactaatgactgtgctat21626kras-2ctcatgtactggtccctcattgaaggtgcactgtaataatccagac15027kras-3gaaacccaaggtacatttcagggtactggtggagtatttga34928map2k1-1tacttctttgggttgacttctctggaatcagtcttccttctaccctggtc35729map2k1-2cttaacctgtttctcctccccctcccagaccaaagattag34330met-1taatttggcagttggagaggtgaaagcgacagaataaaccc29531met-2gcactagcaaagtccgagattgttgacgctgccacag32832met-3ttcctacatggaaatgcctcccctattaaagcagtgctca33533met-4gttaccgtgaagatcccattgcaaactacactcagaacctga23034met-5ataaagttgctatggatgttgcctttccagtacattttcattgccc28035met-6gtggctgaaaaagagaaagccacaacccactgaggtatatg42136met-7cgacaagtgcagtatcctctgagctgagtggaaatacttacctc21637met-8ccaagttctttcttttgcacaggcaaggggaaagtgtaaatcaacg19838met-9gtcaatagaggccagatgaaatacaagaggagaaactcagagataacc34239met-10acttgaacagtaacctactcgaggtagatgctgtaattgctg32140pik3ca-1gaaagggacaacagttaagccccccaagaatcctagtaga36641pik3ca-2ccatctgaaaacatactacaggcccccttaatctcttacagt36942pik3ca-3cacataagggttctcctccaatctgaacaaaaattccgtgg14943pik3ca-4tgctcttcaatcactgacatgaaaaaggaaagaatgggct48844pik3ca-5taatgtgccaactaccaatgatcatctgtgaatccagagg40745pik3ca-6acacaaactagagtcacacaactcatggtggttttgtttc36446pik3ca-7cttgtccatcgtctttcaccgcaccctgttttcttttctc19647pik3ca-8caattcctatgcaatcggtccaggagatgtgttacaaggc35848ret-1tgtgccgaacttcactacatggacacctgcctgttggggag82549ret-2gctatggcacctgcaactgcttccaaattcgccttctcctagagt304650ret-3cttcaaagatgtgtgtggccaacacccacacttacacat24551tp53-1ctcctctgttgctgcagatccaggaaggggctgaggtcact14952tp53-2aagggtggttgggagtagatggaaagaggcaaggaaaggtga32453tp53-3gtgttatctcctaggttggctggagtcttccagtgtgatg12354tp53-4tgggttgcaggaggtgcttacgccactgacaaccacccttaac54655tp53-5tgctcttttcacccatctaccattgaagtctcatggaagc34256tp53-6ttggaagtgtctcatgctggtccaatggatccactcacag16257ros1-1gagtagtagctgcaaataatctagggcccttgcaagtagttttatc222158ros1-2caagggcaccaacttttaggagtggtctgccctagttgta214159ros1-3tacaactagggcagaccacttgtgtcaaggagttcgaaga212360ros1-4ggggttgatcttctcgtggtcagctttctcccactgtattg215561ros1-5gtggacacccttgtcttgtacctcaaatcgtcaccctaacatc105362ros1-6agtttgaagtcaggtagcatgatgccccatggacaggaataatgagtatc21963ros1-7tagttgccattctgactcgcgaaaaagacagacaaccccatc17664ros1-8tgacttccagcttcatccatgcatacccaaaggagtataaatcact21965ros1-9ggagggaaaatgctccaaaactatacctatgtaacaaccctgcacg24766ros1-10tggtggtttataagacgggaggttctagatctttgttccttcc509本发明提出的探针制备方法不仅克服了以往合成探针成本昂贵时间周期长的问题,而且制备方法简单,制备时间周期短,几天即可完成,极大的节约探针合成的时间,通过制备的基因肿瘤11基因探针用于检测中,绕过传统杂交捕获探针的合成方法,降低合成过程中所需要的成本问题,这种探针不仅克服了上述合成探针成本过大的问题,而且制备简单,且制备时间很短,几天即可制备完成,极大的节约探针合成的时间,从而解决了现有技术从定制到获得杂交捕获探针往往需要几个月,这不仅增加了制备成本,而且耗费了很多时间的问题。尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1