一种体外发酵糖醇益生功能评价装置及方法与流程
本发明涉及一种糖醇益生功能评价装置及方法,具体涉及一种体外发酵糖醇益生功能评价装置及方法。
背景技术:
糖醇是通过碳水化合物催化氢化而形成的一类特殊的多元醇。它们自然存在于某些水果、蔬菜和蘑菇中,然而,它们也经常作为无糖甜味剂用于口香糖、糖果和饮料等产品中,糖醇是一种很有吸引力的蔗糖替代品,因为它们每克提供的卡路里更少,不会导致蛀牙,也不会导致血糖升高。美国fda目前已经批准使用8种不同的糖醇,包括赤藓糖醇,氢化淀粉水解物,益寿糖,乳糖醇,麦芽糖醇,甘露醇,山梨醇和木糖醇。糖醇不易被小肠吸收,其中木糖醇有将近一半能够逃避吸收,且粪便中的残余量少,说明能够被肠道菌群利用,具有类似于代表性益生元寡糖和膳食纤维同样的益生消化特性。
gibson和roberfroid在20世纪90年代提出的开创性概念强调了饮食在调节肠道菌群及其与人类健康的关系中的重要性。益生元是一类可被宿主菌选择性利用,并能够促进宿主健康的物质。益生元的开发与应用对人类健康具有重要意义。近年来,对益生元研究的评价标准是:1)能够润肠通便;2)促进肠道中益生菌双歧杆菌、乳酸菌的增殖,抑制有害菌增殖;3)增加有益菌或减少有害菌黏附;4)降低ph及增加利于宿主的微生物活性代谢物质短链脂肪酸(scfa)的生成。
益生元可通过动物模型、临床试验和体外发酵模型三种方法评价。动物模型个体差异大,且一些参数,如微生物群落组成,可能并不能完全代表人类。临床试验是验证功能特性的黄金标准,但是大多数关于肠道菌群的研究,都是基于人体粪便样本的分析,不能反映肠道中肠道菌群的真实情况,且存在伦理问题。现有模拟肠道体外发酵模型主要由fehlbaum等人的单相和三相连续发酵模型,已广泛用于研究饮食干预对微生物之间的相互作用,及代谢的影响。现有单相简便快速,用试管和单个反应器来实现,但是只用作单纯地考究微生物组成和发酵液中代谢物的变化,并不适用于益生效应的考察。与三相连续发酵有关的专利“一种人肠道菌群连续培养的系统及方法”(公开号:cn101368154)、“一种肠道菌群离体培养装置”(公开号:cn101113408)、“一种全自动肠道菌群体外模拟模型装置”(公开号:cn102399692a),都旨在介绍通过改进工艺,精准控制发酵参数来优化能模肠道的、连续的肠道菌群离体培养装置,没有应用到益生元的评估。poeker的报导中阐述polyferms三相连续模型可应用于评估不同膳食纤维的潜在益生功能,该模型相对来说比较成熟,有温度、ph、无氧环境、体积等自动控制系统,比较接近人肠道内腔环境。但是设备大且要求高,前期稳定需要很长时间才能达到肠道菌群环境,整个发酵周期在7~15天,耗时长,其稳定性、重复性和广泛适用性需要进一步考究。
技术实现要素:
本发明的目的是提供一种体外发酵糖醇益生功能评价装置及方法,以解决现有技术的不足。
本发明采用以下技术方案:
一种体外发酵糖醇益生功能评价装置,包括发酵装置和集气装置,发酵装置下部设有取样口,发酵装置和集气装置通过导管连通;发酵装置采用批式深层发酵,发酵装置通过导管向集气装置输送发酵气体,同时预先填充满氮气的集气装置向发酵装置输送氮气以维持厌氧环境。
进一步地,发酵装置为具支试管,下部分支为取样口,具支试管配套有具支帽和塞子;集气装置为锥形瓶,锥形瓶配套有塞子。
利用上述装置进行体外发酵糖醇益生功能评价方法,包括如下步骤:
步骤一、装置灭菌:将体外发酵糖醇益生功能评价装置所用的具支试管、具支帽、具支试管配套塞子、导管、1号锥形瓶、1号锥形瓶配套塞子灭菌;
步骤二、培养基配置:量取蒸馏水于2号锥形瓶中,按照如下培养基配方先称量相应比例组分a于2号锥形瓶中溶解,塞上塞子,灭菌;在无菌操作台中加入相应比例的组分b溶解混匀;空白组和待测糖醇组的各具支试管中各量取30ml培养基;
1l培养基配方:组分a:蛋白胨2.00g,酵母提取物2.00g,氯化钠0.10g,磷酸氢二钾0.04g,磷酸二氢钾0.04g,七水硫酸镁0.01g,六水氯化钙0.01g,碳酸氢钠2.00g,吐温802.00ml;组分b:血红素0.02g,维生素k110.00ml,三号胆盐0.50g,半胱氨酸盐酸盐0.50g;
步骤三、粘膜凝胶小球制备:称取1.1g琼脂或者0.5g结冷胶+0.6g瓜尔豆胶溶解于100ml蒸馏水中,灭菌,在无菌环境下加入1wt%的cacl2,转移到球形磨具中得到直径为5mm的凝胶小球;将凝胶小球浸泡于60±5℃粘液素琼脂溶液制成直径为7±0.2mm的粘膜凝胶小球;
步骤四、粪便预处理:称取新鲜粪便用ph6.8的磷酸盐缓冲液溶解,厌氧环境下纱布过滤掉固体颗粒,所得滤液即为菌液;
步骤五、接种培养:将步骤四得到的菌液以10%的接种量分别接种到步骤二中装有培养基的各支具支试管中,分别加入3~5个步骤三制备的粘膜凝胶小球,将具支试管和对应1号锥形瓶分别填充氮气后,分别塞上塞子,再用导管将两者连接起来,具支帽盖上,各个接口用封口膜密封后,置于37℃培养箱中培养;
步骤六、糖醇发酵:培养24h后,在待测糖醇组的具支试管中分别加入终浓度为9g/l的待测糖醇;再将具支试管和对应1号锥形瓶分别填充氮气后,分别塞上塞子,再用导管连接起来,各个接口用封口膜密封后,置于37℃培养箱中继续培养3天;
步骤七、益生效应评估:
(1)每天收集发酵液及1个粘膜凝胶小球,测定发酵液和粘膜中肠道微生物的组成及分布;
(2)检测发酵液中短链脂肪酸浓度,短链脂肪酸包括乙酸盐、丙酸盐、丁酸盐、戊酸盐;
(3)测定1号锥形瓶中发酵气体成分分布。
进一步地,步骤三粘液素琼脂溶液由如下方法制备得到:称取0.1g琼脂于100ml蒸馏水中加热溶解,待琼脂溶液澄清透明后,称取0.5g粘液素趁热溶解,调节ph为6.8,冷却至60±5℃备用。
进一步地,步骤四粪便预处理具体操作如下:配制0.01mol/l的nah2po4和0.01mol/l的na2hpo4,两者按一定比例混合,配制成ph6.8的磷酸盐缓冲溶液,称取10g新鲜粪便用80ml磷酸盐缓冲液溶解,厌氧无菌环境下纱布过滤掉固体颗粒,所得滤液即为菌液。
进一步地,步骤七用细菌dna试剂盒提取基因组后通过16srrna扩增子高通量测序,测定发酵液和粘膜中肠道微生物的组成及分布。
进一步地,步骤七发酵液中短链脂肪酸浓度检测具体如下:
取1ml发酵液,10000rpm离心10min后取上清,0.22微米滤膜过滤,取0.5ml滤液加入0.05ml50wt%硫酸,0.5ml乙醚,反复振荡30次后10000r/min离心5min,置于4℃恒温箱30min,取上层清液于带有微量管进样瓶,采用ffap弹性石英毛细管色谱柱:30m×0.25mm×0.25μm,色谱柱温度程序:100℃,1min,150℃,5min;载气:高纯氮气,纯度≧99.999%;载气流速:2ml/min;进样口温度:270℃;进样方式:无分流进样;进样量:2.0μl;检测器温:280℃。
进一步地,步骤七用电子鼻或火焰原子吸收法测定发酵气体中成分分布。
本发明的有益效果:
1、本发明体外发酵糖醇益生功能评价装置,包括发酵装置和集气装置,发酵装置下部设有取样口,发酵装置和集气装置通过导管连通,结构简单、操作快捷,体系稳定,重复性好,全面,应用性强,可以应用于快速评价糖醇的益生效果,以及提高试验结果准确性。该装置体外模拟肠道发酵与真实肠道菌群种类相似性达到89.28±2.57%,肠道菌群丰度相似达85.76±4.57%,重复性高达95.56±1.64%。
2、本发明装置发酵采用批式深层发酵,无需厌氧箱和厌氧袋、或连续通氮气维持厌氧环境,只用在厌氧发酵前用氮气排尽液上空空气即可,肠道厌氧菌聚集在发酵装置底部,集气装置中的氮气和发酵装置的液面自动维持着发酵装置底部的无氧环境。既解决批式发酵无气体分析,连续发酵设备要求高,重复性不好,又解决了动物和人体个体差异大,存在伦理问题的缺点。
3、本发明装置设有发酵产气收集装置即集气装置,益生元具有能够短时间内增加肠道产气的作用,气体分析能够全面评估糖醇的益生功能。
4、本发明体外发酵糖醇益生功能评价方法,可快速简便评价糖醇益生功能,添有粘膜凝胶小球评价糖醇对有益菌和有害菌对粘膜的竞争黏附作用,气体分析能够全面评估糖醇的益生功能。
5、本发明装置和方法可应用于新型益生元的开发,快速评价新型益生元的益生效应;本发明装置可替代三相连续模型,结合动物模型和人体试验综合评估益生效应。
附图说明
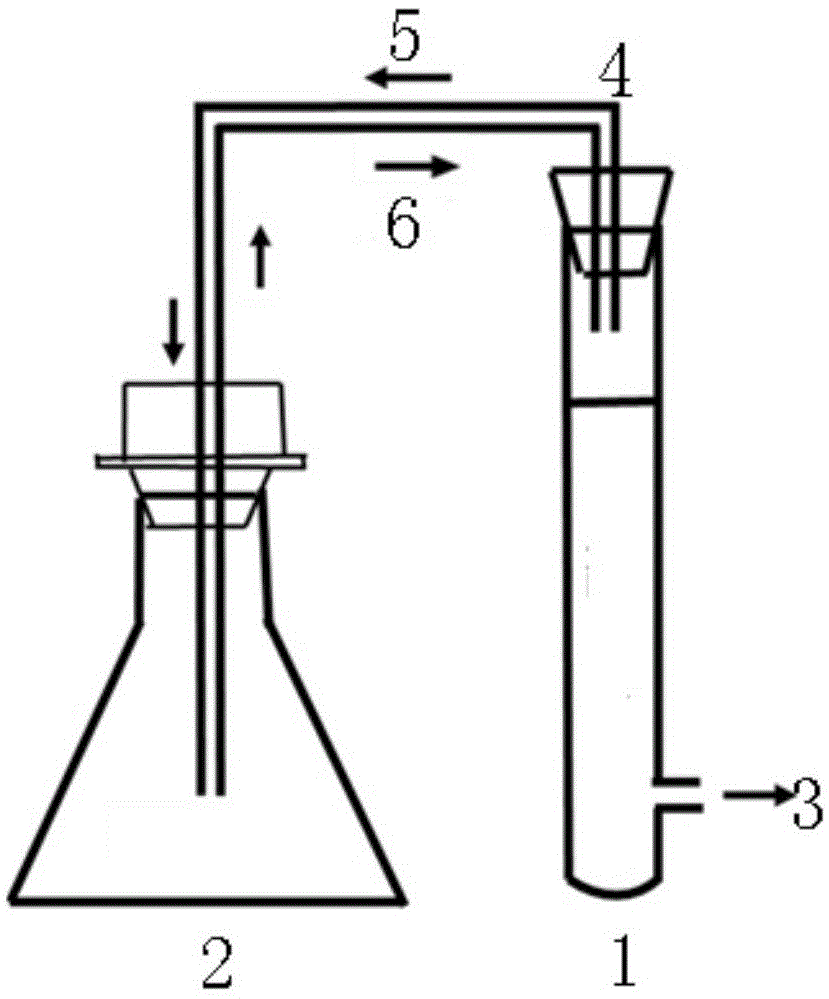
图1为本发明装置结构示意图。
图2为实施例1添加木糖醇后的发酵液中主要益生菌、有害菌变化。
图3为实施例1添加木糖醇后的粘膜凝胶小球中主要益生菌、有害菌变化。
图4为实施例1添加山梨醇后的发酵液中主要益生菌、有害菌变化。
图5为实施例1添加山梨醇后的粘膜凝胶小球中主要益生菌、有害菌变化。
图6为实施例1发酵液中短链脂肪酸变化。
具体实施方式
为了使本发明所要解决的技术问题、技术方案及有益效果更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
一种体外发酵糖醇益生功能评价装置,如图1所示,包括发酵装置1和集气装置2,发酵装置1为具支试管,下部分支为取样口3,具支试管配套有具支帽和塞子;集气装置2为锥形瓶,锥形瓶配套有塞子;发酵装置1和集气装置2通过导管4连通。发酵装置1采用批式深层发酵,发酵装置1通过导管4向集气装置2输送发酵气体5,同时预先填充满氮气6的集气装置2向发酵装置1输送氮气6以维持厌氧环境。
如表1所示,该装置体外模拟肠道发酵与真实肠道菌群种类相似性达到85.28±2.57%,肠道菌群丰度相似达88.76±4.57%,重复性高达95.56±1.64%。
表1
*具支试管1、具支试管试管2、具支试管试管3为下述实施例1对照组发酵培养后所测。
利用上述装置进行体外发酵糖醇益生功能评价方法,包括如下步骤:
步骤一、装置灭菌:将体外发酵糖醇益生功能评价装置所用的具支试管、具支帽、具支试管配套塞子、导管、1号锥形瓶、1号锥形瓶配套塞子灭菌。
步骤二、培养基配置:量取蒸馏水于2号锥形瓶中,按照如下培养基配方先称量相应比例组分a于2号锥形瓶中溶解,塞上塞子,灭菌;在无菌操作台中加入相应比例的组分b溶解混匀;空白组和待测糖醇组的各具支试管中各量取30ml培养基。
1l培养基配方:组分a:蛋白胨2.00g,酵母提取物2.00g,氯化钠0.10g,磷酸氢二钾0.04g,磷酸二氢钾0.04g,七水硫酸镁0.01g,六水氯化钙0.01g,碳酸氢钠2.00g,吐温802.00ml;组分b:血红素0.02g,维生素k110.00ml,三号胆盐0.50g,半胱氨酸盐酸盐0.50g。
步骤三、粘膜凝胶小球制备:称取1.1g琼脂或者0.5g结冷胶+0.6g瓜尔豆胶溶解于100ml蒸馏水中,灭菌,在无菌环境下加入1wt%的cacl2,转移到球形磨具中得到直径为5mm的凝胶小球;将凝胶小球浸泡于60±5℃粘液素琼脂溶液制成直径为7±0.2mm的粘膜凝胶小球;其中,粘液素琼脂溶液由如下方法制备得到:称取0.1g琼脂于100ml蒸馏水中加热溶解,待琼脂溶液澄清透明后,称取0.5g粘液素趁热溶解,调节ph为6.8,冷却至60±5℃备用。
步骤四、粪便预处理:配制0.01mol/l的nah2po4和0.01mol/l的na2hpo4,两者按一定比例混合,配制成ph6.8的磷酸盐缓冲溶液,称取10g新鲜粪便用80ml磷酸盐缓冲液溶解,厌氧无菌环境下纱布过滤掉固体颗粒,所得滤液即为菌液。
步骤五、接种培养:将步骤四得到的菌液以10%的接种量分别接种到步骤二中装有培养基的各支具支试管中,分别加入3~5个步骤三制备的粘膜凝胶小球,将具支试管和对应1号锥形瓶分别填充氮气后,分别塞上塞子,再用导管将两者连接起来,具支帽盖上,各个接口用封口膜密封后,置于37℃培养箱中培养。
步骤六、糖醇发酵:培养24h后,在待测糖醇组的具支试管中分别加入终浓度为9g/l的待测糖醇;再将具支试管和对应1号锥形瓶分别填充氮气后,分别塞上塞子,再用用导管连接起来,各个接口用封口膜密封后,置于37℃培养箱中继续培养3天。
步骤七、益生效应评估:
(1)每天收集发酵液及1个粘膜凝胶小球,用细菌dna试剂盒提取基因组后通过16srrna扩增子高通量测序,测定发酵液和粘膜中肠道微生物的组成及分布。
(2)检测发酵液中短链脂肪酸浓度,短链脂肪酸包括乙酸盐、丙酸盐、丁酸盐、戊酸盐:取1ml发酵液,10000rpm离心10min后取上清,0.22微米滤膜过滤,取0.5ml滤液加入0.05ml50wt%硫酸,0.5ml乙醚,反复振荡30次后10000r/min离心5min,置于4℃恒温箱30min,取上层清液于带有微量管进样瓶,采用ffap弹性石英毛细管色谱柱:30m×0.25mm×0.25μm,色谱柱温度程序:100℃,1min,150℃,5min;载气:高纯氮气,纯度≧99.999%;载气流速:2ml/min;进样口温度:270℃;进样方式:无分流进样;进样量:2.0μl;检测器温:280℃。
(3)用电子鼻或火焰原子吸收法测定1号锥形瓶中发酵气体成分分布。
实施例1
1、装置灭菌:将体外发酵糖醇益生功能评价装置所用的20*200mm具支试管、具支帽、具支试管配套塞子、导管、250ml锥形瓶、250ml锥形瓶配套塞子清洗干净晾干后,用双层报纸包好,放进高压灭菌锅121℃灭菌15min即可。
2、培养基配置:量取300ml蒸馏水于1l锥形瓶中,按照如下培养基配方先称量相应比例组分a于2号锥形瓶中溶解,塞上塞子,121℃灭菌15min;在无菌操作台中加入相应比例的组分b溶解混匀;各量取30ml培养基到9支具支试管中,分别编号1~9,编号1~3为对照组,编号4~6为木糖醇组,编号7~9为山梨醇组。
1l培养基配方:组分a:蛋白胨2.00g,酵母提取物2.00g,氯化钠0.10g,磷酸氢二钾0.04g,磷酸二氢钾0.04g,七水硫酸镁0.01g,六水氯化钙0.01g,碳酸氢钠2.00g,吐温802.00ml;组分b:血红素0.02g,维生素k110.00ml,三号胆盐0.50g,半胱氨酸盐酸盐0.50g。
3、粘膜凝胶小球制备:称取0.5g结冷胶和0.6g瓜尔豆胶溶解于100ml蒸馏水中,121℃高压灭菌15min,在无菌环境下加入1wt%的cacl2,转移到球形磨具中得到直径为5mm的凝胶小球;将凝胶小球浸泡于60℃左右粘液素琼脂溶液制成直径约为7mm的粘膜凝胶小球;其中,粘液素琼脂溶液由如下方法制备得到:称取0.1g琼脂于100ml蒸馏水中加热溶解,待琼脂溶液澄清透明后,称取0.5g粘液素(粘液素ii,cas:84082-64-4,sigma)趁热溶解,调节ph为6.8,冷却至60±5℃备用。
4、粪便预处理:配制0.01mol/l的nah2po4和0.01mol/l的na2hpo4,两者按一定比例混合,配制成ph6.8的磷酸盐缓冲溶液,称取10g新鲜粪便用80ml磷酸盐缓冲液溶解,厌氧无菌环境下纱布过滤掉固体颗粒,所得滤液即为菌液。
5、接种培养:将步骤四得到的菌液以10%的接种量分别接种到步骤二中装有培养基的各支具支试管中,分别加入5个步骤三制备的粘膜凝胶小球,将具支试管和对应锥形瓶分别填充氮气后,分别塞上塞子,再用导管将两者连接起来,具支帽盖上,各个接口用封口膜密封后,置于37℃培养箱中培养。
6、糖醇发酵:培养24h后,在具支试管4、5、6中分别加入终浓度为9g/l的木糖醇,具支试管7、8、9中分别加入终浓度为9g/l的山梨醇;再将具支试管和对应锥形瓶分别填充氮气后,分别塞上塞子,再用用导管连接起来,各个接口用封口膜密封后,置于37℃培养箱中继续培养3天。
7、益生效应评估:
(1)每天收集发酵液及1个粘膜凝胶小球,用tiangen细菌dna试剂盒提取基因组后通过16srrna扩增子高通量测序,测定发酵液和粘膜中肠道微生物(尤其益生菌和有害菌)的组成及分布。结果如图2-5所示,添加木糖醇和山梨醇后,发酵液双歧杆菌属和乳杆菌属上升,埃稀释大肠杆菌减少,在粘膜凝胶小球中也有相同的变化趋势,但是小球中双歧杆菌属和乳杆菌属比发酵液中的多,埃稀释大肠杆菌比发酵液中的少,表现着糖醇的干预对有益菌增殖黏附起到促进作用,而对埃稀释大肠杆菌的增殖黏附具有抑制作用。
(2)检测发酵液中短链脂肪酸浓度,短链脂肪酸包括乙酸盐(acetate)、丙酸盐(propionate)、丁酸盐(butyrate)、戊酸盐(pentanoate):取1ml发酵液,10000rpm离心10min后取上清,0.22微米滤膜过滤,取0.5ml滤液加入0.05ml50wt%硫酸,0.5ml乙醚,反复振荡30次后10000r/min离心5min,置于4℃恒温箱30min,取上层清液于带有微量管进样瓶,采用ffap弹性石英毛细管色谱柱:30m×0.25mm×0.25μm,色谱柱温度程序:100℃,1min,150℃,5min;载气:高纯氮气,纯度≧99.999%;载气流速:2ml/min;进样口温度:270℃;进样方式:无分流进样;进样量:2.0μl;检测器温:280℃。结果如图6所示,木糖醇和山梨醇干预后,发酵液中短链脂肪酸浓度总体升高,尤其是丁酸盐浓度,丁酸盐是小肠上皮细胞的能量来源,具有增强免疫作用等诸多优良性质,糖醇促进微生物产丁酸盐具有一定的益生作用。
(3)锥形瓶中250ml气体,用电子鼻测定发酵气体中成分分布。结果如表2和表3所示,糖醇添加后明显可以促进肠道产气。
表2电子鼻传感器性能描述
表3发酵气体各组分测定电子鼻传感器响应值
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!