抗菌肽、抗菌肽制备方法、抗菌组合物、抗菌方法和应用与流程
本发明属于多肽领域,特别涉及一种抗菌肽、抗菌肽的制备方法、抗菌组合物、抗菌方法以及抗菌肽的应用。
背景技术:
抗菌肽又称抗微生物肽或宿主防御肽,是生物体经诱导产生的具有广谱抗菌活性和免疫调节活性的一类小分子多肽,属于机体非特异性防御系统的固有组成部分,几乎存在于所有生命形式(昆虫、两栖动物、鸟类、鱼类、哺乳动物、植物及人体)中,由12-60个氨基酸组成,相对分子量一般在4kd左右。研究发现,抗菌肽具有快速杀菌和广谱抗菌活性,包括革兰氏阳性细菌、革兰氏阴性细菌、多重耐药细菌、真菌、寄生虫、包膜病毒和肿瘤细胞,并且通过趋化树突状细胞、单核细胞和记忆t细胞,在先天性免疫和获得性免疫反应之间起到桥梁作用,并通过启动获得性免疫系统提高机体抗微生物感染的能力。
抗菌肽的生产方式有三种:1.天然提取法。由于天然提取的资源有限及成本昂贵,目前此方式主要用于科学研究;2.基因工程法。通过微生物、细胞表达,提高产量,可实现产业化,是规模化生产的最佳途径,但是,通过此方法只能获得天然的l型抗菌肽,它对蛋白水解作用十分敏感,因此体内的稳定性很差。3.化学合成法。此方法可在生产抗菌肽过程中融入人工合成氨基酸。
β-casein-197是一种从人类乳汁中分离的含有17个氨基酸的l型多肽,具有一定的抗菌活性,是一种潜在的治疗性抗菌肽,但是其抗微生物最小抑制浓度(mic)较高,即抗菌活性和稳定性较低,不具备成为临床治疗药物的条件。
技术实现要素:
针对现有技术中的不足之处,本发明的目的之一是提供一种全反d型抗菌肽。本案基于β-casein-197序列,采用d型改造技术全化学合成了全反d型β-casein-197,即d-r-β-casein-197;全反d型多肽不仅用d型氨基酸替代原来多肽中的l型氨基酸,而且将多肽序列翻转;d-r-β-casein-197不仅对蛋白水解作用具有较好的耐受性,而且其抗菌活性也大大增强,可成为一类潜在的广谱抗菌药物。
本发明的另一目的是提供这种抗菌肽的制备方法。
本发明的又一目的是提供含有这种抗菌肽的抗菌组合物。
本发明的又一目的是提供使用这种抗菌肽的抗菌方法。
本发明的又一目的是提供这种抗菌肽在药物或医用耗材中的应用。
为实现上述目的,本发明的技术方案如下:
一种抗菌肽,其氨基酸序列为valprotyrileglnhisthrproasnleuleuleugluglnasnleuleu;
其中,所述氨基酸序列中至少存在一个d型氨基酸。
优选的是,所述的抗菌肽,其中,所述氨基酸序列中的氨基酸均为d型氨基酸。
一种如上任一所述抗菌肽的制备方法,包括步骤:
1)取boc-亮氨酸-pam树脂,用tfa脱保护,将另一boc保护的亮氨酸溶解于含0.5m的hbtu的dmf和diea中,室温反应15min,dmf洗涤;
2)按上步操作依次与天冬酰胺、谷氨酰胺、谷氨酸、亮氨酸、亮氨酸、亮氨酸、天冬酰胺、脯氨酸、苏氨酸、组氨酸、谷氨酰胺、异亮氨酸、酪氨酸、脯氨酸和缬氨酸反应;
3)加入含10%β-巯基乙醇及5%diea的dmf溶液洗涤两次,再用tfa脱boc保护后,以氟化氢为切割剂,加入与pam树脂等摩尔量的保护剂对甲苯酚,于0℃反应1h;
4)除去氟化氢后以冰乙醚沉淀,采用洗涤液洗涤沉淀后得到多肽粗品溶液,经纯化冻干后获得抗菌肽。
优选的是,所述的制备方法,其中,所述洗涤液成分为:50wt%乙睛、49.9wt%水和0.1wt%的tfa。
一种抗菌组合物,其至少包括有如上任一所述的抗菌肽。
一种抗菌方法,其使用如上任一所述的抗菌肽。
一种如上任一所述抗菌肽在药物中的应用。
一种如上任一所述抗菌肽在医用耗材中的应用。
本发明的有益效果是:本案采用化学合成手段,可高效获得大量高纯度的全反d型抗菌肽,可保证抗菌肽序列的完整性和纯度,并具有较高热稳定性及抗蛋白酶降解能力,本案的全反d型抗菌肽与l型抗菌肽相比,其广谱抗菌活性大大增强。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
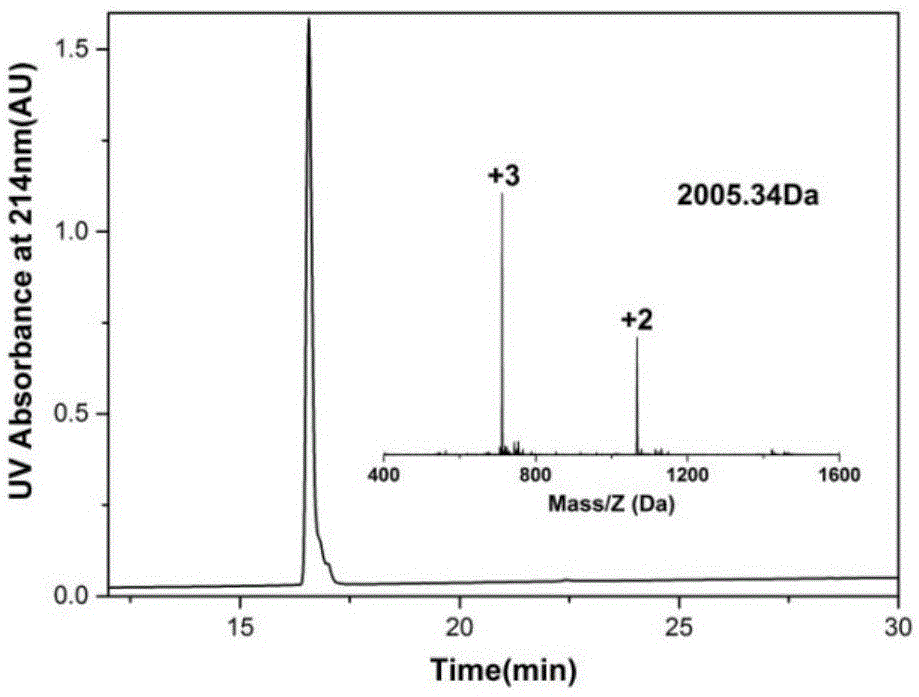
图1为β-casein-197的纯度及分子量表征图。
图2为d-r-β-casein-197的纯度及分子量表征图。
图3为β-casein-197和d-r-β-casein-197的二级结构鉴定图。
图4为β-casein-197的热稳定性测定图。
图5为d-r-β-casein-197的热稳定性测定图。
图6为不同浓度多肽处理后的细胞存活率对比图。
图7为β-casein-197与lps的结合能力测定图。
图8为d-r-β-casein-197与lps的结合能力测定图。
具体实施方式
下面将结合附图对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
此外,下面所描述的本发明不同实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互结合。
实施例1
多肽序列:
β-casein-197:leuleuasnglngluleuleuleuasnprothrhisglniletyrproval;
d-β-casein-197:leuleuasnglngluleuleuleuasnprothrhisglniletyrproval;其中的各个氨基酸均为d型氨基酸;
d-r-β-casein-197:valprotyrileglnhisthrproasnleuleuleugluglnasnleuleu;其中的各个氨基酸均为d型氨基酸。
d-β-casein-197和d-r-β-casein-197的合成方法相同,以d-r-β-casein-197为例,d-r-β-casein-197的合成方法为:
1)称取0.2gboc(叔丁氧羰基)-亮氨酸(leu)-pam树脂(聚丙烯酰胺树脂),用tfa(三氟乙酸)脱保护,将另一boc保护的0.2mm亮氨酸溶解于4ml含0.5m的hbtu(o-(苯并三唑-1-基)-n,n,n',n'-四甲基脲六氟磷酸酯)的dmf(n,n-二甲基甲酰胺)和1mln,n-二异丙基乙胺(diea)中,中,室温反应15min,dmf洗涤;
2)按上步操作依次与0.2mm的天冬酰胺(asn)、谷氨酰胺(gln)、谷氨酸(glu)、亮氨酸(leu)、亮氨酸(leu)、亮氨酸(leu)、天冬酰胺(asn)、脯氨酸(pro)、苏氨酸(thr)、组氨酸(his)、谷氨酰胺(gln)、异亮氨酸(ile)、酪氨酸(tyr)、脯氨酸(pro)和缬氨酸(val)反应;
3)加入10ml含10%β-巯基乙醇及5%diea的dmf溶液洗涤,共两次,脱去组氨酸dnp保护基团,再用tfa脱boc保护后,以氟化氢为切割剂,加入与pam树脂等摩尔量的保护剂对甲苯酚(p-cresol),于0℃反应1h;
4)除去氟化氢后以冰乙醚沉淀,采用洗涤液洗涤沉淀后得到多肽粗品溶液,经纯化冻干后获得抗菌肽。
其中,洗涤液的成分优选但不限于是:50wt%乙睛、49.9wt%水和0.1wt%的tfa。
实施例2
一种抗菌组合物,其至少包括有实施例1中的抗菌肽d-r-β-casein-197。抗菌组合物中可包含有其他与d-r-β-casein-197没有冲突的任何成分。
实施例3
一种抗菌方法,其使用实施例1中的抗菌肽d-r-β-casein-197。
实施例4
一种将实施例1中的抗菌肽d-r-β-casein-197在药物中的应用。
实施例5
一种将实施例1中的抗菌肽d-r-β-casein-197在医用耗材中的应用。
表征测试:
1.1高效液相色谱和质谱表征
以上制备过程中均采用液相检测生成物纯度,色谱条件如下:
色谱柱:xbridgebehshieldrp18column,
采用质谱(esi-ms)检测各产物的分子量。
1.2高效液相色谱纯化
色谱柱:xbridgepeptidebehc18obdprepcolumn,
图1为β-casein-197的纯度及分子量表征图;图2为d-r-β-casein-197的纯度及分子量表征图。由图1和图2可知,经化学合成和纯化,我们得到了实际分子量与理论分子量一致的β-casein-197和d-r-β-casein-197,且纯度均高达95%以上。
1.3二级结构测定
首先,对多肽进行折叠,10mg多肽先溶解于1ml6m的盐酸胍中,然后迅速加入5ml的20mmpb(磷酸钠缓冲液:每升溶液含有23.02gna2hpo4和4.558gnah2po4,ph7.4)稀释,装入透析卡,对2l20mmpb透析3次(透析液中含有10mm的tcep(三(2-羧乙基)膦))。
过夜透析除去残留微量三氟乙酸后,调节多肽浓度至20μm,置于径宽0.1cm的测量皿中,于室温下测定圆二色性。波长扫描范围为190nm至260nm,扫描速度和分辨率分别为10nm/min和1nm。所得椭圆率原始数据按下列公式转换为平均残基摩尔椭圆率([θ]r):
[θ]r=θ/(10×c×n×i)
其中θ为椭圆率(毫度),c为多肽摩尔浓度(m),i为测量皿径宽(cm),n为多肽残基数。以波长扫描范围为横坐标,平均残基摩尔椭圆率为纵坐标,绘制多肽的圆二色谱图。
图3为β-casein-197和d-r-β-casein-197的二级结构鉴定图;由图3可知,β-casein-197和d-r-β-casein-197在加入50%tfe后,即模拟微生物膜的疏水环境或带负电荷的原核细胞环境下,均在192nm、208nm及222nm处出现特征峰,这种谱图表明二者均为α螺旋结构,且d-r-β-casein-197为β-casein-197的镜像体。
1.4热稳定性测定
与圆二色谱表征实验相同,首先需要对多肽进行折叠,缓冲液为1xpbs,10%甘油,200mml-arginine,ph7.4。
采用日本jasco公司j815圆二色谱仪测定热稳定性,10μm样品多肽在缓冲液中进行实验。将制备好的2.5毫升多肽pbs溶液,装入带有转子的3毫升石英分光皿中。在360rpm的不断搅拌下,以每分钟1℃速率升温速率测量25℃到90℃在222nm处的cd圆二色谱信号。其中,每分钟的加热后,等待20秒,使溶液充分混匀,使该温度时信号稳定,然后进行16秒钟采样并积分,得出改点的信号值。温度和采集到cd信号数据用jasco提供的控制软件进行自动化处理。得到每一个温度采样点上的cd信号。
图4为β-casein-197的热稳定性测定图,tm=48.7℃;图5为d-r-β-casein-197的热稳定性测定图,tm=62.12℃。由图4和图5可知,经改造后的d型全反多肽,即d-r-β-casein-197的热稳定性有大幅度提升。
1.5抑菌活性测定
将各耐药病原菌株(铜绿假单胞菌pseudomonasaeruginosa,金黄色葡萄球菌staphylococcusaureus,大肠杆菌escherichiacoli,沙门氏杆菌salmonellatyphi,粪肠球菌enterococcusfaecalis,鲍氏不动杆菌acinetobacterbaumannii)接种至mh培养基(水解酪蛋白培养基)上,于37℃培养24h-48h至肉眼可见菌落,挑取单菌落接种到mh肉汤培养基中37℃过夜培养。再将过夜菌体接种至新鲜mh肉汤培养基中,培养至菌体处于对数生长期,用mh肉汤培养基校正浓度至0.5麦氏比浊标准,最后将所得菌体的菌落数调整为大约105cfu/ml左右。
用灭菌蒸馏水将抗菌肽溶解制成2000μm的储备液,然后用等量无菌mh肉汤培养基进行倍比稀释,得到终浓度为1000μm、500μm、250μm、125μm、62.5μm、31.25μm、15.625μm、7.8μm、3.9μm、1.95μm。
向96孔板1~10列中加入90μl稀释好的菌液,第11列只加菌液不加药作为阳性对照,第12列只加培养基不加菌液作为阴性对照,然后再1~10列中逐一加入梯度稀释抗菌肽10μl。混匀后在37℃振荡培养箱培养18~24h。观察结果,阳性对照生长良好而阴性对照未见浑浊时,以肉眼观察到抑制细菌生长的最低抗菌肽浓度作为其对病原菌的最小抑菌浓度。
表1.多肽对病原菌的抗菌活性对比
由表1可知,d-r-β-casein-197对各病原菌的mic较β-casein-197相比,均有大幅降低,即抗菌活性极大增强,而d-β-casein-197无抗菌活性。
1.6细胞毒性测定
采用mtt法测定抗菌肽对人胚胎成纤维细胞mrc-5的细胞毒性。
将mrc-5复苏后,培养于含有10%胎牛血清的dmem培养液中,培养条件为37℃、5%co2。每隔一天换一次培养液,细胞传代采用胰蛋白酶消化法。当细胞数长满培养瓶底80%后,用pbs液洗涤2次,加入0.25%的胰酶消化液2ml,3min后加入含胎牛血清的dmem培养液终止消化,弃去消化液,加入3ml细胞培养液吹打细胞形成悬液。96孔板中每孔加入50μl细胞悬液,浓度大约为1×104cells/孔。
细胞贴壁后,每孔加入不同梯度稀释的抗菌肽,不加抗菌肽和细胞孔作为阴性对照,加细胞而不加抗菌肽孔为阳性对照,培养20h。
每孔加入mtt50μl,培养4h后加入150μldmso(二甲亚砜)震荡10min以溶解晶体,使用多功能酶标仪在492nm测定吸光度,实验重复三次。
图6为不同浓度多肽处理后的细胞存活率对比图。由图6可知,随着抗菌肽浓度的提高,细胞生存率有不同程度的下降,但即使β-casein-197的浓度达到120μm时,细胞生存率仍超过80%,说明β-casein-197对哺乳动物细胞的毒性并不强,而在相同最大浓度下,d-r-β-casein-197对对哺乳动物细胞的毒性更低,细胞生存率超过90%,说明d型多肽较l型多肽的细胞毒性有所降低,具有低毒优势。
1.7抗蛋白酶水解能力测定
测定抗菌肽经过不同类型蛋白酶处理后的抑菌活性。
在37℃水浴条件下,用反应浓度为1mg/ml的胰蛋白酶(trypsin)、胃蛋白酶(pepsin)、木瓜蛋白酶(papain)、蛋白酶k(proteasek)溶液分别处理抗菌肽,处理时间1h,然后按照抑菌活性测定方法来测定抗菌肽经各蛋白酶处理后的最小抑菌浓度是否发生变化,对照组为没有经过抗菌肽处理的组别。
表2多肽在不同蛋白酶处理下的稳定性
由表2可知,β-casein-197和d-r-β-casein-197经各种蛋白酶处理后,抗菌活性均有所下降,但d-r-β-casein-197的抗菌活性仍远高于β-casein-197,说明d-r-β-casein-197具有较好的抗蛋白酶降解能力。
1.8等温量热滴定法(itc)测定抗菌肽与脂多糖(lps)结合
革兰氏阴性菌细胞外壁的主要成分是lps,抗菌肽通过与lps结合破坏细菌膜结构导致细胞凋亡,从而决定了抗菌肽的抗菌活性。
测定抗菌肽与pseudomonasaeruginosalps的结合能力。多肽浓度设定:抗菌肽浓度为300μm,lps浓度为30μm。实验参数设定:totalinjection=20,celltemperature=25℃,referencepower=15μcal/sec,initialdelay=60s,stimingspeed=1000rpm。滴定参数设定:第一滴volume=0.5μl,duration=1.0s,后面19滴volume=2μl,spacing全部设定为120s,filterperiod全部设定为2s。滴定和数据分析:按上述设定参数开始滴定,滴定结束后,用origin9.0软件对于数据进行分析,拟合曲线得到kd值。
图7为β-casein-197与lps的结合能力测定图,结合常数为10.5μm,图8为d-r-β-casein-197与lps的结合能力测定图,结合常数为51.5nm,二者相差200倍,这一结果说明d-r-β-casein-197与lps的结合能力更强,从机理上进一步解释了其具备更高抗菌活性的原因。
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的图例。
多肽序列:
β-casein-197:leuleuasnglngluleuleuleuasnprothrhisglniletyrproval
d-β-casein-197:leuleuasnglngluleuleuleuasnprothrhisglniletyrproval
d-r-β-casein-197:valprotyrileglnhisthrproasnleuleuleugluglnasnleuleu
- 还没有人留言评论。精彩留言会获得点赞!