一种提高离子交换层析内毒素去除效率的方法及其用途与流程
本发明涉及生物制药技术领域,尤其涉及一种提高离子交换层析内毒素去除效率的方法及其用途。
背景技术:
生物技术药物的安全性是其开发过程中一个重要的考核指标,其主要影响因素除了药物自身理化性质之外,下游制备工艺是决定其关键所在。在生物技术药物下游工艺开发中,杂质的去除程度与其最终制剂的安全性密切相关,这其中内毒素的含量水平控制是生物技术药物下游技术开发中最难以克服的技术之一。国际和国内的相关要求都有明确规定,一般认为没剂量内毒素的含量水平应小于5eu。
内毒素是指能引起体温升高的一大类物质,而在生物技术药物中,内毒素绝大多数时候指代的是脂多糖,又称内毒素。脂多糖是革兰氏阴性细菌细胞壁组成成分。生物技术药物合成设计中,革兰氏阴性细菌中的大肠杆菌常被选用为目标产物的表达体系,即源和表达体系,如重组要用蛋白表达或核酸/质粒扩增等。大肠杆菌表达体系最大的优势在于其增殖速度快,分裂周期短,培养条件简单,营养成分要求低,目标产物表达量高等。
目前通过大肠杆菌表达体系合成的重组药用蛋白包括干扰素(ifn)、粒细胞集落刺激因子(g-csf)、肿瘤坏死因子(tnf),促红细胞生成素(epo)等细胞因子以及天冬酰胺酶、尿酸酶等酶类蛋白。相比于其它重组表达体系,大肠杆菌自身细胞壁成分高含量的脂多糖成分对下游纯化去除工艺要求极高。
脂多糖是一种脂类和多糖的复合物,其结构由三部分构成。脂类a(lipida)为构成内毒素活性的糖脂,以共价键联接到杂多糖链,另两部分:一是核心多糖;另一o特异性链(o-specificchain)。由于其自身结构的特殊性,即含有疏水性相互作用与多种纯化介质如疏水相互作用色谱层析介质(苯基、丁基、辛集等)和阴离子交换介质(q-sepharose,deae-sepharose,poroshq等)发生高载量吸附。此外脂多糖同样可以吸附于阳离子交换介质上,尽管其吸附机理仍然未完全清楚。
在下游制备工艺开发中,为了去除脂多糖成分,通常利用目标产物与其理化性质上的差异来实现分离,其中离子交换柱最为常用。使用阴离子交换层析,目标产物通常以流穿的模式(flow-through)流经层析柱,脂多糖通常被吸附于阴离子交换介质上,达到分离的效果。而在阳离子交换层析中,通常将目标产物吸附于纯化介质上(bind-elute),脂多糖由于其带负电性的不易被吸附,最终脂多糖被流穿去除。然而存在的最大问题就是并不是所有的蛋白都符合这种条件、适用这样的模式。如绝大多数重组蛋白质和脂多糖类似,都能够带有负电荷,都能够与阴离子交换层析介质结合;同样很多重组蛋白也很难与阳离子交换层析介质结合,与之多糖一样被流传经过介质,最终难以实现分离。更甚者,最近的研究表明尽管结合机制不完全清楚,脂多糖与阳离子交换介质也能以高负载量与之吸附结合,为阳离子交换介质以bind-elute模式去除脂多糖的模式构成新的挑战。
技术实现要素:
鉴于现有技术中存在的问题,本发明的目的之一在于提供一种提高内毒素去除效率的具有普适性的方法,实现内毒素被特异性去除,而目标产物收率不受影响。
为达此目的,本发明采用如下技术方案:
第一方面,本发明提供一种提高离子交换层析柱上吸附的内毒素去除效率的方法,包括如下步骤:
(1)将含有目标产物和内毒素的原料液稀释至电导率为10ms/cm以下,并将ph值调节为适合目标产物吸附于离子交换介质的ph值后,载入经过去除热原处理后的离子交换柱中,将所述目标产物静电吸附于所述离子交换柱上;
(2)用无热原水和/或缓冲液淋洗所述离子交换柱;
(3)再用含非离子型物质的缓冲液淋洗所述离子交换柱;
(4)然后用无热原水或缓冲液再度淋洗所述离子交换柱;
(5)洗脱所述离子交换柱,获得目标产物。
其中,所述目标产物包括蛋白质、核酸和多糖中的任意一种或至少两种的组合。
所述非离子型物质兼具亲水性结构和疏水性结构,且能与内毒素非共价结合。
通过将目标产物通过静电相互作用吸附于离子交换层析介质上,然后使用一定浓度的非离子型物质对层析柱进行淋洗,部分非离子型物质,如tritonx-100等由于其不带电荷性,几乎不能通过静电相互作用与离子交换层析介质和重组蛋白质结合,但是由于其自身结构中同样含有疏水性区域,因此可与脂多糖发生一定程度的疏水性相互作用,而蛋白质的疏水区域往往包裹于蛋白质内部,蛋白质表面多为亲水性,因此此类非离子表面活性剂也同样难以与蛋白质结合。基于此疏水性相互作用原理,目前有研究在蛋白质的镍亲和层析过程中使用非离子型表面活性剂进行脂多糖的淋洗,但是其要求蛋白质能够与介质结合,这对于绝大多数的无亲和标签重组蛋白难以适用。考虑到非离子型物质难以通过静电相互作用与离子交换介质吸附,而绝大多数蛋白能够吸附于其上。基于此理化性质上的差异,可将蛋白质通过静电相互作用吸附于离子交换层析介质之上,然后使用非离子型物质淋洗,实现脂多糖被特异性淋洗去除而蛋白质仍然吸附于柱上的原理来实现目标产物与脂多糖的高效分离。
优选地,所述蛋白质包括重组蛋白质和/或天然物中提取的蛋白质。
优选地,所述蛋白质包括细胞因子类蛋白和/或酶类蛋白。
优选地,所述细胞因子类蛋白包括干扰素、粒细胞集落刺激因子、肿瘤坏死因子和促红细胞生成素中的任意一种至少两种的组合。
优选地,所述酶类蛋白包括天冬酰胺酶和/或尿酸酶。
优选地,所述离子交换柱包括阴离子交换柱和/或阳离子交换柱。
优选地,步骤(1)所述原料液包括天然菌体、天然细胞、重组构建表达菌体裂解液和重组构建表达细胞的裂解液中的任意一种至少两种的组合。
优选地,所述重组构建表达菌体裂解液包括大肠杆菌破菌上清液。
优选地,步骤(1)所述载入的方法包括蠕动泵载入、色谱载入和层析系统载入中的任意一种或至少两种的组合。
优选地,步骤(2)所述缓冲液的电导率为0~30ms/cm,例如0ms/cm、1ms/cm、2ms/cm、3ms/cm、4ms/cm、5ms/cm、6ms/cm、8ms/cm、10ms/cm、12ms/cm、15ms/cm、18ms/cm、20ms/cm、22ms/cm、25ms/cm、28ms/cm或30ms/cm等,优选0~5ms/cm。
优选地,步骤(3)所述含非离子型物质的缓冲液中,非离子型物质的体积百分数为0.1~5%,例如0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1.0%、1.2%、1.5%、2%、2.2%、2.5%、2.8%、3%、3.2%、3.5%、3.8%、4%、4.2%、4.5%、4.8%或5%等,优选0.1~1.0%。
优选地,步骤(3)所述含非离子型物质的缓冲液与所述离子交换层析柱的填充体积的体积比为(1~100):1,例如1:1、2:1、5:1、10:1、12:1、15:1、18:1、20:1、25:1、30:1、35:1、40:1、45:1、50:1、55:1、60:1、65:1、70:1、75:1、80:1、85:1或90:1等,优选(1~20):1。
优选地,步骤(3)所述含非离子型物质的缓冲液与步骤(2)所述缓冲液的ph之差△ph满足|△ph|小于等于0.5,例如0.5、0.45、0.4、0.3、0.2、0.1、0.05或0等,优选小于等于0.2。
优选地,步骤(3)所述含非离子型物质的缓冲液与步骤(2)所述缓冲液的电导率之比为(0~10):1,例如0:1、0.2:1、0.5:1、0.6:1、0.7:1、0.8:1、0.9:1、1:1、1.1:1、1.2:1、1.3:1、1.4:1、1.5:1、1.6:1、1.7:1、1.8:1、1.9:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1或10:1等,优选(0.5~2):1。
优选地,步骤(3)所述含非离子型物质的缓冲液中,非离子型物质包括聚乙二醇辛基苯基醚(tritonx-100),聚乙二醇单叔辛基苯基醚(tritonx-114)、聚山梨醇酸酯类(tween-20/40/60/80)和山梨醇脂肪酸酯(span-20/40/60/80)中的任意一种或至少两种的组合,其中典型但非限制性的组合为:聚乙二醇辛基苯基醚(tritonx-100)与聚乙二醇单叔辛基苯基醚(tritonx-114)的组合,聚乙二醇辛基苯基醚(tritonx-100)与聚山梨醇酸酯类(tween-20/40/60/80)的组合,聚乙二醇单叔辛基苯基醚(tritonx-114)与山梨醇脂肪酸酯(span-20/40/60/80)的组合,优选tritonx-100和/或tritonx-114。
优选地,步骤(5)所述洗脱用的洗脱液包括高浓度盐溶液,所述高浓度盐溶液中盐的质量体积浓度为0.1~2.0m,例如0.1m、0.2m、0.5m、0.6m、0.8m、0.9m、1.0m、1.2m、1.3m、1.5m、1.8m、1.9m或2.0m等,优选0.8~1.2m。
优选地,所述高浓度盐溶液中盐包括氯化钠、硫酸铵和硫酸钠中的任意一种或至少两种的组合,其中典型但非限制性的组合包括:氯化钠与硫酸铵的组合,氯化钠与硫酸钠的组合,硫酸铵与硫酸钠的组合,氯化钠、硫酸铵与硫酸钠的组合。
优选地,步骤(5)所述洗脱的方式包括线性梯度洗脱或阶跃梯度洗脱。
作为本发明优选的技术方案,所述方法包括如下步骤:
(1)将含有目标产物和内毒素的原料液稀释至电导率为10ms/cm以下,并将ph值调节为适合目标产物吸附于离子交换介质的ph值后,通过蠕动泵载入、色谱载入和层析系统任意一种或至少两种的组合方式载入经过去除热原处理后的离子交换柱中,所述目标产物静电吸附于所述离子交换柱上;其中,所述目标产物包括蛋白质、核酸和多糖中的任意一种或至少两种的组合;
(2)用无热原水和/或电导率为0~30ms/cm的缓冲液淋洗所述离子交换柱;
(3)再用含非离子型物质体积百分数为0.1~5%的缓冲液淋洗所述离子交换柱;所述含非离子型物质的缓冲液与所述离子交换层析柱的填充体积的体积比为(1~100):1;所述含非离子型物质的缓冲液与步骤(2)所述缓冲液的ph之差△ph满足|△ph|小于等于0.5,电导率之比为(0~10):1;所述非离子型物质包括聚乙二醇辛基苯基醚、聚乙二醇单叔辛基苯基醚、聚山梨醇酸酯类和山梨醇脂肪酸酯中的任意一种或至少两种的组合;
(4)然后用无热原水或缓冲液再度淋洗所述离子交换柱;
(5)用盐的质量体积浓度为0.1~2.0m的高浓度盐溶液洗脱所述离子交换柱,获得目标产物。
第二方面,本发明提供了如第一方面所述方法的用途,所述方法用于生物技术药物下游制备工艺和生物制药纯化工艺。
与现有技术相比,本发明至少具有如下有益效果:
1.通过本发明所述的方法,在其它条件相同的情况下,最终洗脱下来的目标产物中的内毒素含量为未经过本发明处理所获得的产物中的内毒素水平10%以下。
2.本发明所述方法过程简单、易于操作、耗时较短,经济廉价,应用面广。
附图说明
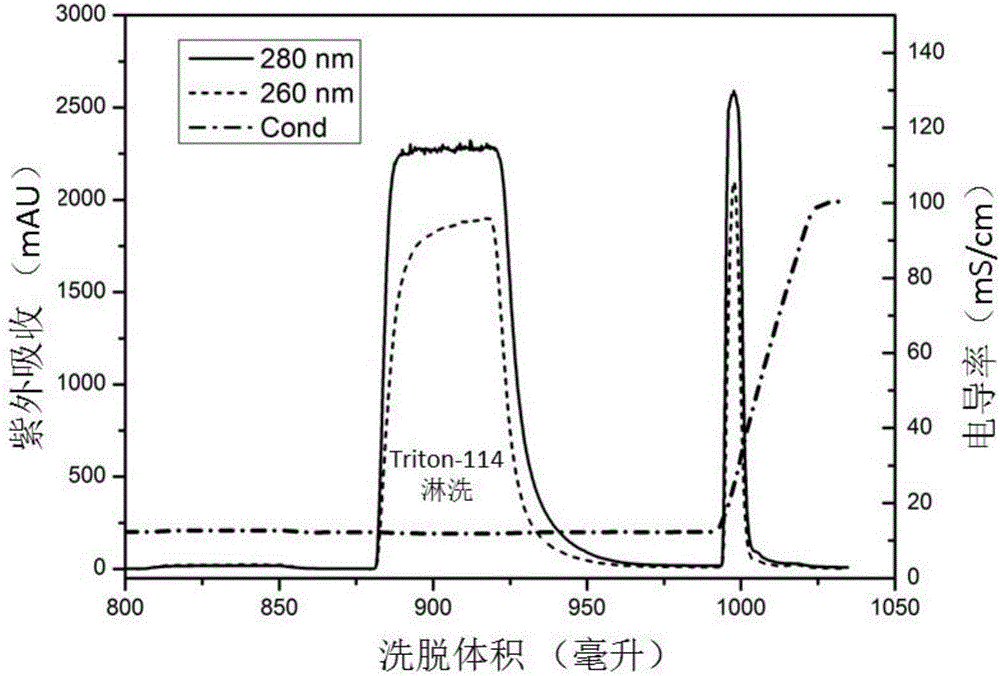
图1为本发明实施例1方法应用于阴离子交换层析过程的代表性层析色谱图;
图2为本发明实施例2方法应用于阴离子交换层析过程的代表性层析色谱图;
图3为本发明实施例1中q-sepharose,deae-sepharose和poroshq三种阴离子交换层析纯化重组人睫状神经营养因子蛋白时,最终洗脱蛋白液中热原含量残留对比图;
图4为本发明实施例2中sp-sepharose,cm-sepharose和poroshs三种阳离子交换层析纯化重组人肿瘤坏死因子蛋白时,最终洗脱蛋白液中热原含量残留对比图
具体实施方式
下面结合附图并通过具体实施方式来进一步说明本发明的技术方案。但下述的实例仅仅是本发明的简易例子,并不代表或限制本发明的权利保护范围,本发明的保护范围以权利要求书为准。
实施例1
阴离子交换层析纯化重组睫状神经营养因子过程中使用tritonx-100进行淋洗去除内毒素:
(1)重组睫状神经营养因子表达:含有rhcntf质粒的大肠杆菌通过20-l发酵,当od600nm值达到6.0以上时,加入1.0mmiptg诱导rhcntf表达,4小时后收获菌体;20mmtris-hcl缓冲液按10%的比例(质量/体积比)重悬收获菌体,经高压均质机匀浆3循环后,离心获得破菌上清液。
(2)q-sepharose柱层析:
步骤一:使用蛋白层析系统将适当量的破菌上清液载入经氢氧化钠处理过的q-sepharose柱后,使用上样缓冲液(20mmtris-hclph8.0,电导为1.0ms/cm)淋洗10个柱体积后;检测器检测波长设定为260nm和280nm;
步骤二:再使用含有0.5%体积tritonx-100的20mmtris-hclph8.0缓冲液淋洗20个柱体积的缓冲液;
步骤三:再使用上样缓冲液淋洗20个柱体积后,最后使用30%1.0mnacl20mmtris-hclph8.0缓冲液以5个柱体积的缓冲液梯度洗脱目标蛋白。
同时在相同条件下,只上样相同蛋白量和淋洗相同体积(50个柱体积)的20mmtris-hclph8.0缓冲液而省略其他步骤为对照,最终以同样的洗脱方式洗脱下来。
(3)deae-sepharose柱层析:
步骤一:使用蛋白层析系统将适当量的破菌上清液载入经氢氧化钠处理过的q-sepharose柱后,使用上样缓冲液(20mmtris-hclph8.0)淋洗10个柱体积后;检测器检测波长设定为260nm和280nm;
步骤二:再使用含有0.5%tritonx-100的20mmtris-hclph8.0缓冲液淋洗20个柱体积的缓冲液;
步骤三:再使用上样缓冲液淋洗20个柱体积后,最后使用30%1.0mnacl20mmtris-hclph8.0缓冲液以5个柱体积的缓冲液梯度洗脱目标蛋白。
同时在相同条件下,上样相同蛋白量和淋洗相同体积(50个柱体积)的20mmtris-hclph8.0缓冲液最为对照,最终以同样的洗脱方式洗脱下来。
(4)poroshq柱层析:
步骤一:使用蛋白层析系统将上述适当量的睫状重组神经营养因子蛋白破菌上清液载入经氢氧化钠处理过的poroshq柱后,使用上样缓冲液(20mmtris-hclph8.0)淋洗10个柱体积后;检测器检测波长设定为260nm和280nm;
步骤二:再使用含有0.5%tritonx-100的20mmtris-hclph8.0缓冲液淋洗20个柱体积的缓冲液;
步骤三:再使用上样缓冲液淋洗20个柱体积后,最后使用30%1.0mnacl20mmtris-hclph8.0缓冲液以5个柱体积的缓冲液梯度洗脱目标蛋白。
同时在相同条件下,上样相同蛋白量和淋洗相同体积(50个柱体积)的20mmtris-hclph8.0缓冲液而省略其他步骤为对照,最终以同样的洗脱方式洗脱下来。
(5)内毒素含量测定:
使用鲎试剂检测法,鲎试剂λ=0.06eu和λ=0.125eu;内毒素标准品;内毒素检测专用无热原水;购自于湛江安度斯生物有限公司。检测方法:参考厂家说明书。
实施例2
阳离子交换层析纯化重组肿瘤坏死因子过程中使用tritonx-100进行淋洗去除内毒素:
(1)重组肿瘤坏死因子大肠杆菌体系表达:含有tnf-α质粒的大肠杆菌通过20-l发酵,当od600nm值达到5.5时,加入1.0mmiptg诱导目标蛋白表达,诱导4小时后收获菌体;使用20mmtris-hclph8.0缓冲液按10%的比例(质量/体积比)重悬收获的菌体,经高压均质机匀浆3循环后,离心获得破菌上清液,使用10%磷酸将离心所得的上清液ph值调整至ph6.0左右,再次离心去除沉淀蛋白,收获上清液。
(2)sp-sepharose柱层析:
步骤一:使用蛋白层析系统将适当量的上述上清液载入经氢氧化钠处理过的sp-sepharose柱后,使用上样缓冲液(20mmna2hpo4/kh2po4,ph6.0,电导2.0ms/cm)淋洗10个柱体积后;检测器检测波长设定为260nm和280nm;
步骤二:再使用含有0.5%tritonx-100的20mmna2hpo4/kh2po4,ph6.0缓冲液淋洗20个柱体积的缓冲液;
步骤三:再使用上样缓冲液淋洗20个柱体积后,最后使用100%1.0mnacl20mmna2hpo4/kh2po4,ph6.0缓冲液以5个柱体积的缓冲液梯度洗脱目标蛋白。
同时在相同条件下,上样相同蛋白量和淋洗相同体积(50个柱体积)的20mmtris-hclph8.0缓冲液而省略其他步骤为对照,最终以同样的洗脱方式洗脱下来。
(3)cm-sepharose柱层析:
步骤一:使用蛋白层析系统将适当量的上述上清液载入经氢氧化钠处理过的cm-sepharose柱后,使用上样缓冲液(20mmna2hpo4/kh2po4,ph6.0)淋洗10个柱体积后;检测器检测波长设定为260nm和280nm;
步骤二:再使用含有0.5%tritonx-100的20mmna2hpo4/kh2po4,ph6.0缓冲液淋洗20个柱体积的缓冲液;
步骤三:再使用上样缓冲液淋洗20个柱体积后,最后使用100%1.0mnacl20mmna2hpo4/kh2po4,ph6.0缓冲液以5个柱体积的缓冲液梯度洗脱目标蛋白。
同时在相同条件下,上样相同蛋白量和淋洗相同体积(50个柱体积)的20mmtris-hclph8.0缓冲液而省略其他步骤为对照,最终以同样的洗脱方式洗脱下来。
(4)poroshs柱层析:
步骤一:使用蛋白层析系统将适当量的上述上清液载入经氢氧化钠处理过的poroshs柱后,使用上样缓冲液(20mmna2hpo4/kh2po4,ph6.0)淋洗10个柱体积后;检测器检测波长设定为260nm和280nm;
步骤二:再使用含有0.5%tritonx-100的20mmna2hpo4/kh2po4,ph6.0缓冲液淋洗20个柱体积的缓冲液;
步骤三:再使用上样缓冲液淋洗20个柱体积后,最后使用100%1.0mnacl20mmna2hpo4/kh2po4,ph6.0缓冲液以5个柱体积的缓冲液梯度洗脱目标蛋白。
同时在相同条件下,上样相同蛋白量和淋洗相同体积(50个柱体积)的20mmtris-hclph8.0缓冲液而省略其他步骤为对照,最终以同样的洗脱方式洗脱下来。
(5)内毒素含量测定:
使用鲎试剂检测法,鲎试剂λ=0.06eu和λ=0.125eu;内毒素标准品;内毒素检测专用无热原水;购自于湛江安度斯生物有限公司。检测方法:参考厂家说明书。
表1为实施例1中q-sepharose,deae-sepharose和poroshq三种阴离子交换层析纯化重组人睫状神经营养因子蛋白时,最终洗脱蛋白液中热原含量残留浓度统计表,其中正常淋洗表示的是相应的上述对照试验。
表2为实施例2中q-sepharose,deae-sepharose和poroshq三种阴离子交换层析纯化重组人肿瘤坏死因子蛋白时,最终洗脱蛋白液中热原含量残留浓度统计表,其中正常淋洗表示的是相应的上述对照试验。
表1
表2
从表1和表2、图1和图2、图3和图4可以看出,通过本发明所述的方法,将蛋白质通过静电相互作用吸附于离子交换层析介质之上,然后使用非离子型物质淋洗,在其它条件相同的情况下,最终洗脱下来的目标产物中的内毒素含量远远低于未经过本发明静电吸附和非离子物质淋洗所获得的产物中的内毒素水平,甚至不在一个数量级。
申请人声明,本发明通过上述实施例来说明本发明的详细工艺设备和工艺流程,但本发明并不局限于上述详细工艺设备和工艺流程,即不意味着本发明必须依赖上述详细工艺设备和工艺流程才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!