一类酯酶激活的聚集诱导发光型抗癌前药及制备方法与流程
本发明属于生物医学用荧光材料技术领域,具体涉及一类具有酯酶激活的聚集诱导发光性质的抗癌前药,以及该前药的制备方法。
背景技术:
生物成像是当今生命科学和生物研究中非常重要有力的工具,荧光成像具有最小的侵入性,高对比度,良好的时间分辨率,高灵敏度,易于使用等优点,因此它提供了一种独特的使细胞和组织的形态细节可视化的方法。相比于传统的荧光染料,aie分子的生物成像具有发光效率高、生物兼容性好、抗光漂白能力强和光吸收率高等优点。生物成像是aie分子目前应用较为广泛的领域之一。化疗是目前治疗恶性肿瘤的主要临床选择。但化疗药物通常有较差的水溶性、非特异性、低生物利用度、快速的血液/肾清除、肿瘤的低积累、严重的多药耐药(mdr)以及不良的脱靶副作用。目前常用的解决方法有脂质体囊泡的药物载体,无机材料和高分子纳米颗粒封装的化疗药物,但许多载体都具有较低的药物负荷能力,并存在一定的生物毒性。近年来,光疗法因其侵袭性小、系统损伤小而越来越的使用在癌症治疗上。光疗包括光动力疗法(pdt,依靠光敏剂生成活性氧,用于杀死肿瘤细胞)和光热疗法(ptt,依靠光热剂将光能转化为肿瘤消融的热)。然而,前者的疗效受到肿瘤中低氧水平的困扰,而后者则需要较高的激光功率,从而导致外侧组织损伤。因此设计一种同时解决化疗和光疗问题的药物变得十分迫切。
技术实现要素:
本发明的目的是提供一类具有酯酶激活的聚集诱导发光性质的抗癌前药,并为该抗癌前药提供一种制备方法。
针对上述目的,本发明所采用的酯酶激活的聚集诱导发光型抗癌前药的结构通式如下所示:
式中drug代表失去羧基的抗癌药物,具体如:失去羧基的苯丁酸氮芥或甲氨蝶呤。
上述酯酶激活的聚集诱导发光型抗癌前药的制备方法为:
1、将三苯基乙烯溶于氯仿中,然后在-78℃下逐滴加入br2,待恢复至室温后搅拌反应至完全,分离纯化,得到化合物i。
2、以甲苯为溶剂,将化合物i、对甲酰基苯硼酸、钯催化剂、四丁基溴化铵在碱性条件下90~100℃回流至反应完全,分离纯化,得到化合物ii。
3、以n,n-二甲基酰胺和苯甲酰氯为溶剂,将化合物ii和4-甲基喹啉在150~160℃下反应完全,分离提纯,得到化合物iii。
4、以n,n-二甲基酰胺为溶剂,将式iii化合物与2-溴乙醇在90~100℃下反应完全,分离提纯,得到化合物iv。
5、以吡啶为溶剂,将化合物iv、二环己基碳二亚胺、4-二甲氨基吡啶和含羧基的抗癌药物在室温下反应完全,纯化分离,得到抗癌前药。
上述步骤1中,优选所述三苯乙烯与br2的摩尔比为1:1~2。
上述步骤2中,优选所述化合物i、钯催化剂、四丁基溴化铵和对甲酰基苯硼酸的摩尔比为1:0.001~0.01:0.05~0.2:2~4,其中所述的钯催化剂为醋酸钯或四(三苯基膦)钯。
上述步骤2中,所述的碱性条件通过碳酸钠、碳酸钾或碳酸铯调节。
上述步骤3中,优选所述化合物ii和4-甲基喹啉的摩尔比为1:1~2。
上述步骤4中,优选所述化合物iii和2-溴乙醇的摩尔比为1:5~10。
上述步骤5中,优选所述化合物iv、含羧基的抗癌药物、二环己基碳二亚胺、4-二甲氨基吡啶的摩尔比为1:1~1.1:1.2~2.2:2.2~3。
本发明以四苯基乙烯衍生物、抗癌药物为原料,将本来对癌细胞呈现毒性的化合物合成生物相容性好的了一系列具有酯酶激活的抗癌前药。这些前药本身无毒,但在酯酶作用下释放出具有聚集诱导发光性的荧光材料,并对活细胞中的线粒体具有较高的特异性标记功能并“点亮”,同时,释放的两分子化合物均对细胞呈现毒性。其次,在该前药不断释放抗癌药物的同时,其所释放的聚集诱导发光分子也具有很强的单线态氧的产生能力,可在进行化疗的同时进行光动力治疗。结合高靶向性,良好的生物相容性,酯酶特异性相应性,光疗与化疗联合治疗的有点,本发明前药可成为抗癌治疗中的有力工具,例如基于酯酶激活的病理学和药理学。
附图说明
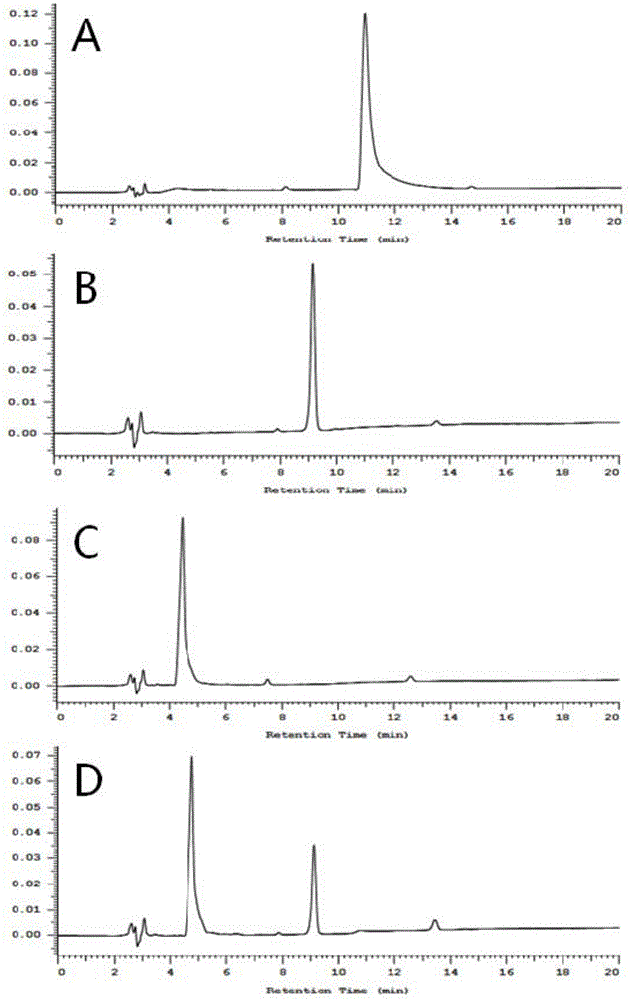
图1是实施例1制备的tpe-oh-cbl在酯酶作用下分解的hplc谱图。
图2是实施例1制备的tpe-oh在dmso与水混合体系中的荧光发射光谱图。
图3是实施例1制备的tpe-oh在dmso与水混合体系中的相对荧光强度图。
图4是实施例1制备的tpe-oh-cbl在不同浓度的酯酶存在下的荧光光谱图。
图5是实施例1制备的tpe-oh-cbl在572nm处的荧光强度随酯酶浓度变化的线性关系图。
图6是实施例1制备的tpe-oh在25mw/cm2的白光光照下,abda的紫外可见吸收光谱图。
图7是实施例1制备的tpe-oh在25mw/cm2的白光光照下,abda在378nm处的吸收强度图。
图8是实施例1制备的tpe-oh-cbl在不同孵化条件的细胞成像图。
图9是实施例1制备的tpe-oh-cbl与商业线粒体染料的细胞成像图。
图10是实施例1制备的tpe-oh、tpe-oh-cbl在不同条件下的毒性。
具体实施方式
下面结合附图和实施例对本发明进一步详细说明,但本发明的保护范围不仅限于这些实施例。
实施例1
1、将1.84g(7.2mmol)三苯基乙烯溶于80ml氯仿中,在-78℃下,逐滴加入3.6ml(7.2mmol)br2,待恢复至室温后搅拌6h,反应完后减压浓缩,浓缩产物经柱层析(石油醚:乙酸乙酯=20:1~10:1,v/v),得到化合物i并命名为ph3-br,其产率为87%。
2、在氮气保护下,将0.90g(2.36mmol)ph3-br、0.94g(6.89mmol)对甲酰基苯硼酸、0.02g(0.01mmol)四(三苯基磷)钯和0.84g(0.24mmol)四丁基溴化铵溶于30ml甲苯中,然后加入0.54g(4mol)溶于2ml水的碳酸钠,90℃回流6h,减压浓缩,柱层析(石油醚:乙酸乙酯=50:1~20:1,v/v),得到化合物ii并命名为tpe-cho,其产率为79%。
3、在氮气保护下,将0.6g(1.61mmol)tpe-cho和0.21ml(1.61mmol)4-甲基喹啉加入10mln,n-二甲基酰胺和0.1ml苯甲酰氯中,在160℃下回流6h,减压浓缩,柱层析(石油醚:乙酸乙酯=20:1~5:1,v/v),得到化合物iii并命名为tpe-qn,其产率为68%。
4、将0.6g(1.26mmol)tpe-qn与0.443ml(6.3mmol)2-溴乙醇加入5mln,n-二甲基酰胺中,在90℃下反应12h,减压浓缩,柱层析(石油醚:乙酸乙酯=5:1~2:1,v/v),得到化合物iv并命名为tpe-oh,其产率为49%。
5、将0.5g(0.82mmol)tpe-oh、0.25g(1.21mmol)二环己基碳二亚胺、0.25g(2mmol)4-二甲氨基吡啶和0.25g(0.82mmol)苯丁酸氮芥溶于4ml吡啶中,在室温下反应12h,减压浓缩,柱层析(石油醚:乙酸乙酯=10:1~5:1,v/v),得到抗癌前药化合物v-1并命名为tpe-oh-cbl,其产率为42%。
所得tpe-oh-cbl的结构表征数据为:1hnmr(400mhz,cdcl3)δ8.54–8.43(m,2h),8.23(d,j=6.0hz,1h),8.11(s,1h),7.88(s,1h),7.74(d,j=4.8hz,2h),7.46(d,j=8.1hz,2h),7.19-7.00(m,17h),6.96(d,j=8.3hz,2h),6.57(d,j=8.4hz,2h),5.69(s,2h),4.72(s,2h),3.66(t,j=6.6hz,4h),3.58(t,j=6.5hz,4h),2.38(t,j=7.4hz,2h),2.21(t,j=7.4hz,2h),1.76–1.66(m,2h).
实施例2
本实施例中,用等摩尔甲氨蝶呤替换实施例1中的苯丁酸氮芥,其他步骤与实施例1相同,得到抗癌前药化合物v-2并命名为tpe-oh-meh。
为了证明本发明的有益效果,发明人对实施例1制备的酯酶激活的聚集诱导发光型抗癌前药tpe-oh-cbl进行了性能测试,具体试验如下:
1、体外验证实验
(1)hplc检测化合物在酯酶作用下分解
将tpe-oh-cbl加入pbs与二甲基亚砜体积比为99:1的混合液中,配制成10-5mol/l的tpe-oh-cbl溶液。将3ml10-5mol/l的tpe-oh-cbl溶液加入5ml样品瓶中,向其中加入0.1u/ml酯酶样品,经过1小时的作用,使用hplc监测tpe-oh-cbl的分解情况(见图1),a是tpe-oh-cbl的hplc谱图,b为苯丁酸氮芥的hplc谱图,c为tpe-oh的hplc谱图,d为tpe-oh-cbl在酯酶作用1小时后的hplc谱图,由图1可见,tpe-oh-cbl在经过酯酶作用1小时后,完全分解为tpe-oh和苯丁酸氮芥。
(2)tpe-oh的聚集诱导发光性能测试
将tpe-oh加入水与二甲基亚砜体积比分别为0%、10%、30%、50%、70%、90%、95%、99%的混合液中,配制成10-5mol/l的tpe-oh溶液,采用日立f-7000荧光分光光度计测试荧光材料的聚集诱导发光性质,见图2~3。由图2可见,在含水量不同的混合液中,tpe-oh的发光强度是不一样的,由图3可见,随这含水量的增加,tpe-oh的荧光强度呈现增长的水平,表明tpe-oh具有很好的聚集诱导发光性能。
(3)tpe-oh-cbl对酯酶的检测灵敏度
将tpe-oh-cbl加入pbs与二甲基亚砜体积比为99:1的混合液中,配制成10-5mol/l的tpe-oh-cbl溶液。将3ml10-5mol/l的tpe-oh-cbl溶液加入4ml比色皿中,向其中加入酯酶样品,分别使所得混合液中酯酶的浓度为0、0.01、0.02、0.05、0.07、0.1、0.15、0.2u/ml,采用荧光光谱仪测量不同浓度酯酶对应体系的荧光光谱(见图4),并绘制在572nm处不同浓度酯酶对应体系的荧光强度随酯酶浓度变化的标准曲线(见图5)。由图4可见,tpe-oh-cbl的荧光强度受到酯酶浓度的影响,伴随着酯酶浓度的增加而增加,说明tpe-oh-cbl在pbs体系中能被酯酶分解为tpe-oh从而被点亮。由图5可见,该体系的荧光强度随着体系中酯酶浓度的增大变化很明显,说明tpe-oh-cbl对酯酶的检测灵敏度很高。其中,酯酶的浓度在0~0.07u/ml时,荧光强度与酯酶浓度呈线性关系,线性方程为:y=9.7575+5855.21429x,式中y为荧光强度,x为酯酶浓度,相关系数r2为0.99804,可见荧光强度与酯酶浓度的线性关系很好。利用最低检测限的公式计算最低检测限,tpe-oh-cbl对酯酶的检测灵敏度很高,检测限达到了6.648×10-5u/ml。
(3)tpe-oh体外产生单线态氧
将3ml10-5mol/l的tpe-oh溶液加入4ml比色皿中,向其中加入9,10-蒽基-双(亚甲基)二丙二酸(简称abda)样品,使所得混合液中abda的浓度为10-4mol/l,测量在25mw/cm2的白光下照射0s、10s、20s、30s、40s、50s、60s时对应体系的紫外吸收光谱(见图6),并绘制在378nm处不同时间对应体系的紫外吸收强度随时间变化的曲线(见图7)。由图6可见,该体系的吸收强度随着体系白光照射时间的增大变化明显,在图7中,a组不添加tpe-oh与b组添加tpe-oh的对比表现出随着光照时间,tpe-oh产生的单线态氧作用于abda,使其吸收峰明显降低,表明tpe-oh可以在白光照射下产生大量的单线态氧。
2、细胞成像实验
(1)细胞内点亮与靶向性
分别使用hela、nih-3t3细胞进行测试,用胰酶消化对数期生长的hella、nih-3t3细胞,经5分钟离心之后,移除上层清液,加入新鲜的dmem不完全高糖培养液1.0ml,制成单细胞悬浮液,并计数以1×104个细胞/mldmem不完全高糖培养液2.0ml接种于35mm培养皿上,培养48小时,并在一定时间段观察细胞形态。待hela细胞可用于细胞成像时,用pbs缓冲溶液洗去漂浮的细胞,并分别加入配制好的500nmol/lhoechst33342的dmem溶液,在37℃的细胞培养箱中孵化培养30分钟,然后小心移走培养液,并用pbs缓冲溶液洗两次之后,加入配制好的10μmol/l化合物tpe-oh-cbl溶液,分别在37℃细胞培养箱中孵化培养15、30、45、60分钟。待样品培养之后,小心移走培养液,用pbs缓冲溶液洗三次,并加入不含酚红的dmem溶液,在奥林巴斯荧光共聚焦显微镜下进行细胞成像。另取一个可用于细胞成像hela细胞,用pbs缓冲溶液洗去漂浮的细胞,并分别加入配制好的500nmol/lhoechst33342和2mmol/l酯酶抑制剂4-(2-氨乙基)苯磺酰氟盐酸盐(简称aebsf)的dmem溶液,在37℃的细胞培养箱中孵化培养30分钟,然后小心移走培养液,并用pbs缓冲溶液洗两次之后,加入配制好的10μmol/ltpe-oh-cbl溶液,分别在37℃细胞培养箱中孵化培养45分钟。待样品培养之后,小心移走培养液,用pbs缓冲溶液洗三次,并加入不含酚红的dmem溶液,在奥林巴斯荧光共聚焦显微镜下进行细胞成像。待nih-3t3细胞可用于细胞成像时,用pbs缓冲溶液洗去漂浮的细胞,并分别加入配制好的500nmol/lhoechst33342的dmem溶液,在37℃的细胞培养箱中孵化培养30分钟,然后小心移走培养液,并用pbs缓冲溶液洗两次之后,加入配制好的10μmol/ltpe-oh-cbl溶液,在37℃细胞培养箱中孵化培养30分钟。待样品培养之后,小心移走培养液,用pbs缓冲溶液洗三次,并加入不含酚红的dmem溶液,在奥林巴斯荧光共聚焦显微镜下进行细胞成像。在图8中,a为tpe-oh-cbl在hela细胞染色15分钟时的成像,b为tpe-oh-cbl在hela细胞染色30分钟时的成像,c为tpe-oh-cbl在hela细胞染色45分钟时的成像,d为tpe-oh-cbl在hela细胞染色60分钟时的成像,e为添加aebs抑制剂抑制酯酶后,再加入tpe-oh-cbl后与hela细胞染色45分钟时的成像,f为tpe-oh-cbl在nih-3t3细胞中染色45分钟时的成像,由图可以清楚的看出,随着孵化时间的增长,hela细胞中的酯酶作用于tpe-oh-cbl,使其分解为tpe-oh而逐渐点亮(见图a~d),同时在酯酶抑制剂的作用下,tpe-oh-cbl不能被hela细胞中的酯酶作用分解从而没有被点亮(见图e),在图f中,证明了tpe-oh-cbl在nih-3t3中的酯酶作用很弱而几乎没有被点亮。由此得到,tpe-oh-cbl可以特异性的被hela细胞中的大量酯酶作用而分解。
(2)共染
使用hela细胞进行测试,用胰酶消化对数期生长的hella细胞,经5分钟离心之后,移除上层清液,加入新鲜的dmem不完全高糖培养液1.0ml,制成单细胞悬浮液,并计数以1×104个细胞/mldmem不完全高糖培养液2.0ml接种于35mm培养皿上,培养48小时,并在一定时间段观察细胞形态。待细胞可用于细胞成像时,用pbs缓冲溶液洗去漂浮的细胞,并分别加入配制好的500nmol/lmitotract-deep-red的dmem溶液,在37℃的细胞培养箱中孵化培养30分钟,然后小心移走培养液,并用pbs缓冲溶液洗两次之后,加入配制好的10μmol/ltpe-oh-cbl溶液,在37℃细胞培养箱中孵化培养30分钟。待样品培养之后,小心移走培养液,用pbs缓冲溶液洗三次,并加入不含酚红的dmem溶液,在奥林巴斯荧光共聚焦显微镜下进行细胞成像。在图9中,a为tpe-oh-cbl在hela细胞中酯酶作用下分解为tpe-oh而点亮的细胞成像,b为mitotract-deep-red对细胞线粒体的成像,d为细胞明场成像,c为图像a、图像b重合后的叠加图,由图可以清楚的看出,tpe-oh-cbl被分解点亮的位置与商业染料的重合度很高,说明tpe-oh-cbl对线粒体具有特异性标记功能。
3、细胞毒性实验
采用mtt法检测tpe-oh-cbl的细胞毒性,评估生物相容性。将hela细胞以1×104个细胞/ml每孔的密度接种于96孔培养板中,培养48小时。待细胞贴壁并长满96孔板之后,除去细胞培养液,加入含有不同浓度tpe-oh-cbl与aebsf(100mmol/l)混合样品、tpe-oh-cbl、tpe-oh、苯丁酸氮芥(0、5、10、30、50、70和90μmol/l)的dmem溶液100μl,在37℃的细胞培养箱中孵化培养2小时,然后移除每孔的dmem,加入不含化合物的dmem,在37℃的细胞培养箱中孵化培养72小时,然后给每孔加入10μlmtt培养液,继续孵化培养4小时,待4小时过后,给每孔加入100μl甲臜溶解液,紧接着在振荡器上匀速振荡10分钟并继续在培养箱中孵化培养4小时,最后在酶标仪上测定570nm下的紫外吸收,每组实验重复7组。同时以含有dmso的pbs溶液为培养基作对照。同时另取细胞贴壁并长满96孔板之后,除去细胞培养液,加入含有不同浓度tpe-oh、tpe-oh-cbl(0、5、10、30、50、70和90μmol/l)的dmem溶液100μl,在37℃的细胞培养箱中孵化培养2小时,然后移除每孔的dmem,加入不含化合物的dmem,在25mw/cm2的白光下光照30分钟,后在37℃的细胞培养箱中孵化培养72小时,然后给每孔加入10μlmtt培养液,继续孵化培养4小时,待4小时过后,给每孔加入100μl甲臜溶解液,紧接着在振荡器上匀速振荡10分钟并继续在培养箱中孵化培养4小时,最后在酶标仪上测定570nm下的紫外吸收,每组实验重复7组。同时以含有dmso的dmem溶液为培养基作对照,其细胞毒性如图10所示(其中a组表示在被aebsf抑制了hela细胞中酯酶后,不同浓度tpe-oh-cbl的细胞存活率,b组表示被hela细胞中酯酶分解了的tpe-oh-cbl的细胞存活率,c组表示tpe-oh的细胞存活率,d组表示苯丁酸氮芥的细胞存活率,e组表示tpe-oh在白光光照下的细胞存活率,f组表示被hela细胞中酯酶分解了tpe-oh-cbl后,又经过白光光照后的细胞存活率)。
由图10中a组的细胞毒性结果可以得知,在被aebsf抑制了hela细胞中酯酶后,tpe-oh-cbl不被酯酶分解,故所得结果为纯tpe-oh-cbl的毒性,结果为细胞的存活率均在90%以上,表明该前药具有良好的生物相容性。由c、d组的细胞毒性结果可以得知,tpe-oh与苯丁酸氮芥本身可以产生很好的治疗癌症的效果。由b组的细胞毒性结果可以得知,tpe-oh-cbl在细胞中酯酶作用下分解后,产生的tpe-oh与苯丁酸氮芥的联合治疗癌症效果,结果细胞存活率要比二者单独的存活率更低,由e组的细胞毒性结果可以得知,tpe-oh在白光光照下产生很好的光动力治疗效果,由f组的细胞毒性结果可以得知,tpe-oh-cbl在白光光照下,可以看到,在tpe-oh-cbl在细胞中酯酶作用下分解后,产生的tpe-oh与苯丁酸氮芥的联合治疗癌症效果的前提下,联合tpe-oh在白光下产生的光动力治疗效果,达到了最低的细胞存活率。所以此抗癌前药可以在其本身具有很好的生物相容性的前提下,特异性靶向癌细胞并在癌细胞中的酯酶作用下分解产生化疗与光疗联合治疗的最佳效果。
- 还没有人留言评论。精彩留言会获得点赞!