一种高纯度隐地蛋白的制备方法与流程
本发明属于生物技术领域,具体涉及一种高纯度隐地蛋白的制备方法。
背景技术:
化肥和农药是提高作物产量和防治病虫害的主选产品,但同时产生了环境、能源以及成本等方面的问题,成为现在困扰世界各国的经济与社会发展的重大问题,严重制约着农业的可持续性发展。而利用来自微生物或真菌的蛋白质制备的生物制品(包括生物肥料和生物农药)是当代作物优质、高效和无公害生产的主要措施。近年来,国内外在此方面已开展了大量的科学研究。早期的微生物蛋白主要是来自苏云金芽孢杆菌的杀虫晶体蛋白(icp),新型微生物蛋白主要是蛋白激发子类物质,目前研究报道的具有代表性的新型微生物蛋白主要有过敏蛋白(harpin)、隐地蛋白(cryptogein)和激活蛋白(activator),这些蛋白质不直接杀灭害虫和病原物,也不直接提供营养物质,而是在促进植物生长发育和对营养物质的吸收、增强植物的广谱抗病性(包括对多种细菌、真菌和病毒的抗性)、增强植物的驱虫性、增强植物的抗逆性(植物对干旱、严寒、盐碱等不良环境的耐受性)、延长作物产品的储存时间、对盆花和苗木的塑形作用方面有广泛应用前景。因此,它们可以配制成生物制品,应用到以上方面。
这些新型微生物蛋白或多肽大都通过发酵重组大肠杆菌等生物工程菌来实现大批量生产,在发酵后的下一步工艺为溶解细菌悬浮液中的细菌细胞以释放微生物蛋白或多肽。细胞溶解的方法有非化学的方法,如高压或超声波处理,使用该方法对设备要求较高,能耗高且难以大规模应用。作为另外的选择,大部分厂商采用将细胞悬浮液与溶菌酶接触来进行,之后还需要进行40-42℃消化,离心去细胞碎片和变性蛋白,以及蛋白纯化工艺以达到需要的纯度。这些工艺操作复杂,成本昂贵,且由于步骤多,过程冗长,会降低微生物蛋白和多肽的收率,并降低它们的生物活性和稳定性。
因此,需要有步骤简便、成本低廉的方法用于这类新型微生物蛋白或多肽的生产。
技术实现要素:
有鉴于此,本发明提供了一种简便、快速高纯度隐地蛋白的制备方法,基于该制备方法本发明还提供了一种农用抗菌抑菌剂。
本发明第一方面提供了一种高纯度隐地蛋白的制备方法,步骤包括:
s1、将隐地蛋白的编码基因与tev蛋白酶、t4噬菌体hoc蛋白基因片段依次连接,制备cryptogein-tev-hoc融合重组蛋白编码基因,所述隐地蛋白的编码区在tev-hoc融合蛋白基因的上游;
s2、将所述cryptogein-tev-hoc融合重组蛋白的编码基因转入质粒中;
s3、将步骤s2所得质粒转入大肠杆菌宿主中;
s4、使用hoc蛋白缺失的hoc-t4噬菌体感染步骤s3所得的大肠杆菌宿主,培养宿主表达展示所述cryptogein-tev-hoc融合重组蛋白的t4噬菌体;
s5、分离展示有所述cryptogein-tev-hoc融合重组蛋白的t4噬菌体;
s6、从步骤s5所得t4噬菌体中分离所述cryptogein-tev-hoc融合重组蛋白,tev蛋白酶切、离心得上清液即为隐地蛋白溶液。
上述方法相比于常规的隐地蛋白制备工艺,避免了透析以及蛋白层析等繁琐、昂贵的纯化步骤,能够简便快速的获取高纯度的隐地蛋白,且所得的隐地蛋白溶液可直接用作农用抗菌抑菌剂,能够达到明显促进植物生长的效果,使隐地蛋白工业化生产及应用成为可能,具有良好的应用前景。
优选的,步骤s1中,所述cryptogein-tev-hoc融合重组蛋白的编码dna序列的上游引入soc启动子序列,下游引入hoc终止子序列。
优选的,步骤s3中,所述质粒转入大肠杆菌宿主中的方法为化学转化法。
优选的,步骤s4中,所述感染步骤包括:以moi=1的噬菌体浓度侵染培养的大肠杆菌细胞。
进一步的,本发明对于隐地蛋白的分离、提纯工艺进行了优化,有效简化了工艺流程。
优选的,步骤s5中,所述分离展示步骤包括:
s51、将步骤s4所得培养液预冷后以42000-44000g离心力低温离心25-35min,弃上清;
s52、以pi-mg缓冲液充分重悬沉淀,并加入dnasei至终浓度为10μg/ml以及氯仿,在36-38℃以180-220rpm转速培养25-35min;所述pi-mg缓冲液组份包括:3.6-3.8g/lna2hpo4、3.8-4.2g/lnacl、2.8-3.2g/lkh2po4、0.9-1.1mmmgso4;
s53、以4000-6000g离心力去除细胞残骸,所得上清即为展示有cryptogein-tev-hoc融合重组蛋白的t4噬菌体颗粒悬浮液。
更加优选的,步骤s6中,分离所述cryptogein-tev-hoc融合组蛋白的步骤包括:将展示有cryptogein-tev-hoc融合重组蛋白的t4噬菌体颗粒悬浮液使用42000-44000g离心力低温离心25-35min,去除上清,沉淀以tev酶切缓冲液重悬。
进一步优选的,步骤s6中,所述tev蛋白酶切获取隐地蛋白溶液的步骤包括:以1000u的酶量30℃温育6h进行酶切处理,再使用42000-44000g离心力低温离心25-30min,上清即为隐地蛋白溶液。
本发明第二方面提供了一种农用抗菌抑菌剂,将上述制备方法制备得到的隐地蛋白溶液,直接作为农用抗菌抑菌剂。
目前暂无以隐地蛋白为有效成分的农用抑菌抗菌剂,已见报道的多为另一种植物超敏反应激发剂harpin蛋白为有效成分的农用抑菌抗菌剂,该类农用抑菌抗菌剂使用了重组表达harpin蛋白的细菌裂解物,直接将细菌裂解物施用于农作物上,表达宿主主要选择的是大肠杆菌。而细菌自身的有害成分(如大肠杆菌细胞壁中的内毒素),有可能污染农作物;且工程菌株携带的人为改造的优势基因(如抗生素抗性基因),其基因扩散有可能造成生态环境的污染等后果。本发明以上述制备方法制备得到的高纯度蛋白溶液直接作为农用抑菌抗菌剂,由于有效成分浓度高,且杂质污染物、蛋白活性抑制剂含量低,比使用简单的细菌裂解物能产生更好的施用效果,且有效避免了作物污染及生态环境污染等不良后果,具有良好的实际应用价值。
优选的,所述隐地蛋白溶液直接喷施在农作物植株上,所述农作物为葡萄。在本发明的实施例中对葡萄植株喷施所述隐地蛋白溶液获得了显著的促生长效果,但本隐地蛋白溶液适用的农作物并不局限于葡萄这一种。
与现有技术相比,本发明的有益效果是:
(1)本发明有效简化了隐地蛋白的提纯工艺,避免了透析、蛋白层析等繁琐、昂贵的纯化步骤,可简便、快速的获取高纯度隐地蛋白,使隐地蛋白工业化生产及应用成为可能。
(2)本发明制备得到的高纯度隐地蛋白可用作农用抗菌抑菌剂,直接喷施于植株可显著促进植物生长,使植株健壮,各种主要的植物学和生理学指标都得到明显的提高,且无毒无污染,喷施简单易行,易被农户接受,便于推广,具有良好的实际应用价值。
附图说明
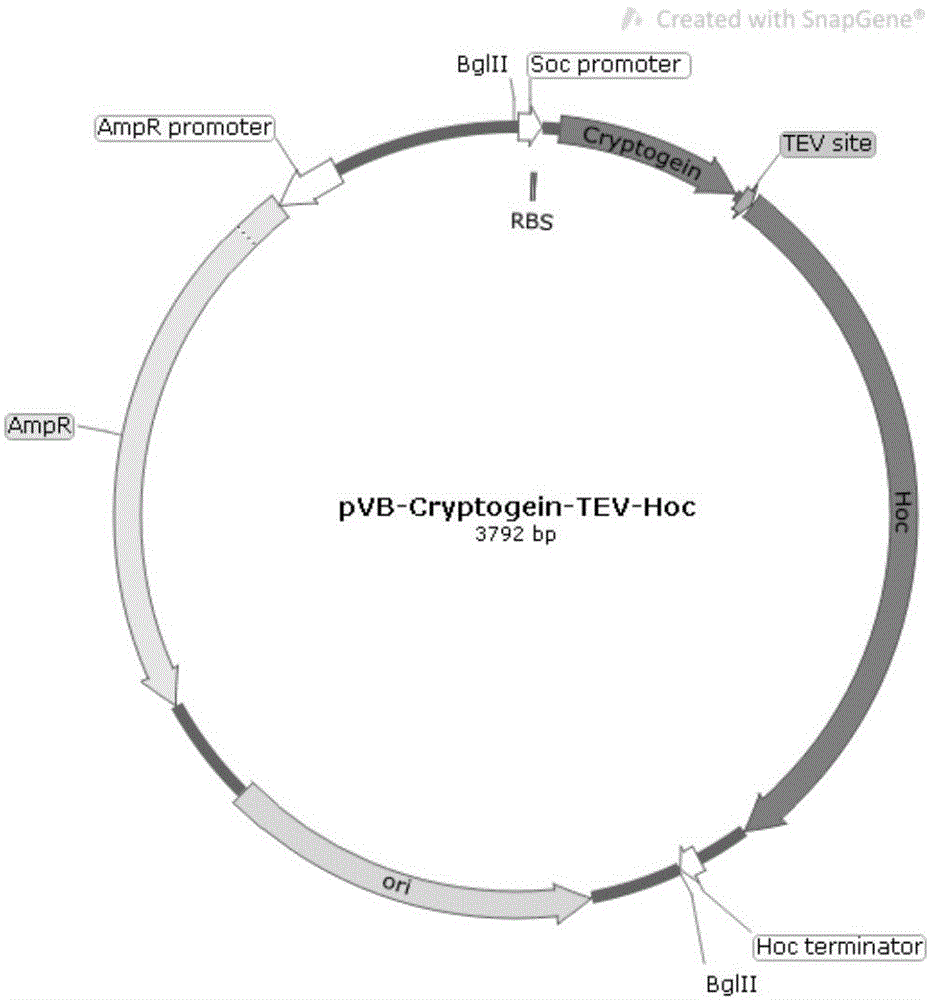
图1为质粒pvb-cryptogein-tev-hoc图谱示意图,以圆环示意环状质粒dna分子,基因表达方向在片段末端以箭头显示;该质粒的结构区域包括:cryptogein-tev-hoc重组蛋白(cryptogein-tev-hocfusion),基因启动子(socpromoter)、终止子(hocterminator)及核糖体结合位(rbs);cryptogein-tev-hoc重组蛋白基因中间部位的tev蛋白酶编码区;氨苄抗性基因(ampr)及复制起始区(ori)。
图2为t4噬菌体表面展示的重组蛋白以及分离的目的蛋白的电泳图,其中:
图2a:泳道1为蛋白分子量标准,单位千道尔顿(kd);泳道2表示展示有cryptogein-tev-hoc重组蛋白的t4噬菌体颗粒悬浮液;泳道3:将展示有cryptogein-tev-hoc重组蛋白(约50kd)的t4噬菌体颗粒悬浮液稀释2倍样品;泳道4:将展示有cryptogein-tev-hoc重组蛋白(约50kd)的t4噬菌体颗粒悬浮液稀释4倍样品。
图2b:泳道1为蛋白分子量标准,单位千道尔顿(kd);泳道2-5表示用tev蛋白酶酶切展示有cryptogein-tev-hoc重组蛋白(约50kd)的t4噬菌体颗粒悬浮液后的cryptogein目的蛋白溶液(10kd)从原液到8倍稀释进行的2倍梯度稀释样品;泳道6-9表示小牛血清蛋白(bsa)从2mg/ml到0.25mg/ml进行2倍梯度稀释样品。
图3为不同处理下“藤稔”葡萄作物植物学性状,左图为对照组即稀释用的清水处理的葡萄作物植物学性状实物图;右图为试验组即以上述方法纯化cryptogein蛋白(按终浓度50μg/ml喷雾施用)处理的葡萄作物植物学性状实物图。cryptogein蛋白处理的“藤稔”葡萄其新梢的粗度较对照增加了20%,新梢的节间长度较对照增加19.04%,果穗重较对照增加23.3%,果粒重较对照增加28.48%。
具体实施方式
为了便于理解本发明,下文将结合实施例对本发明作更全面、细致地描述,但本发明的保护范围并不限于以下具体的实施例。
除非另有定义,下文中所使用的所有专业术语与本领域技术人员通常理解的含义相同。本文中所使用的专业术语只是为了描述具体实施例的目的,并不是旨在限制本发明的保护范围。
除非另有特别说明,本发明中用到的各种原材料、试剂、仪器和设备等,均可通过市场购买得到或者可通过现有方法制备得到。
本发明第一方面提供了一种高纯度隐地蛋白的制备方法,步骤包括:
s1、将隐地蛋白的编码基因与tev蛋白酶、t4噬菌体hoc蛋白基因片段依次连接,制备cryptogein-tev-hoc融合重组蛋白编码基因,所述隐地蛋白的编码区在tev-hoc融合蛋白基因的上游,且表达框一致;所述cryptogein-tev-hoc融合重组蛋白的编码dna序列的上游引入soc启动子序列,下游引入hoc终止子序列。在本发明的一个实施例中,所述隐地蛋白来源于菌株phytophthoracryptogea的genebank编号为caa84224.1的cryptogein蛋白的chaina。
s2、将所述cryptogein-tev-hoc融合重组蛋白的编码基因转入质粒中;
s3、将步骤s2所得质粒采用化学转化法转入大肠杆菌宿主中;
s4、使用hoc蛋白缺失的hoc-t4噬菌体感染步骤s3所得的大肠杆菌宿主,具体的,以moi=1(感染复数)的噬菌体浓度侵染培养的大肠杆菌细胞,培养宿主表达展示所述cryptogein-tev-hoc融合重组蛋白的t4噬菌体;
s5、分离展示有所述cryptogein-tev-hoc融合重组蛋白的t4噬菌体;具体的,所述分离展示步骤包括:
s51、将步骤s4所得培养液预冷后以42000-44000g离心力低温离心25-35min,弃上清;
s52、以pi-mg缓冲液充分重悬沉淀,并加入dnasei至终浓度为10μg/ml以及氯仿,在36-38℃以180-220rpm转速培养25-35min;所述pi-mg缓冲液组份包括:3.6-3.8g/lna2hpo4、3.8-4.2g/lnacl、2.8-3.2g/lkh2po4、0.9-1.1mmmgso4;
s53、以4000-6000g离心力去除细胞残骸,所得上清即为展示有cryptogein-tev-hoc融合重组蛋白的t4噬菌体颗粒悬浮液。
s6、从步骤s5所得t4噬菌体中分离所述cryptogein-tev-hoc融合重组蛋白。具体的,分离所述cryptogein-tev-hoc融合重组蛋白的步骤包括:将展示有cryptogein-tev-hoc融合重组蛋白的t4噬菌体颗粒悬浮液使用42000-44000g离心力低温离心25-35min,去除上清,沉淀以tev酶切缓冲液重悬,所述tev酶缓冲液组份为:50mmtris-hclph8.0,0.5mmedta,1mmdtt。然后tev蛋白酶切后获取隐地蛋白溶液,具体的,所述酶切的步骤包括:以1000u的酶量30℃温育6h进行酶切处理,再使用42000-44000g离心力低温离心25-30min,上清即为隐地蛋白溶液。
本发明第二方面提供了一种农用抗菌抑菌剂,将上述制备方法制备得到的隐地蛋白溶液,直接作为农用抗菌抑菌剂,所述隐地蛋白溶液能够直接喷施在农作物植株上而发挥作用,所述农作物为葡萄。
下面将结合具体实施例对本申请的高纯度隐地蛋白的制备方法进行详细说明。
实施例1、隐地蛋白(cryptogein)的序列获取
来源于菌株phytophthoracryptogea编码cryptogein蛋白的序列已经公开(genebank编号:caa84224.1)。隐地蛋白(cryptogein)基因的获得可以采用基因合成、pcr扩增、提取染色体dna并建立文库等行业内公知的技术。本发明采用基因合成方法,将隐地蛋白(cryptogein)氨基酸序列送合成(中国苏州金唯智生物科技公司)。
实施例2、构建pvb-cryptogein-tev-hoc质粒
质粒的骨架来自puc18质粒。以puc18质粒为模板,使用kod高保真dna聚合酶以pcr方法扩增氨苄抗性基因和质粒复制区。pcr正向引物为puc18氨苄抗性基因上游序列中的18个碱基,反向引物则为puc18质粒复制区下游序列中18个碱基的反向互补序列。正、反向引物的5’端均添加了bglii限制性酶切位点。同时我们以t4噬菌体dna为模板,使用特异性引物通过pcr扩增获得了hoc蛋白基因片段,其中正向引物的5’端引入了tev蛋白酶的基因序列。再使用搭桥pcr将合成的cryptogein蛋白基因片段与tev-hoc蛋白基因片段融合成一个dna分子,其中cryptogein蛋白的编码区在tev-hoc融合蛋白基因的上游,且表达框一致。所得的cryptogein-tev-hoc融合重组蛋白dna序列的上游由pcr引物引入了soc启动子序列,而下游则引入了hoc终止子序列,并且在正、反向引物的5’端添加了bglii限制性酶切位点。
我们将上述方法获得的质粒骨架dna片段及cryptogein-tev-hoc融合重组蛋白基因片段经bglii限制性内切酶处理后,使用t4连接酶连接成环状dna并使用化学转化法转化进入大肠杆菌dh5α感受态细胞中。经细胞培养以及碱裂解法抽提质粒,获得了t4噬菌体同步展示质粒pvb-cryptogein-tev-hoc,质粒图谱见图1。该质粒序列的正确性经过了测序确认(中国苏州金唯智生物科技公司)。
实施例3、融合重组蛋白的体内表达及噬菌体展示
将t4噬菌体同步展示表达质粒pvb-cryptogein-tev-hoc以化学转化法转化进入大肠杆菌p301株系感受态细胞中,并在氨苄抗生素压力下,在37℃摇床中以200rpm的转速培养至细菌密度达到3×108个/ml。用hoc蛋白缺失的hoc-t4噬菌体(由美国天主教大学生物系rao教授实验室赠予)以moi(感染复数)=1侵染培养的大肠杆菌细胞,并继续在37℃摇床中以200rpm转速培养30min。在此过程中,cryptogein-tev-hoc重组蛋白在t4噬菌体颗粒装配通路的调控下表达,并展示在衣壳上。
展示完成后,培养液立即用预冷的离心管分装,并使用43000g离心力低温离心30min。离心后弃上清,以适量pi-mg缓冲液(3.7g/lna2hpo4、4g/lnacl、3g/lkh2po4、1mmmgso4)充分重悬沉淀,并加入dnasei至终浓度为10μg/ml以及数滴氯仿,在37℃以200rpm转速培养30min然后再以4300g离心去除细胞残骸,所得上清即为展示有重组蛋白的t4噬菌体颗粒悬浮液,见图2a。测定噬菌体滴度后,于4℃保存,滴度测试结果见表1。
表1三次重复实验噬菌体滴度测定结果
注:经对三次实验噬菌体展示实验的噬菌体滴度测试,并每次做三组组内平行。结果为噬斑数均在50-150pfu之间,该实验数据表明噬菌体的侵染不影响宿主的生长。
实施例4、cryptogein蛋白的分离
将展示有重组蛋白的t4噬菌体颗粒悬浮液(悬浮液体系是pi-mg缓冲液)使用43000g离心力低温离心30min,去除上清,然后以适量的tev蛋白酶1×反应缓冲液(50mmtri-hclph8.0,0.5mmedta,1mmddt)重悬。利用tev蛋白酶将cryptogein蛋白从上述展示有cryptogein-tev-hoc重组蛋白的t4噬菌体颗粒上分离出来。cryptogein蛋白具有热稳定性,根据tevproteaase说明书进行小量测试蛋白酶切效率后选定1000u的酶量30℃温育6h条件处理,再使用43000g离心力低温离心30min,上清即为cryptogein蛋白溶液,见图2。将cryptogein蛋白溶液补至50%的甘油并于-20℃长期保存。
实施例5、cryptogein蛋白对葡萄作物的应用及效果
选定福山东留公葡萄园品种为3年生“藤稔”葡萄作物,该作物栽培模式为设施促早栽培,株行距为0.6m×2.0m,葡萄园为壤土。土壤基础肥力水平如表2所示。试验时间为2017年1月至2017年6月,常规管理,除了处理不一样,其它农事操作均保持一致。
表2“藤稔”葡萄作物土壤基础肥力水平
选择长势一致的葡萄植株。设计以上述方法纯化的cryptogein蛋白(按终浓度50μg/ml喷雾施用)为实验组、稀释用的清水作为对照组,分别做2组组内平行。试验重复3次。每个处理30株,在葡萄萌芽期、花前10d左右、幼果发育期、果实软化期进行叶面喷施。同时选择花前10d左右、幼果发育期、果实软化期进行单次叶面喷施处理。于新梢生长期测定新梢的长度、粗度及节间长度,于果实成熟期每个处理采集15穗果实,进行果实品质测定。
表3不同处理下“藤稔”葡萄作物植物学性状
由表3可以看出喷施了cryptogein蛋白的“藤稔”葡萄其新梢的粗度较对照增加了20%,新梢的节间长度较对照增加19.04%,果穗重较对照增加23.3%,果粒重较对照增加28.48%,从新梢的粗度、新梢的节间长度、果穗重、果粒重来看,喷施cryptogein蛋白有利于促进葡萄节间长度的生长,增加葡萄粗度,提高葡萄的产量。
表4不同处理下“藤稔”葡萄作物生理性性状
由表4结果显示,与对照相比,蛋白免疫制剂不同程度的增加了果实可溶性固形物含量、总糖、维生素c含量,降低了果实的可滴定酸含量;其中可溶性固形物含量增加20%、总糖增加26.9%、维生素c增加30%,可滴定酸含量降低16%,可见隐地蛋白能有效提高农作物品质,增强其口感,提高其经济效益。
通过本次试验结果表明cryptogein隐地蛋白促进植物生长,植株健壮,各种主要的植物学和生理学指标都得到有效的提高。同时隐地蛋白无毒无污染,喷施简单易行,易被农户接受,便于推广。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!