与布鲁氏菌毒力相关的基因及其在布鲁氏菌毒力评价以及制备弱毒布鲁氏菌中的应用的制作方法
本发明涉及布鲁氏菌的一种新型毒力基因,还涉及该毒力基因在布鲁氏菌毒力评价以及制备弱毒布鲁氏菌中的应用。本发明属于生物技术领域。
背景技术:
布鲁氏菌(brucella)是一种重要的人兽共患病菌,可感染人和多种动物,其引起的疾病称为布鲁氏菌病。人感染布病后会出现关节痛、肌肉痛、波浪热等症状,部分患者可能出现脾肿大或淋巴结肿大、附睾炎和睾丸炎等。家畜感染后会引起公畜睾丸肿大、母畜流产等生殖系统疾病。该病流行范围广泛,几乎遍布世界各地。我国目前主要依靠减毒活疫苗预防该病,如羊种m5-90、牛种s19和猪种s2等。但这类疫苗仍存在毒力较强、可能引起动物流产及对人致病等缺点。为此,寻找新的毒力基因,用于致弱布鲁氏菌毒力有着重要的理论与实践意义。
布鲁氏菌被认为是没有典型毒力因子的病原,其毒力主要依赖于其逃避宿主免疫应答并在宿主细胞内持续存活的能力。巨噬细胞、胎盘滋养层细胞和树突状细胞是布鲁氏菌在宿主内存活复制的主要细胞。在布鲁氏菌内化感染的过程中,一些因子发挥着关键的作用,如四型分泌系统(t4ss)、双组分调控系统(tcs)、脂多糖(lps)和类鞭毛基因等。此外,一些参与金属元素代谢调控的基因也会影响布鲁氏菌的毒力,如缺失znua基因使布鲁氏菌营养成分的摄取能力减弱进而下调细菌毒力。
核糖体蛋白由于需要参与核糖体的装配和功能发挥通常是非常保守的。目前布鲁氏菌中研究较多的核糖体蛋白是l7/l12。有研究报道使用大肠杆菌(e.coli)脂质体(lipidliposome)包裹递送l7/l12重组蛋白为基础免疫小鼠能诱导产生细胞免疫,分泌特异性抗体,产生保护性免疫应答。到目前为止尚未有布鲁氏菌核糖体蛋白l31的相关研究报道。相关研究显示在枯草芽孢杆菌中核糖体蛋白l31与锌元素平衡有关,是核糖体的非必须组成部分,其储存锌的功能大于作为核糖体的组成部分。
本发明首次证实发现核糖体基因l31与布鲁氏菌毒力相关,对于布鲁氏菌新疫苗的研发,具有潜在的应用价值。
技术实现要素:
本发明的目的之一在于提供一种新型的与布鲁氏菌毒力相关的基因及其用途。
本发明的目的之二在于提供一种布鲁氏菌毒力基因检测试剂盒。
本发明的目的之三在于提供一种致弱的布鲁氏菌及其构建方法。
为了达到上述目的,本发明采用了以下技术手段:
一种与布鲁氏菌毒力相关的基因,所述的基因为编码布鲁氏菌核糖体蛋白l31的基因,其核苷酸序列如seqidno.1所示。
进一步的,本发明还提出了所述的与布鲁氏菌毒力相关的基因在布鲁氏菌毒力评价中的应用。以及
所述的与布鲁氏菌毒力相关的基因在制备弱毒布鲁氏菌中的应用。
更进一步的,本发明还提出了一种布鲁氏菌毒力基因检测试剂盒,含有用于扩增编码布鲁氏菌核糖体蛋白l31的基因的引物以及pcr试剂,所述的基因为编码布鲁氏菌核糖体蛋白l31的基因,其核苷酸序列如seqidno.1所示。
其中,优选的,所述的引物由上游引物和下游引物组成,上游引物的核苷酸序列如seqidno.10所示,下游引物的核苷酸序列如seqidno.11所示。
再进一步的,本发明还提出了一种致弱的布鲁氏菌所述的布鲁氏菌的基因组中不含有编码布鲁氏菌核糖体蛋白l31的基因。
其中,优选的,所述的致弱的布鲁氏菌通过以下方法制备得到:
(1)合成用于构建布鲁氏菌l31基因缺失株的引物:
l31_l-f:5’ggtgacactatagaactcgagaaaccgtgatcgatcatgcg3’
l31_l-r:5’gaacttctcaatcctgaaagtctgggg3’
l31_k-f:5’ctttcaggattgagaagttcaaatatgtatccgctcatgaga3’
l31_k-r:5’tcggatcagaagaactcgtcaagaaggc3’
l31_r-f:5’gacgagttcttctgatccgaattgcatctgatttgaa3’
l31_r-r:5’tatagggagaccggcagatctggcgccgaagacgtgcag3’
l31yan_f:5’atcacaaagaaataacgcaggcccg3’
l31yan_r:5’ctcggtttccttcatgttcgatcgc3’
(2)自杀质粒的构建
以布鲁氏菌基因组dna为模板,使用引物l31_l-f、l31_l-r和l31_r-f、l31_r-r分别pcr扩增l31基因n端、c端同源臂;以pblue-kanr为模板,使用引物l31_k-f和l31_k-r扩增kanr表达盒;用xhoi和bglⅱ双酶切psp72载体,切胶回收以上三段目的片段,连接产物转化至感受态细胞中,涂布kanr抗性平板,筛选阳性克隆,得到的阳性克隆命名为psp72-δl31-k;
(3)自杀质粒的电击转化及l31基因缺失株的鉴定筛选
将psp72-δl31-k电转入布鲁氏菌感受态细胞中,筛选获得只有卡那抗性阳性克隆,对筛选到的候选缺失株划线传代,检测其稳定性,利用引物l31yan_f和l31yan_r完成pcr鉴定,并进一步测序鉴定,选取阳性菌株扩大培养后保存,得到致弱的布鲁氏菌,命名为m28δl31。
相较于现有技术,本发明的有益效果是:
布鲁氏菌被认为是没有典型毒力因子的病原,其毒力主要依赖于其逃避宿主免疫应答并在宿主细胞内持续存活的能力。本发明提出了一种新型的与布鲁氏菌毒力相关的基因,通过敲除该基因构建了布鲁氏菌l31基因缺失株m28δl31,实验证明l31基因不会对布鲁氏菌的生长造成显著影响,属生长非必须基因。缺失株m28δl31与野生株相比,宿主细胞内存活能力在感染8h和24h无显著性下降,但在感染48h时缺失株胞内存活能力极显著下降。感染小鼠7d时,m28和m28δl31感染小鼠的脾重均呈相似的上升趋势。在感染后21d和35d时m28δl31感染小鼠脾重与野生株相比均呈极显著下降。m28δl31所感染小鼠与m28感染小鼠相比除21d时(p<0.05)显著下降,在感染后3d、7d和35d脾脏载菌量均呈极显著下降(p<0.01),证明布鲁氏菌l31基因与布鲁氏菌的毒力相关。通过对该基因的检测,能够对布鲁氏菌的毒力进行评价,并且通过敲除该基因或降低该基因的表达水平能够制备得到毒力显著下降的布鲁氏菌,本发明的提出为布鲁氏菌新疫苗的研发提供了新的技术手段。
附图说明
图1为自杀质粒与回补质粒的构建与鉴定;
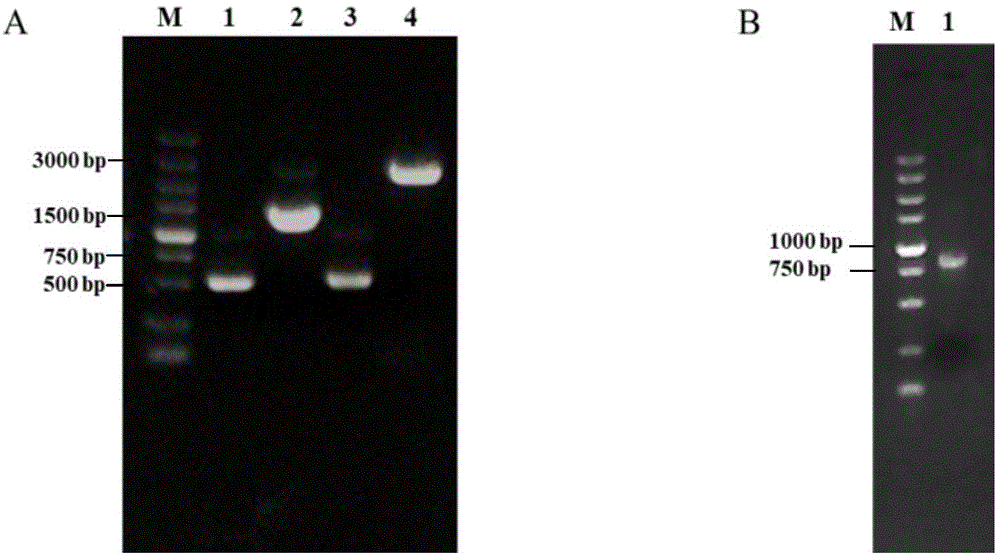
(a)psp72-δl31-k质粒的构建与鉴定:m:dnamarkerdl5000,1-3:l31左同源臂、kan基因、l31右同源臂;4:重组质粒psp72-δl31-k的pcr扩增鉴定;(b)pcr扩增鉴定质粒pbbr1mcs4-l31:m:dnamarkerdl5000,1:重组质粒pbbr1mcs4-l31的pcr扩增鉴定;
图2为m28δl31缺失株与m28δl31-c回补株的pcr鉴定;
(a)m28δl31缺失株pcr鉴定:m:dnamarkerdl5000,1:m28δl31,2:m28;(b)m28δl31-c回补株pcr鉴定:m:dnamarkerdl5000,1:m28δl31,2:m28δl31-c;
图3为m28和m28δl31的生长曲线测定;
图4为l31影响布鲁氏菌胞内存活能力(**:p<0.01,***:p<0.001);
图5为l31影响布鲁氏菌对小鼠的致病力(*:p<0.05;**:p<0.01;***:p<0.001);(a)l31对小鼠脾重的影响;(b)l31对小鼠脾载菌量的影响。
具体实施方式
下面结合具体实例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
实施例1
1材料与方法
1.1菌株、质粒与载体
布鲁氏菌m28由中国农业科学院哈尔滨兽医研究所生物安全三级实验室保存,质粒psp72、pblue-kanr(记载在“酿酒酵母erg6基因缺失突变株的构建,《西北农业学报》2012年第03期,雷洁等”文献中,由中国农业科学院哈尔滨兽医研究所保存提供。)和pbbr1mcs-4均为本实验室保存。dh5α感受态细胞购自南京诺唯赞。6-7周龄spf级balb/c小鼠购自北京维通利华实验动物技术有限公司。所有涉及布鲁氏菌菌株及其致病性的实验均在生物安全三级实验室进行。
1.2试剂
tsb和tsa培养基购自bd公司。brucellaselectivesupplement购自oxoid。
1.3方法
1.31引物设计及合成
根据genbank中m28基因注释信息设计合成用于构建l31基因缺失株及回补株的引物,引物均由哈尔滨博仕生物技术有限公司合成(表1)。
表1构建l31缺失株及回补株引物
1.3.2m28δl31基因缺失株的构建
1.3.2.1自杀质粒的构建
按如下实验步骤构建自杀质粒:以m28基因组dna为模板,使用引物l31_l-f、l31_l-r和l31_r-f、l31_r-r分别pcr扩增l31基因(seqidno.1)n端、c端同源臂;以pblue-kanr为模板,使用引物l31_k-f和l31_k-r扩增kanr表达盒;用xhoi和bglⅱ双酶切psp72载体。切胶回收以上三段目的片段,具体操作参照omegagelextractionkit。使用
使用移液器吹打混匀,37℃反应30min,冰浴5min,保存于-20℃待用。取20μl反应液加入到200μl感受态细胞中,按照常规方式转化,涂布kanr抗性平板,pcr鉴定挑取的单克隆,筛选阳性克隆送样博仕生物公司测序。
1.3.2.2布鲁氏菌m28电击感受态制备
取-80℃保存的菌种,接种到5mltsb培养基中,37℃震荡培养至对数晚期,活化后转接至200ml的tsb培养基中,震荡培养至od600=1.0。冰浴30min后4℃6000rpm离心5min,收集菌体沉淀,使用10%的甘油水溶液反复洗涤3次,最后收集菌体沉淀,加入适当体积的10%甘油水溶液,按照每支100μl分装,保存于-80℃待用。
1.3.2.3自杀质粒的电击转化及l31基因缺失株的鉴定筛选
将psp72-δl31-k与100μl感受态细胞充分混匀,预冷15min,使用0.1cm的转化杯,电击转化仪电击后迅速将其转移至900μl的soc培养基中,37℃振荡培养活化4h,全部涂布到卡那抗性(50μg/ml)的tsa培养基上,3~5天后观察菌落情况。
将卡那抗性的菌落分别划线接种至含有卡那抗性(50μg/ml)和氨苄抗性(50μg/ml)的tsa培养基,进一步筛选确定阳性克隆。筛选到的阳性克隆应只有卡那抗性,对筛选到的候选缺失株划线传代20代,检测其稳定性。取新鲜培养的候选缺失株,使用细菌基因组dna提取试剂盒(天根)完成基因组dna提取。利用引物l31yan_f和l31yan_r完成pcr鉴定,并进一步测序鉴定。选取阳性菌株扩大培养后保存,命名为m28δl31。
1.3.3m28δl31-c回补菌株的构建
1.3.3.1l31回补质粒的构建
与自杀质粒的构建方式相似,设计同源引物l31mcs4_f和l31mcs4_r,pcr扩增l31片段并切胶纯化回收。ecori和kpni双酶切pbbr1mcs-4,并切胶纯化回收。按照
使用移液器吹打混匀各组分,置于37℃反应30min,反应结束后立即冰浴5min。取20μl反应液加入到200μl感受态细胞中,按照常规方式完成转化,涂布氨苄抗性(50μg/ml)的tsa平板,挑取单克隆经pcr鉴定后,送样博仕生物测序。对测序正确的的质粒按照qiagen质粒中提试剂盒说明提取质粒,保存备用。
1.3.3.2布鲁氏菌m28δl31电击感受态制备
制备方法与m28电击感受态的制备相似,详见本章1.3.2.2。简述如下:取-80℃保存的m28δl31菌株,活化后转接扩大培养,震荡培养至od600=1.0。冰浴后4℃6000rpm离心5min,收集菌体沉淀,反复洗涤3次,收集菌体沉淀,用适当体积的10%甘油水溶液重悬,按照每支100μl分装,标记并保存于-80℃待用。
1.3.3.3回补质粒的电击转化及l31回补株的鉴定筛选
采用与构建缺失株同样的方法电击转化pbbr-l31质粒至缺失株中,详见1.3.2.3节。选取氨苄抗性的平皿进行筛选,对挑取的单克隆菌株连续传代后应用pcr的方法进行鉴定,构建成功的回补株命名为m28δl31-c并标记保存。
1.3.3.4m28δl31生长曲线的测定
挑取活化后的单菌落接种到tsb液体培养基中,振荡培养至od600=0.5,按照1:10的比例接种至新的摇菌管中,每支试管接种4mltsb,37℃210rpm振荡培养,每隔8h(8h、16h、24h、32h、40h、48h、56h、64h)测定一次od600值,绘制完成生长曲线。
1.3.3.5l31对布鲁氏菌m28在巨噬细胞内复制能力的影响
在24孔板中培养raw264.7鼠巨噬细胞,待其形成70%左右的单层细胞时,将布鲁氏菌m28、m28δl31和m28δl31-c以moi=100的比例感染细胞。1000rpm水平离心5min,在37℃含5%co2细胞培养箱中孵育3h。用pbs洗涤三次,洗去未感染细胞的胞外菌,加入含有5μg/ml庆大霉素、5%dmem培养基维持感染,直到24h时弃掉的培养基,pbs洗涤三次后加入新培养基,维持感染到48h。在感染后不同时间点(8h、24h和48h)取样。pbs洗涤三次,加入冷的含有0.1%的tritonx-100裂解细胞,1:10倍比稀释,涂板计数活菌量。
1.3.3.6l31对布鲁氏菌m28在小鼠体内复制能力的影响
将96只6-7周龄雌性的spf级balb/c小鼠,平均分为四组(24只/组),其中每个时间点每组6只。分别腹腔注射100μl布鲁氏菌m28、m28δl31、m28δl31-c和pbs,接种剂量为1×106cfu/只。在感染后3d、7d、21d和35d时无菌取脾称重,加入1ml含0.1%tritonx-100的pbs,使用组织研磨机研磨,1:10倍比稀释后,取100μl涂布于tsa平板,37℃培养计数。
2结果
2.1psp72-δl31-k自杀质粒与pbbr1mcs4-l31回补质粒的鉴定
采用pcr扩增和质粒测序的方式完成自杀质粒与回补质粒的鉴定。自杀质粒含有l31基因上下游片段和卡那霉素表达盒,使用一步法克隆后其总长度约为2258bp。如图1a所示,使用引物l31_l-f和l31_r-r进pcr验证后扩增结果与预期一致,自杀质粒命名为psp72-δl31-k。
以野生株m28基因组为模板,pcr扩增l31基因包含其启动子区和终止子区,扩增大小约为888bp,与预期大小相一致(图1b)。pcr鉴定后的质粒送测序,确定无突变且序列一致,回补质粒命名为pbbr1mcs4-l31。
2.2m28δl31缺失株与m28δl31-c回补株的鉴定
经卡那霉素和氨苄霉素筛选后,获得仅有卡那霉素抗性的缺失菌株。设计位于缺失基因l31左右同源臂外侧基因组上一对鉴定引物l31yan_f和l31yan_r,以m28δl31基因组为模板,扩增鉴定筛选到的缺失株。扩增结果显示,缺失株扩增出约2458bp大小的片段,而野生株可扩增到大小为1417bp的片段,说明l31基因已被卡那霉素基因代替,成功被缺失(图2a)。
为了进一步验证l31的功能我们构建了l31回补株。将构建成功的pbbr1mcs4-l31质粒电转导入m28δl31缺失株中,筛选到同时具有氨苄抗性与卡那霉素抗性的回补菌株,以其基因组为模板使用引物l31genef、l31gener,扩增l31基因全长得到大小为222bp的目的片段,说明具有回补基因的质粒被成功导入缺失株中(图2b)。
2.3m28δl31生长曲线的绘制
比较m28和m28δl31生长曲线的差异,结果显示m28δl31在对数期生长稍弱于野生株m28,对数晚期趋于相近,在平台期时m28δl31的生长速度稍强于m28,总体而言差异并不显著(图3)。结果表明l31基因不会对m28生长造成显著影响,属生长非必须基因。
2.4l31对布鲁氏菌m28在巨噬细胞内存活能力的影响
为了检测l31基因的缺失是否会对布鲁氏菌m28的胞内存活能力有影响,本实验以raw264.7小鼠巨噬细胞为模型,分别检测了野生株m28、缺失株m28δl31和回补株m28δl31-c在感染细胞后8h、24h和48h时胞内活菌数。结果表明,在感染24h以内,缺失株m28δl31与野生株m28相比胞内存活能力无显著性下降,但在感染48h时缺失株胞内存活能力极显著下降(p<0.001)(图4)。与野生株m28相比回补株在8h、24h和48h时胞内存活能力均极显著上升(p<0.001)(图4)。
2.5l31对布鲁氏菌m28在小鼠体内复制能力的影响
将m28、m28δl31和m28δl31-c按照1×106cfu/只的剂量,腹腔注射感染6-7周龄的雌性spf级balb/c小鼠,在感染后3d、7d、21d和35d后处死,无菌取脾,称重并研磨计数,测定其脾重和脾载菌量以衡量不同菌株在小鼠体内存活能力。结果显示,在感染后7dm28、m28δl31感染小鼠的脾重均呈相似的上升趋势,在感染后21d和35d时m28δl31感染小鼠脾重与野生株相比均呈极显著下降(p<0.01),回补株m28δl31-c小鼠脾重与野生株的趋势相似,并无显著差异(图5a)。m28δl31所感染小鼠与m28感染小鼠相比除21d时(p<0.05)在感染后3d、7d和35d脾载菌量均呈极显著下降(p<0.01)。回补株m28δl31-c脾载菌量与m28相似,说明成功将l31基因回补(图5b)。
序列表
<110>中国农业科学院哈尔滨兽医研究所(中国动物卫生与流行病学中心哈尔滨分中心)
<120>与布鲁氏菌毒力相关的基因及其在布鲁氏菌毒力评价以及制备弱毒布鲁氏菌中的应用
<130>klpi180959
<160>13
<170>patentinversion3.3
<210>1
<211>222
<212>dna
<213>l31
<400>1
atgaaagccaatatccatcccgactaccacaccatcaaggtcgtgatgaccgatggcacc60
gaatacatgacccgctcgacctggggcaaggaaggcgatacgatgaacctcgatatcgac120
ccgaccacgcacccggcctggacgggcggctcgcagaccctgcttgatcgcggcggccgt180
gtcaccaagttcaagaaccgtttcggcaatctcggcatctga222
<210>2
<211>41
<212>dna
<213>artificialsequence
<400>2
ggtgacactatagaactcgagaaaccgtgatcgatcatgcg41
<210>3
<211>27
<212>dna
<213>artificialsequence
<400>3
gaacttctcaatcctgaaagtctgggg27
<210>4
<211>42
<212>dna
<213>artificialsequence
<400>4
ctttcaggattgagaagttcaaatatgtatccgctcatgaga42
<210>5
<211>28
<212>dna
<213>artificialsequence
<400>5
tcggatcagaagaactcgtcaagaaggc28
<210>6
<211>37
<212>dna
<213>artificialsequence
<400>6
gacgagttcttctgatccgaattgcatctgatttgaa37
<210>7
<211>39
<212>dna
<213>artificialsequence
<400>7
tatagggagaccggcagatctggcgccgaagacgtgcag39
<210>8
<211>25
<212>dna
<213>artificialsequence
<400>8
atcacaaagaaataacgcaggcccg25
<210>9
<211>25
<212>dna
<213>artificialsequence
<400>9
ctcggtttccttcatgttcgatcgc25
<210>10
<211>46
<212>dna
<213>artificialsequence
<400>10
agggaacaaaagctgggtaccatcgatcatgcgccgcagcgccacc46
<210>11
<211>46
<212>dna
<213>artificialsequence
<400>11
tcccccgggctgcaggaattcctctaatcttttgttttgacgcgca46
<210>12
<211>25
<212>dna
<213>artificialsequence
<400>12
atgaaagccaatatccatcccgact25
<210>13
<211>25
<212>dna
<213>artificialsequence
<400>13
tcagatgccgagattgccgaaacgg25
- 还没有人留言评论。精彩留言会获得点赞!