一种D-氨基酸氧化酶突变体及其应用的制作方法
本发明涉及生物
技术领域:
,尤其涉及一种d-氨基酸氧化酶突变体及其应用。
背景技术:
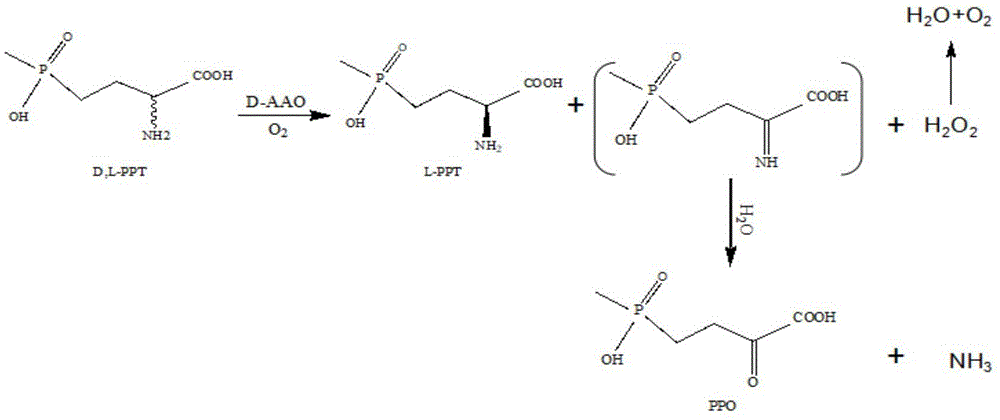
:草铵膦,又名草丁膦,英文名为phosphinothricin(简称ppt),化学名为2-氨基-4-[羟基(甲基)膦酰基]丁酸,是世界第二大转基因作物耐受除草剂,由赫斯特公司(几经合并后现归属拜耳公司)开发生产。草铵膦属膦酸类除草剂,是谷氨酰胺合成酶抑制剂,非选择性(灭生性)触杀型除草剂。众所周知,灭生性除草剂市场巨大。目前,世界三大除草剂分别为百草枯,草甘膦,草铵膦。在市场使用方面,草甘膦独占鳌头,但是由于其长期使用,使得大量杂草产生抗性,而草甘膦也趋于失效;百草枯由于其剧毒性,已被列入《鹿特丹公约》,全球越来越多国家禁用或限用,中国农业部已发布公告说明,百草枯在2014年7月1日停止生产,2016年7月1日禁止使用。目前,草铵膦产量虽小,却具有优异的除草性能和较小的药害副作用,因此,在未来一段时间内拥有巨大的市场潜力。草铵膦由两种光学异构体,分别为l-草铵膦和d-草铵膦;但只有l-型具有除草活性,且在土壤中易分解,对人类和动物的毒性较小,除草谱广,对环境的破坏力小。目前,市场上销售的草铵膦一般都是外消旋混合物。若草铵膦产品能以l-构型的纯光学异构体形式使用,可显著降低草铵膦的使用量,这对于提高原子经济性、降低使用成本、减轻环境压力具有重要意义。手性纯l-草铵膦的主要制备方法主要由三种:手性拆分法,化学合成法和生物催化法。手性拆分法是通过对外消旋d,l-草铵膦或其衍生物进行手性拆分,实现d型和l型异构体的分离,从而得到光学纯的l-草铵膦。此工艺主要存在以下缺点:需要使用昂贵手性拆分试剂、理论收率只能达到50%、单次拆分率低、工艺比较复杂。化学合成法是从手性原料出发合成光学纯l-草铵膦。化学不对称合成法工艺步骤多、收率低,手性原料昂贵导致生产成本高,不利于大规模制备l-草铵膦。生物催化法生产草铵膦则具有立体选择性严格、反应条件温和、收率高等优点,是生产l-草铵膦的优势方法。主要包括以下三类:(1)以l-草铵膦的衍生物为底物,通过酶法直接水解获得,主要优点是转化率高,产物ee值较高,但需要昂贵且不易获得的手性原料为前体。(2)以外消旋草铵膦的前体为底物,通过酶的选择性拆分获得。主要优点为原料相对易得,催化剂活力高,但是理论收率只能达到50%,造成原料浪费。(3)以d,l-草铵膦为原料,经d-氨基酸氧化酶催化d-草铵膦得到l-草铵膦前体2-羰基-4-[羟基(甲基)膦酰基]丁酸,再经氨基酸脱氢酶或转氨酶催化得到l-草铵膦。早在研究草铵膦在土壤微生物的代谢途径中就已经发现l-草铵膦在酶的作用下会被分解成2-羰基-4-[羟基(甲基)膦酰基]丁酸。因此,以2-羰基-4-[羟基(甲基)膦酰基]丁酸为底物,经酶法可逆催化生成l-草铵膦不失为一个好方法。d-氨基酸氧化酶是一类特异选择性的将d-氨基酸及其衍生物催化生成α-酮酸的酶,反应由其本身自带的辅酶fad催化完成,因其表现出的优良催化效率和选择性,d-氨基酸氧化酶被广泛用于生物拆分l-氨基酸和α酮酸的生产。例如,d-氨基酸氧化酶转化头孢菌素c为戊二酰-7-氨基头孢烯酸。技术实现要素:本发明针对现有l-草铵膦工艺合成存在的缺陷,提供了一种d-氨基酸氧化酶突变体及其应用;该突变体具有高酶活、高转化率的特点,可高效制备4-(羟基甲基磷酰基)-2-羰基-丁酸,催化获得的产物收率高,产物可作为底物直接一锅法继续生产l-草铵膦。具体技术方案如下:一种d-氨基酸氧化酶突变体,为下列之一:(1)将seqidno.1所示氨基酸第213位的蛋氨酸突变为丝氨酸,第54位的天门冬酰胺突变为缬氨酸,第58位的苯丙氨酸突变为谷氨酰胺;(2)将seqidno.1所示氨基酸第213位的蛋氨酸突变为丝氨酸,第54位的天门冬酰胺突变为缬氨酸,第58位的苯丙氨酸突变为谷氨酰胺,第52位的甘氨酸突变为亮氨酸;(3)将seqidno.1所示氨基酸第213位的蛋氨酸突变为丝氨酸,第54位的天门冬酰胺突变为缬氨酸,第58位的苯丙氨酸突变为谷氨酰胺,第52位的甘氨酸突变为亮氨酸,第335位的丝氨酸突变为苏氨酸或甘氨酸。(4)将seqidno.1所示氨基酸第213位的蛋氨酸突变为丝氨酸,第54位的天门冬酰胺突变为缬氨酸,第58位的苯丙氨酸突变为谷氨酰胺,第335位的丝氨酸突变为甘氨酸。本发明通过构建d-氨基酸氧化酶突变体文库,获得了具有较高酶活和产物转化率的d-氨基酸氧化酶突变体,进而提供了d-氨基酸氧化酶重组菌在制备l-草铵膦前体2-羰基-4-[羟基(甲基)膦酰基]丁酸中的应用。本发明中,所述野生菌d-氨基酸氧化酶的ncbi登录号为alm22233.1;其氨基酸序列如seqidno.1所示,核苷酸序列如seqidno.2所示。作为优选,所述d-氨基酸氧化酶突变体为将seqidno.1所示氨基酸第213位的蛋氨酸突变为丝氨酸,第54位的天门冬酰胺突变为缬氨酸,第58位的苯丙氨酸突变为谷氨酰胺,第52位的甘氨酸突变为亮氨酸,第335位的丝氨酸突变为甘氨酸。本发明提供了一种所述d-氨基酸氧化酶突变体的编码基因。本发明还提供了所述编码基因的重组载体和基因工程菌。优选重组表达载体pet-24a(+);宿主细胞优选大肠杆菌e.colibl21(de3),通过蛋白诱导表达、细胞破碎,获得粗酶液。本发明还提供了所述的d-氨基酸氧化酶突变体在催化d,l-草铵膦或d-草铵膦合成4-(羟基甲基磷酰基)-2-羰基-丁酸中的应用。本发明还提供了一种制备4-(羟基甲基磷酰基)-2-羰基-丁酸的方法,包括:以d,l-草铵膦或d-草铵膦为底物,fad为辅酶,向缓冲溶液中加入过氧化氢酶后,在催化剂的作用下,进行反应,反应液分离纯化后,得到4-(羟基甲基磷酰基)-2-羰基-丁酸;所述催化剂为d-氨基酸氧化酶突变体或包含d-氨基酸氧化酶突变体基因的基因工程菌及其粗酶液。具体的,上述方法的添加方法为:配置一定浓度的d,l-草铵膦溶液,再以酶活力为单位,加入d-氨基酸氧化酶突变体或包含d-氨基酸氧化酶突变体基因的基因工程菌及其粗酶液,过氧化氢酶,恒温震荡,直至d-草铵膦完全氧化,经检测d-氨基酸氧化酶突变体催化特性。进一步地,反应体系中,d-氨基酸氧化酶的添加量为0.1~100u/l,过氧化氢酶的添加量为0.1~100u/l,底物的初始浓度为10~500mm。进一步地,反应的温度为30~50℃,时间为6~72小时;更优选的,反应温度为25~35℃,时间为6~24小时。进一步地,反应体系的ph值为6~9,缓冲溶液为磷酸盐缓冲液,反应过程中需要通入空气或氧气。与现有技术相比,本发明具有以下有益效果:(1)本发明通过利用随机突变及定点饱和突变技术对seqidno.2所示的d-氨基酸氧化酶基因进行突变,发现第52位、第54位、第58位、第213位和第335位是影响酶活的关键位点,获得酶活和产物转化率远高于野生型d-氨基酸氧化酶基因的突变体,提高了4-(羟基甲基磷酰基)-2-羰基-丁酸生产工艺中的收率;4-(羟基甲基磷酰基)-2-羰基-丁酸又可以被继续催化还原为l-草铵膦,进而实现d,l-草铵膦的原位去消旋化。(2)本发明提供的4-(羟基甲基磷酰基)-2-羰基-丁酸制备方法仅需添加2g/l的过氧化氢酶,显著降低了过氧化氢酶的添加量(一般为50g/l),说明该氨基酸氧化酶突变体的过氧化氢耐受性高,有利于后续工业化应用。(3)本发明提供的4-(羟基甲基磷酰基)-2-羰基-丁酸制备方法能够直接以d,l-草铵膦为底物进行拆分,无需昂贵的拆分试剂,也无需合成草铵膦衍生物,更无需对d-草铵膦进行分离、再消旋、再拆分等步骤;在突变体e7的作用下,最高的转化率为48.4%(最大理论转化率为50%)为目前报道的最高水平,具有较好的应用价值。(4)本发明提供的4-(羟基甲基磷酰基)-2-羰基-丁酸制备方法克服了化学法合成l-草铵膦前体2-羰基-4-[羟基(甲基)膦酰基]丁酸的缺陷,是一种绿色,环保,低碳的工艺路线,适合大规模工业化生产应用。附图说明图1为d-氨基酸氧化酶催化d-草铵膦产生2-羰基-4-[羟基(甲基)膦酰基]丁酸以及氨气和过氧化氢的反应式。图2为产物2-羰基-4-[羟基(甲基)膦酰基]丁酸在不同介质,不同浓度下,与显色剂2,4-二硝基苯肼在380nm处的吸光值。图3为实施例7的反应进程图。图4为实施例7中d-氨基酸氧化酶菌体细胞液、粗酶液和纯酶的sds-page电泳图,其中,泳道1:10-180kda标准蛋白分子量;泳道2:200mm咪唑洗脱的纯酶;泳道3:粗酶液;泳道4:相同浓度的湿菌体。具体实施方式以下结合具体实施例,对本发明做进一步说明。应理解,以下实施例仅用于说明本发明而非用于限制本发明的范围。本实验中的实验方法如无特别说明均为常规方法。上游基因工程所用试剂:本发明实施例中使用的基因组提取试剂盒、质粒提取试剂盒、dna纯化回收试剂盒购自康宁生命科学(吴江)有限公司;e.colidh5α、e.colibl21(de3)、质粒pet-24a(+)等购自上海旭冠生物科技发展有限公司;dnamarker、低分子量标准蛋白、蛋白胶等购自北京genstar有限公司;引物合成,序列测序工作由杭州擎科梓熙生物技术有限公司完成。以上试剂使用方法参考商品说明书。下游催化工艺所用试剂2-羰基-4-[羟基(甲基)膦酰基]丁酸(简称ppo)为实验室合成,也可市售获得;d,l-草铵膦购自sigma-aldrich公司;其他常用试剂购自国药集团化学试剂有限公司。下列实施例通过高效液相色谱(hplc)检测反应的进行产物的检测,并对产物进行分析。hplc分析方法为:色谱柱/c18;柱温/30℃;流速/1ml/min;检测波长/232nm;流动相:50mm(nh2)hpo4,加入1%的10%的四丁基溴化铵水溶液,用磷酸调ph至3.8,加入12%的乙腈。通过手性hplc分析方法检查草铵膦的两个构型含量。具体的,手性hplc分析方法为:色谱柱/pntulipsqs-c18;流动相/50mm乙酸铵溶液:甲醇=9:1;检测波长/338nm;流速/1ml/min;柱温/30℃。衍生化试剂:分别称取0.1g邻苯二甲醛与0.12gn-乙酰-l-半胱氨酸,用10ml乙醇助溶,在加入40ml0.1m硼酸缓冲液(ph)9.8。振荡使其充分溶解,4℃冰箱保存备用(不超过3天)。衍生化反应与测定:取200μl样品加入400μl衍生化试剂,混匀至30℃保温5min,加入400μl超纯水混合,进样10μl进行分析。d-草铵膦(简称d-ppt)的结构式如式(1)所示;l-草铵膦(简称l-ppt)的结构式如式(2)所示;2-羰基-4-[羟基(甲基)膦酰基]丁酸(简称ppo)的结构式如式(3)所示。实施例1d-氨基酸氧化酶突变体文库的构建及筛选将d-氨基酸氧化酶基因(氨基酸序列seqidno.1所示,核苷酸序列为seqidno.2所示)构建表达载体pet-24a(+),转化大肠杆菌,获得出发菌株e.colibl21(de3)/pet-24a。d-氨基酸氧化酶突变体文库的制备通过5轮突变来实现,引物设计如表1所示。具体方法如下:第一轮,以野生菌纤细红酵母菌(rhodotorulagracilis)的基因组为模板,以eppcr-f和eppcr-r为上下游引物,经易错pcr,转化,涂平板,通过优势菌株筛选、测序发现了有益突变位点213、54、58、52、335。第二轮,以野生菌纤细红酵母菌(rhodotorulagracilis)的基因组为模板,以m213-f和m213-r为上下游引物,经定点饱和突变、转化、涂平板,通过优势菌株筛选、获得d-氨基酸氧化酶突变体prtdaao-m213s。第三轮,以氨基酸序列seqidno.1对应的突变体prtdaao-m213s为模板,以n5458-f和n5458-r为引物,经定点饱和突变pcr,转化,涂平板,通过优势菌株筛选,获得d-氨基酸氧化酶突变体prtdaao-m213s-n54v-f58q。第四轮,以突变体prtdaao-m213s-n54v-f58q为模板,以g52-f和g52-r为引物,经定点饱和突变pcr,转化,涂平板,通过优势菌株筛选,获得d-氨基酸氧化酶突变体prtdaao-m213s-n54v-f58q-g52l。第五轮,以突变体prtdaao-m213s-n54v-f58q-g52l为模板,以s335-f和s335-r为引物,经定点饱和突变pcr,转化,涂平板,通过优势菌株筛选,获得d-氨基酸氧化酶突变体prtdaao-m213s-n54v-f58q-g52l-s335g。表1d-氨基酸氧化酶突变引物设计注:n5458是指第54位和第58位共用相同的引物。其中,pcr反应体系如下:2×phantamax缓冲液:25μl;dntps:1μl;上游引物:1μl;下游引物:1μl;模板:0.5μl;phantasuper-fidelitydna聚合酶:0.5μl;ddh2o:21μl。pcr反应条件如下:1)预变性:95℃3min;2)变性:95℃15s;退火:56℃-68℃30s;延伸:72℃6min;共循环30次3)后延伸:72℃10min;4)4℃保存。将pcr结果分别进行dna琼脂糖凝胶电泳阳性验证,结果显示扩增产物为单一条带,大小分别为6400bp左右。将pcr产物进行dpni酶消化模板。将pcr产物转化到大肠杆菌bl21中,首先吸取8ul的pcr产物,加入到bl21的感受态细胞中,冰浴30min,热击90s,冰浴3min,加600ul的lb培养基,培养1h,涂布于含50μg/ml卡那霉素抗性的lb平板上,37℃倒置培养过夜,挑取单菌落到96孔板中,进行培养,进行高通量筛选。实施例2高通量筛选方法的构建以d,l-草铵膦为底物,通过2,4-二硝基苯肼显色法筛选对d-草铵膦有催化活力的酶。定量称取d,l-草铵膦到50mmph=8的磷酸盐缓冲液中,至于反应容器中,使得d,l-草铵膦的终浓度为50mm,粗酶液浓度为50g/l,过氧化氢酶浓度为2g/l。通过水浴控制反应温度为30℃,定时取样。通过2,4-二硝基苯肼显色法检测2-羰基-4-[羟基(甲基)膦酰基]丁酸的含量:取60μl的反应液,加入2mm的2,4-二硝基苯肼40μl,37℃恒温槽保温20分钟,加入100μl1m氢氧化钠,混匀30s,生成红棕色的化合物2,4-二硝基苯棕,并且,随着2-羰基-4-[羟基(甲基)膦酰基]丁酸浓度的升高,红棕色化合物颜色加深。对反应液进行全波长扫描,显示在380nm处有最大光吸收值,并在0.05-1mm范围内成线性。为了准确的测量出2-羰基-4-[羟基(甲基)膦酰基]丁酸和显色剂2,4-二硝基苯肼(dnph)在碱性条件下生成红棕色化合物的含量,分别测定了2-羰基-4-[羟基(甲基)膦酰基]丁酸在水,d,l-草铵膦溶液,铵根离子溶液和菌液为介质按上文所述方法与显色剂dnph反应后,在碱性条件下生成红棕色化合物的最大吸收波长。结果显示:2-羰基-4-[羟基(甲基)膦酰基]丁酸在四种不同介质下在380nm处均有最大光吸收值,并成线性关系,结果参见附图2。由此,确定该方法可以作为高通量筛选d-草铵膦氧化酶的有效方法。对实施例1中的突变体进行高通量筛选,得到优势菌株如下表表2d-氨基酸氧化酶突变体优势菌株对高通量筛选结果进行液相检测,液相检测条件:色谱柱c18(4.6×250mm)柱;流动相:将50mm磷酸二氢胺溶于800ml超纯水中,加入10ml四丁基氢氧化铵(10%)用水稀释并定容至1000ml,用磷酸调ph到3.8,与乙腈以88:12混合。流速:1ml/min,检测波长为232nm,进样量10μl,柱温30℃。选取e4,e5,e7,e8,e9进行液相检测,检测结果为e7>e8>e5>e9>e4,与高通量筛选结果一致。实施例3菌体的培养及突变体的纯化一、菌体的培养将含有d-氨基酸氧化酶基因的工程菌经平皿划线活化后,挑单菌落接种至含有50μg/ml卡那霉素的5mllb液体培养基中,37℃震荡培养12h。按2%的接种量转接至50ml同样含有50μg/ml卡那霉素的lb液体培养基中,37℃震荡培养至od600达到0.8左右时,加入终浓度为0.5mm的iptg,28℃下震荡培养16h。培养结束后,将培养液8000rpm离心10min,弃上清,收集菌体,放到-80℃超低温冰箱中保存,待用。二、粗酶液的制备将培养结束后收集的菌体用ph8的磷酸盐缓冲液(pbs(50mm))洗涤两次,之后,将菌体加入ph8的pbs(50mm)重悬细胞,在冰水混合物上破碎30次,超声破碎条件:功率为400w,破碎2s,间歇5s。将此细胞破碎液于4℃离心10min,去除沉淀,得到的上清,即为重组d-氨基酸氧化酶的粗酶液。三、d-氨基酸氧化酶的纯化将粗酶液与经上样缓冲液(ph8pbs(50mm),其中包含500mmnacl、20mm咪唑)平衡过的ni亲和层析树脂结合后,再用冲洗缓冲液(50mm,ph8pbs,其中包含50mm咪唑、500mmnacl)冲洗至基本无杂蛋白,随后以洗脱缓冲液(50mm,ph8pbs,其中包含200mm咪唑、500mmnacl)洗脱并收集目的蛋白,电泳鉴定纯度后合并目的蛋白并以透析缓冲液(50mm,ph8pbs)透析24h,取截留液采用考马斯亮蓝法测定蛋白含量为2.7mg/ml,将酶液稀释至终浓度为0.5mg/ml分装,冻存于-80℃,即获得重组d-氨基酸氧化酶纯酶。所得d-氨基酸氧化酶菌体细胞液,粗酶液和纯酶的sds-page电泳图见附图4。实施例4d-氨基酸氧化酶活力的测定酶活定义:1961年国际酶学会议规定,1个酶活力单位是指在特定条件(30℃)下,在1分钟内转化1微摩尔底物的酶量,或是转化底物中的1微摩尔的有关基团的酶量。d-氨基酸氧化酶的酶活测定:取溶于50mm的磷酸盐缓冲液的底物溶液(100mmd,l-草铵膦)400μl,置于金属浴振荡器中,30℃保温10min,加入20μl纯酶,开始计时,30℃反应10min,加入20μl6m的盐酸,取出震荡混匀,反应终止,12000rpm离心3min,取上清,用去离子水稀释2倍,进行hplc检测。根据hplc测得的2-羰基-4-[羟基(甲基)膦酰基]丁酸浓度,计算酶活。表3酶活测定结果编号突变类型酶活(u/l)e4m213s-n54v-f58q2.28±0.3e5m213s-n54v-f58q-g52l4.63±0.14e7m213s-n54v-f58q-g52l-s335g5.96±0.22e8m213s-n54v-f58q-g52l-s335t5.01±0.07e9m213s-n54v-f58q-s335g3.21±0.2对照11.31±0.03对照21.29±0.07实施例5菌体的大规模制备因生产l-草铵膦及2-羰基-4-[羟基(甲基)膦酰基]丁酸的过程中,需要大量的生物催化剂,因此需要菌体大规模制备。所用培养基为lb培养基。将保藏有重组d-氨基酸氧化酶工程菌的甘油管经平皿划线活化后,挑单菌落接种至含有50μg/ml卡那霉素的50mllb液体培养基中,37℃震荡培养12h。按2%的接种量转接至1l同样含有50μg/ml卡那霉素的新鲜lb液体培养基中,37℃震荡培养至od600达到0.8左右时,加入终浓度为0.5mm的iptg,28℃下震荡培养16h。培养结束后,将培养液8000rpm离心10min,弃上清,收集菌体,放到-80℃超低温冰箱中保存,待用。粗酶液的制备见实施例2。实施例6d-氨基酸氧化酶(e7)制备2-羰基-4-[羟基(甲基)膦酰基]丁酸按照实施例5的方法培养能够表达d-氨基酸氧化酶(e7)的基因工程菌,离心收集细胞,并超声破碎制备粗酶液。定量称取d,l-草铵膦到50mmph=8的磷酸盐缓冲液中,至于反应容器中,使得d,l-草铵膦的终浓度为50mm,粗酶液浓度为50g/l,仅需要加入2g/l过氧化氢酶。通过水浴控制反应温度为30℃,定时取样用非手性液相色谱检测ppo的生成量,同时用柱前衍生化高效液相色谱检测d-ppt的减少量与ee值。反应结束,数据如下:d-ppt剩余0.8mm,转化率48.4%(其中,最大理论转化率为50%),ppo的生成浓度为20mm,产率为40%(其中,最大理论产率为50%),反应后底物ee值达99%。实施例7d-氨基酸氧化酶(e9)制备2-羰基-4-[羟基(甲基)膦酰基]丁酸按照实施例5的方法培养能够表达d-氨基酸氧化酶(e9)的基因工程菌,离心收集细胞,并超声破碎制备粗酶液。定量称取d,l-草铵膦到50mmph=8的磷酸盐缓冲液中,至于反应容器中,使得d,l-草铵膦的终浓度为50mm,湿菌体浓度为50g/l,仅需要加入2g/l过氧化氢酶。通过水浴控制反应温度为30℃,定时取样用非手性液相色谱检测ppo的生成量,同时用柱前衍生化高效液相色谱检测d-ppt的减少量与ee值。反应结束,数据如下:d-ppt剩余5.6mm,转化率38.8%(其中,最大理论转化率为50%),ppo的生成浓度为12.8mm,产率为25.6%(其中,最大理论产率为50%),反应后底物ee值达99%。实施例8d-氨基酸氧化酶(e8)制备2-羰基-4-[羟基(甲基)膦酰基]丁酸按照实施例5的方法培养能够表达d-氨基酸氧化酶(e8)的基因工程菌,离心收集细胞,并超声破碎制备粗酶液。定量称取d,l-草铵膦到50mmph=8的磷酸盐缓冲液中,至于反应容器中,使得d,l-草铵膦的终浓度为50mm,湿菌体浓度为50g/l,仅需要加入2g/l过氧化氢酶。通过水浴控制反应温度为30℃,定时取样用非手性液相色谱检测ppo的生成量,同时用柱前衍生化高效液相色谱检测d-ppt的减少量与ee值。反应结束,数据如下:d-ppt剩余3.4mm,转化率43.2%(其中,最大理论转化率为50%),ppo的生成浓度为15.6mm,产率为31.2%(其中,最大理论产率为50%),反应后底物ee值达99%。实施例9d-氨基酸氧化酶(e5)制备2-羰基-4-[羟基(甲基)膦酰基]丁酸按照实施例5的方法培养能够表达d-氨基酸氧化酶(e5)的基因工程菌,离心收集细胞,并超声破碎制备粗酶液。定量称取d,l-草铵膦到50mmph=8的磷酸盐缓冲液中,至于反应容器中,使得d,l-草铵膦的终浓度为50mm,湿菌体浓度为50g/l,仅需要加入2g/l过氧化氢酶。通过水浴控制反应温度为30℃,定时取样用非手性液相色谱检测ppo的生成量,同时用柱前衍生化高效液相色谱检测d-ppt的减少量与ee值。反应结束,数据如下:d-ppt剩余4.9mm,转化率40.2%(其中,最大理论转化率为50%),ppo的生成浓度为13.9mm,产率为27.8%(其中,最大理论产率为50%),反应后底物ee值达99%。实施例10d-氨基酸氧化酶(e4)制备2-羰基-4-[羟基(甲基)膦酰基]丁酸按照实施例5的方法培养能够表达d-氨基酸氧化酶(e4)的基因工程菌,离心收集细胞,并超声破碎制备粗酶液。定量称取d,l-草铵膦到50mmph=8的磷酸盐缓冲液中,至于反应容器中,使得d,l-草铵膦的终浓度为50mm,湿菌体浓度为50g/l,仅需要加入2g/l过氧化氢酶。通过水浴控制反应温度为30℃,定时取样用非手性液相色谱检测ppo的生成量,同时用柱前衍生化高效液相色谱检测d-ppt的减少量与ee值。反应结束,数据如下:d-ppt剩余9.7mm,转化率30.6%(其中,最大理论转化率为50%),ppo的生成浓度为13.9mm,产率为27.8%(其中,最大理论产率为50%),反应后底物ee值达99%。对比例1按照实施例5的方法培养能够表达d-氨基酸氧化酶的基因工程菌,离心收集细胞,并超声破碎制备粗酶液。定量称取d,l-草铵膦到50mmph=8的磷酸盐缓冲液中,至于反应容器中,使得d,l-草铵膦的终浓度为50mm,湿菌体浓度为50g/l,过氧化氢酶浓度为10g/l。通过水浴控制反应温度为30℃,定时取样用非手性液相色谱检测ppo的生成量,同时用柱前衍生化高效液相色谱检测d-ppt的减少量与ee值。反应结束,数据如下:d-ppt剩余13mm,转化率24%(其中,最大理论转化率为50%),ppo的生成浓度为10.78mm,产率为21.56%(其中,最大理论产率为50%),反应后底物ee值达99%。对比例2按照实施例5的方法培养能够表达d-氨基酸氧化酶(e3)的基因工程菌,离心收集细胞,并超声破碎制备粗酶液。定量称取d,l-草铵膦到50mmph=8的磷酸盐缓冲液中,至于反应容器中,使得d,l-草铵膦的终浓度为50mm,湿菌体浓度为50g/l,过氧化氢酶浓度为10g/l。通过水浴控制反应温度为30℃,定时取样用非手性液相色谱检测ppo的生成量,同时用柱前衍生化高效液相色谱检测d-ppt的减少量与ee值。反应结束,数据如下:d-ppt剩余12.6mm,转化率24.8%(其中,最大理论转化率为50%),ppo的生成浓度为11.8mm,产率为23.6%(其中,最大理论产率为50%),反应后底物ee值达99%。序列表<110>浙江工业大学<120>一种d-氨基酸氧化酶突变体及其应用<160>12<170>siposequencelisting1.0<210>1<211>368<212>prt<213>纤细红酵母菌(rhodotorulagracilis)<400>1methisserglnlysargvalvalvalleuglyserglyvalilegly151015leuserseralaleuileleualaarglysglytyrservalhisile202530valalaargaspleuprogluaspvalserserglnthrphealaser354045protrpalaglyalaasntrpthrprophemetserleuthraspgly505560proargglnalalystrpglugluleuthrphelyslystrpvalglu65707580leuvalprothrglyglnvalmettrpleulysglythrargargphe859095alaglnasngluaspglyleuleuglyhistrptyrlysaspilethr100105110proasntyrargproleuproserserglucysproproasnserile115120125glyvalthrtyraspthrleuservalhisalaprolystyrcysgln130135140tyrleualaargglyleuglnlysleuglyalathrphegluargarg145150155160thrvalthrservalgluglnalaphegluglyvalaspleuvalval165170175asnalathrglyleuglyalalysserilealaglyileaspaspgln180185190alaalagluproileargglyglnthrvalleuvallysseralacys195200205lysargcysthrmetaspserseraspproserserproalatyrile210215220ileproargproglyglygluvalilecysglyglythrtyrglyval225230235240glyasptrpaspleuservalasnprogluthrvalglnargileleu245250255lyshiscysleuargleuaspproserileserseraspglythrile260265270gluglyilegluvalleuarghisasnvalglyleuargproalaarg275280285argglyglyproargvalglualagluargleuvalleuproleuasp290295300argserlysserproleuserleuglylysglythrthrargalaala305310315320lysglulysgluvalthrleuvalhisalatyrglypheserserala325330335glytyrglnglnsertrpglyalaalagluaspvalalaleuleuval340345350gluglualapheglnargtyrhisglyalaalaarggluserlysleu355360365<210>2<211>1104<212>dna<213>纤细红酵母菌(rhodotorulagracilis)<400>2atgcacagccagaagcgtgtggttgtgctgggtagcggcgttatcggtctgagcagcgcg60ctgattctggcgcgtaaaggctacagcgttcacatcgtggcgcgtgacctgccggaggat120gtgagcagccagacctttgcgagcccgtgggcgggtgcgaactggaccccgtttatgagc180ctgaccgatggtccgcgtcaagcgaagtgggaggaactgaccttcaagaaatgggttgag240ctggtgccgaccggtcaggttatgtggctgaagggcacccgtcgttttgcgcaaaacgaa300gacggtctgctgggccactggtacaaagatatcaccccgaactatcgtccgctgccgagc360agcgagtgcccgccgaacagcattggtgttacctatgacaccctgagcgtgcacgcgccg420aagtactgccagtatctggcgcgtggtctgcagaaactgggcgcgaccttcgaacgtcgt480accgttaccagcgtggagcaggcgtttgaaggtgtggatctggttgtgaacgcgaccggt540ctgggtgcgaagagcatcgcgggtattgacgatcaggcggcggaaccgatccgtggccaa600accgttctggtgaagagcgcgtgcaaacgttgcaccatggacagcagcgatccgagcagc660ccggcgtacatcattccgcgtccgggtggcgaggttatttgcggtggcacctatggtgtg720ggcgactgggatctgagcgttaacccggaaaccgtgcaacgtatcctgaaacactgcctg780cgtctggacccgagcattagcagcgatggtaccatcgagggcattgaagttctgcgtcat840aacgttggcctgcgtccggcgcgtcgtggtggcccgcgtgttgaagcggaacgtctggtg900ctgccgctggaccgtagcaagagcccgctgagcctgggtaaaggcaccacccgtgcggcg960aaggagaaagaagttaccctggtgcacgcgtacggtttcagcagcgcgggctatcagcaa1020agctggggtgcggcggaggatgttgcgctgctggttgaggaagcgttccaacgttaccac1080ggcgcggcgcgtgaaagcaaactg1104<210>3<211>29<212>dna<213>人工序列(artificialsequence)<220><221>misc_feature<222>(17)..(18)<223>nisa,c,g,ort<400>3gtgcaaacgttgcaccnnkgacagcagcg29<210>4<211>29<212>dna<213>人工序列(artificialsequence)<220><221>misc_feature<222>(19)..(20)<223>nisa,c,g,ort<400>4ctcggatcgctgctgtcmnnggtgcaacg29<210>5<211>29<212>dna<213>人工序列(artificialsequence)<220><221>misc_feature<222>(4)..(5)<223>nisa,c,g,ort<220><221>misc_feature<222>(16)..(17)<223>nisa,c,g,ort<400>5gcgnnktggaccccgnnkatgagcctgac29<210>6<211>31<212>dna<213>人工序列(artificialsequence)<220><221>misc_feature<222>(8)..(9)<223>nisa,c,g,ort<220><221>misc_feature<222>(20)..(21)<223>nisa,c,g,ort<400>6gctcatmnncggggtccamnncgcacccgcc31<210>7<211>32<212>dna<213>人工序列(artificialsequence)<220><221>misc_feature<222>(23)..(24)<223>nisa,c,g,ort<400>7gacctttgcgagcccgtgggcgnnkgcggtgt32<210>8<211>33<212>dna<213>人工序列(artificialsequence)<220><221>misc_feature<222>(24)..(25)<223>nisa,c,g,ort<400>8tcattggcggggtccaaaccgcmnncgcccacg33<210>9<211>32<212>dna<213>人工序列(artificialsequence)<220><221>misc_feature<222>(20)..(21)<223>nisa,c,g,ort<400>9gcacgcgtacggtttcagcnnkgcgggctatc32<210>10<211>34<212>dna<213>人工序列(artificialsequence)<220><221>misc_feature<222>(23)..(24)<223>nisa,c,g,ort<400>10ccagctttgctgatagcccgcmnngctgaaaccg34<210>11<211>22<212>dna<213>人工序列(artificialsequence)<400>11atgcacagccagaagcgtgtgg22<210>12<211>22<212>dna<213>人工序列(artificialsequence)<400>12cagtttgctttcacgcgccgcg22当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1