凝血因子Ⅹ激活剂RVV-Ⅹ的制备方法及制得的RVV-Ⅹ与流程
本发明属于生物技术领域,具体涉及凝血因子ⅹ激活剂rvv-ⅹ的制备方法及制得的rvv-ⅹ。
背景技术:
凝血因子ⅹ激活剂(fⅹ激活剂)是蝰亚科、蝮亚科、眼镜蛇科等蛇毒中存在的一类能激活凝血因子ⅹ的促凝组分,它能够激活凝血因子ⅹ,加速凝血过程,促进血液凝固。研究发现,存在于多种蛇毒中的fⅹ激活剂可分为金属蛋白酶和丝氨酸蛋白酶两类,含量丰富且激活fⅹ作用最强的是从圆斑蝰蛇蛇毒中分离出来的fx激活剂(rvv-x)。fx激活剂应用广泛,市场需求潜力巨大。作为体外诊断试剂盒主要成分,可用于fx本身、fvⅱ与fⅹ缺乏症间的区别、狼疮抗凝物诊断及血小板疾病的诊断。如:利用蝰蛇毒激活凝血因子x的凝血机理,测定蝰蛇毒磷脂时间延长可诊断fx缺乏,同时测定凝血酶原时间延长,则为凝血因子ⅶ缺乏症。fⅹ激活剂作为狼疮抗凝物试剂盒的主要成分,该试剂盒对狼疮抗凝物非常敏感,对血栓性栓塞、自身免疫性疾病等多种疾病的早期诊断及抗凝药物监测。fx激活剂还可作为一种止血药应用于临床。现有的止血药如凝血因子,抗纤维蛋白溶解药、抑肽酶等效果常不太理想,而应用fⅹ激活剂制备的止血药更加快速、高效。此外,高纯度的fⅹ激活剂在对其理化性质,分子结构及构象与功能的关系等生物化学与生物物理方面的深入研究也有重要的意义。所有这些应用都需要高纯度的fx激活剂,因而分离纯化fx激活剂具有重要的意义。
目前纯化fⅹ激活剂的方法有很多报道,1976年kisel等采用sephadexg-150凝胶过滤和qae-sephadexa-50离子交换柱从圆斑蝰蛇毒中分离得到电泳纯fⅹ激活剂。此后hoffman和bon采用deae-cellulosecolumns,sephadexg-150,deae-cellulosecolumns从矛头蛇毒中纯化出两种fⅹ激活剂。其他学者也用类似的方法,分别从角蝰蛇毒,极北蝰蛇毒,金环蛇毒等蛇毒中分离提取出fⅹ激活剂,其中从圆斑蝰蛇毒纯化的fⅹ激活剂即为rvv-ⅹ。此外,同种蛇毒的来源不同,提取纯化的fx激活剂的种类也可能不同。例如,杨丽娟等从圆斑蝰蛇毒分离纯化了分子量为61kd的rvv-x;朱炜等从圆斑蝰蛇毒分离纯化了分子量为89kd的rvv-x,其他报道也分离出了不同分子量的rvv-x。
现行的文献报道中,纯化rvv-x主要是通过分子筛过滤、阴离子交换柱和阳离子交换等几种方式的混合使用,其中分子筛主要是采用sephadexg-150,sephadexg-100,sepherdexg-75或superdex75,但这些填料的物理稳定性差,速度慢,不利于放大生产,同时由于整个分离纯化的工艺较复杂,因此收率难以满足市场的实际需求,使得rvv-x难以大规模生产,从而限制了rvv-ⅹ的市场使用范围和对其常规的研究。
技术实现要素:
有鉴于此,本发明的目的在于针对现有技术的缺陷,提供一种凝血因子ⅹ激活剂rvv-ⅹ及其制备方法。
为实现本发明的目的,本发明采用如下技术方案:
凝血因子ⅹ激活剂rvv-ⅹ的制备方法,包括如下步骤:
1)圆斑蝰蛇毒溶于缓冲液后经分子筛层析柱分离,缓冲液洗脱,用核酸蛋白检测仪监测,根据a280nm值绘出洗脱线,采用发色底物法检测确定具有rvv-ⅹ活性的洗脱峰,收集浓缩;
2)将步骤1)活性峰浓缩液,采用弱阳离子柱进行分离,用含0-0.5mol/lnacl的缓冲液梯度洗脱,用核酸蛋白检测仪监测,根据a280nm值绘出洗脱线,采用发色底物法检测分别收集具有rvv-ⅹ活性的洗脱峰。
其中,作为优选,步骤1)所述分子筛层析柱的填料为sephadex、bio-gelp、separose、superdex、sephacryl、
进一步,更优选的,步骤1)所述分子筛层析柱的填料为superdex200、sephacryls-100hr或
作为优选,步骤1)所述缓冲液为0.01-0.05mol/lph6-8的tris缓冲液、柠檬酸盐缓冲液、磷酸缓冲液的任意一种;所述缓冲液洗脱的流速为0.1ml/min-0.5ml/min。
作为优选,步骤2)所述弱阳离子柱的填料为cmbio-gela、cm、cmsephadex、cmsepharose系列中的任意一种。
进一步,更优选的,步骤2)所述弱阳离子柱的填料为cmsepharosecl-6b、cmsephadexc-50或cmsepharosefastflow。
作为优选,步骤2)所述nacl的浓度洗脱梯度为0.1mol/l、0.2mol/l、0.3mol/l、0.5mol/l。
作为优选,步骤2)所述缓冲液为0.01-0.05mol/lph5-8的柠檬酸盐缓冲液、磷酸缓冲液或乙酸盐缓冲液;所述缓冲液洗脱的流速为0.2ml/min-2.0ml/min。
作为优选,步骤2)所述具有rvv-ⅹ活性的洗脱峰为含0.2mol/lnacl的缓冲液洗脱的洗脱液峰和/或含0.3mol/lnacl的缓冲液洗脱的洗脱液峰。
本发明还提供了本发明所述制备方法制得的凝血因子ⅹ激活剂rvv-ⅹ。
作为优选,所述的凝血因子ⅹ激活剂rvv-ⅹ其分子量为98kd。
由上述技术方案可知,本发明提供了凝血因子ⅹ激活剂rvv-ⅹ的制备方法。本发明所述制备方法以圆斑蝰蛇毒为原料,溶于缓冲液后经分子筛层析柱进行粗分离,缓冲液洗脱,收集具有rvv-ⅹ活性的洗脱峰,浓缩采用弱阳离子柱进行分离纯化,用含0-0.5mol/lnacl的缓冲液梯度洗脱,收集具有rvv-ⅹ活性的洗脱峰。本发明所述制备方法原料圆斑蝰蛇毒易于获得,采用分子筛层析柱进行粗分离,分子筛填料物理性质稳定,能够承受高流速,可以保持柱床体积和结构稳定性,避免了每次的重新装柱过程,更利于放大生产。本发明所述制备方法通过分子筛层析柱进行粗分离和弱阳离子柱进行分离纯化的两步过柱分离可以获得79kd和98kd的两种rvv-ⅹ,制备步骤少,得率高,制得的79kd和98kd两种rvv-ⅹ纯度高,且稳定性好。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
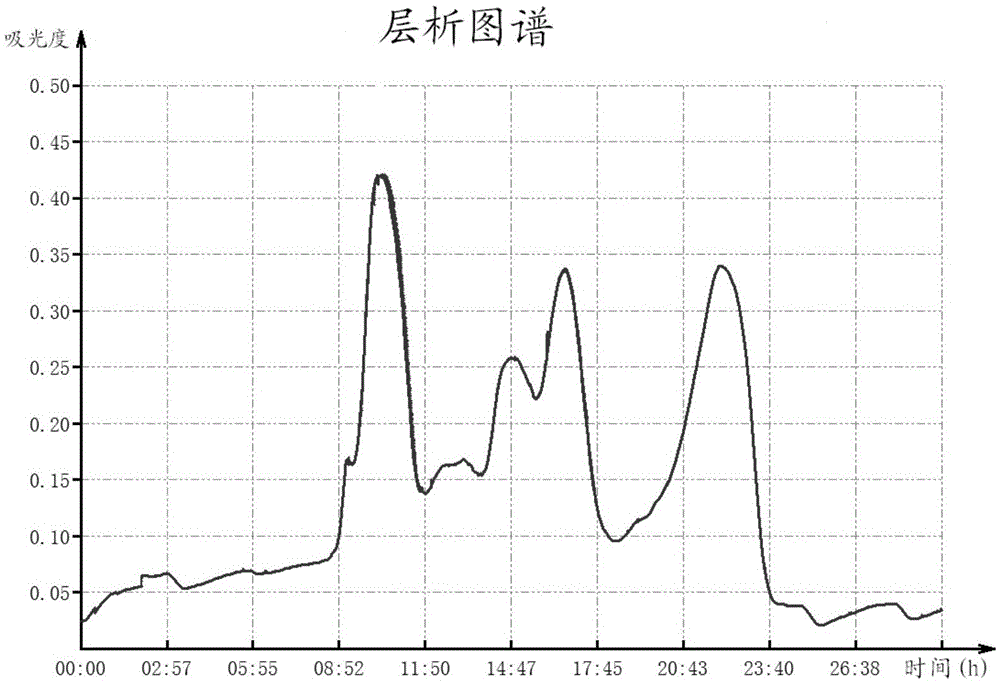
图1示实施例1rvv粗蛇毒在sephacryls-100hr柱上层析谱图;
图2示实施例1rvv-ⅹ在cmsepharosefastflow柱上层析谱图;
图3示实施例1rvv-ⅹ通过分别在sephacryls-100hr柱、cmsepharosefastflow的sds-page电泳图,其中泳道a:mark;b:粗蛇毒;c:sephacryls-100hr过柱子活性蛋白峰;d:cmsepharosefastflow过柱子,用含0.2mol/lnacl的0.05mol/l乙酸铵缓冲液洗脱的洗脱液峰(分子量79kd);e:cmsepharosefastflow过柱子,用含0.2mol/lnacl的0.05mol/l乙酸铵缓冲液洗脱后用含0.3mol/lnacl的0.05mol/l乙酸铵缓冲液洗脱的洗脱液峰(分子量98kd)。
具体实施方式
本发明公开了凝血因子ⅹ激活剂rvv-ⅹ的制备方法及制得的rvv-ⅹ。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及产品已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法进行改动或适当变更与组合,来实现和应用本发明技术。
凝血因子ⅹ激活剂rvv-ⅹ的制备方法,包括如下步骤:
1)圆斑蝰蛇毒溶于缓冲液后经分子筛层析柱分离,缓冲液洗脱,用核酸蛋白检测仪监测,根据a280nm值绘出洗脱线,采用发色底物法检测确定具有rvv-ⅹ活性的洗脱峰,收集浓缩;
2)将步骤1)活性峰浓缩液,采用弱阳离子柱进行分离,用含0-0.5mol/lnacl的缓冲液梯度洗脱,用核酸蛋白检测仪监测,根据a280nm值绘出洗脱线,采用发色底物法检测分别收集具有rvv-ⅹ活性的洗脱峰。
本发明所述制备方法步骤1)以圆斑蝰蛇毒为原料,溶于缓冲液后经分子筛层析柱进行粗分离,缓冲液洗脱,收集具有rvv-ⅹ活性的洗脱峰。
其中,作为优选,步骤1)所述分子筛层析柱的填料为sephadex、bio-gelp、separose、superdex、sephacryl、
进一步,作为优选,步骤1)所述分子筛层析柱的填料为superdex,sephacryl,
在一些具体实施例中,步骤1)所述分子筛层析柱的填料为superdex200;在一些具体实施例中,步骤1)所述分子筛层析柱的填料为sephacryls-100hr;在一些具体实施例中,步骤1)所述分子筛层析柱的填料为
作为优选,步骤1)所述缓冲液为0.01-0.05mol/lph6-8的tris缓冲液、柠檬酸盐缓冲液、磷酸缓冲液的任意一种;所述缓冲液洗脱的流速为0.1ml/min-0.5ml/min。在一些具体实施例中,步骤1)所述缓冲液为0.05mol/lph7.4的tris-hcl缓冲液。
进一步的,在步骤1)前还包括缓冲液平衡分子筛层析柱的步骤。
在一些实施方案中,本发明步骤1)所述圆斑蝰蛇毒溶于缓冲液具体为溶于0.05mol/lph7.4的tris-hcl缓冲液。
进一步的,在所述圆斑蝰蛇毒溶于缓冲液后还包括离心取上清的步骤。在一些实施方案中,所述离心为12000rpm离心10min。
本发明所述制备方法步骤2)采用弱阳离子柱进行分离纯化,用含0-0.5mol/lnacl的缓冲液梯度洗脱,收集具有rvv-ⅹ活性的洗脱峰。
作为优选,步骤2)所述弱阳离子柱的填料为cmbio-gela、cm、cmsephadex、cmsepharose系列中的任意一种。
进一步的,在一些实施方案中,步骤2)所述弱阳离子柱的填料为cmsepharose或cmsephadex系列中的一种。
在一些具体实施例中,步骤2)所述分子筛层析柱的填料为cmsepharosecl-6b;在一些具体实施例中,步骤2)所述分子筛层析柱的填料为cmsephadexc-50;在一些具体实施例中,步骤2)所述分子筛层析柱的填料为cmsepharosefastflow。
在一些实施方案中,本发明所述制备方法步骤2)在步骤1)活性峰浓缩液用弱阳离子柱分离前还包括缓冲液平衡的步骤。
本发明所述制备方法步骤2)采用含0-0.5mol/lnacl的缓冲液洗脱上样后的弱阳离子柱。
在一些实施方案中,步骤2)所述nacl的浓度洗脱梯度为0.1mol/l、0.2mol/l、0.3mol/l、0.5mol/l。
在一些实施方案中,本发明所述制备方法步骤2)在用含0-0.5mol/lnacl的缓冲液梯度洗脱前还包括缓冲液洗脱至基线平稳的步骤。
作为优选,步骤2)所述缓冲液为0.01-0.05mol/lph5-8的柠檬酸盐缓冲液、磷酸缓冲液或乙酸盐缓冲液。在一些具体实施例中,所述缓冲液为0.05mol/l、ph5.8乙酸铵缓冲液。
作为优选,步骤2)所述缓冲液洗脱的流速为0.2ml/min-2.0ml/min。在一些具体实施例中,所述缓冲液洗脱的流速为0.5ml/min。
本发明所述制备方法步骤2)用核酸蛋白检测仪监测,根据a280nm值绘出洗脱线,主要获得3个峰,采用发色底物法检测收集到两个具有rvv-ⅹ活性的洗脱峰。
在一些实施方案中,步骤2)所述具有rvv-ⅹ活性的洗脱峰为含0.2mol/lnacl的0.05mol/lph5.8乙酸铵缓冲液洗脱的洗脱液峰。sds-page鉴定该洗脱液峰中rvv-ⅹ分子量为79kd。
在一些实施方案中,步骤2)所述具有rvv-ⅹ活性的洗脱峰为含0.3mol/lnacl的0.05mol/lph5.8乙酸铵缓冲液洗脱的洗脱液峰。sds-page鉴定该洗脱液峰中rvv-ⅹ分子量为98kd。
本发明还提供了本发明所述制备方法制得的凝血因子ⅹ激活剂rvv-ⅹ。
作为优选,所述的凝血因子ⅹ激活剂rvv-x其分子量为98kd。
由上述技术方案可知,本发明提供了凝血因子x激活剂rvv-x的制备方法。本发明所述制备方法以圆斑蝰蛇毒为原料,溶于缓冲液后经分子筛层析柱进行粗分离,缓冲液洗脱,收集具有rvv-x活性的洗脱峰,浓缩采用弱阳离子柱进行分离纯化,用含0-0.5mol/lnacl的缓冲液梯度洗脱,收集具有rvv-x活性的洗脱峰。本发明所述制备方法原料圆斑蝰蛇毒易于获得,采用分子筛层析柱进行粗分离,分子筛填料物理性质稳定,能够承受高流速,可以保持柱床体积和结构稳定性,避免了每次的重新装柱过程,更利于放大生产。本发明所述制备方法通过分子筛层析柱进行粗分离和弱阳离子柱进行分离纯化的两步过柱分离可以获得79kd和98kd的两种rvv-x,制备步骤少,得率高,制得的79kd和98kd两种rvv-x纯度高,且稳定性好。
为了进一步理解本发明,下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
如无特殊说明,本发明实施例中所涉及的试剂均为市售产品,均可以通过商业渠道购买获得。其中,圆斑蝰蛇毒购买自广州新源蛇毒经销部。
实施例1
将圆斑蝰蛇毒100mg溶于1.5ml0.05mol/ltris-hcl缓冲液(ph7.4),12000rpm离心10min,取上清上样至用上述缓冲液完成平衡的sephacryls-100hr柱,继续加缓冲液洗脱,流速0.2ml/min,自动收集洗脱液。用核酸蛋白检测仪监测,根据a280nm值绘出洗脱线(见图1),同时采用发色底物法检测确定具有rvv-x活性的洗脱峰。结果显示,该步分离主要获得3个峰,将具有rvv-x活性的峰收集浓缩并进行电泳图分析,可知该步去除了大部分小分子物质。
将具有rvv-x活性的峰浓缩上样至用0.05mol/l乙酸铵缓冲液(ph5.8)完成平衡的弱阳离子cmsepharosefastflow柱。用0.05mol/l乙酸铵缓冲液(ph5.8)继续洗脱至基线平稳。然后用含不同浓度nacl(依次为0.1mol/l、0.2mol/l、0.3mol/l、0.5mol/l)的0.05mol/l乙酸铵缓冲液(ph5.8)依次洗脱,流速0.5ml/min,每个nacl浓度2-3个柱体积,自动收集洗脱液。用核酸蛋白检测仪监测,根据a280nm值绘出洗脱线(见图2),同时采用发色底物法检测确定具有rvv-x活性的洗脱峰。结果显示该步分离主要获得3个峰。将具有rvv-x活性的两个峰(分别为含0.2mol/lnacl的0.05mol/l乙酸铵缓冲液和0.3mol/lnacl的0.05mol/l乙酸铵缓冲液洗脱的洗脱液)进行收集并进行sds-page电泳分析。结果显示,具有rvv-x活性的两个峰分子量分别为79kd、98kd(见图3)。以mark为标准,利用quantityone软件计算两种rvv-x的纯度均大于95%。
实施例2
圆斑蝰蛇毒100mg溶于1.5ml0.05mol/ltris-hcl缓冲液(ph7.4),12000rpm离心10min,取上清上样至用上述缓冲液完成平衡的superdex200柱,继续加缓冲液洗脱,流速0.2ml/min,自动收集洗脱液。用核酸蛋白检测仪监测,根据a280nm值绘出洗脱线,同时采用发色底物法检测确定具有rvv-x活性的洗脱峰。结果与图1相似,该步分离主要获得3个峰,将具有rvv-x活性的峰收集浓缩并进行电泳图分析,可知该步去除了大部分小分子物质。
将具有rvv-x活性的峰浓缩上样至用0.05mol/l乙酸铵缓冲液(ph5.8)完成平衡的弱阳离子cmsepharosefastflow柱。用0.05mol/l乙酸铵缓冲液(ph5.8)继续洗脱至基线平稳。然后用含不同浓度nacl(依次为0.1mol/l、0.2mol/l、0.3mol/l、0.5mol/l)的0.05mol/l乙酸铵缓冲液(ph5.8)依次洗脱,流速0.5ml/min,每个nacl浓度2-3个柱体积,自动收集洗脱液。用核酸蛋白检测仪监测,根据a280nm值绘出洗脱线,同时采用发色底物法检测确定具有rvv-x活性的洗脱峰。结果与图2相似,该步分离主要获得3个峰。将具有rvv-x活性的两个峰(分别为含0.2mol/lnacl的0.05mol/l乙酸铵缓冲液和0.3mol/lnacl的0.05mol/l乙酸铵缓冲液洗脱的洗脱液)进行收集并进行sds-page电泳分析。结果显示,具有rvv-ⅹ活性的两个峰分子量分别为79kd、98kd。以mark为标准,利用quantityone软件计算两种rvv-ⅹ的纯度均大于95%。
实施例3、
将圆斑蝰蛇毒100mg溶于1.5ml0.05mol/ltris-hcl缓冲液(ph7.4),12000rpm离心10min,取上清上样至用上述缓冲液完成平衡的aca44柱,继续加缓冲液洗脱,流速0.2ml/min,自动收集洗脱液。用核酸蛋白检测仪监测,根据a280nm值绘出洗脱线,同时采用发色底物法检测确定具有rvv-ⅹ活性的洗脱峰。结果与图1相似,该步分离主要获得3个峰,将具有rvv-ⅹ活性的峰收集浓缩并进行电泳图分析,可知该步去除了大部分小分子物质。
将具有rvv-ⅹ活性的峰浓缩上样至用0.05mol/l乙酸铵缓冲液(ph5.8)完成平衡的弱阳离子cmsepharosefastflow柱。用0.05mol/l乙酸铵缓冲液(ph5.8)继续洗脱至基线平稳。然后用含不同浓度nacl(依次为0.1mol/l、0.2mol/l、0.3mol/l、0.5mol/l)的0.05mol/l乙酸铵缓冲液(ph5.8)依次洗脱,流速0.5ml/min,每个nacl浓度2-3个柱体积,自动收集洗脱液。用核酸蛋白检测仪监测,根据a280nm值绘出洗脱线,同时采用发色底物法检测确定具有rvv-ⅹ活性的洗脱峰。结果与图2相似,该步分离主要获得3个峰。将具有rvv-ⅹ活性的两个峰(分别为含0.2mol/lnacl的0.05mol/l乙酸铵缓冲液和0.3mol/lnacl的0.05mol/l乙酸铵缓冲液洗脱的洗脱液)进行收集并进行sds-page电泳分析。结果显示,具有rvv-ⅹ活性的两个峰分子量分别为79kd、98kd。以mark为标准,利用quantityone软件计算两种rvv-ⅹ的纯度均大于95%。
实施例4、活力和得率比较
根据文献报道关于不同来源圆斑蝰蛇毒的传统纯化方法为大致通过分子筛,阴离子交换,阳离子交换或分子筛,阴离子交换,分子筛或分子筛,阳离子交换进行分离纯化,其中分子筛主要是sephadex,separose,superdex。阴离子交换填料主要为deaeff;阳离子交换填料主要为cmsephadexc-50。
为了考察本发明所述方法制得的rvv-ⅹ活力和回收率,分别采用了传统方法1:连续使用sphadexg-75、deaeff、cmsephadexc-50分离柱纯化得到rvv-ⅹ(hofmannh,bonc.bloodcoagulationinducedbythevenomofbothropsatrox.2.identification,purification,andpropertiesoftwofactorⅹactivators[j].biochemistry,1987,26(3):780-787.)及传统方法2:连续使用sphadexg-75,cmsephadexc-50,sphadexg-75分离柱纯化得到rvv-ⅹ(杨丽娟.圆斑蝰蛇泰国亚种蛇毒中凝血ⅹ因子激活剂的分离及特性[d].福建医科大学,2001.),分别与本发明实施例1-3所述方法进行了比较,其结果如表1所示。其中rvv-ⅹ含量采用考马斯亮蓝法测定,rvv-x活力采用发色底物s-2765方法测定(suntravatm,nuchprayooni,pérezjc.comparativestudyofanticoagulantandprocoagulantpropertiesof28snakevenomsfromfamilieselapidae,viperidae,andpurifiedrussell’svipervenom-factorxactivator(rvv-x)),回收率的计算公式如下:
表1本发明纯化方法与传统方法比较
结果显示与传统方法相比,本发明方法在酶的专一性活力和回收率两个方面比传统纯化方法都有显著的提高,因而更容易满足市场的需求。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!