由多能干细胞制作肠道类器官的方法与流程
本发明涉及由多能干细胞制作肠道类器官的方法和其用途。本申请要求基于2017年5月9日提出申请的日本专利申请第2017-093418号的优先权,该专利申请的全部内容通过参照而援用于本说明书中。
背景技术:
在研究口服给予的医药品的药代动力学方面小肠是非常重要的器官。在非临床试验的阶段,为了综合性地评价在人小肠中的药物动力学(吸收、排泄、代谢),希望利用原代小肠上皮细胞,但其本身难以获得。近年来,作为新型体外评价系统,模拟了肠道组织的三维组织结构体(类器官)备受瞩目。但是,由胚胎干细胞(embryonicstemcells:es细胞)以及具有与es细胞同样的多分化潜能和几乎无限的增殖能力且也期待在药物发现研究中应用的诱导多能干细胞(inducedpluripotentstemcells:ips细胞)分化诱导的肠道类器官尚未成熟,几乎没有进行药物动力学的功能的解析。
另外,人以外的哺乳动物对疾病模型、生物医学研究有用。特别是在药物发现研究中作为实验动物使用的食蟹猴在很多方面与人非常类似,药物代谢酶、转运蛋白的氨基酸序列被认为有90~95%的同源性,底物特异性类似。因此,在非临床试验的阶段,通过使用食蟹猴确认体内以及体外的相关性,能够更准确地对人进行预测。
报告了由es细胞、ips细胞通过二维(2d)培养制作肠道上皮细胞(例如参照专利文献1、2),以及通过利用了基质胶(matrigel)等的三维(3d)培养制作肠道类器官(例如,专利文献3、4、非专利文献1~4)。
现有技术文献
专利文献
专利文献1:国际公开第2014/132933号小册子
专利文献2:国际公开第2012/060315号小册子
专利文献3:国际公开第2016/093222号小册子
专利文献4:日本特开2006-239169号公报
非专利文献
非专利文献1:drugmetab.pharmacokineticvol.29(1).p.44-51(2014)
非专利文献2:nature,vol.470,p.l05-109(2011)
非专利文献3:stemcells,vol.24,p.2618-2626(2006)
非专利文献4:biochem.biophys.res.commun.,vol.391(1),no.7,p.38-42(2010)
技术实现要素:
上述通过2d培养得到的肠道上皮细胞难以长时间培养。另外,并没有形成肠道类器官,利用其的评价系统在其构成、用途、利用价值的方面等与肠道类器官的情况不同。另一方面,对于通过3d培养制作的肠道类器官,没有充分地进行其功能性的验证(认为大概是未成熟的结构体),即,其实用性尚不明确,难以说能够用于药物动力学解析等。因此,本发明的第1课题在于由多能干细胞制作功能性的(即,具有药物动力学功能的)肠道类器官,第2课题在于提高肠道类器官的制作效率。
为了解决上述课题进行了深入研究,结果本发明人等发现了对于功能性肠道类器官的形成有效的因子的组合。在成功形成的肠道类器官中确认到功能性紧密连接,还确认到排出转运蛋白的输送功能、药物代谢酶活性等。在证实了能够构建具备药物动力学功能的功能性肠道类器官的方面,本发明人等的成果也与过去的报告完全不同。另一方面,通过对培养方法进行改良,也成功地提高了肠道类器官的制作效率。应予说明,新型组合中采用的因子均是廉价且批次间差异少的低分子化合物,该特征除降低了肠道类器官的制作成本以外,还提高了肠道类器官的品质和可靠性等。
通过进一步的研究,发现了在应用于再生医疗时特别有利的制作方法。
以下的发明主要基于以上的成果。
[1]一种由多能干细胞制作肠道类器官的方法,包括以下的工序(1)~(4):
(1)使多能干细胞向内胚层样细胞分化的工序,
(2)使工序(1)中得到的内胚层样细胞向肠道干细胞样细胞分化的工序,
(3)对工序(2)中得到的肠道干细胞样细胞进行培养,形成球状体的工序,
(4)使工序(3)中形成的球状体分化,形成肠道类器官的工序,包括在上皮生长因子、bmp抑制剂和wnt信号活化剂以及mek1/2抑制剂、dna甲基化抑制剂、tgfβ受体抑制剂和γ-分泌酶抑制剂的存在下的培养。
[2]根据[1]所述的制作方法,其中,所述多能干细胞为诱导多能干细胞或胚胎干细胞。
[3]根据[1]或[2]所述的制作方法,其中,所述多能干细胞为人或灵长类的细胞。
[4]根据[1]所述的制作方法,其中,所述多能干细胞为人诱导多能干细胞,工序(2)包括在fgf4和wnt激动剂的存在下的培养。
[5]根据[4]所述的制作方法,其中,所述人诱导多能干细胞为来自肠疾病患者的诱导多能干细胞。
[6]根据[1]所述的制作方法,其中,所述多能干细胞为食蟹猴诱导多能干细胞,工序(2)包含在fgf2和gsk-3抑制剂的存在下的培养。
[7]根据[1]~[6]中任一项所述的制作方法,其中,在工序(3)的培养中,使用均匀形状和大小的多个孔形成为细胞低粘附性或细胞非粘附性的培养面的培养容器来汇集地形成多个球状体。
[8]根据[1]~[7]中任一项所述的制作方法,其中,bmp抑制剂为noggin,wnt信号活化剂为r-spondin-1。
[9]根据[1]~[8]中任一项所述的制作方法,其中,mek1/2抑制剂为pd98059,dna甲基化抑制剂为5-氮杂-2’-脱氧胞苷,tgfβ受体抑制剂为a-83-01,γ-分泌酶抑制剂为n-[(3,5-二氟苯基)乙酰基]-l-丙氨酰基-2-苯基-1,1-二甲基乙基酯-甘氨酸。
[10]根据[1]~[9]中任一项所述的制作方法,其中,在工序(4)的培养中使用添加了在水溶液中形成三维网状结构的材料的液体培养基,将工序(3)中形成的多个球状体汇集地进行悬浮培养。
[11]根据[10]所述的制作方法,其中,所述材料为选自高分子凝胶和多糖中的一种以上的材料。
[12]根据[10]所述的制作方法,其中,所述材料包含脱酰化结冷胶。
[13]根据[1]~[12]中任一项所述的制作方法,其中,工序(4)的培养时间为12天~36天。
[14]根据[1]~[12]中任一项所述的制作方法,其中,工序(4)包括以下的工序(4-1)和工序(4-2):
(4-1)在上皮生长因子、bmp抑制剂和wnt信号活化剂的存在下进行培养的工序;
(4-2)在上皮生长因子、bmp抑制剂和wnt信号活化剂以及mek1/2抑制剂、dna甲基化抑制剂、tgfβ受体抑制剂和γ-分泌酶抑制剂的存在下进行培养的工序。
[15]根据[14]所述的制作方法,其中,工序(4-1)的培养时间为3天~15天,工序(4-2)的培养时间为3天~21天。
[16]一种肠道类器官,是通过[1]~[15]中任一项所述的制作方法而得到的。
[17]一种使用[16]所述的肠道类器官评价被检物质的药代动力学或毒性的方法。
[18]根据[17]所述的评价方法,其中,所述药代动力学为代谢、吸收性、膜透性、药物相互作用、药物代谢酶的诱导或药物转运蛋白的诱导。
[19]根据[18]所述的方法,包括以下的工序(i)和(ii):
(i)使被检物质与[16]所述的肠道类器官接触的工序,
(ii)对被检物质的代谢、吸收性、膜透性、药物相互作用、药物代谢酶的诱导或药物转运蛋白的诱导、或者毒性进行测定·评价的工序。
[20]一种移植材料,包含[16]所述的肠道类器官。
附图说明
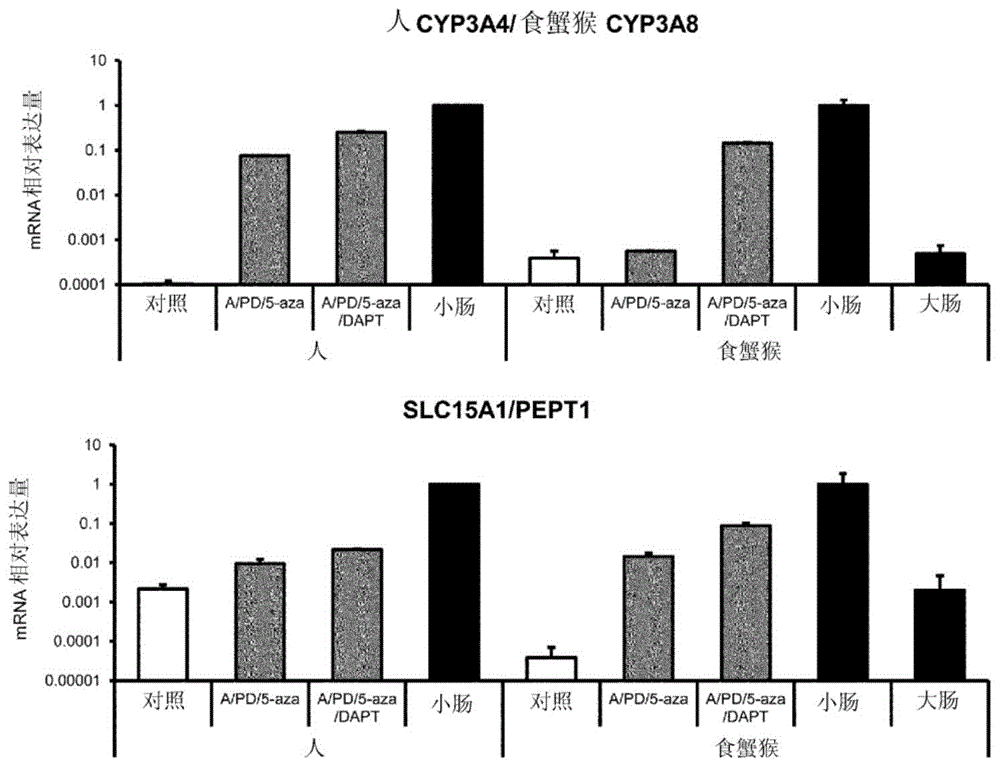
图1-1是低分子化合物对由人和食蟹猴ips细胞向肠道类器官的分化的效果。以平均±s.d.(n=3)显示数据。对照为低分子化合物非添加组。将小肠的值作为基准(小肠=1)。
图1-2是图1的延续。
图1-3是图1的延续。
图1-4是图1的延续。
图1-5是图1的延续。
图1-6是图1的延续。
图1-7是图1的延续。
图2是通过低分子化合物的新型组合而分化诱导的人和食蟹猴肠道类器官的形态学观察。(a),(b):明视场观察。比例尺500μm。(c),(d):利用透射型电子显微镜观察微绒毛(mv:黑色箭头尖端)、紧密连接(tj:白色箭头尖端)。比例尺1μm。(e)-(g):he染色。比例尺100μm。(h)-(j):阿尔新蓝染色(黑色箭头)。比例尺100μm。
图3是通过低分子化合物的新型组合而分化诱导的人和食蟹猴肠道类器官的免疫荧光染色。(a)-(c):绒毛蛋白/olfm4。(d)-(f):e-cad(上皮细胞粘附因子)/muc2。(g)-(i):e-cad/chga(嗜铬粒蛋白a)。(j)-(l):e-cad/lyso(溶菌酶)。(m)-(o):vim(波形蛋白:成纤维细胞标记物)/α-sma(平滑肌标记物)。dapi:核染色。比例尺50μm。
图4是通过低分子化合物的新型组合而分化诱导的人和食蟹猴肠道类器官的功能性紧密连接的形成。(a)-(c):咬合蛋白的免疫荧光染色。dapi:核染色。比例尺50μm。(d)-(g)利用fitc-葡聚糖4000(fd-4)的摄入试验。fd-4(1mg/ml)37℃、孵育1小时。(d),(e):明视场观察。(f),(g):fd-4的荧光观察。比例尺100μm。
图5是通过低分子化合物的新型组合而分化诱导的人和食蟹猴肠道类器官的转运蛋白的免疫染色。(a)-(c):slc15a1/pept1的免疫荧光染色。(d)-(f):abcb1/mdr1的免疫荧光染色。dapi:核染色。(a)-(e)比例尺50μm。(f)比例尺100μm。
图6是通过低分子化合物的新型组合而分化诱导的人肠道类器官的使用罗丹明123的abcb1/mdr1的功能评价。在作为abcb1/mdr1的抑制剂的维拉帕米(100μmol/l)的非存在下(a,b)和存在下(c,d)添加罗丹明123(10μmol/l),在37℃孵育1小时。比例尺100μm。
图7是通过低分子化合物的新型组合而分化诱导的人和食蟹猴肠道类器官的cyp3a诱导能力。平均±s.d.(n=3);对照;诱导剂非添加组。**p<0.01,*p<0.05vs对照组(人)。
图8是通过低分子化合物的新型组合而分化诱导的食蟹猴肠道类器官的cyp3a8代谢活性。平均±s.d.(n=4);对照;酮康唑非添加组。
图9是由诱导多能干细胞向肠道类器官的新型分化方案。(a)是由人ips细胞向肠道类器官的分化方案。(b)是由食蟹猴ips细胞向肠道类器官的分化方案。作为低分子化合物的组合,对以下的2种进行比较·研究。a/pd/5-aza:a-83-01(0.5μmol/l)、pd98059(20μmol/l)、5-氮杂-2’-脱氧胞苷(5μmol/l)添加组。a/pd/5-aza/dapt:a-83-01(0.5μmol/l)、pd98059(20μmol/l)、5-氮杂-2’-脱氧胞苷(5μmol/l)、dapt(5μmol/l)添加组。
图10-1是多糖类聚合物(fp001、fp003)对由人ips细胞向肠道类器官的分化的效果。以平均±s.d.(n=3)显示数据。将小肠的值作为基准(小肠=1)。*p<0.05,**p<0.01vs基质胶
图10-2是图10的延续。
图10-3是图10的延续。
图10-4是图10的延续。
图11是使用多糖类聚合物(fp001、fp003)分化诱导的人肠道类器官的形态学观察。(a)-(c):明视场观察。比例尺500μm。(d)-(f):he染色。比例尺100μm。
图12是使用多糖类聚合物(fp001、fp003)分化诱导的人肠道类器官的免疫荧光染色。(a)-(c):绒毛蛋白/olfm4。(d)-(f):cdx2(肠道谱系的细胞)/muc2。(g)-(i):e-cad(上皮细胞粘附因子)/chga(嗜铬粒蛋白a)。(j)-(l):ki67(增殖细胞标记物)/lgr5(干细胞标记物)。(m)-(o):e-cad/lyso(溶菌酶)。(p)-(r):vim(波形蛋白:成纤维细胞标记物)/α-sma(平滑肌标记物)。(s)-(u):咬合蛋白(紧密连接)。(v)-(x):abcg2/bcrp(排出转运蛋白)。dapi:核染色。比例尺50μm。
图13是使用多糖类聚合物(fp001、fp003)分化诱导的人肠道类器官的使用罗丹明123的abcb1/mdr1的功能评价。作为abcb1/mdr1的抑制剂,使用维拉帕米(100μmol/l)。以平均±s.d.(n=3)显示数据。将对照组(抑制剂非添加)的值作为基准(对照组=1)。*p<0.05vs对照组。
图14是使用多糖类聚合物(fp001、fp003)分化诱导的人肠道类器官的使用hoechst33342的abcg2/bcrp的功能评价。作为abcg2/bcrp的抑制剂,使用ko143(20μmol/l)。以平均±s.d.(n=3)显示数据。将对照组(抑制剂非添加)的值作为基准(对照组=1)。*p<0.05vs对照组。
图15是使用多糖类聚合物(fp001、fp003)分化诱导的人肠道类器官的cyp3a4诱导能力。(a)以平均±s.d.(n=3)显示数据。对照;诱导剂非添加组。**p<0.01,*p<0.05vs对照组。将对照组的值作为基准(对照组=1)。(b)以平均±s.d.(n=4)显示数据。对照;诱导剂非添加组。**p<0.01,*p<0.05vs对照组。
图16是使用多糖类聚合物分化诱导的人肠道类器官的cyp3a4代谢活性。以平均±s.d.(n=4)显示数据。对照;酮康唑非添加组。n.d.;未检测出。**p<0.01,*p<0.05vs对照组。
具体实施方式
1.制作肠道类器官的方法
本发明涉及由多能干细胞制作肠道类器官的方法(以下,也称为“本发明的制作方法”)。根据本发明,可得到显示与生物体的肠道组织类似的特性的(模拟了肠道组织的)三维组织结构体即肠道类器官。
“多能干细胞”是指兼具可分化成为构成生物体的全部细胞的能力(分化多能性)和经由细胞分裂产生具有与自身相同的分化潜能的子细胞的能力(自我复制能力)的细胞。分化多能性可以通过将评价对象的细胞移植到裸鼠中并检测有无形成包含三胚层(外胚层、中胚层、内胚层)的各细胞的畸胎瘤来进行评价。
作为多能干细胞,可举出胚胎干细胞(es细胞)、胚胎生殖细胞(eg细胞)、诱导多能干细胞(ips细胞)等,只要是兼具分化多能性和自我复制能力的细胞就并不限定于此。优选使用es细胞或ips细胞。进一步优选使用ips细胞。多能干细胞优选为哺乳动物(例如,人、黑猩猩、食蟹猴等灵长类,小鼠、大鼠等啮齿类)的细胞,特别优选为人的细胞。
es细胞例如可以通过培养着床以前的早期胚胎、构成该早期胚胎的内部细胞团、单个分裂球等而建立(manipulatingthemouseembryoalaboratorymanual,secondedition,coldspringharborlaboratorypress(1994);thomson,j.a.etal.,science,282,1145-1147(1998))。作为早期胚胎,可以使用通过对体细胞的核进行核移植而制作的早期胚胎(wilmutetal.(nature,385,810(1997))、cibellietal.(science,280,1256(1998))、入谷明等(蛋白质核酸酶,44,892(1999))、baguisietal.(naturebiotechnology,17,456(1999))、wakayamaetal.(nature,394,369(1998);naturegenetics,22,127(1999);proc.natl.acad.sci.usa,96,14984(1999))、rideoutiiietal.(naturegenetics,24,109(2000)、tachibanaetal.(humanembryonicstemcellsderivedbysomaticcellnucleartransfer,cell,153,1228-1238(2013))。作为早期胚胎,也可以使用单性生殖胚胎(kimetal.(science,315,482-486(2007))、nakajimaetal.(stemcells,25,983-985(2007))、kimetal.(cellstemcell,1,346-352(2007))、revazovaetal.(cloningstemcells,9,432-449(2007))、revazovaetal.(cloningstemcells,10,11-24(2008))。除上述论文以外,对于es细胞的制作,参考strelchenkon.,etal.reprodbiomedonline.9:623-629,2004;klimanskayai.,etal.nature444:481-485,2006;chungy.,etal.cellstemcell2:113-117,2008;zhangx.,etalstemcells24:2669-2676,2006;wassarman,p.m.etal.methodsinenzymology,vol.365,2003等。应予说明,通过es细胞与体细胞的细胞融合而得到的融合es细胞也包含在本发明的制作方法所使用的胚胎干细胞中。
es细胞中也存在可以从保藏机关获得的es细胞或市售的es细胞。例如,对于人es细胞,可以从京都大学再生医科学研究所(例如khes-1、khes-2和khes-3)、wicellresearchinstitute、esibio等获得。
eg细胞可以通过将原始生殖细胞在lif、bfgf、scf的存在下进行培养等而建立(matsuietal.,cell,70,841-847(1992)、shamblottetal.,proc.natl.acad.sci.usa,95(23),13726-13731(1998)、turnpennyetal.,stemcells,21(5),598-609,(2003))。
“诱导多能干细胞(ips细胞)”是通过利用初始化因子的导入等将体细胞进行重编程而制作的具有多能性(多分化潜能)和增殖能力的细胞。诱导多能干细胞显示与es细胞接近的性质。ips细胞的制作中使用的体细胞没有特别限定,可以为已分化的体细胞,也可以为未分化的干细胞。另外,其来源也没有特别限定,优选使用哺乳动物(例如,人、黑猩猩、食蟹猴等灵长类,小鼠、大鼠等啮齿类)的体细胞,特别优选使用人的体细胞。ips细胞可以通过迄今为止报告的各种方法来制作。另外,当然也可想到应用今后开发的ips细胞制作法。
如果使用来自肠疾病患者的ips细胞(由患者的体细胞制备的ips细胞),可以制作疾病特异性的肠道类器官。该ips细胞可由从患者采取的体细胞(例如皮肤、血液、单核细胞等)制备。作为在此的肠疾病的例子,可举出难治性炎症性肠疾病(克罗恩氏病、溃疡性大肠炎)、息肉、大肠癌、药剂性肠炎等。疾病特异性的肠道类器官作为肠道病理模型有用,可期待在药剂评价系统中的利用,有助于阐明疾病的机制(与发病、病理形成、进展有关的分子机制等)。
ips细胞制作法的最基本的方法是将作为转录因子的oct3/4、sox2、klf4和c-myc的4个因子利用病毒导入细胞的方法(takahashik,yamanakas:cell126(4),663-676,2006;takahashi,k,etal:cell131(5),861-72,2007)。对于人ips细胞,有通过oct4、sox2、lin28和nonog这个4种因子的导入而建立的报告(yuj,etal:science318(5858),1917-1920,2007)。也报告了通过除c-myc以外的3个因子(nakagawam,etal:nat.biotechnol.26(1),101-106,2008)、oct3/4和klf4这2种因子(kimjb,etal:nature454(7204),646-650,2008)或者仅oct3/4(kimjb,etal:cell136(3),411-419,2009)的导入而建立ips细胞。另外,也报告了将作为基因的表达产物的蛋白质导入细胞的方法(zhouh,wus,joojy,etal:cellstemcell4,381-384,2009;kimd,kimch,moonji,etal:cellstemcell4,472-476,2009)。另一方面,也有可以通过使用针对组蛋白甲基转移酶g9a的抑制剂bix-01294、组蛋白脱乙酰化酶抑制剂丙戊酸(vpa)或bayk8644等来提高制作效率、减少导入的因子等这样的报告(huangfud,etal:nat.biotechnol.26(7),795-797,2008;huangfud,etal:nat.biotechnol.26(11),1269-1275,2008;silvaj,etal:plos.biol.6(10),e253,2008)。对基因导入法也进行了研究,除逆转录病毒以外,还开发了将慢病毒(yuj,etal:science318(5858),1917-1920,2007)、腺病毒(stadtfeldm,etal:science322(5903),945-949,2008)、质粒(okitak,etal:science322(5903),949-953,2008)、转座子载体(woltjenk,michaelip,mohsenip,etal:nature458,766-770,2009;kajik,norrbyk,pacaa,etal:nature458,771-775,2009;yusak,radr,takedaj,etal:natmethods6,363-369,2009)或附加型载体(yuj,huk,smuga-ottok,tians,etal:science324,797-801,2009)用于基因导入的技术。
对于产生了向ips细胞的转化、即初始化(重编程)的细胞,可以将fbxo15、nanog、oct/4、fgf-4、esg-1和cript等多能干细胞标记物(未分化标记物)的表达等作为指标而进行选择。将所选择的细胞作为ips细胞进行回收。
ips细胞例如也可以由国立大学法人京都大学或独立行政法人理化学研究所生物资源中心提供。
在本说明书中,“分化”、“诱导”这样的术语是指以沿特定的细胞谱系进行分化的方式推进。在本发明中,使多能干细胞向肠道类器官分化。本发明的制作方法大致分为4个阶段的培养工序,即,(1)使多能干细胞向内胚层样细胞分化的工序(工序(1)),使工序(1)中得到的内胚层样细胞向肠道干细胞样细胞分化的工序(工序(2)),将工序(2)中得到的肠道干细胞样细胞进行培养,形成球状体的工序(工序(3)),以及使工序(3)中形成的球状体分化,形成肠道类器官的工序,包括在上皮生长因子、bmp抑制剂和wnt信号活化剂以及mek1/2抑制剂、dna甲基化抑制剂、tgfβ受体抑制剂和γ-分泌酶抑制剂的存在下的培养的工序(工序(4))。以下,对各工序的详细情况进行说明。
<工序(1)向内胚层样细胞的分化>
在该工序中,将多能干细胞进行培养,使其向内胚层样细胞分化。换言之,在诱导向内胚层样细胞的分化的条件下培养多能干细胞。只要多能干细胞向内胚层样细胞分化,培养条件就没有特别限定。例如,依据常规方法,在添加了激活素a的培养基中进行培养。此时,使培养基中的激活素a的浓度为例如10ng/ml~200ng/ml,优选为20ng/ml~150ng/ml。从细胞的增殖率、维持等观点考虑,优选在培养基中添加血清或血清替代物(knockoutserumreplacement(ksr)等)。血清不限于胎牛血清,也可以使用人血清、羊血清等。血清或血清替代物的添加量例如为0.1%(v/v)~10%(v/v)。
也可以将wnt/β-联蛋白信号通路的抑制剂(例如,六氯酚、槲皮素、作为wnt配体的wnt3a)添加于培养基来谋求促进向内胚层样细胞的分化。
作为工序(1),可以进行2个阶段的培养。在第1阶段的培养中,在添加了较低浓度的血清(例如,0.1%(v/v)~1%(v/v))的培养基中进行,在接下来的第2阶段的培养中,在与第1阶段的培养相比提高了血清浓度的培养基(使血清浓度为例如1%(v/v)~10%(v/v))中进行。从通过第1阶段的培养而抑制未分化细胞的增殖、通过接下来的第2阶段而使已分化的细胞增殖的方面出发,优选如此采用2个阶段的培养。
工序(1)的时间(培养时间)例如为1天~10天,优选为2天~7天。采用2个阶段的培养作为作为工序(1)时,使第1阶段的培养时间为例如1天~7天、优选为2天~5天,使第2阶段的培养时间为例如1天~6天、优选为1天~4天。
<工序(2)向肠道干细胞样细胞的分化>
在该工序中,将工序(1)中得到的内胚层样细胞进行培养,使其向肠道干细胞样细胞分化。换言之,在诱导向肠道干细胞样细胞的分化的条件下培养内胚层细胞。只要内胚层样细胞向肠道干细胞样细胞分化,则培养条件没有特别限定。使用人细胞作为供于工序(1)的多能干细胞时,优选在fgf4(成纤维细胞增殖因子4)和wnt激动剂(例如wnt3a、bml-284、2-氨基-4-(3,4-(亚甲基二氧基)苄基氨基)-6-(3-甲氧基苯基)嘧啶等)的存在下进行培养。作为fgf4,优选使用人fgf4(例如人重组fgf4)。另一方面,使用食蟹猴细胞、猕猴细胞、黑猩猩细胞等作为供于工序(1)的多能干细胞时,优选在fgf2(成纤维细胞增殖因子2)和gsk-3抑制剂(例如chir99021、chir98014、bio、sb415286、sb216763、tws119、a1070722等)的存在下进行培养。作为fgf2,使用例如人fgf2(例如人重组fgf2)。
典型而言,将经过工序(1)而得到的细胞群体或其一部分在不进行筛选的情况下供于工序(2)。另一方面,也可以在从经过工序(1)而得到的细胞群体中筛选了内胚层样细胞的基础上实施工序(2)。内胚层样细胞的筛选例如只要以细胞表面标记物作为指标利用流式细胞仪(细胞分选仪)进行即可。
“在fgf4和wnt激动剂的存在下”与在培养基中添加有fgf4和wnt激动剂的条件意义相同。因此,为了进行在fgf4和wnt激动剂的存在下的培养,只要使用添加有fgf4和wnt激动剂的培养基即可。如果示出fgf4的添加浓度的例子,则为100ng/ml~5μg/ml,优选为300ng/ml~1μg/ml。另外,如果示出wnt激动剂的添加浓度的例子(wnt3a的情况),则为100ng/ml~5μg/ml,优选为300ng/ml~1μg/ml。
同样地,“在fgf2和gsk-3抑制剂的存在下”与在培养基中添加有fgf2和gsk-3抑制剂的条件意义相同。因此,为了进行在fgf2和gsk-3抑制剂的存在下的培养,只要使用添加有fgf2和gsk-3抑制剂的培养基即可。如果示出fgf2的添加浓度的例子,则为50ng/ml~2.5μg/ml,优选为150ng/ml~500ng/ml。另外,如果示出gsk-3抑制剂的添加浓度的例子(chir99021的情况),则为600nmol/l~60μmol/l,优选为1μmol/l~20μmol/l。
应予说明,对于使用与例示的化合物、即wnt3a、chir99021不同的化合物时的添加浓度,考虑到使用的化合物的特性与例示的化合物的特性的不同(特别是活性的不同),对于本领域从业人员而言可以依据上述浓度范围进行设定。另外,设定的浓度范围是否适当可以通过依据后述的实施例的初步实验来确认。
工序(2)的时间(培养时间)例如为2天~10天,优选为3天~7天。如果该培养时间过短,则无法充分地得到所期待的效果(提高分化效率、促进作为肠道干细胞的功能的获得)。另一方面,如果该培养时间过长,则引起分化效率的降低。
向肠道干细胞样细胞的分化例如可以以肠道干细胞标记物的表达为指标进行判定或评价。如果举出肠道干细胞标记物的例子,则为包含富含亮氨酸重复序列的g蛋白偶联受体5(lgr5)、肝配蛋白b2受体(ephb2)。
<工序(3)球状体的形成>
在该工序中,将工序(2)中得到的肠道干细胞样细胞进行培养,形成球状体。为了形成球状体,优选悬浮培养。在悬浮培养中,通常,使用具备细胞低粘附性或细胞非粘附性的培养面(例如,通过聚合物材料、水凝胶等的处理/结合而赋予了细胞低粘附性/细胞非粘附性的培养面)的培养容器,在与培养面离开的状态(即悬浮状态)下培养细胞。悬浮培养中使用的培养容器没有特别限定,例如可以使用皿、烧瓶、微孔板、管、托盘、培养袋等。优选使用均匀形状和大小的多个孔形成为细胞低粘附性或细胞非粘附性的培养面的培养容器(一般被称为模板。作为具体例,可举出agctechnoglass株式会社提供的ezsphere(注册商标)、kuraray株式会社提供的elplasia等),汇集地形成多个球状体。这样,能够高效地形成球状体,进而肠道类器官的制作效率提高。
在悬浮培养时,只要能够维持对培养面的非粘附状态,则可以将细胞/细胞团进行静置培养,也可以进行回转培养、振荡培养。优选通过静置培养进行在此的悬浮培养。静置培养具有不需要特别的装置、可期待对细胞的冲击或损伤也少、也能够减少培养液的量等许多优点。
只要能够形成球状体,则培养条件没有特别限定。典型而言,为了一边维持干细胞性一边形成球状体,在上皮生长因子(egf)、bmp抑制剂和wnt信号活化剂的存在下,即,使用添加有这些成分的培养基进行悬浮培养。
通过使用上皮生长因子,则可以期待促进细胞增殖的效果。另外,通过使用bmp抑制剂,可以期待抑制干细胞的分化,维持干细胞性的效果。对于wnt信号活化剂而言,可以期待维持干细胞的增殖和干细胞性的效果。
作为bmp抑制剂,例如可以使用noggin。另外,作为wnt信号活化剂,例如可以使用r-spondin-1。
如果示出上皮生长因子的添加浓度的例子,则为10ng/ml~500ng/ml,优选为50ng/ml~200ng/ml。如果示出bmp抑制剂的添加浓度的例子(noggin的情况),则为10ng/ml~500ng/ml,优选为50ng/ml~200ng/ml。同样地,如果示出wnt信号活化剂的添加浓度的例子(r-spondin-1的情况),则为10ng/ml~1000ng/ml,优选为50ng/ml~500g/ml。
应予说明,对于使用与例示的化合物、即noggin、r-spondin-1不同的化合物时的添加浓度,考虑到使用的化合物的特性与例示的化合物的特性的不同(特别是活性的不同),对于本领域技术人员而言可以依据上述浓度范围进行设定。另外,设定的浓度范围是否适当可以通过依据后述的实施例的初步实验来确认。
工序(3)的时间(培养时间)例如为1天~10天,优选为2天~7天。如果该培养时间过短,则无法形成充分大小的球状体。另一方面,如果该培养时间过长,则球状体超出必要地变大,内部的细胞有可能发生坏死。优选形成直径为100μm~200μm左右的球状体。例如,可以通过使用均匀地形成有直径为400~500μm、深度为100~200μm的孔的模板而形成该尺寸的球状体。
<工序(4)肠道类器官的形成>
在该工序中,使工序(3)中形成的球状体分化,形成肠道类器官。为了该目的,进行在上皮生长因子、bmp抑制剂和wnt信号活化剂以及mek1/2抑制剂、dna甲基化抑制剂、tgfβ受体抑制剂和γ-分泌酶抑制剂的存在下的培养。使用mek1/2抑制剂、dna甲基化抑制剂、tgfβ受体抑制剂和γ-分泌酶抑制剂的组合这方面在本发明中是特别的特征,有助于提高分化诱导效率、促进肠道类器官的成熟化。
该工序的培养中使用的因子中,对于上皮生长因子、bmp抑制剂和wnt信号活化剂的具体例、添加浓度等,与工序(3)的情况同样,因此,省略其其说明。
作为mek1/2抑制剂,可举出pd98059、pd184352、pd184161、pd0325901、u0126、mekinhibitori、mekinhibitorii、mek1/2inhibitorii、sl327。同样地,作为dna甲基化抑制剂,可举出5-氮杂-2’-脱氧胞苷、5-氮杂胞苷、rg108、折布拉林。对于tgfβ受体抑制剂,优选可以使用对tgf-β受体alk4、alk5、alk7中的一种以上显示抑制活性的tgfβ受体抑制剂。例如,a-83-01、sb431542、sb-505124、sb525334、d4476、alk5inhibitor、ly2157299、ly364947、gw788388、repsox满足该条件。如果举出γ-分泌酶抑制剂的例子,则可举出n-[(3,5-二氟苯基)乙酰基]-l-丙氨酰基-2-苯基-1,1-二甲基乙基酯-甘氨酸(dapt)、l-685,458、化合物e(cas209986-17-4)、(r)-氟比洛芬、bms299897、jlk6、ly-411575、r04929097、mk-0752、scp0004、scp0025、γ-分泌酶抑制剂xi、γ-分泌酶抑制剂xvi、γ-分泌酶抑制剂i、γ-分泌酶抑制剂vii、司马西特(ly450139)、γ-分泌酶抑制剂iii、化合物34、bms-708163、化合物w、yo-01027(二苯扎西平)、阿加司他(bms-708163)。
如果示出mek1/2抑制剂的添加浓度的例子(pd98059的情况),则为4μm~100μm,优选为10~40μm。同样地,如果示出dna甲基化抑制剂的添加浓度的例子(5-氮杂-2’-脱氧胞苷的情况),则为1μm~25μm,优选为2.5μm~10μm,如果示出tgfβ受体抑制剂的添加浓度的例子(a-83-01的情况),则为0.1μm~2.5μm,优选为0.2μm~1μm,如果示出γ-分泌酶抑制剂的添加浓度的例子(dapt的情况),则为1nm~20μm,优选为0.1μm~10μm。
应予说明,对于使用与例示的化合物、即pd98059、5-氮杂-2’-脱氧胞苷、a-83-01、dapt不同的化合物时的添加浓度,考虑到使用的化合物的特性与例示的化合物的特性的不同(特别是活性的不同),则对于本领域技术人员而言可以依据上述浓度范围进行设定。另外,设定的浓度范围是否适当可以通过依据后述的实施例的初步实验来确认。
为了由球状体形成肠道类器官,工序(4)的培养以悬浮培养进行。在此的悬浮培养优选使用添加了在水溶液中形成三维网状结构的材料的液体培养基,将工序(3)中形成的多个球状体汇集地(即,多个球状体并存于一个培养容器内的状态)进行悬浮培养。即,在优选的方式中,工序(3)中形成的球状体的一部分(其中2个以上)或全部被供于使用了特征性的液体培养基的悬浮培养。
通过使用在水溶液中形成三维网状结构的材料(以下,称为“粘性材料”),将球状体捕捉或捕获在网状结构中,或者培养基的粘性升高而球状体的运动受到限制,能够防止球状体的缔合、凝聚。因此,能够将多个球状体汇集地进行悬浮培养,能够进行有效率的肠道类器官的形成。
作为粘性材料,例如可以使用高分子凝胶、多糖。高分子凝胶的例子为胶原蛋白、高分子水凝胶、基质胶tm(通常的基质胶、减少了生长因子的含量的生长因子减少(gfr)基质胶等)。多糖的例为结冷胶、结晶纤维素、纳米纤维素、羧基纤维素、羧甲基纤维素等。可以将2种以上的材料并用。
在优选的一个方式中,作为粘性材料,可使用具有阴离子性的官能团的高分子化合物。作为阴离子性的官能团,可举出羧基、磺基、磷酸基和它们的盐,优选羧基或其盐。本发明中使用的高分子化合物可以使用具有选自上述阴离子性的官能团中的1种或2种以上的高分子化合物。作为在此的高分子化合物的优选的具体例,没有特别限制,可举出10个以上的单糖类(例如,三碳糖、四碳糖、五碳糖、六碳糖、七碳糖等)聚合而成的多糖类,更优选可举出具有阴离子性的官能团的酸性多糖类。在此所谓的酸性多糖类只要在其结构中具有阴离子性的官能团就没有特别限制,例如为具有糖醛酸(例如,葡糖醛酸、艾杜糖醛酸、半乳糖醛酸、甘露糖醛酸)的多糖类、在结构中的一部分中具有硫酸基或磷酸基的多糖类或者具有这两种结构的多糖类,不仅包括天然得到的多糖类,还包括由微生物产生的多糖类、基因工程产生的多糖类或者使用酶而人工合成的多糖类。更具体而言,可例示由选自透明质酸、结冷胶、脱酰化结冷胶、鼠李聚糖胶、迪特胶(diutangum)、黄原胶、角叉菜胶、汉生胶、已糖醛酸、岩藻依聚糖、果胶、果胶酸、果胶酯酸、硫酸乙酰肝素、肝素、硫酸类肝素、硫酸角质、硫酸软骨素、硫酸皮肤素、硫酸鼠李聚糖和它们的盐中的1种或2种以上构成的多糖类。多糖类优选为透明质酸、脱酰化结冷胶、迪特胶、黄原胶、角叉菜胶或它们的盐,如果考虑能够以低浓度的使用而实现目的等,则最优选为脱酰化结冷胶。在此所谓的盐例如可举出锂、钠、钾之类的碱金属的盐,钙、钡、镁之类的碱土金属的盐,或者铝、锌、铜、铁、铵、有机碱和氨基酸等的盐。
上述高分子化合物(多糖类等)的重均分子量优选为10000~50000000,更优选为100000~20000000,进一步优选为1000000~10000000。例如,该分子量可以通过基于凝胶渗透色谱法(gpc)的普鲁兰多糖换算进行测定。
进而,脱酰化结冷胶也可以使用磷酸化的结冷胶。该磷酸化可以通过公知的方法进行。
在本发明中,可以组合多种(优选2种)上述多糖类。多糖类的组合的种类只要能够防止球状体的缔合、凝聚就没有特别限定,优选该组合至少包含脱酰化结冷胶或其盐。即,优选的多糖类的组合包含脱酰化结冷胶或其盐、以及脱酰化结冷胶或其盐以外的多糖类(例如,黄原胶、海藻酸、角叉菜胶、迪特胶、甲基纤维素、刺槐豆胶或它们的盐)。作为具体的多糖类的组合,可举出脱酰化结冷胶与鼠李聚糖胶、脱酰化结冷胶与迪特胶、脱酰化结冷胶与黄原胶、脱酰化结冷胶与角叉菜胶、脱酰化结冷胶与汉生胶、脱酰化结冷胶与刺槐豆胶、脱酰化结冷胶与κ-角叉菜胶、脱酰化结冷胶与海藻酸钠、脱酰化结冷胶与甲基纤维素等,但并不限定于这些。
作为本发明中使用的粘性材料的进一步优选的具体例,可举出透明质酸、脱酰化结冷胶、迪特胶、角叉菜胶和黄原胶以及它们的盐,作为最优选的例子,可举出脱酰化结冷胶或其盐。在脱酰化结冷胶的情况下,可以使用市售的物质,例如、三晶株式会社制“kelcogel(cp·kelco公司的注册商标)cg-la”、三荣源f·f·i株式会社制“kelcogel(cp·kelco公司的注册商标)”等。另外,作为天然型结冷胶,可以使用三荣源f·f·i株式会社制“kelcogel(cp·kelco公司的注册商标)ht”等。作为特别优选的粘性材料的例子,可举出日产化学工业株式会社提供的聚合物fp001或聚合物fp003。应予说明,聚合物fp001为日产化学工业株式会社制的三维培养培养基fcem(注册商标)系列的配合成分,聚合物fp003为该fcem(注册商标)预制备试剂盒的配合成分。
粘性材料的使用量、即向培养基的添加量只要能够发挥所期待的上述效果就没有特别限定,例如以培养基的粘度成为5mpas·s~2000mpas·s的方式调整粘性材料的使用量。如果培养基的粘度过低,则得不到防止球状体的缔合、凝聚这样的效果。另一方面,如果培养基的粘度过高,则也有可能对操作性(处理)造成影响(例如,回收操作变得繁杂),对培养基成分向细胞的供给造成影响。应予说明,作为粘性材料的使用量的具体例,如果示出基质胶的情况,则可以为通常的使用(即作为三维培养用的基材的使用)中的使用量的1%~10%左右。另外,在脱酰化结冷胶的情况下,可以在培养基中添加0.001%~1.0%(w/v)、优选0.003%~0.5%(w/v)、更优选0.005%~0.3%(w/v)、进一步优选0.01%~0.05%(w/v)、最优选0.01%~0.03%(w/v)。
悬浮培养中使用的培养容器没有特别限定,例如可以使用皿、烧瓶、微孔板、管、托盘、培养袋等。
应予说明,工序(4)的时间(培养时间)例如为12天~36天。
作为工序(4),优选依次进行以下的工序(4-1)和工序(4-2)。在该方式中,在工序(4-2)中使用工序(4)中特征性的低分子化合物的组合(即,mek1/2抑制剂、dna甲基化抑制剂、tgfβ受体抑制剂和γ-分泌酶抑制剂的组合)。
<工序(4-1)>
该工序可以定位为通过4种低分子化合物(mek1/2抑制剂、dna甲基化抑制剂、tgfβ受体抑制剂和γ-分泌酶抑制剂)的组合来促进积极的分化诱导之前的准备阶段。通过介设该工序,可促进球状体的生长,对构建功能性肠道类器官有利。该工序的培养可以在与工序(3)相同条件(即,在上皮生长因子、bmp抑制剂和wnt信号活化剂的存在下的悬浮培养)下进行,但优选使用添加了在水溶液中形成三维网状结构的材料(粘性材料)的液体培养基,将工序(3)中形成的多个球状体汇集地进行悬浮培养,从而谋求操作性和效率性的提高。
工序(4-1)的时间(培养时间)例如为3天~15天,优选为6天~12天。如果该培养时间过短,则球状体小,容易引起细胞死亡。另一方面,如果该培养时间过长,则得不到基于低分子化合物的充分的效果。
<工序(4-2)>
在该工序中,进行在上皮生长因子、bmp抑制剂和wnt信号活化剂以及mek1/2抑制剂、dna甲基化抑制剂、tgfβ受体抑制剂和γ-分泌酶抑制剂的存在下的悬浮培养,促进积极的分化诱导,形成肠道类器官。培养条件与上述工序(4)的培养条件同样,因此,省略其说明。
工序(4-2)的时间(培养时间)例如为3天~21天,优选为9天~18天。如果该培养时间过短,则无法带来充分的功能提高。另一方面,如果该培养时间过长,则由于对球状体的损伤而有可能引起细胞死亡。
构成本发明的各工序(工序(1)、工序(2)、工序(3)、工序(4)、工序(4-1)、工序(4-2))中的其它培养条件(培养温度等)只要是在动物细胞的培养中通常采用的条件即可。即,只要在例如37℃、5%co2的环境下进行培养即可。另外,作为基本培养基,可以使用伊思考夫改良杜尔贝可培养基(imdm)(gibco公司等)、hamf12培养基(hamf12)(sigma公司、gibco公司等)、杜尔贝科改良伊格尔培养基(d-mem)(nacalaitesque株式会社、sigma公司、gibco公司等)、glasgow基本培养基(gibco公司等)、rpmi1640培养基等。也可以并用两种以上的基本培养基。在工序(3)和工序(4)(进行工序(4-1)和工序(4-2)作为工序(4)时为这些工序)中,优选使用适于上皮细胞的培养的基本培养基(例如d-mem和hamf12培养基的混合培养基、d-mem)。作为可添加于培养基的成分的例子,可举出牛血清白蛋白(bsa)、抗生素、2-巯基乙醇、pva、非必需氨基酸(neaa)、胰岛素、转铁蛋白、硒。
也可以在构成本发明的工序(1)、工序(2)的中途进行传代培养。例如在达到汇合或近汇合时采集细胞的一部分并转移到另一培养容器中,继续培养。细胞的回收只要利用细胞解离液等即可。作为细胞解离液,例如可以单独或适当组合使用胰蛋白酶-edta、胶原酶iv、金属蛋白酶等蛋白水解酶等。优选使用细胞损害性小的细胞解离液。作为这样的细胞解离液,例如可以获得dispase(eidia)、tryple(invitrogen)或accutase(millipore)等市售品。可以以成为分散(离散)状态的方式将回收后的细胞用细胞滤网等处理后,供于传代培养。另一方面,在构成本发明的各工序中,根据需要进行培养基更换。例如,可以以24小时~3天1次的频率进行培养基更换。
在伴随传代培养、培养基更换的细胞回收时,为了抑制细胞死亡,可以利用y-27632等rock抑制剂(rho相关卷曲螺旋形成蛋白激酶/rho结合激酶)预先对细胞进行处理。
根据以上说明的本发明,能够制作功能性的肠道类器官。“功能性的肠道类器官是具有肠道特征性的药物动力学功能的肠道类器官,确认到功能性的紧密连接,具有代谢(吸收、排出)功能。功能性肠道类器官可以通过紧密连接标记物的表达、各种转运蛋白(肽转运蛋白、排出转运蛋白、有机阴离子转运蛋白等)的表达、药物代谢酶的表达/活性等进行评价。另外,药物应答性的有无、程度作为评价肠道类器官的功能性的指标也有用。紧密连接标记物的例子为咬合蛋白,肽转运蛋白的例子为slc15a1/pept1(slc(溶质载体)家族成员15a1/肽转运蛋白1),排出转运蛋白例为abcb1/mdr1(atp结合盒转运蛋白b1/多药抗性蛋白1)、abcc2/mrp2(atp结合盒转运蛋白c2/多药抗性相关蛋白2)、abcg2/bcrp(atp结合盒转运蛋白g2/乳腺癌抗性蛋白),有机阴离子转运蛋白的例子为slco2b1/oatp2b1(slc(溶质载体)有机阴离子转运蛋白2b1),药物代谢酶的例子为cyp3a4(细胞色素p4503a4)、cyp3a8(细胞色素p4503a8)。药物应答性的评价例如可以将介由利福平或维生素d受体的药物代谢酶cyp3a(例如,在人的情况下为cyp3a4,在食蟹猴的情况下为cyp3a8)的表达诱导作为指标。
应予说明,cdx2(尾侧型同源盒2)、嗜铬粒蛋白a、e-cad(e-钙粘蛋白;上皮钙粘蛋白)、lgr5(包含富含亮氨酸重复序列的g蛋白偶联型受体)、溶菌酶、muc2(粘糖蛋白2)、olfm4(嗅素蛋白4)、绒毛蛋白、vim(波形蛋白)等也在评价肠道类器官的结构或功能性方面有用。
2.肠道类器官的用途
本发明的第2方面涉及一种通过本发明的制作方法得到的肠道类器官的用途。作为第1用途,可提供各种分析。本发明的肠道类器官可用于肠道、特别是小肠的模型系统,对肠道、特别是小肠中的药物动力学(吸收、代谢等)的评价、毒性的评价有用。换言之,本发明的肠道类器官可在化合物的药代动力学的评价、毒性的评价中谋求利用。
具体而言,可以使用本发明的肠道上皮细胞样细胞对被检物质的代谢、吸收性、膜透性、药物相互作用、药物代谢酶的诱导、药物转运蛋白的诱导、毒性等进行试验。即,作为肠道类器官的用途之一,本发明提供对被检物质的代谢、吸收性、膜透性、药物相互作用、药物代谢酶的诱导、药物转运蛋白的诱导、毒性等进行评价的方法。在该该方法中进行如下工序:(i)使被检物质与通过本发明的制作方法得到的肠道类器官接触的工序,以及(ii)对被检物质的代谢、吸收性、膜透性、药物相互作用、药物代谢酶的诱导或药物转运蛋白的诱导、或者毒性进行测定·评价的工序。
工序(i)中的“接触”典型而言通过在培养基中添加被检物质而进行。被检物质的添加时机没有特别限定。因此,可以在不含被检物质的培养基中开始培养后,在某一时刻添加被检物质,也可以在预先含有被检物质的培养基中开始培养。
被检物质可以使用各种分子尺寸的有机化合物或无机化合物。作为有机化合物的例子,可例示核酸、肽、蛋白质、脂质(单纯脂质、复合脂质(磷酸甘油酯、鞘脂、糖基甘油酯、脑苷酯等)、前列腺素、类异戊二烯、萜烯、类固醇、多酚、儿茶素、维生素(b1、b2、b3、b5、b6、b7、b9、b12、c、a、d、e等)。医药品、营养食品、食品添加物、农药、香妆品(化妆品)等现有成分或候选成分也是优选的被检物质之一。也可以将植物提取液、细胞提取液、培养上清液等作为被检物质使用。通过同时添加2种以上的被检物质,可以调查被检物质间的相互作用、协同作用等。被检物质可以为天然物来源,或者也可以为通过合成而得到的物质。在后者的情况下,例如可以利用组合合成的方法来构建有效的分析系统。
使被检物质接触的时间可任意地设定。接触时间例如为10分钟~3天,优选为1小时~1天。也可以分次多次进行接触。
在工序(i)之后,对被检物质的代谢、吸收性、膜透性、药物相互作用、药物代谢酶的诱导、或药物转运蛋白的诱导、或者毒性进行测定·评价(工序(ii))。可以在工序(i)后立刻,即,被检物质接触后,在没有实质性时间间隔的情况下对代谢等进行测定·评价,或者也可以在经过一定时间(例如10分钟~5小时)后对代谢等进行测定·评价。代谢的测定例如可以通过代谢产物的检测来进行。此时,通常将工序(i)后的培养液作为样品,对预想的代谢产物进行定性或定量测定。测定方法只要根据代谢产物选择适当的测定方法即可,例如可以采用质谱、液相色谱法、免疫学方法(例如荧光免疫测定法(fia法)、酶免疫测定法(eia法))等。
典型而言,在检测出被检物质的代谢产物时,判定或评价为“被检物质被代谢”。另外,可以根据代谢产物的量来评价被检物质的代谢量。可以基于代谢产物的检测结果和被检物质的使用量(典型而言是向培养基的添加量)来算出被检物质的代谢效率。
也可以将肠道类器官中的药物代谢酶(细胞色素p450(特别是人为cyp3a4,食蟹猴为cyp3a8)、尿苷二磷酸-葡糖醛酸转移酶(特别是ugt1a8、ugt1a10)、硫酸转移酶(特别是sult1a3等))的表达作为指标来测定被检物质的代谢。药物代谢酶的表达可以通过mrna水平或蛋白质水平来评价。例如,在药物代谢酶的mrna水平确认到上升时,可以判定为“基因水平的表达量上升”。同样地,在药物代谢酶的活性确认到上升时,可以判定为“被检物质被代谢”。与将代谢产物作为指标进行判定的情况同样地,可以基于药物代谢酶的表达量进行定量的判定·评价。
为了评价被检物质的吸收,例如,测定培养液中的被检物质的残留量。通常,对工序(i)后的培养液进行取样而对被检物质进行定量。测定方法只要根据被检物质选择适当的测定方法即可。例如可以采用质谱、液相色谱法、免疫学方法(例如荧光免疫测定法(fia法)、酶免疫测定法(eia法))等。典型而言,在确认到培养液中的被检物质的含量降低时,判定·评价为“被检物质被吸收”。另外,可以根据降低的程度来判定·评价被检物质的吸收量或吸收效率。应予说明,也可以通过测定摄入细胞内的被检物质的量来评价吸收。
应予说明,可以同时或平行进行代谢的测定·评价和吸收的测定·评价。
作为通过本发明的制作方法得到的肠道类器官的第2用途,可提供包含肠道类器官的移植材料。本发明的移植材料可应用于各种肠疾病(例如难治性炎症性肠疾病)的治疗。特别是设想作为受损伤的(包含功能不全的)肠道组织的再生·重建用的材料而利用。即,可以期待有助于再生医疗。本发明的移植材料可以直接或者进行基质胶、胶原蛋白凝胶包埋等处理后作为移植材料进行利用。另外,还设想作为各种肠疾病病理模型的治疗药候选化合物的筛选、病理机制的阐明研究这样的利用形态。为了保护细胞,可以在本发明的移植材料中含有二甲基亚砜(dmso)、血清白蛋白等,为了阻止细菌的混入,可以在本发明的移植材料中含有抗生素等,为了细胞的活性化、增殖或分化诱导等,可以在本发明的移植材料中含有各种成分(维生素类、细胞因子、生长因子、类固醇等)。此外,在本发明的移植材料中也可以含有制剂上允许的其它成分(例如,载体、赋形剂、崩解剂、缓冲剂、乳化剂、悬浮剂、无痛剂、稳定剂、保存剂、防腐剂、生理盐水等)。
本发明的移植材料也能够用于体内实验系统的构建。例如,可以将包含使用人多能干细胞制作的肠道类器官的移植材料移植到小鼠、大鼠、豚鼠、仓鼠、猪、食蟹猴、猕猴、黑猩猩等实验动物,制作人源化动物(人肠道模型)。这样的人源化动物对药物动力学、毒性试验等实验特别有用,可以期待有助于首过效应对口服药的影响、药剂性肠炎等的研究。
对于使用来自肠疾病患者的ips细胞制作的肠道类器官,除可以作为肠道病理模型用于药剂评价系统以外,也可以用于以阐明肠疾病的发病、病理形成和/或进展的机制为目的的研究中的各种实验。
实施例
<来自ips细胞的肠道类器官的制作>
为了创建制作功能性的肠道类器官的新型方法,进行了以下的研究。
1.方法
(1)细胞
人ips细胞(ips-51:windy)是使用泛嗜性逆转录病毒载体将八聚体结合蛋白3/4(oct3/4)、性别决定区y框蛋白2(sox2)、kruppel样因子4(klf4)、v-myc骨髓细胞瘤病毒癌基因同源物(avian)(c-myc)导入人胎儿肺成纤维细胞mrc-5后、对人es细胞样集落进行克隆化而得到的,由国立成育医疗研究中心梅泽明弘博士提供。食蟹猴ips细胞是通过电穿孔法将作为附加型载体的pcxle-hoct3/4-shp53-f、pcxle-hsk、pcxle-hul导入由食蟹猴皮肤组织培养的成纤维细胞后、对食蟹猴es细胞样集落进行克隆化而得到的,由本发明人等建立。饲养细胞使用小鼠胎鼠成纤维细胞(mef)。
(2)培养基
mef的培养使用含有10%胎牛血清(fbs)、2mmol/ll-谷氨酰胺(l-glu)、1%非必需氨基酸(neaa)、100units/ml青霉素g、100μg/ml链霉素的杜尔贝科改良伊格尔培养基(dmem)。mef的剥离液使用0.05%胰蛋白酶-乙二胺四乙酸(edta),mef的保存液使用cellbanker-1。人ips细胞的维持培养使用含有20%knockout血清替代物(ksr)、0.8%neaa、2mmol/ll-glu、0.1mmol/l2-巯基乙醇(2-mee)、5ng/ml成纤维细胞增殖因子(fgf)2的dmemham’sf-12(dmem/f12)。食蟹猴ips细胞的维持培养使用含有20%ksr、1.0%neaa、2mmol/ll-glu、100units/ml青霉素g、100μg/ml链霉素、0.1mmol/l2-mee、5ng/mlfgf2的dmem/f12。人和食蟹猴ips细胞的剥离液使用含有1mg/ml胶原酶iv、0.25%胰蛋白酶、20%ksr、1mmol/l氯化钙的杜尔贝科磷酸缓冲生理盐水(pbs)。人和食蟹猴ips细胞的保存液使用灵长类es/ips细胞用冷冻保存液。
(3)人和食蟹猴ips细胞的培养
人ips细胞接种于实施了丝裂霉素c处理的mef(6×105cells/100mm皿)上,食蟹猴ips细胞接种于实施了丝裂霉素c处理的mef(1×106cells/100mm皿)上,在5%co2/95%空气条件下、在co2培养箱中以37℃进行培养。人和食蟹猴ips细胞的传代在培养3~5天后,以1:2~1:3的分流比进行。人和食蟹猴ips细胞在解冻48小时后更换培养基,其以后每天更换。
(4)人和食蟹猴ips细胞向肠道类器官的分化
人和食蟹猴ips细胞向肠道类器官的分化是接种于利用在传代时以人和食蟹猴ips细胞用培养基稀释成30倍的基质胶(除去了生长因子)涂布了的培养皿,用含有35ng/mlfgf2的stemsure(注册商标)hpsc培养基进行培养,在未分化集落所占的比例达到约80%的状态下开始。通过用含有100ng/ml激活素a、100units/ml青霉素g、100μg/ml链霉素、2mmol/ll-glu的roswellpark纪念研究所(rpmi)培养基培养1天,用含有0.2%fbs、100ng/ml激活素a、100units/ml青霉素g、100μg/ml链霉素、2mmol/ll-glu的rpmi培养基培养1天,用含有2%fbs、100ng/ml激活素a、100units/ml青霉素g、100μg/ml链霉素、2mmol/ll-glu的rpmi培养基培养1天,使其分化为内胚层。然后,对于人ips细胞,用含有2%fbs、500ng/mlfgf4、500ng/mlwnt3a、100units/ml青霉素g、100μg/ml链霉素的rpmi+glutamx培养基培养4天,从而使其分化为肠道干细胞。对于食蟹猴ips细胞,用含有2%fbs、250ng/mlfgf2、6μmol/lchir99021、100units/ml青霉素g、100μg/ml链霉素的rpmi+glutamx培养基培养4天,从而使其分化为肠道干细胞。对于人ips细胞是在fgf4、wnt3a处理后,对于食蟹猴ips细胞是在fgf4、chir99021处理后,以成为10μmol/l的方式添加y-27632(rho结合激酶抑制剂),在5%co2/95%空气条件下、在co2培养箱中以37℃进行60分钟处理,将得到的细胞用0.05%胰蛋白酶-edta剥离,利用40μm尼龙网的细胞滤网将细胞团破碎,将7.0×106细胞接种于100mmezsphere(注册商标)上。然后,用含有2mmol/ll-glu、2%b27supplement、1%n2supplement、100units/ml青霉素g、100μg/ml链霉素、100ng/ml上皮生长因子(egf)、100ng/mlnoggin、200ng/mlr-spondin-1、10μmol/ly-27632的advanced-dmem/f12培养3天后,用含有2mmol/ll-glu、2%b27supplement、1%n2supplement、100units/ml青霉素g、100μg/ml链霉素、100ng/mlegf、100ng/mlnoggin、200ng/mlr-spondin-1、除去了生长因子的基质胶3%的advanced-dmem/f12在超低粘附6孔板上悬浮培养24天,从而使其分化为肠道类器官。药物代谢酶的诱导剂处理通过如下操作进行:在含有2mmol/ll-glu、2%b27supplement、1%n2supplement、100units/ml青霉素g、100μg/ml链霉素、100ng/mlegf、100ng/mlnoggin、200ng/mlr-spondin-1、除去了生长因子的基质胶3%的advanced-dmem/f12中添加40μmol/l的利福平或者添加1μmol/l的1α,25-二羟基维生素d3(vd3),在回收前培养72小时。另外,从分化开始第19天~第34天,除以前我们发现的低分子化合物即pd98059(20μmol/l)、5-氮杂-2’-脱氧胞苷(5μmol/l)、a-83-01(0.5μmol/l)以外还添加5μmol/ln-[(3,5-二氟苯基)乙酰基]-l-丙氨酰基-2-苯基-1,1-二甲基乙基酯-甘氨酸(dapt),研究对向肠道类器官的分化造成的影响。应予说明,将以上的培养方法(分化方案)的概要示于图9。
(5)总核糖核酸(rna)提取
在人和食蟹猴ips细胞的分化诱导结束后,依照agencourtrnadvencetissue的随附手册进行提取总rna。
(6)逆转录反应
互补dna(cdna)的合成使用revertraaceqpcrrtmastermix,依照随附手册进行。
(7)实时rt-pcr法
实时rt-pcr使用kapasybrfastqpcrkit,以cdna作为模板,反应按照随附手册进行。结果使用甘油醛-3-磷酸脱氢酶(gapdh)作为内源性对照进行了校正。
(8)苏木精-伊红(he)染色和阿尔新蓝染色
分化诱导结束后,将肠道类器官用4%多聚甲醛固定,用oct化合物进行冷冻包埋。制作厚度10μm的冷冻切片后,贴附于载玻片,在he染色中,使用迈耶苏木精和曙红醇进行染色。在阿尔新蓝染色中,染色ph2.5的阿尔新蓝,作为核染色,使用核固红。
(9)免疫荧光染色
分化诱导结束后,将肠道类器官用4%多聚甲醛固定,用oct化合物进行冷冻包埋。制作厚度10μm的冷冻切片后,贴附于载玻片,进行抗原的激活。用5%fbs溶液封闭30分钟,使一次抗体在4℃反应过夜。然后,将载玻片清洗,使二次抗体在室温反应1小时,作为核染色,使用4',6-二脒基-2-苯基吲哚(dapi)。进行密封作业,使用zeisslsm510共焦点激光显微镜观察荧光。
(10)基于透射型电子显微镜的观察
分化诱导结束后,将肠道类器官用2.5%戊二醛进行前固定,在4℃孵育过夜。然后,用1%四氧化锇在4℃进行2小时后固定,利用乙醇进行脱水作业。替换为环氧丙烷后,包埋于树脂内。制作0.1μm的切片,用乙酸铀酰进行电子染色后,使用jem-1400plus透射型电子显微镜进行微绒毛和紧密连接的观察。
(11)fitc-葡聚糖4000(fd-4)的透过实验
分化诱导结束后,将肠道类器官在含有fitc-葡聚糖4000(fd-4)的hbss(汉克斯缓冲盐类溶液)中以37℃进行孵育。hbss使用含有137mmol/l氯化钠、5.4mmol/l氯化钾、0.81mmol/l硫酸镁、0.44mmol/l磷酸二氢钾、0.34mmol/l磷酸氢二钠、1.3mmol/l氯化钙、4.2mmol/l碳酸氢钠、5.6mmol/ld-葡萄糖、10mmol/lhepes的ph7.4的溶液。孵育结束后,用冰冷的hbss清洗细胞。然后,使用nikoneclipseti-s显微镜观察荧光。
(12)罗丹明123的摄入实验
分化诱导结束后,将肠道类器官在含有罗丹明123的hbss中以37℃进行孵育。孵育结束后,用冰冷的hbss清洗细胞,从而使摄入停止。然后,使用zeisslsm510共焦点激光显微镜观察荧光。
(13)药物代谢实验
分化诱导结束后,将肠道类器官在含有5μmol/l咪达唑仑的培养基(含有2mmol/ll-glu、2%b27supplement、1%n2supplement、100units/ml青霉素g、100μg/ml链霉素的advanced-dmem/f12)中以37℃进行孵育,经过24小时后,对培养基进行取样。代谢活性由使用液相色谱-质谱仪(lc-ms/ms)测定的培养基中的1-氢氧化咪达唑仑的量算出。代谢实验结束后,进行蛋白定量,将代谢活性用蛋白量进行了校正。
将本研究中使用的标记物基因的特征示于以下。
α-sma(alpha-smoothmuscleactin。平滑肌标记物)
abcb1/mdr1(atp结合盒转运蛋白b1/多药抗性蛋白1。p糖蛋白。排出转运蛋白)
abcc2/mrp2(atp结合盒转运蛋白c2/多药抗性相关蛋白2。排出转运蛋白)
abcg2/bcrp(atp结合盒转运蛋白g2/乳腺癌抗性蛋白。排出转运蛋白)
cdx2(尾侧型同源盒2。参与肠道上皮细胞的增殖·分化的转录因子)
嗜铬粒蛋白a(存在于分泌颗粒中的特异性蛋白质。肠道内分泌细胞标记物)
cyp3a4(细胞色素p4503a4。人小肠中的主要药物代谢酶)
cyp3a8(细胞色素p4503a8。食蟹猴小肠中的主要药物代谢酶)
e-cad(e-钙粘蛋白)(上皮钙粘蛋白。存在于细胞表面的一组糖蛋白,负责细胞粘附的分子)
lgr5(包含富含亮氨酸重复序列的g蛋白偶联型受体。肠道干细胞的标记物)
溶菌酶(将构成真细菌的细胞壁的多糖类水解的酶。肠道帕内特细胞标记物)
muc2(粘糖蛋白2。杯细胞标记物)
咬合蛋白(occludin。参与紧密连接(密合结合)的形成的主要蛋白质)
olfm4(嗅素蛋白4。肠道干细胞标记物)
slc15a1/pept1(slc(溶质载体)家族成员15a1/肽转运蛋白1。在小肠的顶膜侧表达)
slco2b1/oatp2b1(slc(溶质载体)有机阴离子转运蛋白2b1。在小肠的顶膜侧表达)
绒毛蛋白(villin。微绒毛的主要构成成分。吸收上皮细胞标记物)
vim(波形蛋白)(vimentin。间充质细胞特有的中间丝)
2.结果·考察
(1)使用低分子化合物的向肠道类器官的分化诱导(图1)
对由人和食蟹猴ips细胞向肠道类器官的分化诱导时添加的低分子化合物的影响进行调查。其结果,在添加了a-83-01(0.5μmol/l)、pd98059(20μmol/l)、5-氮杂-2’-脱氧胞苷(5μmol/l)的组(a/pd/5-aza)中,以肠道相关基因、cyp3a等为代表的各种药物动力学相关基因的mrna表达量增加。进而,在加入了dapt(5μmol/l)的组(a/pd/5-aza/dapt)中,在人肠道类器官中与对照组相比,肠道中的主要药物代谢酶即细胞色素p450(cyp)3a4为约2000倍、肽的摄入转运蛋白即slc15a1/pept1为约10倍、排出转运蛋白即abcb1/mdr1为约36倍、abcg2/bcrp为约125倍、abcc2/mrp2为约47倍等,许多药物动力学相关基因的mrna表达上升。另外,构成肠道的细胞标记物即绒毛蛋白(吸收上皮细胞)、muc2(杯细胞)、嗜铬粒蛋白a(肠道内分泌细胞)、cdx2(肠道谱系的细胞)、lgr5(肠道干细胞)与对照组相比,显示相同程度或其以上的mrna表达。在食蟹猴肠道类器官中也显示与人同样的趋势,与对照组相比,cyp3a8为约1400倍、slc15a1/pept1为约2200倍、abcb1/mdr1为约18倍、abcg2/bcrp为约2.8倍、abcc2/mrp2为约27倍等,许多药物动力学相关基因的mrna表达上升。另外,绒毛蛋白、muc2、嗜铬粒蛋白a、溶菌酶、cdx2与对照组相比,显示相同程度或其以上的mrna表达。因此,在以后的实验中,添加a-83-01、pd98059、5-氮杂-2’-脱氧胞苷和dapt进行分化,进行解析。
(2)通过低分子化合物的新型组合进行分化诱导而得的人和食蟹猴肠道类器官的形态学观察
通过低分子化合物的新型组合进行分化诱导而得的人和食蟹猴ips细胞由来肠道类器官形成球状的形状(图2a,b)。由透射型电子显微镜的观察在肠道类器官的内侧确认到存在于肠道刷状缘膜侧的微绒毛和紧密连接的形成(图2c,d)。另外,由he染色、阿尔新蓝染色的结果可知,肠道类器官为包含分泌细胞的细胞群体(图2e~j)。
(3)通过低分子化合物的新型组合进行分化诱导而得的人和食蟹猴肠道类器官的免疫荧光染色
通过免疫荧光染色确认到构成肠道的各种细胞(吸收上皮细胞、肠道干细胞、杯细胞、肠道内分泌细胞、帕内特细胞、间充质细胞)的标记物的表达(图3)。因此,表明肠道类器官为含有这些细胞的肠道组织类似物。
(4)通过低分子化合物的新型组合进行分化诱导而得的人和食蟹猴肠道类器官的紧密连接的形成和其功能
为了确认是否形成有功能性紧密连接,首先,通过免疫荧光染色确认作为紧密连接标记物的咬合蛋白的蛋白质表达(图4a~c)。根据该结果,表明紧密连接沿着肠道类器官的管腔侧进行表达。另外,由透射型电子显微镜的观察明确,肠道类器官的管腔内侧相当于肠道刷状缘膜侧(图2c,d)。因此,使用作为非吸收性标记物的fitc-葡聚糖4000(fd-4)进行向肠道类器官内的透过试验,结果在类器官内没有确认到蓄积(图4d~g)。根据该结果,表明通过低分子化合物的新型组合进行分化诱导而得的人和食蟹猴肠道类器官形成功能性紧密连接。
(5)通过低分子化合物的新型组合进行分化诱导而得的人和食蟹猴肠道类器官的转运蛋白的免疫荧光染色
在通过低分子化合物的新型组合进行分化诱导而得的人和食蟹猴肠道类器官中,沿着肠道类器官的内侧管腔确认到小肠特异性表达的slc15a1/pept1以及肠道中主要的排泄转运蛋白即abcb1/mdr1的蛋白质表达(图5)。
(6)通过低分子化合物的新型组合进行分化诱导而得的人肠道类器官的使用罗丹明123的abcb1/mdr1的功能评价
使用作为排出转运蛋白即abcb1/mdr1的底物的罗丹明123和作为抑制剂的维拉帕米进行abcb1/mdr1的功能评价。确认到罗丹明123向肠道类器官内的排出(图6a,b),其排出方向的输送被维拉帕米显著抑制(图6c,d)。由此,表明通过低分子化合物的新型组合进行分化诱导而得的人肠道类器官具有abcb1/mdr1的功能。
(7)通过低分子化合物的新型组合进行分化诱导而得的人和食蟹猴肠道类器官的cyp3a诱导能力
使用作为cyp3a的诱导剂的利福平和1α,25-二羟基维生素d3(vd3)对cyp3a的mrna表达诱导进行研究。人肠道类器官与对照组相比,利福平添加组为约2倍,vd3添加组为约4.5倍,显著地诱导了cyp3a4的mrna表达(图7)。由此,表明通过低分子化合物的新型组合进行分化诱导而得的人肠道类器官具有cyp3a的药物应答性。食蟹猴肠道类器官与对照组相比,利福平添加组为约2倍,显著诱导了cyp3a8的mrna表达,但没有确认到vd3的mrna表达诱导(图7)。
(8)通过低分子化合物的新型组合进行分化诱导而得的食蟹猴肠道类器官的cyp3a8代谢活性
使用作为人cyp3a4和食蟹猴cyp3a8的底物的咪达唑仑和作为其抑制剂的酮康唑对cyp3a8的代谢活性进行评价。在食蟹猴肠道类器官中确认到咪达唑仑的代谢活性,并且该活性因酮康唑的添加而被显著地抑制到约20分之1(图8)。因此,表明通过低分子化合物的新型组合进行分化诱导而得的食蟹猴肠道类器官具有cyp3a8的代谢能力。
3.结论
根据以上的结果,本研究新发现了对由人和食蟹猴ips细胞向肠道类器官的分化促进有用的低分子化合物的组合。另外,明确了通过该方法制作的肠道类器官除功能性紧密连接、排出转运蛋白的输送机能以外,还具有药物代谢酶活性和诱导能力等肠道特征性的各种药物动力学功能。
<悬浮培养条件的研究>
为了促进分化和获得更高的功能以及不使用来自不同种动物的成分的培养系统构建,在制作肠道类器官时,采用使用多糖类聚合物代替基质胶的培养基进行悬浮培养。
1.方法
(1)细胞
人ips细胞(ips-51:windy)是使用泛嗜性逆转录病毒载体将八聚体结合蛋白3/4(oct3/4)、性别决定区y框蛋白2(sox2)、kruppel样因子4(klf4)、v-myc骨髓细胞瘤病毒癌基因同源物(avian)(c-myc)导入人胎儿肺成纤维细胞mrc-5后、对人es细胞样集落进行克隆化而得到的,由国立成育医疗研究中心梅泽明弘博士提供。饲养细胞使用小鼠胎鼠成纤维细胞(mef)。
(2)培养基
mef的培养使用含有10%胎牛血清(fbs)、2mmol/ll-谷氨酰胺(l-glu)、1%非必需氨基酸(neaa)、100units/ml青霉素g、100μg/ml链霉素的杜尔贝科改良伊格尔培养基(dmem)。mef的剥离液使用0.05%胰蛋白酶-乙二胺四乙酸(edta),mef的保存液使用cellbanker-1。人ips细胞的维持培养使用含有20%knockout血清替代物(ksr)、0.8%neaa、2mmol/ll-glu、0.1mmol/l2-巯基乙醇(2-mee)、5ng/ml成纤维细胞增殖因子(fgf)2的dmemham’sf-12(dmem/f12)。人ips细胞的剥离液使用含有1mg/ml胶原酶iv、0.25%胰蛋白酶、20%ksr、1mmol/l氯化钙的杜尔贝科磷酸缓冲生理盐水(pbs)。人ips细胞的保存液使用灵长类es/ips细胞用冷冻保存液。
(3)人ips细胞的培养
人ips细胞接种于实施了丝裂霉素c处理的mef(6×105cells/100mm皿)上,在5%co2/95%空气条件下、在co2培养箱中以37℃进行培养。人ips细胞的传代在培养3~5天后,以1:2~1:3的分流比进行。人ips细胞在解冻48小时后更换培养基,其以后每天更换。
(4)人ips细胞向肠道类器官的分化
人ips细胞向肠道类器官的分化是接种于涂布了在传代时用人ips细胞用培养基稀释成30倍的除去了生长因子的基质胶的培养皿,用含有35ng/mlfgf2的stemsure(注册商标)hpsc培养基进行培养。在未分化集落所占的比例达到约80%的状态下开始。用含有100ng/ml激活素a、100units/ml青霉素g、100μg/ml链霉素、2mmol/ll-glu的roswellpark纪念研究所(rpmi)培养基培养1天,用含有0.2%fbs、100ng/ml激活素a、100units/ml青霉素g、100μg/ml链霉素、2mmol/ll-glu的rpmi培养基培养1天,用含有2%fbs、100ng/ml激活素a、100units/ml青霉素g、100μg/ml链霉素、2mmol/ll-glu的rpmi培养基培养1天,从而使其分化为内胚层。然后,用含有2%fbs、500ng/mlfgf4、3μmol/lchir99021、100units/ml青霉素g、100μg/ml链霉素的rpmi+glutamx培养基培养4天,从而使其分化为肠道干细胞。在fgf4、chir99021处理后,以成为10μmol/l的方式添加y-27632(rho结合激酶抑制剂),在5%co2/95%空气条件下、在co2培养箱中以37℃进行60分钟处理,将得到的细胞用0.05%胰蛋白酶-edta剥离,用40μm尼龙网的细胞滤网将细胞团破碎,将3.0×106细胞接种于100mmezsphere(注册商标)上。然后,用含有2mmol/ll-glu、2%b27supplement、1%n2supplement、100units/ml青霉素g、100μg/ml链霉素、100ng/ml上皮生长因子(egf)、100ng/mlnoggin、200ng/mlr-spondin-1、10μmol/ly-27632的advanced-dmem/f12培养3天后,用含有2mmol/ll-glu、2%b27supplement、1%n2supplement、100units/ml青霉素g、100μg/ml链霉素、100ng/mlegf、100ng/mlnoggin、200ng/mlr-spondin-1、除去了生长因子的基质胶3%或多糖类聚合物(脱酰化结冷胶)的advanced-dmem/f12在超低粘附6孔板上悬浮培养24天,从而使其分化为肠道类器官。另外,从分化开始第19天~第34天,除以前我们发现的低分子化合物即pd98059(20μmol/l)、5-氮杂-2’-脱氧胞苷(5μmol/l)、a-83-01(0.5μmol/l)以外,还添加5μmol/ln-[(3,5-二氟苯基)乙酰基]-l-丙氨酰基-2-苯基-1,1-二甲基乙基酯-甘氨酸(dapt)。药物代谢酶的诱导剂处理通过如下操作进行:在含有2mmol/ll-glu、2%b27supplement、1%n2supplement、100units/ml青霉素g、100μg/ml链霉素、100ng/mlegf、100ng/mlnoggin、200ng/mlr-spondin-1、除去了生长因子的基质胶3%或多糖类聚合物(脱酰化结冷胶)的advanced-dmem/f12中以成为1μmol/l的方式添加,1α,25-二羟基维生素d3(vd3),在回收前进行72小时培养。多糖类聚合物以培养基中浓度0.015%(w/v)使用由日产化学工业株式会社提供的fp001或fp003,研究对向肠道类器官的分化造成的影响。
(5)总核糖核酸(rna)提取
在人ips细胞的分化诱导结束后,依照agencourtrnadvencetissue的随附手册进行提取总rna。
(6)逆转录反应
互补dna(cdna)的合成使用revertraaceqpcrrtmastermix,依照随附手册进行。
(7)实时rt-pcr法
实时rt-pcr使用kapasybrfastqpcrkit,以cdna作为模板,反应依照随附手册进行。结果使用次黄嘌呤磷酸核糖转移酶(hprt)作为内源性对照进行了校正。
(8)苏木精-伊红(he)染色
分化诱导结束后,将肠道类器官用4%多聚甲醛固定,用oct化合物进行冷冻包埋。制作厚度10μm的冷冻切片后,贴附于载玻片,使用迈耶苏木精和曙红醇进行染色。
(9)免疫荧光染色
分化诱导结束后,将肠道类器官用4%多聚甲醛固定,用oct化合物进行冷冻包埋。制作厚度10μm的冷冻切片后,贴附于载玻片,进行抗原的激活。用5%fbs溶液封闭30分钟,使一次抗体在4℃反应过夜。然后,将载玻片清洗,使二次抗体在室温反应1小时,作为核染色,使用4',6-二脒基-2-苯基吲哚(dapi)。进行密封作业,使用zeisslsm510共焦点激光显微镜观察荧光。
(10)罗丹明123的输送实验
分化诱导结束后,将肠道类器官在含有罗丹明123的hbss中以37℃进行孵育。hbss使用含有137mmol/l氯化钠、5.4mmol/l氯化钾、0.81mmol/l硫酸镁、0.44mmol/l磷酸二氢钾、0.34mmol/l磷酸氢二钠、1.3mmol/l氯化钙、4.2mmol/l碳酸氢钠、5.6mmol/ld-葡萄糖、10mmol/lhepes的ph7.4的溶液。孵育结束后,用冰冷的pbs清洗细胞,从而使摄入停止。用加热至37℃的pbs孵育4小时,从而使罗丹明123释放到类器官外。然后,使用synergyhtx酶标仪测定上清液的荧光强度。输送实验结束后,进行蛋白定量,将荧光强度用蛋白量进行了校正。
(11)hoechst33342的输送实验
分化诱导结束后,将肠道类器官在含有hoechst33342的hbss中以37℃进行孵育。孵育结束后,用冰冷的pbs清洗细胞,从而使摄入停止。用加热至37℃的pbs孵育4小时,从而使hoechst33342释放到类器官外。然后,使用synergyhtx酶标仪测定上清的荧光强度。输送实验结束后,进行蛋白定量,将荧光强度用蛋白量进行了校正。
(12)药物代谢实验
分化诱导结束后,将肠道类器官在含有5μmol/l咪达唑仑的培养基(含有2mmol/ll-glu、2%b27supplement、1%n2supplement、100units/ml青霉素g、100μg/ml链霉素的advanced-dmem/f12)中以37℃进行孵育,经过24小时后,对培养基进行取样。代谢活性由使用液体色谱-质谱仪(lc-ms/ms)测定的培养基中的1-氢氧化咪达唑仑的量算出。代谢实验结束后,进行蛋白定量,将代谢活性用蛋白量进行了校正。
在本研究中,使用以下的标记物基因、即α-sma、abcb1/mdr1、abcg2/bcrp、cdx2、嗜铬粒蛋白a、cyp3a4、e-cad(e-钙粘蛋白)、ki67(在位于g1期、s期、g2期、m期的细胞表达。增殖细胞标记物)、lgr5、溶菌酶、muc2、咬合蛋白、olfm4、pxr(孕烷x受体。参与cyp3a4等的转录调节的核内受体)、蔗糖酶-异麦芽糖酶(跨膜ii型糖蛋白。在肠的上皮细胞的刷状缘表达)、slc15a1/pept1、绒毛蛋白、vim(波形蛋白)。
2.结果·考察
(1)使用多糖类聚合物的向人肠道类器官的分化诱导
对由人ips细胞向肠道类器官的分化诱导时添加的多糖类聚合物的影响进行调查。其结果,在添加了fp001和fp003的组中,以肠道相关基因、cyp3a等为代表的各种药物动力学相关基因的mrna表达量增加。特别是加入了fp001的组与加入了除去生长因子的基质胶3%的对照组相比,肠道中的主要药物代谢酶即细胞色素p450(cyp)3a4为3.7倍,肽的摄入转运蛋白即slc15a1/pept1为4.1倍、排出转运蛋白即abcb1/mdr1为4.5倍等,许多药物动力学相关基因的mrna表达上升。另外,构成肠道的细胞标记物即绒毛蛋白(吸收上皮细胞)、蔗糖酶-异麦芽糖酶(上皮细胞的刷状缘)、muc2(杯细胞)、lgr5(肠道干细胞)与对照组相比,显示相同程度或其以上的mrna表达。(图10)。
(2)使用多糖类聚合物进行分化诱导而得的人肠道类器官的形态学观察
使用基质胶和多糖类聚合物进行分化诱导而得的来自人ips细胞的肠道类器官形成球状的形状(图11a-c)。根据he染色的结果,在使用多糖类聚合物进行分化诱导而得的人肠道类器官中也确认到管腔(图11d-f)。
(3)使用多糖类聚合物进行分化诱导而得的人肠道类器官的免疫荧光染色
通过免疫荧光染色确认到构成肠道的各种细胞(吸收上皮细胞、肠道干细胞、杯细胞、肠道内分泌细胞、帕内特细胞、间充质细胞)和排出转运蛋白、紧密连接的标记物的表达(图12)。因此,表明肠道类器官为含有这些细胞的肠道组织类似物。
(4)使用多糖类聚合物进行分化诱导而得的人肠道类器官的使用罗丹明123的abcb1/mdr1的功能评价
使用作为排出转运蛋白即abcb1/mdr1的底物的罗丹明123和作为抑制剂的维拉帕米进行abcb1/mdr1的功能评价。确认到罗丹明123向肠道类器官内的排出,该排出方向的输送被维拉帕米抑制(图13)。由此,表明使用多糖类聚合物进行分化诱导而得的人肠道类器官具有abcb1/mdr1的功能。
(5)使用多糖类聚合物进行分化诱导而得的人肠道类器官的使用hoechst33342的abcg2/bcrp的功能评价
使用作为排出转运蛋白即abcg2/bcrp的底物的hoechst33342和作为抑制剂的ko143进行abcg2/bcrp的功能评价。确认到hoechst33342向肠道类器官内的排出,该排出方向的输送被ko143抑制(图14)。由此,表明使用多糖类聚合物进行分化诱导而得的人肠道类器官具有abcg2/bcrp的功能。
(6)使用多糖类聚合物进行分化诱导而得的人肠道类器官的cyp3a4诱导能力
使用作为cyp3a的诱导剂的1α,25-二羟基维生素d3(vd3)对cyp3a4的mrna表达诱导进行研究。与对照组相比,vd3添加组显著地诱导了cyp3a4的mrna表达(图15a)。另外,在vd3添加组中,咪达唑仑的代谢活性显著上升(图15b),并确认到cyp3a4的蛋白质水平的诱导。由此,表明使用多糖类聚合物进行分化诱导而得的人肠道类器官具有cyp3a4的药物应答性。
(7)使用多糖类聚合物进行分化诱导而得的人肠道类器官的cyp3a4代谢活性
使用作为cyp3a4的底物的咪达唑仑和作为其抑制剂的酮康唑对cyp3a4的代谢活性进行评价。在人肠道类器官中,确认到咪达唑仑的代谢活性,并且该活性因酮康唑的添加而被显著地抑制(图16)。因此,表明使用多糖类聚合物进行分化诱导而得的人肠道类器官具有cyp3a4的代谢能力。
3.结论
根据以上的结果,本研究新发现了对由人ips细胞向肠道类器官的分化有用的浮选剂(粘性材料)。另外,明确了通过该方法制作的肠道类器官除排出转运蛋白的输送功能以外,还具有药物代谢酶活性和诱导能力等肠道特征性的各种药物动力学功能。此外,fp001和fp003为多糖类的聚合物,不含来自不同种动物的成分,因此,认为作为将肠道类器官用于再生医疗时使用的培养材料极其有用。
产业上的可利用性
本发明能够制作功能性肠道类器官。本发明中采用的因子的组合(mek1/2抑制剂、dna甲基化抑制剂、tgfβ受体抑制剂和γ-分泌酶抑制剂)是廉价且批次间差异小的低分子化合物。该特征在实用性方面极其重要,根据本发明,带来肠道类器官的制作成本的降低、肠道类器官的品质和可靠性的提高等。通过本发明制作的肠道类器官是功能性结构体,可期待在各种用途中的应用。例如,能够用于体外评价系统(药效、毒性、药物动力的评价)、难治性炎症肠疾病等肠道病理模型的制作和使用其的病理机制的阐明、向生物体(人、实验动物等)的移植。
本发明并不受上述发明的实施方式和实施例的说明任何限定。在不脱离权利要求书记载的情况下,本领域技术人员能够容易地想到的范围内的各种变形方式也包含在本发明中。本说明书中明示的论文、公开专利公报和专利公报等内容通过援用而引用其全部内容。
- 还没有人留言评论。精彩留言会获得点赞!