用于改进的细胞转染和/或rAAV载体生产的增强剂的制作方法
相关申请信息
本申请要求于2017年6月7日提交的美国临时专利申请no.62/516,432和2017年7月12日提交的美国临时专利申请no.62/531,626的优先权。上述申请的包括所有文本、表格、序列表和附图的全部内容通过引用并入本文。
本发明涉及用核酸(例如质粒)进行细胞转导(转染)的领域。更具体地,本发明提供了用于产生转导的(转染的)细胞的组合物和方法,所述细胞任选地产生腺相关病毒(raav)载体。
引用
在整个说明书中引用了多个出版物和专利文件,以描述本发明所涉及的现有技术。这些引用中的每一个都通过引用并入本文,如同在本文完整地阐述。
技术实现要素:
本发明提供了用至少一种核酸序列转染细胞的组合物和方法。在一个实施方案中,转染组合物和方法包括:(a)使细胞与用包含聚乙烯亚胺(pei)的溶液配制的至少一种核酸接触;(b)用所述核酸和聚乙烯亚胺(pei)溶液温育或培养所述细胞;(c)在步骤(a)时或之后立即或在步骤(a)后最多但不到3小时加入增强剂以产生混合物;以及(d)温育步骤(c)的所述混合物,从而用所述核酸序列转染所述细胞。
本发明还提供了制备产生重组病毒载体(如raav载体)的细胞的组合物和制备方法。在一个实施方案中,一种组合物或方法包括以下步骤:(a)提供组分(i)、(ii)和(iii)的pei/质粒混合物,其中(i)是包含编码aav包装蛋白的核酸和/或编码辅助蛋白的核酸的一种或多种质粒;(ii)是包含编码蛋白或被转录成目标转录物的转基因的质粒;以及(iii)是聚乙烯亚胺(pei)溶液,(b)使细胞与步骤(a)的所述质粒/pei混合物接触以产生质粒/pei细胞培养物;(c)向所述质粒/pei细胞培养物中添加增强剂以产生第二混合物;以及(d)温育步骤(c)的所述第二混合物,从而制备产生重组raav载体的转染细胞。
在本发明的组合物和方法的各种其他实施方案中,包括一个或多个另外的任选步骤。
在特定的方面,进一步的步骤包括步骤(e)收获在步骤(d)中产生的所述转染细胞和/或来自步骤(d)中产生的所述转染细胞的培养基,以产生细胞和/或培养基收获物。
在特定的方面,进一步的可选步骤包括(e)培养、扩增、分离或选择已被所述核酸或质粒转染的细胞。
在特定的方面,进一步的可选步骤包括(e)从步骤(d)产生的所述转染细胞分离和/或纯化重组aav载体和/或从步骤(d)产生的所述转染细胞分离和/或纯化培养基。
在特定的方面,进一步的可选步骤包括(f)从步骤(e)中产生的所述转染细胞和/或培养基收获物中分离和/或纯化重组aav载体。
在另一实施方案中,所述核酸序列包括载体和/或质粒。
在另一实施方案中,所述核酸序列包含病毒载体和/或病毒质粒。在特定的方面,所述病毒载体或病毒质粒包括慢病毒载体或质粒、或腺相关病毒(aav)载体或质粒。
在另一实施方案中,所述载体包括编码蛋白或被转录成目标转录物的转基因。在特定的方面,所述转基因编码野生型或功能性变异凝血因子、apoe2、tpp1、精氨琥珀酸合酶、铜转运atp酶2、酸性α-葡萄糖苷酶、β-葡萄糖脑苷脂酶、α-半乳糖苷酶或c1抑制剂丝氨酸蛋白酶抑制剂。在特定的方面,所述野生型或功能性变异凝血因子为因子vii、因子viii或因子ix。
在另一实施方案中,所述增强剂在步骤(a)之前、在步骤(a)时或在步骤(a)之后立即添加。
在另一实施方案中,所述增强剂在步骤(a)之前、在步骤(a)时或在步骤(a)之后最多16小时添加。
在另一实施方案中,所述增强剂在步骤(a)之前、在步骤(a)时或在步骤(a)之后最多但不到3小时添加。
在另一实施方案中,所述增强剂在步骤(a)之前、在步骤(a)时添加,在步骤(a)或(b)之前或之后将所述增强剂添加两次或更多次。
在另一实施方案中,首先在步骤(a)时或之后立即或在步骤(a)后最多16小时首先添加所述增强剂,并在步骤(a)或(b)后16-72小时再次添加,或在步骤(a)或(b)后16-48小时再次添加,或在步骤(a)或(b)之后16-24小时再次添加。
在另一实施方案中,首先在步骤(a)时或之后立即或在步骤(a)后最多但不到3小时首先添加所述增强剂,并在步骤(a)或(b)后12-72小时再次添加,或在步骤(a)或(b)后12-48小时再次添加,或在步骤(a)或(b)之后12-24小时再次添加。
在另一实施方案中,所述增强剂首先在步骤(a)之前12至72小时添加,并且在步骤(a)时或者之后立即或者在步骤(a)后最多16小时再次添加所述增强剂。
在另一实施方案中,所述增强剂首先在步骤(a)之前12至72小时添加,并且在步骤(a)时或者之后立即或者在步骤(a)后最多但不到3小时再次添加所述增强剂。
在另一实施方案中,所述质粒(i)和(ii)的摩尔比范围为约1:0.01至约1:100,或摩尔比范围为约100:1至约1:0.01,其中所述组分(i)、(ii)和(iii)的混合物任选在步骤(b)之前温育约10秒至约4小时的时间段。
在另一实施方案中,所述核酸或质粒是在重量比范围为约0.1:1至约5:1的pei:核酸或pei:质粒,或重量比范围为约5∶1至约0.1∶1的pei:核酸或pei∶质粒中。
在另一实施方案中,所述核酸或质粒是在重量比范围为约1:1至约5:1的pei:核酸或pei:质粒,或重量比范围为约5∶1至约1∶1的pei:核酸或pei:质粒中。
在另一实施方案中,所述核酸或质粒是在重量比范围为约1:1至约3:1的pei:核酸或pei:质粒。
在另一实施方案中,所述核酸或质粒是在重量比范围为约1:1,约1.5:1,约2:1,约2.5:1或约3:1的pei:核酸或pei:质粒。
在另一实施方案中,所述组合物或方法还包括向所述细胞添加游离pei。
在另一实施方案中,在步骤(a)或(b)之前、之时或之后,或在步骤(c)之前或之时或之后,向所述细胞添加游离pei。
在另一实施方案中,在步骤(a)或(b)时或之后,或在步骤(c)时或之后,向所述细胞添加游离pei。
在另一实施方案中,添加所述游离pei,以使pei:核酸或pei:质粒的重量比在约0.1:1至约5:1的范围内,或在约5:1至约0.1:1的范围内。
在另一实施方案中,添加所述游离pei,以使所述pei:核酸或pei:质粒的重量比在约1:1至约5:1的范围内,或在约5:1到约1:1的范围内。
在另一实施方案中,所述pei:核酸和/或pei:质粒中的所述pei和/或游离pei包括线性聚乙烯亚胺。
在另一实施方案中,所述pei:核酸和/或pei:质粒中的所述pei和/或游离pei包括水解的线性聚乙烯亚胺。
在另一实施方案中,所述pei:核酸和/或pei:质粒中的所述pei和/或游离pei包括游离碱形式的分子量为约4,000至约160,000和/或分子量为约2,500至约250,000的水解的线性聚乙烯亚胺。
在另一实施方案中,所述pei:核酸和/或pei:质粒中的所述pei和/或游离pei包括游离碱形式的分子量为约40,000和/或分子量约25,000的水解的线性聚乙烯亚胺。
在另一实施方案中,所述核酸:pei和/或质粒:pei中,总pei中的氮(n)比磷酸盐(p)的摩尔比在约1:1至约50:1(n:p)的范围内。
在另一实施方案中,在核酸:pei和/或质粒:pei中,总pei中的氮(n)比磷酸盐(p)的摩尔比为约5:1至约10:1。
在另一实施方案中,在核酸:pei和/或质粒:pei中,总pei中的氮(n)比磷酸盐(p)的摩尔比为约5:1、6:1、7:1、8:1、9:1或10:1(n:p)中的任一种。
在另一实施方案中,所述游离pei的量为所述总pei的约10%至约90%。
在另一实施方案中,所述游离pei的量为所述总pei的约25%至约75%。
在另一实施方案中,所述游离pei的量为所述总pei的约50%。
在另一实施方案中,所述游离pei的量为约0.1μg/ml至约10μg/ml。
在另一实施方案中,所述游离pei的量为约1.0μg/ml至约5μg/ml。
在另一实施方案中,所述pei溶液和/或游离pei包括ph为约7.0至约8.0的溶液。
在另一实施方案中,在步骤(a)之前,将所述核酸序列和pei彼此温育约10秒至约4小时。
在另一实施方案中,在步骤(a)之前,将所述核酸序列和pei彼此温育约30秒至约4小时。
在另一实施方案中,在步骤(a)之前,将所述核酸序列和pei彼此温育约1分钟至约30分钟。
在另一实施方案中,在步骤(b)之前,将所述组分(i)、(ii)和(iii)的混合物一起温育约10秒至约4小时。
在另一实施方案中,在步骤(b)之前,将所述组分(i),(ii)和(iii)的混合物一起温育约30秒至约4小时。
在另一实施方案中,在步骤(b)之前,将所述组分(i)、(ii)和(iii)的混合物一起温育约1分钟至约4小时。
在另一实施方案中,所述步骤(d)的温育持续至少约4小时。
在另一实施方案中,所述步骤(d)的温育持续约4小时至约140小时。
在另一实施方案中,所述步骤(d)的温育持续约4小时至约96小时。
在另一实施方案中,所述细胞包括哺乳动物细胞。在特定的方面,所述细胞是人胚肾(hek)或中国仓鼠卵巢(cho)细胞。在特定的方面,所述细胞包括人胚胎肾(hek)293细胞。在特定的方面,所述细胞是hek293e、hek293f或hek293t细胞。
在另一实施方案中,所述细胞被稳定或瞬时转染。
在另一实施方案中,所述细胞处于悬浮培养液中。
在另一实施方案中,所述细胞是粘附性的。
在另一实施方案中,所述细胞在无血清培养基中生长或维持。
在另一实施方案中,所述细胞当与所述核酸序列或所述质粒/pei混合物接触时和/或当与所述游离pei接触时,其密度在约1×105细胞/ml至约1×108细胞/ml的范围内。
在另一实施方案中,所述细胞当与所述核酸序列或所述质粒/pei混合物接触时和/或当与所述游离pei接触时,其密度在约5×105细胞/ml至约1×107细胞/ml的范围内。
在另一实施方案中,所述细胞当与所述核酸序列或所述质粒/pei混合物接触时和/或当与所述游离pei接触时,所述细胞的密度在约1×106细胞/ml至约5×106细胞/ml的范围内。
在另一实施方案中,所述细胞当与所述核酸序列或质粒/pei混合物或与所述游离pei接触时的生存力为约60%或大于60%,或其中所述细胞当与所述核酸序列或质粒/pei混合物接触时处于对数期生长。
在另一实施方案中,所述细胞当与所述核酸序列或质粒/pei混合物或与所述游离pei接触时的生存力为约90%或大于90%,或其中所述细胞当与所述核酸序列或质粒/pei混合物或与所述游离pei接触时处于对数期生长。
在另一实施方案中,所述核酸序列或质粒的总量在每ml细胞约0.1μg至约15μg的范围内。
在另一实施方案中,包含所述转基因的所述质粒比包含编码aav包装蛋白的核酸和/或编码辅助蛋白的核酸的所述一种或多种质粒的摩尔比为约1:5至约1:1或约1:1至约5:1。
在另一实施方案中,所述一种或多种质粒包括包含编码aav包装蛋白的所述核酸的第一质粒和包含编码辅助蛋白的所述核酸的第二质粒。
在另一实施方案中,包含所述转基因的所述质粒比包含编码aav包装蛋白的所述核酸的所述第一质粒比包含编码辅助蛋白的所述核酸的所述第二质粒的摩尔比在约1-5:1:1或1:1-5:1或1:1:1-5。
在另一实施方案中,所编码的所述aav包装蛋白包含aavrep和/或aavcap。
在另一实施方案中,所编码的所述aav包装蛋白包含任何aav血清型的aavrep和/或aavcap蛋白。
在另一实施方案中,所编码的所述辅助蛋白包括腺病毒e2和/或e4、varna蛋白和/或非aav辅助蛋白。
在另一实施方案中,所述重组aav载体包含aav血清型1-12、aavvp1、vp2和/或vp3衣壳蛋白,或经修饰的或变异的aavvp1、vp2和/或vp3衣壳蛋白,或野生型aavvp1、vp2和/或vp3衣壳蛋白中的任何一种。
在另一实施方案中,所述腺相关病毒(aav)载体包含与选自aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9和aav10血清型的反向末端重复序列(itr)或任何衣壳蛋白序列的itr序列或衣壳蛋白序列具有70%或更多序列同一性的衣壳vp1、vp2和/或vp3蛋白序列或反向末端重复序列。
在另一实施方案中,所述腺相关病毒(aav)载体包含与选自seqidno:1和seqidno:2的衣壳蛋白序列具有70%或更多序列同一性的衣壳vp1、vp2和/或vp3蛋白序列。
在另一实施方案中,所述aav载体包括aav血清型或aav假型,其中所述aav假型包括与所述itr血清型不同的aav衣壳血清型。
在另一实施方案中,所述aav载体包含选自aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10、seqidno:1和seqidno:2的任何血清型的衣壳vp1、vp2和/或vp3蛋白或反向末端重复序列。
在另一实施方案中,所述aav载体还包含内含子、表达控制元件、一个或多个腺相关病毒(aav)反向末端重复序列(itr)和/或填充物多核苷酸序列。
在另一实施方案中,所述内含子位于编码蛋白或被转录成目标转录物的核酸之内或两侧。
在另一实施方案中,所述表达控制元件与编码蛋白或被转录成目标转录物的核酸能操作地连接。
在另一实施方案中,aavitr位于编码蛋白或被转录成目标转录物的核酸的5'或3'末端的两侧。
在另一实施方案中,所述填充物多核苷酸序列位于编码蛋白或被转录成目标转录物的核酸的5'或3'末端的两侧。
在另一实施方案中,所述表达控制元件包括组成型或可调节的控制元件,或组织特异性表达控制元件或启动子。
在另一实施方案中,所述表达控制元件包括赋予肝脏中的表达的元件。
在另一实施方案中,所述itr包括aav2或aav6血清型或其组合中的任一者的一种或多种itr。
在另一实施方案中,所述细胞在与所述核酸序列或质粒/pei混合物接触之前,被传代培养至降低的细胞密度。
在另一实施方案中,所述细胞在与所述核酸序列或质粒/pei混合物接触之前,被传代培养至范围在约0.1×106细胞/ml至约5.0×106细胞/ml的细胞密度。
在另一实施方案中,在传代培养后,使所述细胞与所述核酸序列或质粒/pei混合物接触介于2天至5天的时间段之间。
在另一实施方案中,在传代培养后,使所述细胞与所述核酸序列或质粒/pei混合物接触介于3天至4天的时间段之间。
在另一实施方案中,与不向所述细胞培养物中添加游离pei的情况相比,在具有向所述细胞培养物中添加游离pei的步骤的情况下,引入所述转染细胞中的所述核酸序列或质粒的量至少多50%。
在另一实施方案中,与不添加所述增强剂的情况相比,在具有添加所述增强剂的步骤的情况下,引入所述转染细胞中所述的核酸序列或质粒的量至少多50%。
在另一实施方案中,与不向所述质粒/pei细胞培养物中添加游离pei的情况相比,在具有向所述质粒/pei细胞培养物中添加游离pei的步骤的情况下,所产生的重组aav载体的量是至少50%或更多。
在另一实施方案中,与不向所述质粒/pei细胞培养物中添加游离pei的情况相比,在具有向所述质粒/pei细胞培养物中添加游离pei的步骤的情况下,所产生的重组aav载体的量大1-5、5-8、8-10或10-20倍。
在另一实施方案中,与不向所述质粒/pei细胞培养物中添加所述增强剂的情况相比,在具有向所述质粒/pei细胞培养物中添加所述增强剂的步骤的情况下,所产生的重组aav载体的量大1-5、5-8、8-10或10-15倍。
在另一实施方案中,所述细胞是在约10-500ml、500ml-2升、2-20升、20-50升、50-100升、100-500升、500-1,000升或1,000-2,000升的培养体积中。
在另一实施方案中,所述转基因具有约4.0kb至约6.0kb的大小。
在另一实施方案中,所述转基因具有约4.5kb至约6.0kb的大小。
在另一实施方案中,所述转基因具有约4.5kb至约5.5kb的大小。
在另一实施方案中,所述转基因具有约4.5kb至约5.0kb的大小。
在另一实施方案中,所述增强剂包含丙戊酸、其盐或衍生物。在特定的方面,丙戊酸盐包括钠盐或钾盐。在特定的方面,丙戊酸衍生物包含与其连接或共轭的氨基酸。
在另一实施方案中,所述增强剂包含异丁酸、其盐或衍生物。在特定的方面,异丁酸盐包括钠盐或钾盐。在特定的方面,异丁酸衍生物包含与其连接或共轭的氨基酸。
在另一实施方案中,所述增强剂包含异戊酸、其盐或衍生物或由其组成。在特定的方面,异戊酸盐包括钠盐或钾盐。在特定的方面,异戊酸衍生物包含与其连接或共轭的氨基酸。
在另一实施方案中,在添加之后,所述增强剂的浓度为约0.1mm至约25mm。
在另一实施方案中,在添加之后,所述增强剂的浓度为约0.5mm至约10mm。
在另一实施方案中,在添加之后,所述增强剂的浓度为约0.5mm至约5mm。
在另一实施方案中,在添加之后,所述增强剂的浓度为约1mm至约10mm、约1mm至约9mm、约1mm至约8mm、约1mm至约7mm、约1mm至约6mm、约1mm至约5mm、约1mm至约4mm、约1mm至约3mm或约1mm至约2mm。
在另一实施方案中,如实施例1至3中所阐述的那样执行权利要求1至94中任一项所述的步骤(a)至(f)或条件中的任何一项。
附图说明
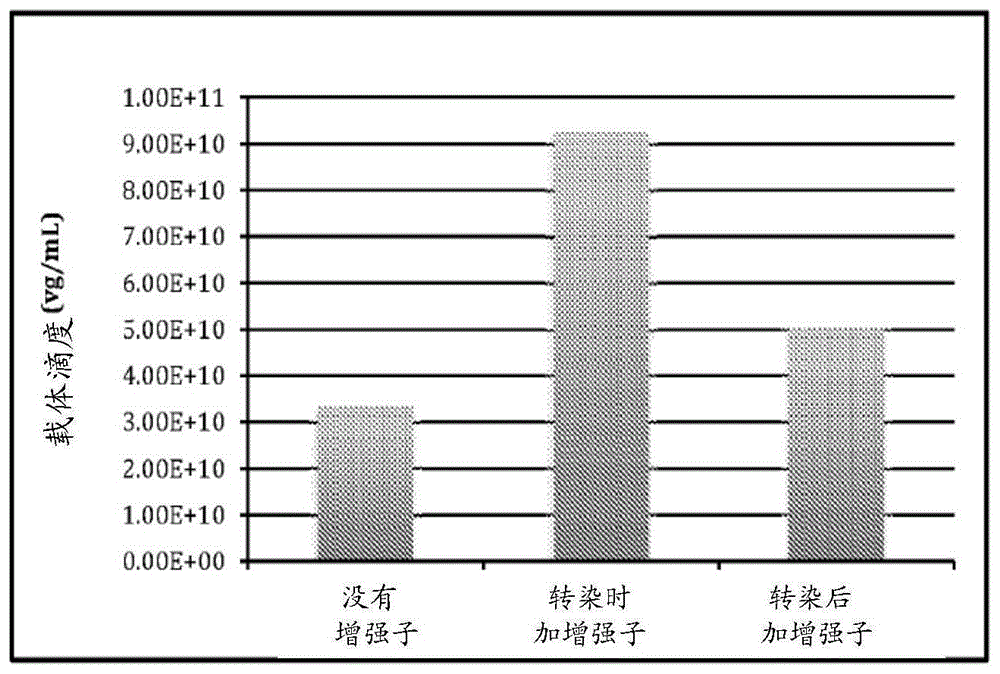
图1显示了raav-fviii载体生产率的比较。旋转瓶中的hek293f细胞用三种质粒转染:pad辅助质粒含有来自用于产生raav的腺病毒的辅助基因;paavrep/cap表达reps和caps的aav基因;paavhfviii包含侧接aavitr的人因子viii表达盒。使用的总dna量为1.86ug/ml,摩尔比为1∶1∶1。比例为1:1(重量)的pei/dna用于制备pei/dna复合物并转染细胞。在转染时,还将另外的游离pei(其量与制备pei/dna复合物所用的量相同)分别添加到细胞培养物中。将expifectaminetm293转染试剂盒中的增强子1和2在转染时或转染后16-18小时同时添加到细胞中(按照制造商的说明)。增强子1和2分别以1:200和1:20的培养物体积使用。转染后72小时收获细胞培养物,并通过q-pcr分析确定raav-fviii载体。与在转染后16小时添加增强子或不添加增强子相比,在转染时添加增强子时,raav-fviii载体滴度高2-3倍。
图2显示了使用不同的dna量和pei/dna比率优化raav-fviii载体的生产。使用三种质粒,分别用1.2、1.86或2.8μg/mldna的总dna量转染旋转瓶中的hek293f细胞。质粒dna比率与先前描述的相同。但是,本研究中使用的pei/dna比率为1:1、1.5:1、2:1、2.5:1和3:1。所使用的游离pei为1.5μg/ml。如上所述,使用了expifectaminetm293转染试剂盒中的增强子1和2。转染时细胞密度为2-3×106细胞/ml。在转染后48h(#)或72h(*)采集样品,并通过q-pcr测定法确定raav载体滴度。在1.2μg/mldna,pei/dna比率为2-2.5:1的条件下,并使用增强子,可以观察到最高的raav载体收率。
图3证实了raav-fviii载体在生物反应器中的生产率。hek293f细胞在生物反应器中以400ml的规模培养,并用三种质粒转染(质粒dna总量为1.2或2.8μg/ml)。使用摩尔比为1∶1∶1的质粒dna,比率(重量)为1.5∶1、2∶1、2.5∶1和3∶1的pei/dna。如前所述,还使用了1.5μg/ml的游离pei以及增强子1和2。转染时细胞密度为2-3×106细胞/ml。在1.2μg/ml的总dna和pei/dna比率为2.5-3:1的条件下观察到最高的载体产量(q-pcr数据)。
图4显示在dasgip生物反应器的全规模下仍保持高的raav载体生产率。进一步评估了在dasgip生物反应器的1.2升(l)规模(完整规模)下的在优化的转染条件下的raav生产率。将hek293f细胞在dasgip生物反应器中在1.2l规模下以2或3个叶轮以130rpm、150rpm和170rpm的搅拌速度进行培养。用总质粒dna为1.2μg/ml的三种质粒转染细胞,比率为2.5:1的pei/dna用于制备pei/dna复合物;dna摩尔比以及游离pei和转染增强子的量如前所述。q-pcr数据表明,在1.2l规模的载体生产率仍与在较小规模下观察到的相当,这表明可以扩大优化的转染水平。尽管不希望受到任何理论的束缚,但q-pcr数据还表明,高搅拌速度可以进一步提高载体的生产率。
图5显示单独的增强子1将raav生产率提高到与当同时使用增强子1和2时产生的水平相同的水平。为了进一步优化raav的生产方法,在转染时仅使用一种增强子(增强子1或增强子2)进行研究,以比较载体生产率与使用两种增强子时的载体生产率。q-pcr数据表明,使用增强子1时的raav生产率与同时使用增强子1和2时的raav生产率相当。但是,增强子2仅导致较低的raav产量,表明增强子2对raav的产量没有积极影响。此外,减少转染时增强子1和2的量会导致raav滴度降低。
图6显示在转染(tf)时和转染后24小时或48小时重复使用增强子1和2或者在转染时以及转染后24小时和48小时重复使用增强子1和2三次使raav滴度略有增加。首先在转染时分别以1:200和1:20的培养物体积使用增强子1和2。在转染后24小时或48小时或同时在转染后24小时和48小时将额外量的增强子1和2加入细胞培养物中。该研究中使用的转染条件如图5所示。q-pcr数据表明,重复使用增强剂可使raav载体的生产率略有提高(不到1倍)。
图7显示表明丙戊酸增强的raav产量的数据。如前所述,使用pei转染方法用三种质粒转染旋转瓶中的hek293f细胞。本研究未使用expifectaminetm293转染试剂盒的增强子。在转染时将不同浓度的丙戊酸添加到细胞中。用1.2μg/ml的全部三种质粒dna转染细胞,三种质粒的dna摩尔比为1:1:1,pei/dna(重量)比为2:1,并且使用1.5μg/ml的游离pei。评价了0.25mm至2mm的丙戊酸。q-pcr数据表明,当2mm丙戊酸用于转染时,与不存在丙戊酸时产生的载体数量相比,观察到的raav载体产量高10倍。
图8显示了通过qpcr确定的在不同浓度的丙戊酸下的raav-fviii载体的产量。2mm至8mm(2mm、3mm、4mm、5mm、6mm、7mm和8mm)的丙戊酸用于1l生物反应器培养物中hek293f细胞的转染。丙戊酸≥4mm导致aav载体产量比2mm的丙戊酸高1.2-1.8倍。在本研究中,使用了1.2μg/ml的dna、摩尔比为1:1:1的dna、重量比为2.5的pei/dna和1.5μg/ml的游离pei。
具体实施方式
本文公开了用诸如核酸(例如质粒)之类的分子高效转导细胞的组合物和方法。这种高效转导的细胞当用编码蛋白或包含转录成目标转录物的序列的核酸(质粒)转导时,可以高效产生蛋白和/或转录物。另外,这些细胞当用编码病毒包装蛋白和/或辅助蛋白的序列(例如质粒)以及编码蛋白或被转录成目标转录物的转基因转导时可以产生包含编码蛋白的转基因或包含转录成目标转录物的序列的重组载体,其又以高产量产生重组病毒载体。
本发明提供了包括将其与当前的“行业标准”病毒(例如,aav)载体生产工艺区分开的特征的细胞转染/转导和/或病毒(例如,aav)载体生产平台。本发明的组合物和方法的特征在于在某些条件下将pei与核酸混合。将pei与核酸混合会导致pei诱导的核酸高效紧缩,形成称为多聚体的稳定复合物。用核酸转染细胞的组合物和方法包括在某些条件下使细胞与混合有pei的核酸接触。
本发明的组合物和方法还包括向细胞添加增强剂。在某些实施方案中,在细胞与核酸/pei混合物接触之前、约同时或同时添加增强剂。在某些实施方案中,在细胞与核酸/pei混合物接触后添加增强剂。在某些方面,在细胞与核酸/pei混合物接触后5-30或30-60秒加入增强剂。在某些方面,在使细胞与核酸/pei混合物接触后1-2、2-5、5-10、10-20、20-30、30-60分钟添加增强剂。在某些方面,在细胞与核酸/pei混合物接触后1-2、2-4、4-6、6-12、12-24、24-36、36-48或48-72小时添加增强剂。
增强剂可以保持与细胞接触一段时间。在某些实施方案中,在细胞与核酸/pei混合物接触后,增强剂与细胞接触5分钟至72小时。在某些实施方案中,在细胞与核酸/pei混合物接触后,增强剂与细胞接触1-2、2-5、5-10、10-20、20-30、30-60分钟。在某些方面,在细胞与核酸/pei混合物接触后,增强剂与细胞接触1-72小时、6-48小时、12-36小时、24-48小时或36-72小时。在某些方面,在细胞与核酸/pei混合物接触后,增强剂与细胞接触1-2、2-4、4-6、6-12、12-24、24-36、36-48或48-72小时。
在某些实施方案中,使细胞与游离pei接触,或者所述方法包括相对于使细胞与pei/核酸混合物接触的步骤以特定序列使细胞与游离pei接触。在某些实施方案中,当细胞与核酸/pei混合物接触时,细胞约同时或同时与游离pei接触。在特定的实施方案中,在细胞已经与核酸/pei混合物接触之后,使细胞与游离pei接触。
在某些实施方案中,使细胞与游离pei接触,或者该方法包括相对于向与核酸/pei混合物接触的细胞添加增强剂的步骤,以特定序列使细胞与游离pei接触。在某些实施方案中,在细胞与增强剂接触的同时或约同时,细胞与游离pei接触。在特定的实施方案中,在细胞已经与增强剂接触之后,使细胞与游离pei接触。
术语“核酸”和“多核苷酸”在本文可互换使用,是指所有形式的核酸、寡核苷酸,包括脱氧核糖核酸(dna)和核糖核酸(rna)。核酸和多核苷酸包括基因组dna、cdna和反义dna,以及剪接或未剪接的mrna、rrnatrna和抑制性dna或rna(rnai,例如小或短发夹(sh)rna,microrna(mirna)、小或短干扰(si)rna、反式剪接rna或反义rna)。核酸和多核苷酸包括天然存在的、合成的和有意修饰或改变的序列(例如,变异核酸)。
核酸或质粒也可以指编码蛋白的序列。这样的蛋白可以是野生型或变异的、修饰的或嵌合的蛋白。“变异蛋白”可以指经修饰的蛋白,使得与野生型蛋白相比,经修饰的蛋白具有氨基酸改变。
由核酸或质粒编码的蛋白包括治疗性蛋白。非限制性示例包括血液凝血因子(例如,因子xiii、因子ix、因子x、因子viii、因子viia或蛋白c),apoe2,tpp1,精氨琥珀酸合酶,铜转运atp酶2,酸性α-葡糖苷酶,β-葡萄糖脑苷脂酶,α-半乳糖苷酶,c1抑制剂丝氨酸蛋白酶抑制剂,cftr(囊性纤维化跨膜调节蛋白),抗体,视网膜色素上皮特异性65kda蛋白(rpe65),促红细胞生成素,ldl受体,脂蛋白脂肪酶,鸟氨酸转氨甲酰酶,β-球蛋白,α-球蛋白,血影蛋白,α-抗胰蛋白酶,腺苷脱氨酶(ada),金属转运蛋白(atp7a或atp7),磺胺酰胺酶,涉及溶酶体贮积病(arsa)的酶,次黄嘌呤鸟嘌呤磷酸核糖基转移酶,β-25葡萄糖脑苷脂酶,鞘磷脂酶,溶酶体己糖胺酶,支链酮酸脱氢酶,激素,生长因子(如胰岛素样生长因子1和2,血小板衍生生长因子,表皮生长因子,神经生长因子,神经营养因子-3和-4,脑源性神经营养因子,神经胶质衍生的生长因子,转化生长因子α和β等),细胞因子(例如α-干扰素,β-干扰素,γ-干扰素,白介素-2,白介素-4,白介素12,粒细胞-巨噬细胞集落刺激因子,淋巴毒素等),自杀基因产物(例如,单纯疱疹病毒胸苷激酶,胞嘧啶脱氨酶,白喉毒素,细胞色素p450,脱氧胞苷激酶,肿瘤坏死因子等),抗药性蛋白(例如,其对癌症疗法中使用的药物提供抗性),抑癌蛋白(例如p53,rb,wt-1,nf1,冯·希佩尔·林道(vhl),腺瘤性息肉病(apc)),具有免疫调节特性的肽,具有致耐受性或免疫原性的肽或蛋白tregitopes或hcdr1,胰岛素,葡萄糖激酶,鸟苷酸环化酶2d(lca-gucy2d),rab伴游蛋白1(无脉络膜症(choroideremia)),lca5(lca-lebercilin),鸟氨酸酮酸氨基转移酶(回旋形萎缩症(gyrateatrophy)),视黄醛毒素1(x连锁性视网膜分裂症),ush1c(乌氏综合症1c),x连锁性视网膜色素变性gtpase(xlrp),mertk(rp的ar形式:色素变性视网膜炎),dfnb1(连接蛋白26耳聋),achm2、3和4(色盲),pkd-1或pkd-2(多囊肾病),tpp1,cln2,导致溶酶体贮积病(如硫酸盐酶,n-乙酰氨基葡萄糖-1-磷酸转移酶,组织蛋白酶a,gm2-ap,npc1,vpc2,鞘脂激活蛋白等))的基因缺陷,一种或多种用于基因组编辑的锌指核酸酶,或用作基因组编辑的修复模板的供体序列。
核酸或质粒还可以指在转录时产生转录物的序列。这样的转录物可以是rna,例如抑制性rna(rnai,例如,小或短发夹(sh)rna,microrna(mirna),小或短干扰(si)rna,反式剪接rna或反义rna)。
非限制性示例包括抑制以下物质的表达的抑制性核酸:亨廷顿蛋白(htt)基因,与齿状核红核苍白球路易体萎缩症(例如,atrophin1,atn1)相关的基因;脊髓球肌萎缩症的x染色体上的雄激素受体,人类ataxin-1、-2、-3和-7,cav2.1p/q电压依赖性钙通道由(cacna1a)tata结合蛋白编码,ataxin8反向链,也称为atxn8os,脊髓小脑共济失调的丝氨酸/苏氨酸蛋白磷酸酶2a55kda调节亚基bβ亚型(1、2、3、6、7、8、12、17型),易碎x综合征中的fmr1(易碎x智力低下1),易碎x相关性震颤/共济失调综合征中的fmr1(易碎x智力低下1),易碎xe智力低下中的fmr1(易碎x智力低下2)或af4/fmr2家庭成员2;肌强直性营养不良中的肌钙蛋白激酶(mt-pk);弗雷德赖希共济失调中的frataxin;肌萎缩性侧索硬化症中超氧化物歧化酶1(sod1)基因的突变体;与帕金森氏病和/或阿尔茨海默氏病发病机理有关的基因;载脂蛋白b(apob)和原蛋白转化酶枯草杆菌蛋白酶/kexin9型(pcsk9),高胆固醇血症;hiv感染中的hivtat,人类免疫缺陷病毒转录基因的反式激活子;hiv感染中的hivtar,hivtar,人类免疫缺陷病毒反式激活因子响应元件基因;hiv感染中的c-c趋化因子受体(ccr5);rsv感染中的劳斯肉瘤病毒(rsv)核衣壳蛋白,丙型肝炎病毒感染中的肝特异性microrna(mir-122);p53,急性肾损伤或延迟移植物功能肾移植或肾损伤急性肾衰竭;蛋白激酶n3(pkn3)提前复发或转移性实体恶性肿瘤;lmp2,lmp2也称为蛋白酶体亚基β型9(psmb9),转移性黑色素瘤;lmp7,也称为蛋白酶体亚基β8型(psmb8),转移性黑色素瘤;mecl1,其也称为蛋白酶体亚基β型10(psmb10),转移性黑色素瘤;实体瘤中的血管内皮生长因子(vegf);实体瘤中的驱动蛋白纺锤体蛋白,慢性粒细胞白血病中的凋亡抑制性b细胞cll/淋巴瘤(bcl-2);实体瘤中的核糖核苷酸还原酶m2(rrm2);实体瘤中的弗林蛋白酶;肝肿瘤中的polo-样激酶1(plk1),丙型肝炎感染中的二酰基甘油酰基转移酶1(dgat1),家族性腺瘤性息肉病中的β-链蛋白;β2肾上腺素能受体,青光眼;在糖尿病性黄斑水肿(dme)或年龄相关性黄斑变性中的rtp801/redd1,其也称为dan损伤诱导转录物4蛋白;年龄相关性黄斑变性或脉络膜新血管形成中的血管内皮生长因子受体i(vegfr1),非动脉缺血性视神经病变中的胱天蛋白酶2;先天性厚甲症的角蛋白6an17k突变蛋白;流感感染中的甲型流感病毒基因组/基因序列;sars感染中的严重急性呼吸综合征(sars)冠状病毒基因组/基因序列;呼吸道合胞病毒感染中的呼吸道合胞病毒基因组/基因序列;埃博拉病毒感染中的埃博拉病毒病毒基因组/基因序列;乙型和丙型肝炎感染中的乙型和丙型肝炎病毒基因组/基因序列;hsv感染中的单纯疱疹病毒(hsv)基因组/基因序列,柯萨奇病毒b3感染中的柯萨奇病毒b3基因组/基因序列;原发性肌张力障碍的致病等位基因(如torsina(tor1a))、移植中特异的泛i类和hla等位基因的沉默(等位基因特异性沉默);常染色体显性遗传性色素性视网膜炎(adrp)中的突变视紫红质基因(rho);或抑制性核酸结合任何前述基因或序列的转录物。
核酸(质粒)可以是单、双或三重的,线性或环状的,并且可以具有任何长度。在讨论核酸(质粒)时,本文中可以根据在5'至3'方向上提供序列的惯例描述特定多核苷酸的序列或结构。
“质粒”是核酸或多核苷酸的形式,其通常具有用于质粒的表达(例如,转录、复制等)或繁殖(复制)的附加元件。如本文所用的质粒也可以用于参考核酸和多核苷酸序列。因此,在所有方面,本发明的组合物和方法适用于质粒、核酸和多核苷酸,例如用于将质粒、核酸或多核苷酸引入细胞,用于用质粒、核酸或多核苷酸转导(转染)细胞,用于产生具有质粒、核酸或多核苷酸的转导的(转染的)细胞,以产生产生病毒(例如,aav)载体的细胞,以产生病毒(例如,aav)载体,以产生具有病毒(例如,aav)载体的细胞培养基等。
本发明的组合物和方法包括聚乙烯亚胺(pei)。pei是阳离子聚合物,并且能够与核酸形成稳定的复合物,其称为多聚复合物。尽管不希望受到任何理论的束缚,但是相信该多聚复合物是通过内吞作用引入细胞。
pei可以是线性pei或支链pei。pei可以为盐形式或游离碱形式。在特定的实施方案中,pei是线性pei,例如任选地水解的线性pei。水解的pei可以是完全或部分水解的。水解的线性pei与非水解的线性pei相比具有更大比例的游离(质子化)氮,与非水解的线性pei相比,通常具有至少多1-5%的游离(质子化)氮,与非水解的线性pei相比,更通常具有多5-10%的游离(质子化)氮,或者与非水解的线性pei相比,更通常具有多10-15%的游离(质子化)氮。
在特定的实施方案中,pei可以具有约4,000至约160,000的范围内的分子量和/或游离碱形式的分子量为约2,500至约250,000的分子量。在另外的特定实施方案中,pei可以具有游离碱形式的分子量在约40,000和/或约25,000的分子量。具体地,线性pei具有游离碱形式的分子量为约40,000和/或约25,000的分子量。另外,也可以使用化学改性的线性pei或支链pei。pei是可商购的(例如,美国宾夕法尼亚州沃灵顿的polysciences,inc.)。
在本发明的组合物和方法中,将核酸(例如质粒)与pei混合以形成pei混合物或溶液。此类混合物或溶液可称为“质粒/pei混合物”或“核酸/pei混合物”。因此,术语“质粒/pei混合物”和“核酸/pei混合物”表示pei已与核酸/质粒混合。因此,本文所述的pei可以在接触细胞以进行转导/转染之前或基本同时与核酸(质粒)混合。
如本文所使用的,术语“游离pei”是指基本上或完全不含核酸(质粒)的pei。因此,本文所述的pei也可以是游离pei的形式。因此,“质粒/pei混合物”或“核酸/pei混合物”不同于游离pei。如果游离pei基本上是游离的,则存在的核酸(质粒)序列的量按分子量或质量确定将不超过约5%。当然,该量可以小于5%,例如,约4.5%或以下,约4%或以下,约3.5%或以下,约3%或以下,约2.5%或以下,约2%或以下,约1.5%或以下,约1%或以下,或约0.5%或以下。
如本文所使用的,术语“总pei”是指pei/质粒混合物中存在的pei和游离pei之和。因此,总pei包括与质粒混合的pei和基本上或完全不含核酸序列(例如质粒)的pei。
pei的量、比例、组成、溶液、溶剂和缓冲液,ph、盐以及细胞接触和温育的时序和持续时间的公开适用于以下任何一种、任何两种或全部三种:1)在质粒/pei混合物中或在核酸/pei混合物中的pei;2)为游离pei的pei(即基本或完全不含核酸或多核苷酸序列(例如质粒)的pei);和3)总pei(质粒/pei混合物或核酸/pei混合物中的pei+游离pei)。
在特定的实施方案中,pei是溶液,例如水性(例如水)溶液。在另外的特定实施方案中,pei是酸化或中和的pei。术语“酸化的pei”是指通过将pei溶解在酸性溶剂中而制备的pei溶液。酸化的pei溶液的酸度通常为约0至约3.0的ph,更通常为约0.5至约2.0的ph。术语“中和的pei”是指通过将pei溶解在中性溶剂或缓冲剂中而制备的pei溶液。中和的pei溶液的ph可以在约6.0至约8.0的范围内,典型地在约6.5至约7.5的范围内,更典型地ph在约6.8至约7.2的范围内,并且最典型地ph在约7.0至约7.2的范围内,例如约7.1。
在不破坏pei的转染活性的情况下,任何溶剂或缓冲液均可用于将pei溶液的ph建立或维持在上述范围内。酸性溶剂的示例包括无机酸,例如盐酸(hci),以及ph在酸性范围内的有机酸,例如甘氨酸-盐酸溶液。中性溶剂/缓冲剂的非限制性示例包括tris(trizma碱)和hepes。缓冲液的范围可以从约1mm到约100mm,更通常地从约2mm到约50mm,并且最通常地从约5mm到约20mm。
pei溶液可任选地包含盐。盐的非限制性示例包括钠盐(na)、钾盐(k)和镁盐(mg)。在特定方面,pei溶液的盐浓度范围为约50mm至约500mm,更通常为约100mm至约250mm,并且最通常为约125mm至约175mm。
通过在溶液中混合核酸(质粒)和pei来实现核酸(质粒)和pei的混合物。混合可以在任何与基于pei的细胞转导兼容的溶液中进行。非限制性示例如本文所述。混合后,可将核酸(质粒)/pei混合物温育约1分钟至约8小时;从约10秒到约4小时;从约1分钟到约60分钟;从约1分钟到约30分钟;从约10分钟到约45分钟;从约10分钟到约30分钟;和/或约20分钟到约30分钟的时间段。通常,时间包括约1分钟,约5分钟,约10分钟,约15分钟,约20分钟和约30分钟。
pei和核酸(质粒)以不受限制的比例混合。典型的比率包括摩尔(或重量)比范围在约1:0.01至约1:100或摩尔(或重量)比范围在约100:1至约1:0.01的质粒混合物以产生质粒/pei混合物。更典型的摩尔(或重量)比包括摩尔(或重量)比范围为约1:1至约1:5,或摩尔(或重量)比范围为约1:2至约1:4的质粒混合物,以产生质粒/pei混合物。在另外的实施方案中,pei∶质粒重量比在约0.1∶1至约5∶1的范围内,或在约5∶1至约0.1∶1的范围内。在进一步的实施方案中,游离pei/质粒/pei细胞培养物的pei:质粒重量比范围为约0.1:1至约5:1,或pei:质粒重量比范围为约5:1至约0.1:1。在特定的实施方案中,质粒/pei混合物的pei∶质粒重量比为约1∶1至约5∶1,或约5∶1至约1∶1。在其他特定的实施方案中,游离pei/质粒/pei细胞培养物的pei∶质粒重量比在约1∶1至约5∶1的范围内,或在约5∶1至约1∶1的范围内。
用于产生细胞转导的组合物和方法的核酸(质粒)的量是变化的。在特定的实施方案中,在游离pei/质粒/pei细胞培养物中,总pei中的氮(n)比质粒中的磷酸盐(p)的摩尔比的范围为约1:1至约50:1(n:p),或者,在游离pei/质粒/pei细胞中,总pei中的氮(n)比质粒中的磷酸盐(p)的摩尔比约为1:1至10:1(n:p),或者,在游离pei/质粒/pei细胞中,总pei中的氮(n)比质粒中磷酸盐(p)的比率约为5:1、6:1、7:1、8:1、9:1或10:1(n:p)。在另外的特定实施方案中,包含编码蛋白的核酸或被转录成目标转录物的核酸的质粒和包含编码aav包装蛋白的核酸和/或编码辅助蛋白的核酸的一种或多种质粒的总量的范围为每毫升细胞约0.1微克至约15微克。
将核酸(质粒)/pei的混合物应用于细胞通过将核酸(质粒)/pei的混合物添加至细胞使得核酸(质粒)/pei的混合物接触细胞来进行。添加(接触)了核酸(质粒)/pei溶液混合物的细胞可以是贴壁细胞或悬浮细胞。这样的细胞可以包括与其他细胞的共培养物。
使细胞与不受限制的核酸(质粒)/pei的混合物接触一段时间,以实现细胞转导。细胞与游离pei的接触通常在细胞与核酸(质粒)/pei混合物接触的同时(或之后立即)或之后发生。如果细胞与核酸(质粒)/pei混合物接触与细胞与游离pei接触之间存在时间间隔,则该时间间隔可以为约1秒至约140小时,通常为约1秒至约96小时,更典型地为约1秒至约48小时或约72小时,最典型地为约1秒至约24小时或更少,例如约16,约12,约8或约6小时或更少。
对于长期接触,细胞可能受到pei的细胞毒性的影响,导致死亡(非存活)细胞数量增加,从而降低了转染效率。细胞与总pei接触后的温育时间范围可以从数秒到数天。具体而言,可以使细胞与核酸(质粒)/pei或总pei接触,例如,约1分钟至约48小时;从约1分钟到约24小时;从约1分钟到约16小时;从约1分钟到约8小时;从约1分钟到约4小时;从约1分钟到约120分钟;从约5分钟到约60分钟;从约10分钟到约45分钟;或约10分钟到约30分钟的时间段。
为了降低pei的细胞毒性,在使细胞与核酸(质粒)/pei接触之后,培养基可以用新鲜的培养基更换。转染后更换培养基可以最大程度地降低pei细胞毒性,而不会明显损失细胞转染效率。
用于转染的细胞在与质粒/pei混合物接触和/或与增强剂接触和/或与游离pei接触之前或之时的密度在约1×105细胞/ml至约1×108细胞/ml的范围内。通常,细胞的密度在约2×105细胞/ml至约5×106细胞/ml的范围内。更通常地,细胞的密度在约3×105细胞/ml至约4×106细胞/ml的范围内,例如,约4×105细胞/ml至约3×106细胞/ml,或约5×105细胞/ml至约2×106细胞/ml的范围内。在其他实施方案中,细胞的密度在约5×105细胞/ml至约5×106细胞/ml的范围内,例如,在约6×105细胞/ml至约4×106细胞/ml,或约7×105细胞/ml至约3×106细胞/ml的范围内。在进一步的实施方案中,细胞的密度在约1×106细胞/ml至约5×106细胞/ml的范围内,例如在约1×106细胞/ml至约4×106细胞/ml,或约2×106细胞/ml至约3×106细胞/ml的范围内。
用于转染的细胞在与质粒/pei混合物接触和/或与增强剂接触和/或与游离pei接触之前或之时,可以任选地处于对数(指数)生长阶段。用于转染的细胞在与质粒/pei混合物接触和/或与增强剂接触和/或与游离pei接触之前或之时可以选择性地具有60%或大于60%的活力,例如70%、80%或90%或大于90%的活力。
如本文所述可以接触的细胞包括哺乳动物细胞,例如人细胞。这样的细胞可以是能够在体外生长或维持生存力的原代细胞或细胞系,或者已经适于体外组织培养。细胞系的示例包括hek(人胚肾)细胞,其包括hek293细胞,例如hek293f(293f)和hek293t(293t)细胞。
更一般地,如本文所述接触的此类细胞可称为“宿主细胞”。“宿主细胞”表示例如微生物、酵母细胞、昆虫细胞和哺乳动物细胞,其可以用作或已用作编码包装蛋白(例如aav包装蛋白)的核酸(质粒),编码辅助蛋白的核酸(质粒),编码蛋白或转录成目标转录物的核酸(质粒)或其他转移核酸(质粒)的受体。该术语包括已被转导或转染的原始细胞的后代。因此,本文所用的“宿主细胞”通常是指已被外源核酸序列转导或转染的细胞。应当理解,由于自然、偶然或故意的突变,单个亲本细胞的后代在形态或基因组或总核酸补体上不一定与原始亲本完全相同。
适合于维持细胞生存力或提供细胞生长和/或增殖的多种细胞生长培养基可商购获得或可以容易地生产。这种培养基的示例包括无血清的真核生长培养基,例如用于维持生存力或提供用于哺乳动物(例如人)细胞生长的培养基。非限制性示例包括ham的f12或f12k培养基(sigma-aldrich),freestyletm(fs)f17培养基(thermo-fisherscientific)、mem、dmem、rpmi-1640(thermo-fisherscientific)及其混合物。可以向这种培养基补充维生素和/或微量矿物质和/或盐和/或氨基酸,例如哺乳动物(例如,人)细胞的必需氨基酸。
“增强剂”(在本文中也称为“转染增强子”,或在同一背景中简称为“增强子”)是用核酸(质粒)增加细胞转导/转染的化合物。在特定的实施方案中,增强剂包含丙戊酸、其盐或衍生物或由丙戊酸、其盐或衍生物组成。在某些实施方案中,丙戊酸盐包含钠盐或钾盐或由其组成。在某些实施方案中,丙戊酸衍生物包含与其连接或缀合的氨基酸或由与其连接或缀合的氨基酸组成。增强剂的其他示例包括,例如但不限于,在美国专利公开no.2013/0316400和no.2017/0016043中描述的那些以及本领域已知的其他转染增强子,所述专利通过引用整体并入本文。
包括丙戊酸的增强剂可以例如但不限于以范围为约0.1mm至约25mm的浓度或由该范围涵盖的任何子范围或浓度值使用。在某些实施方案中,增强剂的浓度为约0.5mm至约10mm。在某些实施方案中,增强剂的浓度为约0.5mm至约5mm。在某些实施方案中,增强剂的浓度为约1mm至约4mm,约1mm至约3mm或约1mm至约2mm。
术语“转导”和“转染”是指将诸如核酸(质粒)之类的分子引入宿主细胞。当将外源核酸引入细胞膜内部时,细胞已被“转导”或“转染”。因此,“转导的细胞”是已被导入“核酸”或“多核苷酸”的细胞,或其已被导入外源核酸的后代。在特定的实施方案中,“转导的”细胞(例如,在哺乳动物中,例如细胞、组织或器官细胞中)是在掺入外源分子(例如核酸(例如转基因))后细胞中的遗传变化。可以繁殖“转导的”或“转染的”细胞,并且转录导入的核酸和/或表达蛋白。
在“转导的”或“转染的”细胞中,核酸(质粒)可以整合或可以不整合到受体细胞的基因组核酸中。如果引入的核酸整合入受体细胞或生物体的核酸(基因组dna)中,则可以将其稳定地维持在该细胞或生物中,并进一步传递至受体细胞或生物体的后代细胞或生物体或由其遗传。最后,引入的核酸可以染色体外或仅瞬时存在于受体细胞或宿主生物体中。已知许多技术(参见,例如,grahametal.(1973)virology,52:456,sambrooketal.(1989)molecularcloning,alaboratorymanual,coldspringharborlaboratories,newyork,davisetal.(1986)basicmethodsinmolecularbiology,elsevier,andchuetal.(1981)gene13:197)。这种技术可用于将一种或多种外源dna部分引入合适的宿主细胞中。
术语“载体”是指小载体核酸分子、质粒、病毒(例如aav载体)或可通过插入或并入核酸操纵的其它载体。此类载体可用于基因操作(即“克隆载体”),以将多核苷酸引入/转移到细胞中,并在细胞中转录或翻译插入的多核苷酸。“表达载体”是一种专用载体,其包含具有宿主细胞中的表达所需的必要调节区的基因或核酸序列。载体核酸序列通常至少包含用于在细胞中增殖的复制起点以及任选的附加元件,例如异源多核苷酸序列,表达控制元件(例如启动子、增强子),内含子,itr,可选的标记(例如,抗生素抗性),聚腺苷酸化信号。为了本发明的目标,本文所述的“载体”在“质粒”的在本文所用的该术语的范围内。
病毒载体来源于或基于一种或多种包含病毒基因组的核酸元件。具体的病毒载体包括慢病毒,假型慢病毒和细小病毒载体,例如腺相关病毒(aav)载体。
作为载体的修饰语,诸如重组病毒,例如慢病毒或细小病毒(例如raav)载体,以及作为序列的修饰语,诸如重组多核苷酸和多肽,术语“重组”意指组合物已经以通常不在自然界中发生的方式操纵(即,工程化)。重组载体(例如aav载体)的具体示例将是通常在野生型病毒(例如aav)基因组中不存在的多核苷酸插入病毒基因组中(即是异源的)的情况。尽管在本文提及载体,诸如病毒和aav载体以及序列诸如多核苷酸时,并不总是使用术语“重组”,但明确地包括包括多核苷酸在内的重组形式,尽管存在任何此类省略。
通过使用分子方法从病毒(例如aav)中移除野生型基因组,并用非天然核酸(例如转录成转录物或编码蛋白的核酸)取代,由病毒(诸如aav)的野生型基因组衍生重组病毒“载体”或“aav载体”。通常,对于aav而言,aav基因组中的一个或两个反向末端重复(itr)序列保留在aav载体中。“重组”病毒载体(例如,aav)区别于病毒(例如aav)基因组,因为病毒基因组的全部或一部分已用关于病毒(例如aav)的基因组核酸的非天然(即,异源的)序列取代。因此,并入非天然序列将病毒载体(例如aav)定义为“重组”载体,其在aav的情况下可被称为“raav载体”。
可以包装重组载体(例如,慢病毒、细小病毒、aav)序列-本文中称为“颗粒”以用于后续体外、试管内或体内感染(转导)细胞。在将重组载体序列壳体化或包装成aav颗粒的情况下,该颗粒也可称为“raav”。此类颗粒包括壳体化或包装载体基因组的蛋白。具体的示例包括病毒包膜蛋白,并且在aav的情况下为衣壳蛋白,例如aavvp1、vp2和vp3。
载体“基因组”指重组质粒序列的部分,其最终被包装或衣壳化以形成病毒(例如aav)颗粒。在使用重组质粒构建或制造重组载体的情况下,载体基因组不包含不对应于重组质粒的载体基因组序列的“质粒”部分。这种重组质粒的非载体基因组部分被称为“质粒骨架”,其对于质粒的克隆和扩增而言是重要的,这是繁殖和重组病毒生产所需的过程,但其本身不被包装或衣壳化成病毒(例如aav)颗粒。因此,载体“基因组”是指由病毒(例如aav)包装或衣壳化的核酸。
术语“空衣壳”和“空颗粒”是指aav病毒体,其包括aav蛋白壳,但整体或部分缺少编码蛋白的核酸或转录成侧接aavitr的目标转录物的核酸。因此,空衣壳不具有将编码蛋白或被转录成目标转录物的核酸转移到宿主细胞中的功能。但是,空衣壳制剂可用于其他应用,例如elisa。
术语“包装蛋白”是指aav进行其复制所依赖的非aav衍生的病毒和/或细胞功能。因此,该术语捕获aav复制所需的蛋白和rna,包括与aav基因转录激活,阶段特异性aavmrna剪接,aavdna复制,cap表达产物和aav衣壳组件的合成有关的部分。基于病毒的辅助功能可以源自任何已知的辅助病毒中的任何一种,例如腺病毒、疱疹病毒(除单纯疱疹病毒1型以外)和牛痘病毒。
如本文所用,“aav包装蛋白”是指aav衍生的序列,其反式起作用以用于生产性aav复制。因此,aav包装蛋白由主要的aav开放阅读框(orf)、rep和cap编码。已经表明rep蛋白具有许多功能,尤其包括:dna复制的aav起源的识别、结合和切刻;dna解旋酶活性;和aav(或其他异源)启动子的转录调控。cap(衣壳)蛋白提供必要的包装功能。aav包装蛋白在本文中用于补充aav载体缺失的反式aav功能。
“编码aav包装蛋白的核酸”通常是指这样的核酸分子,其包括提供从aav载体缺失的aav功能的核苷酸序列,该核苷酸序列将用于产生转导重组aav载体。编码aav包装蛋白的核酸通常用于提供aavrep和/或cap基因的瞬时表达,以补充缺失的aav复制所需的aav功能;然而,核酸构建体缺少aavitr,并且既不能复制也不能包装自身。编码aav包装蛋白的核酸可以是质粒、噬菌体、转座子、粘粒、病毒或病毒体的形式。已经描述了许多核酸构建体,例如编码rep和cap表达产物的常用质粒paav/ad和pim29+45。参见,例如,samulskietal.(1989)j.virol.63:3822-3828;和mccartyetal.(1991)j.virol.65:2936-2945。已经描述了许多编码rep和/或cap表达产物的载体(例如,美国专利no.5,139,941和no.6,376,237)。
术语“编码辅助蛋白的核酸”通常是指包含编码提供辅助功能的蛋白的核苷酸序列的核酸分子。可以将具有编码辅助蛋白的核酸的载体转染到合适的宿主细胞中,其中该载体然后能够支持宿主细胞中aav病毒体的产生。术语中明确排除的是自然界中存在的传染性病毒颗粒,例如腺病毒、疱疹病毒或牛痘病毒颗粒。
因此,辅助蛋白载体可以是质粒、噬菌体、转座子或粘粒的形式。特别地,已经证明辅助功能不需要腺病毒基因的完全互补。例如,已经证明不能进行dna复制和后期基因合成的腺病毒突变体允许aav复制。itoetal.,(1970)j.gen.virol.9:243;ishibashietal,(1971)virology45:317。
已显示e2b和e3区域内的突变体支持aav复制,其表明e2b和e3区域可能不参与提供辅助功能。carteretal:,(1983)virology126:505。然而,在e1区域中有缺陷或具有缺失的e4区域的腺病毒不能支持aav复制。因此,对于腺病毒辅助蛋白,直接或间接进行aav复制可能需要eia和e4区域。laughlinetal.,(1982)j.virol.41:868;janiketal.,(1981)proc.natl.acad.sci.usa78:1925;carteretal.,(1983)virology126:505。其他表征的ad突变体包括:eib(laughlinetal.(1982),supra;janiketal.(1981),同上;ostroveetal.,(1980)virology104:502);e2a(handaetal.,(1975)j.gen.virol.29:239;straussetal.,(1976)j.virol.17:140;myersetal.,(1980)j.virol.35:665;jayetal.,(1981)proc.natl.acad.sci.usa78:2927;myersetal.,(1981)j.biol.chem.256:567);e2b(carter,adeno-associatedvirushelperfunctions,在icrchandbookofparvoviruses(p.tijssened.,1990))中;e3(carteretal.(1983),同上);和e4(carteretal.(1983),同上;carter(1995))。
由在e1b中具有突变的腺病毒提供的辅助蛋白的研究报告了aav病毒体生产需要e1b55k,而不需要e1b19k。另外,国际公开wo97/17458和matshushitaetal.,(1998)genetherapy5:938-945描述了编码各种ad基因的辅助功能载体。辅助载体的示例包括腺病毒varna编码区、腺病毒e4orf6编码区、腺病毒e2a72kd编码区、腺病毒e1a编码区和缺乏完整eibs5k编码区的腺病毒e1b区(参见例如,国际公开no.wo01/83797)。
在本文中,“转基因”用于方便地指旨在或已经引入细胞或生物体的核酸。转基因包括任何核酸,例如转录成转录物或编码多肽或蛋白的基因。
“表达控制元件”是指影响可操作连接的核酸表达的核酸序列。控制元件(包括本文所述的表达控制元件,例如启动子和增强子、包含aav载体的载体序列)可以包含一个或多个“表达控制元件”。通常,包括此类元件以促进适当的异源多核苷酸转录以及如果合适的翻译(例如,启动子、增强子、内含子的剪接信号、基因的用以允许mrna的框内翻译的正确阅读框的维持、以及终止密码子等)。这样的元件通常以顺式作用,称为“顺式作用”元件,但是也可以以反式作用。
表达控制可以处于转录、翻译、剪接、消息稳定性等的水平。通常,将调节转录的表达控制元件并置在转录的核酸的5'端附近(即,“上游”)。表达控制元件也可以位于转录序列的3'末端(即“下游”)或在转录物内(例如在内含子中)。表达控制元件可以位于与转录的序列相邻或相距一定距离处(例如,来自多核苷酸的1-10、10-25、25-50、50-100、100-500或更多个核苷酸),甚至位于相当大的距离处。然而,由于某些载体,例如aav载体的长度限制,表达控制元件通常将在距转录的核酸1至1000个核苷酸内。
在功能上,可操作地连接的核酸的表达至少部分地可被元件(例如启动子)控制,使得该元件调节核酸的转录以及适当地调节转录物的翻译。表达控制元件的具体示例是启动子,其通常位于转录序列的5'端。与不存在启动子时表达的量相比,启动子通常增加了从可操作连接的核酸表达的量。
本文所用的“增强子”可以指与异源多核苷酸相邻的序列。增强子元件通常位于启动子元件的上游,而且也起作用,并且可以位于核酸序列的下游或内部。因此,增强子元件可以位于核酸上游或下游的100个碱基对、200个碱基对或300个或更多个碱基对。增强子元件通常使可操作连接的核酸的表达增加到超过由启动子元件提供的表达。
表达构建体可包含用于驱动特定细胞或组织类型中表达的调节元件。表达控制元件(例如,启动子)包括在特定组织或细胞类型中具有活性的那些,其在本文中称为“组织特异性表达控制元件/启动子”。组织特异性表达控制元件通常在特定细胞或组织(例如肝脏)中具有活性。表达控制元件通常在特定的细胞、组织或器官中具有活性,因为它们被特定细胞、组织或器官类型所特有的转录激活蛋白或其他转录调节因子所识别。这样的调节元件是本领域技术人员已知的(参见,例如,sambrooketal.(1989)和ausubeletal.(1992))。
在本发明的质粒中掺入组织特异性调节元件为核酸表达提供了至少部分组织嗜性。在肝中有活性的启动子的示例是ttr启动子(例如突变型ttr启动子)、人α1-抗胰蛋白酶(haat)启动子;白蛋白,miyatake,etal.j.virol.,71:5124-32(1997);乙型肝炎病毒核心启动子,sandig,etal.,genether.3:1002-9(1996);α-甲胎蛋白(afp),arbuthnot,etal.,hum.gene.ther.,7:1503-14(1996)],等等。在肝脏中有活性的增强剂的示例是载脂蛋白e(apoe)hcr-1和hcr-2(allanetal.,j.biol.chem.,272:29113-19(1997))。
表达控制元件还包括能够在许多不同细胞类型中驱动多核苷酸表达的普遍存在的或混杂的启动子/增强子。此类元件包括但不限于巨细胞病毒(cmv)立即早期启动子/增强子序列,劳斯肉瘤病毒(rsv)启动子/增强子序列以及在多种哺乳动物细胞类型中活跃的其他病毒启动子/增强子或自然界中不存在的合成元件(参见,例如,boshartetal,cell,41:521-530(1985)),sv40启动子,二氢叶酸还原酶启动子,细胞质β-肌动蛋白启动子和磷酸甘油激酶(pgk)启动子。
表达控制元件也可以以可调节的方式赋予表达,即信号或刺激增加或减少可操作连接的异源多核苷酸的表达。响应于信号或刺激而增加可操作连接的多核苷酸的表达的可调节元件也被称为“诱导元件”(即,由信号诱导)。具体示例包括但不限于激素(例如,类固醇)诱导型启动子。通常,这些元件赋予的增加或减少的数量与存在的信号或刺激的数量成正比。信号或刺激的数量越大,表达的增加或减少越大。特别的非限制性示例包括锌诱导的绵羊金属硫蛋白(mt)启动子;类固醇激素诱导的小鼠乳腺肿瘤病毒(mmtv)启动子;t7聚合酶启动子系统(wo98/10088);四环素可抑制系统(gossen,etal.,proc.natl.acad.sci.usa,89:5547-5551(1992));四环素诱导系统(gossen,etal.,science.268:1766-1769(1995);也参见harvey,etal.,curr.opin.chem.biol.2:512-518(1998));ru486-诱导系统(wang,etal.,nat.biotech.15:239-243(1997)和wang,etal.,genether.4:432-441(1997)];和雷帕霉素诱导系统(magari,etal.,j.clin.invest.100:2865-2872(1997);rivera,etal.,nat.medicine.2:1028-1032(1996))。在本文中可能有用的其他可调节的控制元件是那些通过特定的生理状态例如温度、急性期、发育来调节的。
表达控制元件还包括核酸的天然元件。当希望异源多核苷酸的表达应模仿天然表达时,可以使用天然控制元件(例如启动子)。当异源多核苷酸的表达将在时间或发育上,或以组织特异性方式或响应于特定转录刺激而被调节时,可以使用天然元件。也可以使用其他天然表达控制元件,例如内含子、聚腺苷酸化位点或kozak共有序列。
术语“可操作地连接”是指表达编码序列所必需的调控序列相对于编码序列被置于适当位置,以实现编码序列的表达。有时将该相同定义应用于表达载体中编码序列和转录控制元件(例如启动子、增强子和终止元件)的排列。该定义有时也应用于其中产生杂合核酸分子的第一和第二核酸分子的核酸序列的排列。
在与核酸可操作连接的表达控制元件的示例中,该关系使得控制元件调节核酸的表达。更具体地说,例如,两个dna序列可操作地连接是指两个dna以这样的关系(顺式或反式)排列,使得至少一个dna序列能够对另一个序列发挥生理作用。
因此,载体的其他元件包括但不限于表达控制(例如,启动子/增强子)元件、转录终止信号或终止密码子、5'或3'非翻译区(例如,聚腺苷酸化(polya)序列)侧翼于序列,例如aavitr序列的一个或多个拷贝,或内含子。
进一步的元件包括例如填充物或填塞物多核苷酸序列,例如以改善包装并减少污染性核酸的存在。aav载体通常接受dna插入物,该dna插入物的大小范围通常为约4kb至约5.2kb,或稍大。因此,对于较短的序列,包括填塞物或填充物以将长度调节至接近或处于aav载体包装到病毒颗粒中可接受的病毒基因组序列的正常大小。在多种实施方案中,填充物/填塞物核酸序列是核酸的非翻译(非蛋白编码)区段。对于小于4.7kb的核酸序列,填充物或填塞物多核苷酸序列具有使得当其与所述序列组合(例如插入载体中)时具有介于约3.0-5.5kb之间,或介于约4.0-5.0kb之间,或介于4.3-4.8kb之间的总长度的长度。
内含子还可以充当填充物或填塞物多核苷酸序列,以便获得将aav载体包装到病毒颗粒中的长度。用作填充物或填塞物多核苷酸序列的内含子和内含子片段也可以增强表达。
由“核酸”或“质粒”编码的“多肽”、“蛋白”和“肽”包括全长天然序列,如天然存在的野生型蛋白,以及功能性子序列,经修饰的形式或序列变体,只要功能性子序列,经修饰的形式或变体保留了天然全长蛋白的某种程度的功能,就可以形成各种形式的变体或序列变体。例如,蛋白可以具有缺失、取代或添加,并保留至少部分功能或活性。
术语“修饰”或“变体”及其语法变化是指核酸或多肽偏离参考序列。因此,经修饰的序列和变体序列可以具有与参考序列基本相同、更大或更小的表达、活性或功能,但是至少保留参考序列的部分活性或功能。
修饰的非限制性示例包括一个或多个核苷酸或氨基酸取代(例如1-3、3-5、5-10、10-15、15-20、20-25、25-30、30-40、40-50、50-100、100-150、150-200、200-250、250-500、500-750、750-850或更多核苷酸或残基)。
氨基酸修饰的一个示例是参考序列的保守氨基酸取代或缺失(例如,子序列或片段)。在特定实施方案中,修饰或变体序列保留未修饰序列的功能或活性的至少一部分。
包括所有哺乳动物和非哺乳动物形式的被转录的核酸以及编码蛋白的核酸。因此,本发明包括来自非哺乳动物、除人类以外的哺乳动物和人类的基因和蛋白,这些基因和蛋白以与人类基因和蛋白基本相似的方式起作用。
在如本文所述的细胞转染和/或产生重组病毒(例如,aav)载体之后,如果需要,可以从细胞/细胞培养物中收集/收获病毒(例如,raav)病毒体,并任选地纯化和//或使用多种常规方法从转染细胞中分离。这样的方法包括柱色谱法、cscl梯度法等。例如,可以使用多个柱纯化步骤,例如在阴离子交换柱、亲和柱和/或阳离子交换柱上的纯化。(参见,例如,国际公开no.wo02/12455和美国申请公开no.20030207439)。替代地或附加地,可以使用cscl梯度步骤。(参见,例如,美国申请公开no.20120135515;和no.20130072548),如果使用感染性病毒来表达包装和/或辅助蛋白,则可以使用各种方法使残留病毒失活。例如,可以通过加热至约60℃的温度例如20分钟或以上来使腺病毒失活。该处理有效地灭活了辅助病毒,因为aav是热稳定的,而辅助腺病毒是热不稳定的。
术语“分离的”当用作组合物的改性剂时,是指所述组合物是由人的手工制备的,或者与它们的天然存在的体内环境完全或至少部分地分离。通常,分离的组合物基本上不含它们通常在天然状态所缔合的一种或多种材料,例如一种或多种污染物,例如蛋白、核酸、脂质、碳水化合物、细胞膜。
关于rna分子,术语“分离的”主要是指由如上定义的分离的dna分子编码的rna分子。可选地,该术语可以指已经与在天然状态下(即在细胞或组织中)与其所缔合的rna分子充分分离的rna分子,其以“基本上纯的”形式存在(术语“基本上纯的”定义如下)。
关于蛋白,本文有时使用术语“分离的蛋白”或“分离和纯化的蛋白”。该术语主要是指通过表达分离的核酸分子产生的蛋白。替代地,该术语可以指已经与天然与其缔合的其他蛋白充分分离的蛋白,从而以“基本上纯的”形式存在。
术语“分离的”不排除人手产生的组合,例如重组载体(例如,raav)序列或包装或衣壳化载体基因组和药物制剂的病毒颗粒。术语“分离的”也不排除组合物的替代物理形式,例如杂种/嵌合体、多聚体/低聚物、修饰(例如,磷酸化、糖基化、脂化)或衍生化形式,或在人手产生的宿主细胞中表达的形式。
术语“基本上纯的”是指包含按重量计至少50-60%的目标化合物(例如,核酸、寡核苷酸、蛋白等)的制剂。该制剂可包含至少75重量%,或约90-99重量%的目标化合物。通过适用于目标化合物的方法(例如色谱法、琼脂糖或聚丙烯酰胺凝胶电泳、hplc分析等)来测量纯度。
核酸分子、表达载体(例如,载体基因组)、质粒可以通过使用重组dna技术方法来制备。核苷酸序列信息的可用性使得可以通过多种手段制备分离的核酸分子。例如,可以使用各种标准克隆、重组dna技术,通过细胞表达或体外翻译和化学合成技术来制备核酸(例如质粒)。纯度可以通过测序、凝胶电泳等来确定。例如,可以使用杂交或基于计算机的数据库筛选技术分离核酸。这些技术包括但不限于:(1)基因组dna或cdna文库与探针的杂交以检测同源核苷酸序列;(2)抗体筛选以检测具有共同结构特征的多肽,例如使用表达文库进行;(3)使用能够退火至目标核酸序列的引物对基因组dna或cdna进行聚合酶链反应(pcr);(4)计算机在序列数据库中搜索相关序列;(5)差异筛选减去的核酸文库。
核酸可以在任何方便的克隆载体中作为dna保持。在一实施方案中,核酸维持在质粒中。或者,可以将核酸维持在适于在哺乳动物细胞中表达的载体中。
核酸、质粒、载体、表达载体(例如,raav)和重组病毒颗粒、方法和用途允许治疗遗传疾病。对于缺乏状态的疾病,基因转移可用于将正常基因带入受影响的组织以进行替代治疗,以及使用反义突变为该疾病创建动物模型。对于不平衡的疾病状态,可以使用基因转移在模型系统中创建疾病状态,然后可以努力将其用于抵消疾病状态。还可以使用核酸序列的位点特异性整合来纠正缺陷。
病毒载体(例如慢病毒和细小病毒载体,包括aav血清型及其变体)提供了将核酸离体、体外和体内递送到细胞中的手段,所述核酸编码蛋白,使得细胞表达编码的蛋白。aav是可用作基因治疗载体的病毒,因为它们可以穿透细胞并引入核酸/遗传物质,从而可以将核酸/遗传物质稳定地维持在细胞中。另外,这些病毒可以例如将核酸/遗传物质引入特定位点。由于aav与人类的致病性疾病无关,因此aav载体能够将异源多核苷酸序列(例如治疗性蛋白和试剂)传递给人类患者,而不会引起严重的aav发病机理或疾病。
可以使用的病毒载体包括但不限于多种血清型的腺相关病毒(aav)载体(例如,aav-1至aav-12等)以及杂种/嵌合aav载体、慢病毒载体和假型慢病毒载体(例如埃博拉病毒、水泡性口炎病毒(vsv)和猫免疫缺陷病毒(fiv))、单纯疱疹病毒载体、腺病毒载体(有或没有组织特异性启动子/增强子)、痘苗病毒载体、逆转录病毒载体、慢病毒载体、非病毒载体等。
aav和慢病毒颗粒可以有利地用作有效基因递送的载体。此类病毒体具有用于此类应用的许多理想特征,包括用于分裂和非分裂细胞的向性。这些载体的早期临床经验也表明没有持续的毒性,而且免疫反应极少或无法检测到。已知aav通过受体介导的内吞作用或通过胞吞作用在体内和体外感染多种细胞类型。这些载体系统已经在针对视网膜上皮、肝脏、骨骼肌、气道、大脑、关节和造血干细胞的人类中进行了测试。例如基于质粒dna或小环的非病毒载体也是合适的基因转移载体。
因此,在本发明的多种实施方案中,载体包括慢病毒或细小病毒载体,例如腺病毒载体。在特定的实施方案中,重组载体是细小病毒载体。细小病毒是具有单链dna基因组的小型病毒。细小病毒家族中有“腺相关病毒”(aav)。
aav载体和慢病毒载体通常不包括与发病机理相关的病毒基因。这样的载体通常具有全部或部分缺失的一种或多种野生型aav基因,例如rep和/或cap基因,但是保留了至少一种功能性侧翼itr序列,这对于将重组载体拯救、复制和包装到aav载体颗粒中是必需的。例如,仅包括载体的必要部分,例如分别包括itr和ltr元素。因此,aav载体基因组将包括顺式复制和包装所需的序列(例如功能性itr序列)。
重组aav载体及其方法和用途包括任何病毒株或血清型。举非限制性示例而言,重组aav载体可基于任何aav基因组,诸如aav-1、-2、-3、-4、-5、-6、-7、-8、-9、-10、-11、-12、-rh74、-rh10或-2i8。此类载体可基于相同的菌株或血清型(或亚组或变体),或者彼此不同。举非限制性示例而言,基于一种血清型基因组的重组aav载体可与包装载体的衣壳蛋白中的一种或多种相同。此外,重组aav载体基因组可基于不同于包装载体的aav衣壳蛋白中的一种或多种的aav(例如aav2)血清型基因组。例如,aav载体基因组可以基于aav2,然而三种衣壳蛋白中的至少一种可以为例如aav1、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、aav12或aav-2i8或其变体。aav变体包括aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、aav12aav-2i8、seqidno1和seqidno:2衣壳的变体和嵌合体。
在特定的实施方案中,腺相关病毒(aav)载体包括aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、aav12、aav-2i8、seqidno1和seqidnono:2、及其变体(例如,衣壳变体,诸如氨基酸插入、添加、取代和缺失),例如如wo2013/158879(国际专利申请pct/us2013/037170)、wo2015/013313(国际专利申请pct/us2014/047670)和us2013/0059732(美国申请13/594,773,其公开了lk01、lk02、lk03等)中所示的。
aav和aav变体(例如衣壳变体)血清型(例如vp1、vp2和/或vp3序列)可以或可以不与其他aav血清型不同,包括例如aav1-aav12(例如,不同于任何aav1-aav12血清型的vp1、vp2和/或vp3序列)。
如本文所用,术语“血清型”是用于指代在血清学上不同于其他aav血清型的具有衣壳的aav的独特性。基于针对一种aav的抗体与另一种aav的抗体之间缺乏交叉反应性来确定血清学独特性。这种交叉反应性差异通常是由于衣壳蛋白序列/抗原决定簇的差异(例如由于aav血清型的vp1、vp2和/或vp3序列差异)所致。尽管包括衣壳变体的aav变体可能在血清学上与参考aav或其他aav血清型没有区别,但与参考或其他aav血清型相比,它们相差至少一个核苷酸或氨基酸残基。
在传统定义下,血清型是指就中和活性针对所有现有和表征的血清型特异的血清测试了目标病毒,并且未发现中和目标病毒的抗体。由于发现了更多自然产生的病毒分离株和/或产生了衣壳突变体,因此与任何目前存在的血清型可能存在血清学差异,也可能没有血清学差异。因此,在新病毒(例如,aav)没有血清学差异的情况下,该新病毒(例如,aav)将是相应血清型的亚组或变体。在许多情况下,尚未对具有衣壳序列修饰的突变病毒进行针对中和活性的血清学测试,以根据传统的血清型定义确定它们是否属于另一种血清型。因此,为了方便起见并避免重复,术语“血清型”广义上既指血清学上不同的病毒(例如aav),也指可能在亚组或给定血清型的变体内的没有血清学上不同的病毒(例如aav)。
在多种示例性实施方案中,与参考血清型相关的aav载体具有包括与一个或多个aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、aav12、aav-2i8、seqidno1或seqidno:2(例如itr,或vp1,vp2,和/或vp3序列)至少80%或更多(例如85%、90%、95%、96%、97%、98%、99%、99.1%、99.2%、99.3%、99.4%、99.5%等)相同的序列或由组成的多核苷酸、多肽或其子序列。
本发明的组合物、方法和用途包括与参考aav血清型(例如aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、aav12或aav-2i8)具有不到100%的序列同一性,但与已知的aav基因或蛋白(例如aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、aav12或aav-2i8)不同且不一致的aav序列(多肽和核苷酸)及其子序列,基因或蛋白等。在一实施方案中,aav多肽或其子序列包括与任何参考aav序列或其子序列(例如aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、aav12、aav-218、seqidno1或seqidno:2(例如,vp1,vp2和/或vp3衣壳或itr))具有至少75%或更多同一性,例如80%、85%、85%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、等直至100%同一性的序列或由其组成。在特定方面,aav变体具有1、2、3、4、5、5-10、10-15、15-20或更多个氨基酸取代。
重组aav载体(其包括aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、aav12、aav-2i8、seqidno1或seqidno:2以及相关的变体、杂合序列和嵌合序列)可使用本领域技术人员已知的重组技术来构建,以包括侧接一个或多个功能性aavitr序列的一个或多个核酸序列(转基因)。
核酸(质粒)、载体、重组载体(例如,raav)和重组病毒颗粒可以掺入药物组合物中。此类药物组合物尤其可用于体内或离体给药和递送至受试者。在特定的实施方案中,药物组合物包含药学上可接受的载体或赋形剂。这样的赋形剂包括本身不会诱导对接收该组合物的个体有害的免疫应答,并且可以在没有过度毒性的情况下给药的任何药物试剂。
如本文所使用的,术语“药学上可接受的”和“生理上可接受的”是指适合于一种或多种施用途径、体内递送或接触的生物学上可接受的制剂、气态、液体或固体或其混合物。“药学上可接受的”或“生理上可接受的”组合物是在生物学上或在其他方面不是不期望的材料,例如,可以将该材料施用于受试者而不会引起实质的不期望的生物学作用。因此,这样的药物组合物可以用于例如向受试者施用核酸、载体、病毒颗粒或蛋白。
药学上可接受的赋形剂包括但不限于液体,例如水、盐水、甘油、糖和乙醇。药学上可接受的盐也可以包括在其中,例如,无机酸盐,例如盐酸盐、氢溴酸盐、磷酸盐、硫酸盐等;以及有机酸的盐,例如乙酸盐、丙酸盐、丙二酸盐、苯甲酸盐等。另外,在这种载体中可以存在辅助物质,例如润湿剂或乳化剂、ph缓冲物质等。
药物组合物可以以盐形式提供,并且可以与许多酸形成,包括但不限于盐酸、硫酸、乙酸、乳酸、酒石酸、苹果酸、琥珀酸等。盐倾向于更溶于水或其他质子溶剂,而不是相应的游离碱形式。在其他情况下,制剂可以是冻干粉末,其可以包含以下任意一种或全部:ph范围为4.5至5.5的1-50mm组氨酸、0.1%-2%蔗糖和2-7%甘露醇,在使用前将其与缓冲液结合使用。
药物组合物包括溶剂(水性或非水性)、溶液(水性或非水性)、乳剂(例如水包油或油包水)、悬浮液、糖浆、e剂、分散液和悬浮液介质,包衣、等渗和吸收促进或延迟剂,其与药物给药或体内接触或递送相容。水性和非水性溶剂、溶液和悬浮液可包括悬浮剂和增稠剂。此类药学上可接受的载体包括片剂(包衣的或未包衣的)、胶囊(硬或软的)、微珠、粉末、颗粒和晶体。补充的活性化合物(例如防腐剂、抗菌剂、抗病毒剂和抗真菌剂)也可以掺入组合物中。
可以将药物组合物配制为与特定的给药或递送途径相容。因此,药物组合物包括适合通过各种途径施用的载体、稀释剂或赋形剂。
组合物和方法可以是无菌的。可以在适合于这种工艺的容器中制备组合物并且可以进行方法。这样的容器包括碟、烧瓶、滚瓶、袋、生物反应器、容器、管、小瓶等。容器可以由包括但不限于玻璃、塑料和聚合物的材料(例如聚苯乙烯、聚丁烯、聚丙烯等)制成。
组合物和方法步骤可以以指定的顺序或重新排列的顺序执行。该方法步骤可以阶段性地或间隔地执行,其间有间隔时间段。换句话说,可以执行方法步骤,然后可以与下一步骤之间出现时间间隔,该间隔范围例如从约1秒到约60秒;从约1分钟到约60分钟;从约1小时到约24小时;从约1天到约7天;或约1周到约48周。
用于产生腺病毒载体的方案已在美国专利no.5,998,205,no.6,228,646;no.6,093,699和no.6,100,242;以及国际专利申请no.wo94/17810和no.wo94/23744中描述,其全部内容通过引用结合在此。
本发明可用于生产用于人和兽医医学应用的细胞和载体。因此,合适的受试者包括哺乳动物,例如人类,以及非人类哺乳动物。术语“受试者”是指动物,通常是哺乳动物,例如人、非人灵长类动物(猿、长臂猿、大猩猩、黑猩猩、猩猩、猕猴)、家畜(狗和猫)、农场动物(家禽、例如鸡和鸭、马、牛、山羊、绵羊、猪)和实验动物(小鼠、大鼠、兔子、豚鼠)。人类受试者包括胎儿、新生儿、婴儿、少年和成人受试者。受试者包括动物疾病模型,例如小鼠和其他血液凝固疾病(例如hema和本领域技术人员已知的其他疾病)的动物模型。
如本文所使用的,“单位剂型”是指适合作为待治疗受试者的单位剂量的物理上离散的单位;每个单元含有任选地与药物载体(赋形剂、稀释剂、赋形剂或填充剂)关联的预定量,该载体在以一剂或多剂施用时被计算为产生所需的作用(例如,预防或治疗作用)。单位剂型可以在例如安瓿和小瓶中,其可以包括液体组合物,或处于冷冻干燥或冻干状态的组合物;例如,可以在体内给药或递送之前加入无菌液体载体。单个单位剂型可包含在多剂量试剂盒或容器中。重组载体(例如,raav)序列、重组病毒颗粒及其药物组合物可以包装为单一或多个单位剂型,以便于给药和剂量均匀。
本发明提供了其中具有包装材料和一种或多种组分的试剂盒。试剂盒通常包括标签或包装插页,其中包括其中的组分说明或组分的使用说明书。试剂盒可包含此类组分的集合,例如核酸(质粒)、pei、增强剂、细胞。
试剂盒是指容纳试剂盒的一种或多种组分的物理结构。包装材料可以无菌地保持组分,并且可以由通常用于这种目标的材料(例如,纸、波纹纤维、玻璃、塑料、箔、安瓿、小瓶、管等)制成。
标签或插入物可包括标识在其中的一种或多种组分的信息。标签或插页可以包含标识制造商、批号、制造地点和日期、有效期的信息。标签或插页可包含标识制造商信息、批号、制造商位置和日期的信息。标签或插页可以包括在方法、使用或制造协议中使用一种或多种试剂盒组分的说明。说明书可以包括用于生产组合物或实施本文所述的任何方法的说明。
标签或插入物包括“印刷品”,例如纸或纸板,其或单独或固定在组分、试剂盒或包装材料(例如盒子)上,或连接到包含试剂盒组分的安瓿、试管或小瓶上。标签或插入物可以另外包括计算机可读介质,例如条形码打印的标签,磁盘,光盘,例如cd-或dvd-rom/ram,dvd,mp3,磁带,或电存储介质,例如ram和rom或它们的混合体,例如磁/光存储介质,flash介质或存储类型卡。
除非另有定义,否则本文所用的所有技术和科学术语均具有与本发明所属领域的普通技术人员通常理解的相同的含义。尽管在本发明的实践或测试中可使用与本文描述的那些方法和材料相似或等同的方法和材料,但本文描述了适宜的方法和材料。
本文引用的所有专利、专利申请、出版物和其它参考文献、基因库(genbank)引用和atcc引文以参考形式全文并入。在冲突的情况下,本说明书(包括定义)将起控制作用。
上文并且整个说明书和权利要求书中使用了涉及本发明的生物分子的各种术语。
本文公开的所有特征可以以任何组合进行组合。说明书中公开的每个特征结构可由用于相同、等同或相似用途的替代的特征结构替代。因此,除非另有明确说明,否则公开的特征结构(例如,pei、质粒、载体(例如,raav或重组病毒颗粒))是具有等同或相似特征结构的种类的示例。
如本文所使用的,除非上下文另有明确指示,否则单数形式“一”、“一个”和“该”包括复数指代物。因此,例如,提及的“质粒”或“核酸”包括多种此类质粒或核酸,提及“载体”包括多种此类载体,提及“病毒”或“颗粒”包括多种此类病毒/颗粒,并且提及“增强剂”包括多种这样的试剂。
如本文所用的,除非上下文另有明确指示,否则所有数值或数值范围包括此类范围内的整数和值的分数或范围内的整数。因此,为了说明,提及80%或更多的同一性,包括81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%等,以及81.1%、81.2%、81.3%、81.4%、81.5%等,82.1%、82.2%、82.3%、82.4%、82.5%等等。
提及具有更多(更大)或更少的整数分别包括大于或小于参考数值的任何数值。因此,例如,提及小于100,包括99、98、97等,一路下降到数值一(1);并且小于10,包括9、8、7等,一路下降到数值一(1)。
如本文所使用的,除非上下文另有明确指示,否则所有数值或范围包括此类范围内的值和整数的分数,以及此类范围内的整数的分数。因此,为了说明,提及数值范围,诸如1-10包括1、2、3、4、5、6、7、8、9、10,以及1.1、1.2、1.3、1.4、1.5等等。因此提及1-50的范围包括1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20等,最多至并包括50,以及1.1、1.2、1.3、1.4、1.5等,2.1、2.2、2.3、2.4、2.5等。
提及一系列范围包括将该系列内的不同范围的边界的值组合的范围。因此,为了说明提及的一系列范围,例如范围1-10、10-20、20-30、30-40、40-50、50-60、60-75、75-100、100-150、150-200、200-250、250-300、300-400、400-500、500-750、750-850,包括范围1-20、1-30、1-40、1-50、1-60、10-30、10-40、10-50、10-60、10-70、10-80、20-40、20-50、20-60、20-70、20-80、20-90、50-75、50-100、50-150、50-200、50-250、100-200、100-250、100-300、100-350、100-400、100-500、150-250、150-300、150-350、150-400、150-450、150-500等。
本文通常使用肯定语言描述多个实施方案和方面来公开本发明。本发明还具体地包括其中全部或部分排除特定主题,诸如物质或材料、方法步骤和条件、方案或程序的实施方案。例如,在本发明的某些实施方案或方面中,排除了材料和/或方法步骤。因此,尽管本发明在本文中一般不就本发明不包括的内容进行表达,但本发明中未明确排除的方面在本文中公开。
已经描述了本发明的多个实施方案。然而,在不脱离本发明的精神和范围的情况下,本领域技术人员可对本发明进行各种改变和修改,以使其适应各种用途和条件。因此,以下实施例旨在说明而不是以任何方式限制本发明的范围。
实施例1
代表性材料和方法
细胞培养物:将从购自thermofisherscientific(r79007)的freestyletm293f(hek293f)细胞在补充有1×glutamaxtm(thermofisherscientific,35050-061)和1×抗生素-抗真菌药(thermofisherscientific,15240)的freestyletmf17(f17)表达培养基(thermofisherscientific,a1383501)中进行培养。将细胞在旋转瓶(corning,3152或3153)、摇瓶(corning431143或431145)或生物反应器中培养。对于旋转杯/摇瓶,将细胞在37℃培养箱中以170rpm搅拌速率和8%co2的潮湿气氛进行培养;对于生物反应器(eppendorf,dasgip平行生物反应器系统,玻璃器皿和一次性容器),通过程序设定的参数(do40%,ph7.2,130rpm、150rpm或170rpm的搅拌速率)控制细胞培养。通常,将细胞以0.25-0.5×106/ml接种,当细胞密度达到约2-3×106/ml时,通过添加新鲜的细胞培养基每2-3天进行传代培养。使用vi-celltmxr细胞活力分析仪(beckmancoulter)确定细胞密度和活力。
质粒:使用三种质粒来产生重组腺相关病毒载体(raav):1)含有hfviii的转基因质粒,其旁侧有itr,2)含有rep和cap基因的包装质粒,3)含有腺病毒的腺病毒辅助质粒e2、e4和varna基因。所有质粒均购自aldevron并由aldevron制造。
pei溶液的制备:线性聚乙烯亚胺(pei)“max”40kda(polysciences,24765-2,线性pei25kda的盐酸盐)用作转染试剂。为了进行转染优化研究,将pei“max”溶于5mmtris中制成0.5mg/ml溶液,并将溶液调节至不同的ph值,包括ph7.0、7.1、7.2、7.3、7.4、7.6、7.8或8.0。经过数次研究后,由于最佳转染和raav产生,如果未指定,则选择ph7.1的pei溶液用于所有研究。
在pei介导的转染中使用增强剂:潜在转染增强剂(其对转染和raav产生的作用被评估)是在expifectaminetm293转染试剂盒(thermofisherscientific,a14525)中的增强子1和2、在
hek293f细胞在旋转瓶或摇瓶中的f17培养基中加入1×glutamaxtm补充物和1×抗生素-抗真菌药。转染前一天,通过添加新鲜培养基以0.5-2×106细胞/ml的密度接种细胞。24小时后,以1-4×106细胞/ml的细胞密度转染细胞。使用三种转染质粒:hfviii,rep/cap,ad2辅助物,摩尔比为1:1:1、0.5:1:1和1:2:2,重量比为0.75:0.75:0.75、1:1:1和1.5:1.5:1.5。用于转染的总dna量为每毫升细胞培养体积0.5至4.2μg。制备pei/dna复合物,其中使用不同的pei和dna重量比,为1:1、1.5:1、2:1、2.5:1和3:1,并在室温下温育1、5、10、15、20、25和30分钟,然后将dna/pei复合物添加到细胞培养物中。在dna/pei复合物加入后,再立即将0.5μg/ml至5.6μg/ml的游离pei(无dna)添加到细胞培养物中。在转染时或转染前24小时或转染后16-18小时将增强剂直接添加到细胞中。研究了不同量的增强剂。在转染后48和72小时采集包括细胞和细胞培养基在内的样品,以进行细胞计数和细胞活力研究,并在转染后72小时收获细胞培养物。
在生物反应器中产生raav载体:装备有两个或三个斜叶叶轮的2ldasgip平行生物反应器系统(eppendorf)用于扩大载体的生产过程。最终工作体积调整为400ml或1.2l。搅拌速度设定为130rpm、150rpm或170rpm,温度保持在37℃。在6.3、6.8、7.2、7.4、7.6或8下测试ph。选择ph7.2是由于最佳的细胞生长和raav产生。通过补充氧气、二氧化碳和空气的混合气体,可将溶解的氧气保持在40%。所有这些参数均由带有dasgipcontrol4.0软件的dasgip控制系统进行监视和控制。在f17培养基中培养的hek293f细胞以0.4×106细胞/ml的细胞密度接种,活力大于95%。接种后第3天,通过添加新鲜培养基对细胞进行传代培养。在传代培养后,将细胞密度调节至约0.5-1.7×106细胞/ml。传代培养后二十四小时,将细胞用pei/dna复合物、游离pei和转染增强子进行转染,如上所述和附图插图中所述。转染时细胞密度为约1-3×106细胞/ml。分析1.2至4.2μg/ml的dna,重量比为1:1、1.5:1、2:1、2.5:1或3:1的pei/dna以及0.5-4.2μg/ml游离pei和增强剂的质粒转染和raav生产。转染后72小时收获细胞培养物。
raav载体的定量:通过微流化(microfluidizertm,microfluidics)或三次超声处理,从转染的hek293f细胞收获物中释放出raav载体。离心沉淀细胞碎片,收集上清液并通过实时pcr分析。
raav载体基因组拷贝数使用taqmanmastermix(thermofisherscientific,4304437)通过实时聚合酶链反应(q-pcr)(thermofisherscientific,quanstudio7)确定。10μl细胞裂解液首先用2μl通用rna(biochain,r423565)处理,然后用7.6udnasei(qiagen,79254)处理以消化污染的未包装dna。然后将该溶液用0.2%sds/5mmedta/0.2mnacl处理,并在95℃加热10分钟以使dnasei失活并释放载体dna。引物和探针检测转基因hfviii序列:正向引物:5'-tgaggaggctgaagactat-3'(seqidno:3),反向引物5'-ccacagacctgatctgaatgaa-3'(seqidno:4)和探针/5'-6fam/tggatgtgg/zen/tgaggtttgatgatgaca/3iabkfq/-3'(seqidno:5)。通过线性化paav-hfviii质粒来生成标准品。所有样品均重复三次。
蛋白印迹分析:通过微流化(microfluidizertm,microfluidics)或三次超声作用从转染的hek293f细胞收获物中释放出raav载体。通过离心沉淀出细胞碎片,并收集上清液用于蛋白印迹。将细胞裂解液与4×nupagelds样品缓冲液(thermofisherscientific,np0007)混合,然后在95℃加热5分钟。样品通过sds-page分离,并转移至pvdf膜(thermofisherscientific,lc2002)。用odyssey封闭缓冲液(li-corbiosciences,927-50000)封闭1小时后,将膜与小鼠单克隆抗aavvp1,2,3抗体以1:500稀释度(americanresearchproducts,inc.,03-65158)在室温下温育2小时。漂洗三遍后,将膜与山羊抗小鼠igg,alexafluo680共轭二抗以1:5000的稀释度(invitrogen,a21057)在室温下温育1小时。用
实施例2
转染增强剂提高raav-fviii载体的生产率。
开发了一种使用pei“max”作为转染试剂的高效的基于pei的转染方法,将三种质粒转染到f17培养基中的hek293f细胞中,以产生raav载体。已经描述了用于质粒转染以获得最高raav生产率的最佳细胞培养窗。但是,当用于生成raav-fviii载体时,载体生产率相对较低(载体滴度为2-3e+10vg/ml)。生产率低下的原因可能是因为与其他转基因(例如egfp,fix)相比,fviii转基因非常大。
进行了寻找可以提高转染效率的试剂的研究。评估了几种转染试剂盒(包括expifectaminetm293转染试剂盒,
在存在或不存在这些增强子的情况下,进一步优化转染参数,其包括转染时的细胞密度、dna量、pei/dna比、游离pei量。数据显示,在存在增强子的情况下,增大转染时的细胞密度以及增大pei/dna比率,使用较少的dna和游离pei,产生最大的raav生产率。
图2显示了通过qpcr确定的在旋转瓶中使用不同dna量和pei/dna比率的raav-fviii载体的产量。用1.2、1.86、2.8μg/ml的dna转染转瓶中的hek293f细胞,使用的pei/dna(n/p)比率为1:1、1.5:1、2:1、2.5:1、3:1和1.5μg/ml的游离pei。在转染时将expifectaminetm293转染试剂盒中的增强子1和2添加到细胞中。增强子1和增强子2分别以1:200和1:20的培养体积使用。转染时细胞密度为2.5-3×106细胞/ml。产生载体的最佳条件是在转染时使用1.2μg/ml的dna和比为2-2.5:1的pei/dna和1.5μg/ml的游离pei和增强子1(1:200稀释)和增强子2(1:20稀释)。
对2ldasgip生物反应器中的条件进行了评估,并在更大范围内进行了进一步优化。图3显示了通过qpcr确定的在生物反应器中使用不同dna量和pei/dna比率的raav-fviii载体的产量。hek293f细胞在生物反应器中于37℃、ph7.2、do40%、150rpm的搅拌速率在400mlf17中培养。用摩尔比为1:1:1的dna和1.2或2.8μg/ml的dna,比率为1.5:1、2:1、2.5:1或3:1的pei/dna(n/p)和1.5μg/ml的游离pei转染细胞。在转染时将expifectaminetm293转染试剂盒中的增强子1和2添加到细胞中。增强子1和增强子2分别以1:200和1:20的培养体积使用。转染时细胞密度为2-3×106细胞/ml。产生最高raav载体生产率的条件是使用摩尔比为1:1:1的dna和1.2μg/ml的dna,比率为2.5-3:1的pei/dna和1.5μg/ml的游离pei和增强剂。
在生物反应器中,细胞培养体积从400ml增加到1.2l以产生raav。hek293f细胞在37℃、ph7.2、do40%、使用2或3个叶轮的130rpm、150rpm或170rpm的搅拌速率下培养。用摩尔比为1:1:1的dna、1.2μg/ml的dna,比率为2.5:1的pei/dna(n/p)和1.5μg/ml的游离pei转染细胞。如上所述,使用了expifectaminetm293转染试剂盒中的增强子1和2。图4显示了来自这些研究的raav滴度。数据表明,从小规模的50ml旋转瓶中优化的条件可以放大到400ml,然后放大到1.2l。在优化的pei介导的转染条件下使用增强剂可以在无血清悬浮培养物中将raav载体的生产率提高8-10倍。此过程高效、安全且可扩展。
为了确定转染时是否同时需要增强子1和2以改善raav的产生并进一步定义这些增强子的量,分别对其进行了评估。数据表明,单独的增强子1可以将raav的生产率提高到与增强子1和2结合时的生产率相同的水平。单独的增强子2没有可检测地增加raav的产量(图5)。还减少了增强子1和2的量,以进一步定义该工艺的最佳条件。增强子1和2的量减少导致raav滴度降低(图5)。转染时量增加的增强子1(1:100或1:150稀释度)和2(1:10或1:15稀释度)没有明显提高raav的生产率。除了在转染时使用增强子1和2之外,还在转染后24小时或48小时或同时在24小时和48小时对它们进行评估,以确定它们是否可以进一步提高raav滴度。图6显示重复使用增强子会稍微增加raav的产量。
实施例3
丙戊酸提高raav-fviii载体的生产率。
评价了多种化合物,其包括丙戊酸、依托泊苷、替尼泊苷、西霉素a和伏立诺他,以确定它们对转染和raav产量的影响。在这些化合物中,丙戊酸显著提高了raav的生产率。丙戊酸是组蛋白脱乙酰基酶的抑制剂,也是fda批准的治疗癫痫的药物。转瓶/摇瓶培养物以及dasgip生物反应器培养物中的转染使用了不同浓度的丙戊酸,即0.25mm,0.5mm,1mm,1.5mm,2mm,5mm,7.5mm和10mm。与无任何增强子相比,在优化的pei介导的转染中使用丙戊酸使raav-fviii载体滴度提高约10倍,并达到与无血清悬浮培养系统中增强子1和2相同的raav生产率水平或比其高的水平(图7)。在这些丙戊酸研究中,使用1.2μg/ml的dna、摩尔比为1:1:1的dna、重量比为2:1或2.5:1的pei/dna和1.5μg/ml的游离pei。将pei/dna复合物和游离pei在转染时添加至细胞后,添加不同浓度的丙戊酸。本研究未使用expifectaminetm293转染试剂盒的增强子。图8显示了在1l生物反应器培养物中,在增加的丙戊酸浓度(例如4mm或更高的丙戊酸,例如5-8mm)下,aav载体产量提高。
实施例4
在优化的基于pei的转染方法中,单独使用expifectaminetm293转染试剂盒的单独增强子1和丙戊酸可比目前报告的使用类似技术的生产方案显著提高raav载体的生产率,约为10倍。在raav生产系统中单独使用增强子1或丙戊酸提供了新的可扩展的raav生产平台,该平台可用于在无血清悬浮细胞培养物中高效生产任何血清型的raav载体。该工艺特别适用于用大转基因产生raav载体和产生难以产生的raav载体。该工艺是完全可扩展的、符合cgmp的通用raav生产系统,其对于大规模制造raav是可行的。
实施例5
图4中的数据证明,从旋转瓶中小规模的50ml的优化条件可以扩大到400ml,然后扩大到1.2l规模。可以实现直至更大体积的进一步的可扩展性。例如,可以预期的是,这些方法将可扩展至2升、2-20升、20-50升或50-100升。可以设想更大的体积,例如100-500升、500-1,000升或1,000或更多升。这种扩展可以包括克隆细胞和选择产生大量raav载体的克隆。创建大量表达raav载体的此类克隆的主细胞库提供了适用于本发明组合物和方法的可靠且可再现的细胞来源。
raav载体收获物的细胞培养条件、转染条件、细胞裂解和/或培养上清液收集的进一步完善,杂质的去除和随后的下游纯化条件也可能导致可扩展性的显著提高。
实施例6
1.0为使用悬浮细胞增加raav载体(例如lk03-fviii)的生产规模而变化的示例性、非限制性、工艺开发接受标准,概述,流程说明和参数
1.1细胞解冻和扩展
1.2在1.2l生物反应器规模下的raav载体生产
2.0工艺概述
2.1细胞解冻和细胞扩增工艺
2.1.1工艺流程图
以下是上游raav载体工艺的细胞解冻和细胞扩增部分的代表性工艺流程图:
2.1.2工艺流程说明
以下是上游raav载体(例如lk03-fviii)工艺的细胞解冻和细胞扩增部分的代表性工艺流程说明:
2.1.3在细胞解冻和细胞扩展研究期间变化的参数
在293-f细胞解冻和细胞扩增工艺期间评估了以下参数:
实施例7
2.3以1.2l生物反应器规模生产的示例性非限制性raav载体(例如lk03-fviii),工艺流程和参数随raav载体蛋白的增加而变化
2.3.1.工艺流程图
以下是1.2l生物反应器生产raav载体(例如lk03-fviii)的代表性工艺流程图:
2.3.2工艺流程说明
以下是1.2l生物反应器生产raav载体(例如lk03-fviii)的工艺流程说明:
2.3.3在raav载体(例如lk03-fviii)生产开发研究期间变化的参数
在开发用于raav载体(例如lk03-fviii)的1.2l生物反应器生产过程中,评估了以下参数:
实施例8
代表性的aav衣壳(vp1)蛋白
aav-spkvp1衣壳(seqidno:1)
aav-lk03vp1衣壳(seqidno:2)
maadgylpdwlednlsegirewwalqpgapkpkanqqhqdnarglvlpgykylgpgngldkgepvnaadaaalehdkaydqqlkagdnpylkynhadaefqerlkedtsfggnlgravfqakkrlleplglveeaaktapgkkrpvdqspqepdsssgvgksgkqparkrlnfgqtgdsesvpdpqplgeppaaptslgsntmasgggapmadnnegadgvgnssgnwhcdsqwlgdrvittstrtwalptynnhlykqissqsgasndnhyfgystpwgyfdfnrfhchfsprdwqrlinnnwgfrpkklsfklfniqvkevtqndgtttiannltstvqvftdseyqlpyvlgsahqgclppfpadvfmvpqygyltlnngsqavgrssfycleyfpsqmlrtgnnfqfsytfedvpfhssyahsqsldrlmnplidqylyylnrtqgttsgttnqsrllfsqagpqsmslqarnwlpgpcyrqqrlsktandnnnsnfpwtaaskyhlngrdslvnpgpamashkddeekffpmhgnlifgkegttasnaeldnvmitdeeeirttnpvateqygtvannlqssntapttrtvndqgalpgmvwqdrdvylqgpiwakiphtdghfhpsplmggfglkhpppqimikntpvpanppttfspakfasfitqystgqvsveiewelqkenskrwnpeiqytsnynksvnvdftvdtngvyseprpigtryltrpl
- 还没有人留言评论。精彩留言会获得点赞!