RNA序列调整的制作方法
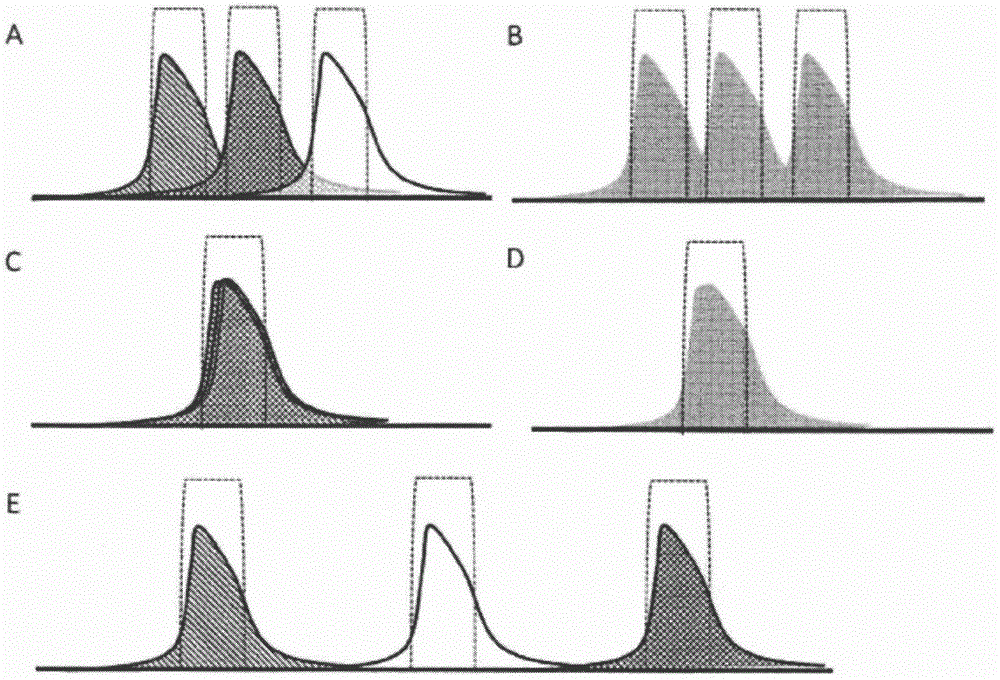
引言本发明涉及改变rna在色谱柱上的保留时间的方法。本发明还涉及从至少两个rna种类的混合物中纯化rna的方法。此外,本发明涉及从至少两个rna种类的混合物中共纯化至少两个rna种类的方法。特别地,本发明提供了一种用于协调至少两个rna种类中的a和/或u核苷酸的数目的方法。本发明还涉及通过所述方法可获得的rna,包含所述rna的组合物或包含所述rna的疫苗以及用于产生这种rna和组合物的方法。此外,本发明涉及试剂盒,特别是试剂盒套装,其包含rna、组合物或疫苗。本发明还涉及一种治疗或预防病症或疾病的方法,rna、组合物和疫苗的第一药用和第二药用。此外,本发明涉及提供调整的rna序列或调整的rna混合物的方法。基于核糖核酸(rna)的疗法可用于免疫疗法、基因疗法和基因疫苗接种。它们可以为多种疾病的治疗提供高度特异性和个性化的治疗选择。对于某些医学治疗和应用,期望施用包含不同rna分子种类的rna混合物。基于rna混合物的此类治疗的实例包括施用提供针对病原体的几种血清型(例如,来自甲型和乙型流感病毒的多种血清型的血凝素(ha))的保护的多价rna混合物;施用提供一种病原体的不同抗原(例如流感的不同抗原,例如ha、核蛋白(np)、神经氨酸酶(na)等)的rna混合物;施用提供针对癌症抗原的几种同种型或变体的保护(例如前列腺癌中的前列腺特异性抗原(psa))的rna混合物;施用提供抗原的不同表位的rna混合物;施用含有癌症特异性和/或患者特异性癌症抗原(表达的抗原或突变的抗原)的rna混合物;施用编码各种抗体(例如,靶向一种或多于一种蛋白质的不同表位的抗体)的rna混合物,或任何其他具有治疗活性的rna混合物(例如,编码用于分子疗法的酶的不同同工型,编码用于治疗其中必须补充几种蛋白质的适应症的不同治疗性蛋白质)。通过建立经监管机构批准的rna制造方法,实现了基于rna的治疗领域的重要一步,如wo2016/180430a1中所述,对dna水平和rna水平实施了各种质量控制。所述方法的关键要素是经由rp-hplc的rna产物的制备性纯化(如wo2008/077592a1中所述)。然而,到目前为止,rna制备方法仅适合一次制备一种单一的特定rna分子,例如编码一种特异性治疗靶标的rna分子。每个rna分子种类都必须用单独的制备方法制备。为了制备包含不同rna分子种类的rna混合物,必须进行单独的制备过程,并且必须将单独生产制备的rna分子种类混合以产生rna混合物。因此,常规制备包含几种rna分子种类(例如,编码不同抗原,例如流感病毒抗原的rna)的rna混合物(例如多价疫苗)是费力、昂贵且耗时的,因为需要多次运行dna模板产生、rna产生和rna产物的hplc纯化。除了经济原因外,特别是在大流行情况下,加速rna混合物(例如多价rna疫苗)的制备可能是非常有利的,并且对公共卫生至关重要。因此,理想的是同时制备和纯化rna混合物,理想的是只用一个制备和纯化方法。rna混合物的同时制备、纯化和分析对于多价/多功能疫苗,特别是多价/多功能流感rna疫苗的制造特别重要。有利的是,这种多价/多功能流感rna疫苗的制备应允许快速交换(一种或多于一种)抗原(例如,疫苗的季节性调整;大流行情况),而无需改变关键制备方法的条件(例如,纯化、分析等)。最近,如wo20171090134中所述,已经开发了在一种制备过程中同时制备不同rna分子种类的程序,旨在经济化和加速制备基于rna混合物的治疗剂。同时制备不同的rna分子种类,例如wo20171090134中所描述的,将节省基于rna混合物的治疗剂的制备中的时间、人工成本、生产成本和生产能力(例如空间、设备)。然而,存在与使用rp-hplc来同时制备纯化所获得的rna混合物(在本文中也称为“共纯化”)有关的严重问题。rna混合物中的不同rna分子种类通常在不同的时间点洗脱(由于hplc中保留时间不同),这使得在大多数情况下通过hplc进行共纯化在技术上是不可能的(如图1a和图1b所示)。例如,仅在以下情况下才可以通过hplc进行共纯化,其中rna混合物中包含的所有不同rna分子种类在基本上相同的时间点洗脱,使得不同rna产物峰重叠,从而有助于分离纯净的全长rna产物混合物(峰部分)以及与杂质分离(如图1c和图1d所示)。因此,用本领域已知的现有方法纯化rna混合物,例如包含多个rna种类的基于rna的治疗剂(例如,多价rna疫苗)是不可行的。特别地,在rna混合物中共纯化单个rna种类是不可行的。然而,例如在开发能够适应抗原组成的季节性变化的多价/多功能流感rna疫苗平台的背景下,这样的共纯化是非常需要的。在这种情况下,需要快速交换抗原(例如流感血凝素(ha)和/或神经氨酸酶(na))。由于编码不同抗原的不同种类的rna分子通常会在不同的时间点洗脱,因此本领域中可用的方法不允许从rna混合物中共纯化不同的rna种类,特别是通过hplc。出于相似的原因,当使用现有技术时,同时进行基于rna混合物或(多价)疫苗的hplc质量控制(以一种制备方法制备或单独制备并混合)也是不可行的。为了分析包含rna混合物的治疗剂,需要根据存在、完整性、比率和数量(质量控制参数)表征药物产品的不同组分(即不同的rna分子种类)。这样的质量控制可以在rna混合物的制备过程期间或之后进行,和/或作为间歇释放质量控制。但是,如上所述,rna混合物中不同种类的rna分子通常会在不同的时间点洗脱,这严重阻碍了通过hplc同时评估单个rna分子种类/或整个rna混合物的质量/完整性(“共分析”)(如图1a和图1b所示)。仅在可以清楚地区分每个rna分子种类的峰面积(同时确定每个rna分子种类的rna质量;见图1e)的情况下和/或在rna混合物中不同的rna种类在基本上相同的时间点洗脱,从而使得基本完全覆盖hplc峰(确定整个rna混合物的rna质量;请参见图1c和图1d)的情况下,才有可能通过hplc可靠地确定rna混合物的完整性。因此,用本领域提供的现有方法分析rna混合物,例如包含多个rna种类的rna治疗剂(例如,多价流感rna疫苗)也是不可行的。特别地,不可能对rna混合物中的rna种类进行共分析。例如,共分析,如通过hplc进行的共分析不适用于需要快速交换抗原的多价rna疫苗平台(例如季节性疫苗,例如流感疫苗),因为不同种类的rna分子各自编码不同的抗原(例如流感ha和/或na)在不同的时间点洗脱,通常导致hplc峰部分重叠。总之,上述技术难题严重阻碍了rna混合物的(共)纯化和(共)分析。特别是,代表一般rna纯化和分析、特别是gmp级rna纯化和分析关键要素的rp-hplc,不能用于rna混合物中单个rna种类的(共)纯化和(共)分析。此外,必须解决所描述的问题以促进开发用于制备可快速调节的rna疫苗例如rna流感疫苗的多价/多功能rna制备方法。综上所述,仍然需要满足能够对rna混合物进行纯化和/或分析的系统的需求。因此,本发明的目的是提供一种用于纯化和/或分析rna,特别是rna混合物的系统。本发明的另一个优选目的是提供一种用于(共)纯化和/或(共)分析包含多个rna种类的rna混合物中的各个rna种类的系统。通过所要求保护的主题解决了该问题。技术实现要素:本申请与电子格式的序列表一起提交,序列表是本申请说明书的一部分。与本申请一起提交的电子格式的序列表中包含的信息通过引用整体并入本文。除非另有说明,否则在本文中提及“seqidno:”时,是指序列表中具有相应标识符的相应核酸序列或氨基酸序列。为了清楚和可读起见,提供以下定义。针对这些定义提及的任何技术特征可以在本发明的每个实施方案中阅读到。在这些实施方案的上下文中可以具体地提供附加的定义和解释。定义:适应性免疫应答:如本文中所使用的术语“适应性免疫应答”将被本领域普通技术人员所认识和理解,并且例如意在指免疫系统的抗原特异性应答。抗原特异性可产生针对特定病原体或病原体感染细胞的应答。通常通过“记忆细胞”(b细胞)在体内维持产生这些定制的应答的能力。在本发明的上下文中,抗原由编码至少一种抗原性肽或蛋白质的rna编码区提供。适应性免疫系统:适应性免疫系统主要致力于消除或防止病原体的生长。它通常通过为脊椎动物的免疫系统提供识别和记忆特定病原体的能力(以产生免疫力),并在每次遇到病原体时发起更强的攻击来调节适应性免疫应答。佐剂/辅助组分:广义上的佐剂或辅助组分通常是可增强其他试剂如药物或疫苗作用的药理学和/或免疫学试剂。应当从广义上解释它,并且指的是各种物质。通常,这些物质能够增加抗原的免疫原性。例如,佐剂可以被先天免疫系统所识别,并且例如可以引起先天性免疫应答。“佐剂”通常不引起适应性免疫应答。就此而言,“佐剂”属于抗原。它们的作用方式不同于抗原引起的适应性免疫应答。抗原:在本发明的上下文中,“抗原”通常是指可以被免疫系统识别的物质,优选地被适应性免疫系统识别的物质,并且能够触发抗原特异性的免疫应答,例如通过形成抗体和/或抗原特异性t细胞作为适应性免疫应答的一部分。通常,抗原可以是或可以包含可由mhc呈递给t细胞的肽或蛋白质。在本发明的意义上,抗原可以是本文定义的提供的rna的翻译产物。在本文中,也将包含至少一个表位的肽和蛋白质的片段、变体和衍生物理解为抗原。在本发明的上下文中,如本文所定义的肿瘤抗原和致病性抗原是特别优选的。双顺反子rna、多顺反子rna:双顺反子或多顺反子rna通常是rna,优选为mrna,其通常可以具有两个编码区(双顺反子)或多于两个编码区(多顺反子)。在本文中,编码区是可翻译成肽或蛋白质的密码子序列。运载体/聚合物运载体:在本发明的上下文中,运载体通常可以是促进另一种化合物(货物)的运输和/或络合的化合物。聚合物运载体通常是由聚合物形成的运载体。运载体可以通过共价或非共价相互作用与其货物关联。运载体可以将核酸例如rna或dna运输至靶细胞。在一些实施方案中,运载体可以是阳离子组分。阳离子组分:术语“阳离子组分”通常是指带电荷的分子,其在通常为1至9的ph值下,优选在等于9或低于9(例如5至9)、等于8或低于8(例如5至8)、等于7或低于7(例如5至7)的ph值下,最优选在生理ph,例如从7.3到7.4下带正电(阳离子)。因此,阳离子组分可以是在生理条件下,特别是在体内生理条件下带正电的任何带正电荷的化合物或聚合物,优选为阳离子肽或蛋白质。“阳离子肽或蛋白质”可以包含至少一种带正电荷的氨基酸,或多于一种带正电荷的氨基酸,例如选自arg、his、lys或orn的氨基酸。因此,“聚阳离子”组分也在给定条件下呈现出多于一个正电荷的范围内。编码区:在本发明的上下文中,编码区通常是几个核苷酸三联体的序列,其可以翻译成肽或蛋白质。编码区优选在其5’末端含有起始密码子,即通常编码氨基酸甲硫氨酸的三个连续核苷酸(atg)和通常具有长度为3个核苷酸倍数的连续区域的组合。编码区优选终止于终止密码子(例如,taa、tag、tga)。通常,这是编码区唯一的终止密码子。因此,在本发明的上下文中,编码区优选是核苷酸序列,其由可以被三整除的多个核苷酸组成,其开始于起始密码子(例如atg)并且优选终止于终止密码子(例如taa、tga或tag)。可以分离编码区,或者可以将其掺入更长的核酸序列中,例如掺入载体或mrna中。在本发明的上下文中,编码区也可以称为“蛋白质编码区”、“编码序列”、“cds”、“开放阅读框”或“orf”。序列片段:序列的片段通常可以是例如核酸分子或氨基酸序列的全长序列的较短部分。因此,片段通常包含或组成为与全长序列内的相应片段相同的序列。在本发明的上下文中,优选的序列片段包含或组成为连续的实体片段,例如对应于衍生该片段的分子中的实体的连续片段的核苷酸或氨基酸,其占衍生该片段的整体(即全长)分子的至少5%、10%、20%,优选至少30%,更优选至少40%,更优选至少50%,甚至更优选至少60%,甚至更优选至少70%,最优选至少80%。优选地,本文所用序列的片段与衍生它的序列至少5%、10%、20%、30%、40%、50%、60%,优选至少70%,更优选至少80%,甚至更优选至少90%,甚至更优选至少95%,最优选至少99%相同。优选地,本文使用的片段与全长分子相比具有相同的生物学功能或比活性。异源序列:如果两个序列不是来自同一基因或同一等位基因,则通常被理解为“异源”。即,尽管异源序列可以源自同一生物,但是它们本身(天然地)不存在于同一核酸分子中,例如同一mrna中。(核酸序列/氨基酸序列的)同源物:术语“同源物”通常是指相同种类或另一种类的序列,其与参考序列相关联,但优选不相同。术语“同源物”涵盖直系同源物和旁系同源物。在这种情况下,“直系同源物”是由通过物种形成从共同祖先基因进化而来的不同物种的基因编码的蛋白质。直系同源物通常在进化过程中保留相同的功能。因此,当比较一对直系同源物时,可能会丢失或获得功能。“旁系同源物”是通过基因组内的基因复制产生的基因。旁系同源物也可能进化出新功能或最终成为假基因。在本发明的上下文中,核酸序列或氨基酸序列的同源物优选与参考序列至少5%、10%、20%、30%、40%、50%、60%,更优选至少70%,甚至更优选至少80%,甚至更优选至少90%,甚至更优选至少95%,最优选至少99%相同。还优选地,本文所用的“同源物”由实体,例如对应于参考分子中的实体的连续片段的核苷酸或氨基酸残基的连续片段组成,其占整体(即全长)参考分子的至少5%、10%、20%,优选至少30%,更优选至少40%,更优选至少50%,甚至更优选至少60%,甚至更优选至少70%,最优选至少80%。免疫原:在本发明的上下文中,免疫原通常可以理解为能够刺激免疫应答的化合物。优选地,免疫原是肽、多肽或蛋白质。在一个特别优选的实施方案中,本发明意义上的免疫原是所提供的核酸分子,优选如本文所定义的rna分子的翻译产物。通常,免疫原引起至少一种适应性免疫应答。免疫应答:免疫应答通常可以是适应性免疫系统对特定抗原的特异性反应(所谓的特异性或适应性免疫应答)或先天性免疫系统的非特异性反应(所谓的非特异性或先天性免疫应答)或其组合。免疫系统:免疫系统可以保护生物体免受感染。如果病原体成功穿过生物体的物理屏障并进入该生物体,则先天性免疫系统会立即提供非特异性应答。如果病原体逃避了这种先天性应答,脊椎动物还具有第二层保护,即适应性免疫系统。在这里,免疫系统在感染过程中调整其应答,以改善其对病原体的识别能力。然后,在消除病原体后,以免疫记忆的形式保留了这种改善的应答,并且每次遇到此病原体时,适应性免疫系统都会发起更快更强的攻击。据此,免疫系统包括先天性和适应性免疫系统。这两个部分通常都包含所谓的体液和细胞组分。核酸序列/氨基酸序列:通常将核酸分子的序列理解为其核苷酸的特定和单独的顺序,即其核苷酸的连续排列。通常将蛋白质或肽的序列理解为其氨基酸残基的顺序,即其氨基酸残基的连续排列。肽:肽或多肽通常是通过肽键连接的氨基酸单体的聚合物。肽通常包含少于50个单体单元。然而,术语“肽”并不排除具有超过50个单体单元的分子。长肽也称为多肽,通常具有50个至600个单体单元。然而,本文所用的术语“多肽”通常不受其所指分子的长度的限制。在本发明的上下文中,术语“多肽”还可以用于包含少于50个(例如10个)氨基酸的肽或包含甚至超过600个氨基酸的肽的情况。多价/多功能疫苗:多价疫苗(也称为“多功能疫苗”)通常包含多于一种病毒株的抗原(或其片段或变体)或同一病毒的不同抗原(或其片段或变体)或其任何组合。术语“多价疫苗”描述该疫苗具有多于一个效价。在本发明的上下文中,多价疫苗(例如流感疫苗、诺如病毒疫苗)优选包括包含编码衍生自几种(基因上)不同病毒的抗原肽或蛋白质的核酸、或包含编码(基因上)相同病毒的不同抗原的核酸、或其组合的疫苗。在一个优选的实施方案中,多价疫苗包含2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个、31个、32个、33个、34个、35个、36个、37个、38个、39个、40个、41个、42个、43个、44个、45个、46个、47个、48个、49个、50个、51个、52个、53个、54个、55个、56个、57个、58个、59个、60个、61个、62个、63个、64个、65个、66个、67个、68个、69个、70个、71个、72个、73个、74个、75个、76个、77个、78个、79个、80个、81个、82个、83个、84个、85个、86个、87个、88个、89个、90个、91个、92个、93个、94个、95个、96个、97个、98个、99个、100个或甚至多于100个不同的rna或rna种类,优选如本文所述的rna或rna种类,其各自编码至少一种不同的抗原性肽或蛋白质。pct申请wo20171090134中公开了制备多价mrna疫苗的方法。治疗有效量:在本发明的上下文中,治疗有效量通常应理解为例如在病理情况下足以诱导药物作用例如免疫应答的量,其改变了表达的肽或蛋白质的病理水平或替代了缺失的基因产物。蛋白质:蛋白质通常包含一个或多于一个肽或多肽。蛋白质通常折叠成3维形式,这可能是蛋白质发挥其生物学功能所必需的。rna、mrna:rna是核糖核酸的常用缩写。它是核酸分子,即由核苷酸组成的聚合物。这些核苷酸通常是腺苷单磷酸、尿苷单磷酸、鸟苷单磷酸和胞苷单磷酸单体,它们沿着所谓的骨架相互连接。骨架是通过第一相邻单体的糖即核糖和第二相邻单体的磷酸部分之间的磷酸二酯键形成的。单体的特定顺序被称为rna序列。通常,rna可以例如在细胞内部通过dna序列的转录而获得。在真核细胞中,转录通常在细胞核或线粒体内进行。通常,dna的转录通常会产生所谓的未成熟的rna,必须将其加工成所谓的信使-rna,通常称为mrna。例如在真核生物中,未成熟的rna的加工包含多种不同的转录后修饰,例如剪接、5’-加帽、聚腺苷酸化、从细胞核或线粒体输出等。这些过程的总和也称为rna成熟。成熟的信使rna通常提供核苷酸序列,其可被翻译成特定肽或蛋白质的氨基酸序列。通常,成熟的mrna包含5′-帽、5′-utr、编码区、3′-utr和多聚腺苷酸(poly(a))序列。除了信使rna,还存在几种非编码类型的rna,它们可参与转录和/或翻译的调控。序列同一性、(序列的)同一性:如果两个或多于两个序列具有相同的长度和核苷酸或氨基酸的顺序,则它们是相同的。同一性百分比通常描述两个序列相同的程度,即,它通常描述在其序列位置上与参考序列的相同核苷酸相对应的核苷酸的百分比。为了确定同一性程度,待比较的序列被视为具有相同的长度,即,待比较的序列中最长的序列的长度。这意味着由8个核苷酸组成的第一序列与包含第一序列的由10个核苷酸组成的第二序列80%相同。因此,在本发明的上下文中,序列的同一性优选地涉及在两个或多于两个具有相同长度的序列中具有相同位置的序列的核苷酸的百分比。因此,例如可以将第一序列的位置与第二序列的相应位置进行比较。如果第一序列中的一个位置被第二序列中某个位置的相同组分(残基)占据,则两个序列在该位置上是相同的。如果不是这种情况,则序列在该位置处是不同的。如果与第一序列相比,在第二序列中发生插入,则可以将空位插入第一序列中以允许进一步比对。如果与第一序列相比在第二序列中发生缺失,则可以将空位插入第二序列中以允许进一步比对。然后,两个序列相同的百分比是相同位置数除以包括只在一个序列中被占据的那些位置的位置总数的函数。可以使用数学算法确定两个序列相同的百分比。可以使用的数学算法的优选而非限制性实例是karlin等人(1993),pnasusa,90:5873-5877或altschul等人(1997),nucleicacidsres.,25:3389-3402的算法。这种算法集成在blast程序中。可以通过该程序鉴别在某种程度上与本发明的序列相同的序列。转染:术语“转染”是指将核酸分子,例如dna或rna(例如mrna)分子引入细胞,优选地引入真核细胞。在本发明的上下文中,术语“转染”涵盖本领域技术人员已知的用于将核酸分子引入细胞,优选地引入真核细胞,例如哺乳动物细胞中的任何方法。这样的方法包括例如电穿孔、脂转染例如基于阳离子脂质和/或脂质体、磷酸钙沉淀、基于纳米颗粒的转染、基于病毒的转染或基于阳离子聚合物如deae-葡聚糖或聚乙烯亚胺的转染等。优选地,引入是非病毒性的。疫苗:疫苗通常被理解为提供至少一种抗原,优选免疫原的预防性或治疗性材料。抗原或免疫原可以衍生自适合于疫苗接种的任何材料。例如,抗原或免疫原可衍生自病原体,例如衍生自细菌或病毒颗粒等、或衍生自肿瘤或癌性组织。抗原或免疫原刺激人体的适应性免疫系统以提供适应性免疫应答。载体:术语“载体”是指核酸分子,优选地是指人工核酸分子。在本发明的上下文中,载体适合于掺入或包含期望的核酸序列,例如包含编码区的核酸序列。这样的载体可以是贮存载体、表达载体、克隆载体、转移载体等。贮存载体是允许方便地贮存核酸分子例如mrna分子的载体。因此,载体可包含对应于例如所需mrna序列或其一部分的序列,例如对应于mrna的编码区和3’-utr和/或5’-utr的序列。表达载体可用于产生表达产物如rna例如mrna、或肽、多肽或蛋白质。例如,表达载体可包含转录载体的序列片段所需的序列,例如启动子序列,例如rna聚合酶启动子序列。克隆载体通常是包含克隆位点的载体,其可用于将核酸序列掺入到载体中。克隆载体可以是例如质粒载体或噬菌体载体。转移载体可以是适于将核酸分子转移到细胞或生物中的载体,例如病毒载体。在本发明的上下文中,载体可以是例如rna载体或dna载体。优选地,载体是dna分子。优选地,在本申请的意义上,载体包含克隆位点、选择标记例如抗生素抗性因子、和适合于载体复制的序列例如复制起点。优选地,在本申请的上下文中,载体是质粒载体。媒介物:通常将媒介物理解为适合于存储、运输和/或施用化合物例如药物活性化合物的材料。例如,媒介物可以是生理上可接受的液体,其适合于存储、运输和/或施用药物活性化合物。序列的变体:核酸序列或氨基酸序列的变体通常在一个或多于一个残基上与原始序列不同,例如一个或多于一个置换、插入和/或缺失的核苷酸或氨基酸残基。优选地,这些变体与全长分子相比具有相同的生物学功能或比活性。在本发明的上下文中,核酸序列或氨基酸序列的变体优选与参考序列至少5%、10%、20%、30%、40%、50%、60%,更优选至少70%,甚至更优选至少80%,甚至更优选至少90%,甚至更优选至少95%,最优选至少99%相同。还优选地,本文所用的“变体”包含或组成为实体,例如核苷酸或氨基酸残基的连续片段,其对应于参考分子中的实体的连续片段,其占整体(即全长)参考分子的至少5%、10%、20%、30%、40%、50%、60%,优选至少70%,更优选至少80%,甚至更优选至少90%,甚至更优选至少95%,最优选至少99%。改变rna在色谱柱上的保留时间的方法:本发明的一个方面涉及一种用于改变rna在色谱柱上的保留时间的方法。特别地,本发明提供了一种用于纯化rna的方法,例如用色谱从多个rna种类的混合物中纯化rna的方法。通过改变rna的保留时间,本发明的方法优选地允许所述rna的物理分离。根据优选的实施方案,本发明涉及用于改变rna在色谱柱上的保留时间的方法,其中该方法包括通过相对于原始rna序列中腺嘌呤(a)核苷酸和/或尿嘧啶(u)核苷酸的数目改变rna序列中a核苷酸和/或尿u核苷酸的数目来调整rna(序列)的步骤。发明人出人意料地发现,rna中a和u核苷酸的总数会影响rna在色谱方法,例如高压(高效)液相色谱(hplc),更优选反相hplc中色谱柱上的保留时间。如本文所用,术语“保留时间”通常是指化合物(例如rna)在被注入后在色谱柱上所经历的时间。如果样品中的两种化合物,例如rna混合物中的两个rna种类具有不同的保留时间,则每种化合物在色谱柱上经历的时间不同。保留时间通常以秒或分钟为单位。在这种情况下,发明人还发现,可以通过改变rna序列中腺嘌呤(a)和/或尿嘧啶(u)核苷酸的数目来调节给定色谱方法的分离因子。发现至少两个rna种类之间a和/或u核苷酸数目差的增加与增加的分离因子相关(参见图16)。因此,本发明的方法可用于通过改变rna序列中腺嘌呤(a)和/或尿嘧啶(u)核苷酸的数目来增加色谱法的分离因子。至少两个rna种类之间的a和/或u核苷酸数目差的减小与分离因子的减小相关。因此,本发明的方法可用于通过改变rna序列中腺嘌呤(a)和/或尿嘧啶(u)核苷酸的数目来降低色谱法的分离因子。如本文所用,术语“rna种类”通常涉及具有相同核苷酸序列的多个rna分子或(至少一个rna分子)。优选地,rna种类的保留时间是所述rna种类在柱中迁移或从柱上洗脱所需的时间,该时间由从样品注入流动相流的瞬间到出现最大峰值的时间点来测量。备选地,保留时间还可以通过测量从样品被注入的瞬间到第一个未保留的rna出现在出口处的时间来确定。在优选的实施方案中,通过计算相应的保留体积来去除保留时间对给定流速的依赖性,该相应的保留体积通常被计算为保留时间乘以流动相的体积流速。因此,在优选的实施方式中,可以通过根据本发明的方法来改变保留体积。通过本发明的方法改变rna的保留时间,其中保留时间优选增加或减少。特别地,通过改变所述原始rna(序列)中的a和/或u核苷酸的数目来改变原始rna(序列)的保留时间,从而获得具有改变的保留时间的调整的rna(序列)。在这种情况下,术语“原始rna(序列)”可以指任何rna(序列),其保留时间可以通过本文所述的方法被改变。因此,“原始rna(序列)”可以是野生型rna序列。此外,在本发明的意义上,修饰的rna序列,优选优化的rna序列,更优选如本文所述的rna序列(例如,已经就g/c含量进行了修饰(优化)的rna序列)也可用作“原始rna(序列)”。如本文所用,术语“调整的rna(序列)”优选是指衍生自原始rna(序列)的rna(序列),其与原始rna(序列)的区别在于a和/或u核苷酸的总数不同。换句话说,可以通过本发明的方法获得调整的rna(序列),特别是通过改变原始rna(序列)中a和/或u核苷酸的数目,从而优选地改变rna的保留时间来获得调整的rna(序列)。在一个优选的实施方案中,通过本发明的方法获得调整的rna(序列),其与原始rna(序列)的区别仅在于a和/或u核苷酸的数目不同或相应核苷酸位置处的相应序列变化。因此,通常通过本发明的方法来改变原始rna的保留时间,其中相对于原始rna的保留时间,优选地改变,更优选地增加或减少调整的rna的保留时间。如本文所用,术语“rna(序列)”可以指作为单独化合物的rna或指rna种类,优选如本文所述的rna种类,或指给定rna或rna种类的核苷酸序列。在本发明的上下文中,术语“rna种类”通常涉及由某个核苷酸序列限定的rna。具有相同核苷酸序列的多个rna分子在本文中也可以称为“rna种类”。特别地,本文所用的术语“rna种类”可以指第一rna种类,例如共享相同核苷酸序列的第一多个rna分子(或指共享相同核苷酸序列的rna分子群),其中所述rna种类优选与第二(或其他)rna种类,例如与共享不同于第一rna种类核苷酸序列的核苷酸序列的第二(或其他)多个rna分子(或与共享不同于第一rna种类核苷酸序列的核苷酸序列的第二(或其他)rna分子群)一起存在于混合物中。如本文所用,术语“rna”可以是指任何类型的rna,没有限制。优选地,术语rna是指选自长链rna、编码rna、非编码rna、单链rna(ssrna)、双链rna(dsrna)、线性rna(linrna)、环状rna(circrna)、信使rna(mrna)、rna寡核苷酸、小干扰rna(sirna)、小发夹rna(shrna)、反义rna(asrna)、crispr/cas9指导rna、核糖开关、免疫刺激rna(isrna)、核酶、适体、核糖体rna(rrna)、转移rna(trna)、病毒rna(vrna)、逆转录病毒rna或复制子rna、小核rna(snrna)、小核仁rna(snorna)、微rna(mirna)、环状rna(circrna)和与piwi相互作用的rna(pirna)的分子或分子种类。优选地,rna是编码rna。根据一个特别优选的实施方案,所述方法用于改变编码rna,优选mrna,更优选如本文所述的rna的保留时间。根据优选的实施方案,编码rna,优选mrna,是如本文所述的长链rna。根据本发明的方法优选地用于改变单链rna(ssrna)或双链rna(dsrna),更优选ssrna的保留时间。如本文所用,术语“单链rna”或“ssrna”通常是指由单个rna链组成的rna分子,其可以任选地包含(例如基于条件)二级结构元件(例如发夹,茎-环等)。在本发明的上下文中,术语“双链rna”或“dsrna”通常是指包含两个rna链的rna分子,其优选形成(杂)双链体。优选地,本文所用的rna包含多于30个核苷酸。更优选地,rna不选自sirna、小发夹rna、微rna或小核rna(snrna)。在一个特别优选的实施方案中,本文所用的rna不是sirna。根据一个优选的实施方案,所述方法用于改变长链rna的保留时间。如本文所用,术语“长链rna”通常是指优选如本文所述的优选包含至少30个核苷酸的rna分子。或者,长链rna可包含至少35个、40个、45个、50个、55个、60个、65个、70个、75个、80个、85个、90个、95个、100个、150个、200个、250个、300个、350个、400个、450个、500个、550个、600个、650个、700个、750个或至少800个核苷酸。长链rna分子还可以包含至少100个核苷酸,甚至更优选至少200个核苷酸。在本发明的上下文中,长链rna还优选包含30个至50000个核苷酸、30个至20000个核苷酸、100个至20000个核苷酸、200个至20000个核苷酸、200个至15000个核苷酸、500个至20000个核苷酸、800个至20000个核苷酸、800个至5000个核苷酸或800个至2000个核苷酸。如本文所用,术语“长链rna”不限于特定类型的rna,而仅是指所述rna中包含的核苷酸的数目。例如,长链rna可以是编码rna,优选为mrna,更优选如本文所述的rna。根据本发明的优选实施方案,确定原始rna序列中的a和/或u核苷酸的数目。在本发明的上下文中,短语“a和/或u核苷酸的数目”可以指腺嘌呤(a)核苷酸的总数,指尿嘧啶(u)核苷酸的总数,或更优选地,指a核苷酸和u核苷酸的总数。优选将a和/或u核苷酸的数目增加或减少至目标数目,其可以是已知数目或已经预定的数目,优选如本文所述的数目。目标数目优选地根据各自的目的来选择。通常保留时间的改变越大,原始rna序列中a和/或u核苷酸的目标数目与原始数目之间的差越大。因此,本发明的方法包括确定原始rna序列中a和/或u核苷酸的数目的步骤,和增加或减少所述a和/或u核苷酸的数目以获得调整的rna序列的步骤。如本文所用,术语“腺嘌呤核苷酸”或“a核苷酸”通常是指腺嘌呤核苷酸或其类似物,例如化学修饰的a核苷酸,优选如本文所述的a核苷酸。术语“尿嘧啶核苷酸”或“u核苷酸”可以指尿嘧啶核苷酸或其类似物,例如化学修饰的u核苷酸,优选如本文所述的u核苷酸。在本文中,短语“a和/或u核苷酸的数目”还可以指腺嘌呤(a)核苷酸和腺嘌呤核苷酸类似物的总数,指尿嘧啶(u)核苷酸和尿嘧啶核苷酸类似物的总数,或更优选地指a核苷酸、腺嘌呤核苷酸类似物、u核苷酸和u核苷酸类似物的总数。以类似的方式,术语“鸟嘌呤核苷酸”或“g核苷酸”可以指鸟嘌呤核苷酸或其类似物,例如化学修饰的g核苷酸,优选如本文所述的g核苷酸。术语“胞嘧啶核苷酸”或“c核苷酸”可以指胞嘧啶核苷酸或其类似物,例如化学修饰的c核苷酸,优选如本文所述的c核苷酸。在本文中提及a、u、g或c核苷酸时,该术语还包括相应的核苷酸类似物,优选地如本文所述的核苷酸,更优选化学修饰的核苷酸。在本文中提及“尿嘧啶核苷酸”、“u核苷酸”或尿嘧啶核苷酸的类似物时,还应理解的是,这些术语还可以涉及对应于rna序列的dna序列中的胸腺嘧啶核苷酸(例如在编码如本文所述的rna的dna载体中)。优选不改变原始rna的长度,以使原始rna和调整的rna中的核苷酸总数基本相同。备选地,原始rna的长度也可以增加或减少,例如通过添加或缺失核苷酸来增加或减少。在优选的实施方案中,将原始rna序列中的g和/或c核苷酸替换为a和/或u核苷酸,从而相对于原始rna序列中a和/或的u核苷酸的数目改变,特别是增加rna序列中的a和/或u核苷酸的数目。根据一些实施方案,本发明的方法包括用a和/或u核苷酸替换原始rna序列中的g和/或c核苷酸的步骤。或者,可以将原始rna序列中的a和/或u核苷酸替换为g和/或c核苷酸,从而相对于原始rna序列中a和/或的u核苷酸的数目改变,特别是减少rna序列中的a和/或u核苷酸的数目。根据一些实施方案,本发明的方法包括用g和/或c核苷酸替换原始rna序列中的a和/或u核苷酸的步骤。根据一些实施方案,所述方法还可包括将另外的核苷酸,优选g和/或c核苷酸,更优选地a和/或u核苷酸引入rna序列的步骤。其中,优选将核苷酸插入原始rna序列的非编码区。在优选的实施方案中,本发明涉及一种用于改变包含至少一个编码区的rna的保留时间的方法。在这些实施方案中,优选在编码区内改变a和/或u核苷酸的数目,优选如本文所述。例如,编码区中的g和/或c核苷酸被a和/或u核苷酸替换,以增加编码区中的a和/或u核苷酸的数目。备选地,编码区中的a和/或u核苷酸可以被g和/或c核苷酸替换,以减少编码区中的a和/或u核苷酸的数目。在一个特别优选的实施方案中,改变rna中至少一个编码区中a和/或u核苷酸的数目,而不改变由原始rna(序列)的编码序列编码的氨基酸序列。遗传密码的简并性允许在编码区改变密码子而不会改变编码的氨基酸序列。因此,根据本发明的方法优选包括将rna的编码区中的至少一个密码子替换为编码相同氨基酸的替代密码子,其中所述替代密码子优选特征在于a和/或u核苷酸的数目与原始密码子中的a和/或u数目不同。参考本文中用于提供调整的rna序列的本发明方法的描述,其中更详细地解释了合适的密码子替换的选择。优选地,将a和/或u核苷酸的数目增加或减少到使得保留时间得以充分改变以用于给定目的的程度。根据该目的,可以将a和/或u核苷酸的数目调整为预定的目标数目。例如,给定的(原始)rna序列中的a和/或u核苷酸的数目可以调整至也存在于混合物中并将与待调整的rna共纯化的另一个rna种类的序列中的a和/或u核苷酸的数目或调整至与该数目基本上相同的数目。具有基本相同数目的a和/或u核苷酸的rna种类通常以在色谱柱例如hplc柱上的保留时间基本相同为特征。相应地,这些rna种类从色谱柱中洗脱出相同的级分(峰)。备选地,可以选择目标数目,以使与混合物中另一个rna种类中a和/或u核苷酸的数目之差足以使调整的rna以单独的级分(峰)洗脱(这可以确定每个rna种类的完整性)。在优选的实施方案中,改变rna序列中的a和/或u核苷酸的数目,以使调整的rna序列中的a和/或u核苷酸的数目与原始rna序列中a和/或u核苷酸的数目相差至少1个,优选至少2个,更优选至少3个,甚至更优选至少4个,甚至更优选至少5个,甚至更优选至少10个,最优选至少15个。备选地,调整的rna序列中a和/或u核苷酸的数目与原始rna序列中a和/或u核苷酸的数目可以相差至少5个,优选至少10个,更优选至少20个,甚至更优选至少30个,甚至更优选至少40个,甚至更优选至少50个,最优选至少60个。备选地,调整的rna序列中a和/或u核苷酸的数目与原始rna序列中a和/或u核苷酸的数目可以相差至少60个,优选至少80个,更优选至少100个,甚至更优选至少120个,甚至更优选至少140个,甚至更优选至少160个,最优选至少200个。根据优选的实施方案,所述方法用于相对于原始rna的保留时间增加调整的rna的保留时间,其中相对于原始rna序列中a和/或u核苷酸的数目,调整的rna序列中a和/或u核苷酸的数目增加至少1个,优选至少2个,更优选至少3个,甚至更优选至少4个,甚至更优选至少5个,甚至更优选至少10个,最优选至少15个。备选地,相对于原始rna序列中a和/或u核苷酸的数目,调整的rna序列中a和/或u核苷酸的数目可以增加至少5个,优选至少10个,更优选至少20个,甚至更优选至少30个,甚至更优选至少40个,甚至更优选至少50个,最优选至少60个。备选地,相对于原始rna序列中a和/或u核苷酸的数目,调整的rna序列中a和/或u核苷酸的数目可以增加至少60个,优选至少80个,更优选至少100个,甚至更优选至少120个,甚至更优选至少140个,甚至更优选至少160个,最优选至少200个。所述方法还可以用于相对于原始rna的保留时间,减少调整的rna的保留时间,其中相对于原始rna序列中a和/或u核苷酸的数目,调整的rna序列中a和/或u核苷酸的数目减少至少1个,优选至少2个,更优选至少3个,甚至更优选至少4个,甚至更优选至少5个,甚至更优选至少10个,最优选至少15个。备选地,相对于原始rna序列中a和/或u核苷酸的数目,调整的rna序列中a和/或u核苷酸的数目可以减少至少5个,优选至少10个,更优选至少20个,甚至更优选至少30个,甚至更优选至少40个,甚至更优选至少50个,最优选至少60个。备选地,相对于原始rna序列中a和/或u核苷酸的数目,调整的rna序列中a和/或u核苷酸的数目可以减少至少60个,优选至少80个,更优选至少100个,甚至更优选至少120个,甚至更优选至少140个,甚至更优选至少160个,最优选至少200个。在一些实施方案中,所述方法包括通过使a核苷酸的数目与u核苷酸的数目的比为0.2至5,优选0.5至3,更优选1至3,甚至更优选1至2.5,甚至更优选1.2至2,甚至更优选1.4至2,甚至更优选1.5至2,最优选1.6至2的方式改变a和/或u核苷酸的数目来调整原始rna序列的步骤。根据一些实施方案,改变rna在色谱柱上的保留时间,其中改变rna序列中的a核苷酸的数目比改变rna序列的u核苷酸的数目对rna的保留时间有更强的影响。优选地,通过改变a核苷酸的数目而获得的保留时间的改变比通过改变相同数目的u核苷酸而获得的保留时间的改变强约1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍或2倍,优选1.5倍。在一些实施方案中,相对于原始rna序列中a核苷酸的数目与u核苷酸的数目的比,rna序列中a核苷酸的数目与u核苷酸的数目的比增加(而不改变a和u核苷酸的总数),从而增加了调整的rna的保留时间。或者,相对于原始rna序列中a核苷酸的数目与u核苷酸的数目的比,rna序列中a核苷酸的数目与u核苷酸的数目的比降低(而不改变a和u核苷酸的总数),从而减少了调整的rna的保留时间。本发明方法的每个实施方案可以以单独步骤或其任何组合形式使用,所述方法包括以任何方式改变rna序列中a和/或u核苷酸的数目,以导致保留时间的所需改变(减少或增加)的步骤。因此,如本文所定义,rna的保留时间的增加可优选地通过将原始rna序列中,优选编码区中的g和/或c核苷酸替换为a和/或u核苷酸和/或通过将额外的a和/或u核苷酸引入原始rna序列,优选引入utr区,和/或通过相对于原始rna序列中a核苷酸数目与u核苷酸数目的比,增加rna序列中a核苷酸数目与u核苷酸数目的比(而不改变a和u核苷酸的总数)来获得,其中所有这些调整都适用,且不改变原始rna(序列)编码区编码的氨基酸序列。因此,如本文所定义,rna的保留时间的减少可通过将原始rna序列中,优选编码区中的a和/或u核苷酸替换为g和/或c核苷酸,和/或通过将额外的g和/或c核苷酸引入原始rna序列,优选引入utr区,和/或通过相对于原始rna序列中a核苷酸数目与u核苷酸数目的比,减少rna序列中a核苷酸数目与u核苷酸数目的比(而不改变a和u核苷酸的总数)来获得,其中所有这些调整都适用,且不改变原始rna(序列)编码区编码的氨基酸序列。在优选的实施方案中,所述方法包括就如本文所述从混合物中纯化至少一个rna种类的方法而言和/或就如本文所述从混合物中共纯化至少两个rna种类的方法而言,通过改变rna序列中a和/或u核苷酸的数目来调整原始rna序列的步骤。优选提供根据本发明的方法作为用于改变rna在色谱柱上的保留时间的方法,其中该色谱柱是hplc柱。在这种情况下,该方法优选用于在适合于rna的分析或制备性纯化的条件下改变rna的保留时间。适用于在分析或制备规模上,特别是通过rp-hplc纯化rna的色谱程序和实验条件是本领域已知的,并且描述于例如wo2008/077592中,其通过引用整体并入本文。在优选的实施方案中,该方法用于在反相hplc(rp-hplc)中改变rna在色谱柱上的保留时间。优选地,rp-hplc如wo2008/077592中所述。根据一个优选的实施方案,色谱柱包括反相作为固定相。在反相色谱中,优选将非极性化合物用作固定相,并将极性溶剂,例如乙腈和/或甲醇的水溶液用作流动相,用于洗脱。可用作固定相的柱可以以珠形式或整体柱形式提供,其优选为聚合的“块”,即填充色谱柱大部分的块。不管其精确的性质如何,聚合物固定相(特别是用于制备性纯化时)的性质优选是多孔的,这意味着珠或块的特征在于孔。在其他实施方案中,反相是无孔反相。在一个优选的实施方案中,特别是用于制备性纯化时,提供粒径为8.0μm至50μm,特别是8.0μm至30μm,还更优选8.0μm至25μm的多孔反相材料。反相材料可以小珠的形式存在。本发明的方法可以特别有利地用具有该粒径的多孔反相进行,任选地以珠形式进行,其中对于制备性纯化获得了特别好的分离结果。在优选的实施方案中,反相的孔径为至特别地孔径为至更优选为至至或至反相的特别优选的孔径是至更优选至最优选至或至在其他实施方案中,反相是具有不确定的孔径的多孔反相。至特别是至更优选至至或至的孔径可适合将rna与混合物的其他组分分离,该rna优选具有如本文关于长链rna所提及的大小,例如至多约15000个核苷酸(作为单链rna分子)或碱基对(作为双链rna分子),特别是100个至10000个,更优选500个至10000个核苷酸或碱基对,甚至更优选800个至5000个核苷酸或碱基对,甚至更优选800个至2000个核苷酸或碱基对。但是,也可以根据待分离的rna的大小来选择反相的孔径,即,如果要分离较大的rna分子,则可以选择较大的孔径,如果可以选择较小的rna分子,则可以选择较小的孔径。这是由于rna分子的保留和分离不仅取决于(反)相的相互作用,还取决于分子进入基质孔内的可能性,从而提供另外的保留影响。不限于此,例如因此可以使用约至约优选约至约最优选约至约的反相孔径来分离较大的rna分子,例如100个至10000个,更优选500个至10000个核苷酸或碱基对,甚至更优选800个至5000个核苷酸或碱基对,甚至更优选800个至2000个核苷酸或碱基对的rna分子。替代地,但不限于此,可以使用约至约更优选约至约最优选约至的反相孔径来分离较小的rna分子,例如约30个至1000个、50个至1000个或100个至1000个或20个至200个、20个至100个、20个至50个或20个至30个核苷酸的rna分子也可以这种方式分离。通常,在本发明的上下文中,已知用作反相固定相的任何材料,特别是任何聚合材料都可以用于色谱法。固定相可以由有机和/或无机材料构成。用于本发明的聚合物的实例是(非烷基化或烷基化的)聚苯乙烯、(非烷基化或烷基化的)聚苯乙烯二乙烯基苯、硅胶、经非极性残基改性的硅胶,特别是经含烷基残基,更优选用丁基、辛基和/或十八烷基的残基改性的硅胶、经苯基残基改性的硅胶、聚甲基丙烯酸酯等或其他合适的材料,例如用于凝胶色谱法或如上所述的其他色谱法的方法,例如葡聚糖,包括例如和材料、琼脂糖、葡聚糖/琼脂糖混合物、聚丙烯酰胺等。优选地,色谱柱包含选自以下的材料:聚苯乙烯、非烷基化的聚苯乙烯、烷基化的聚苯乙烯、聚苯乙烯二乙烯基苯、非烷基化的聚苯乙烯二乙烯基苯、烷基化的聚苯乙烯二乙烯基苯、硅胶、经非极性残基改性的硅胶、经含烷基残基(选自含丁基、辛基和/或十八烷基的残基)改性的硅胶、经苯基残基改性的硅胶或聚甲基丙烯酸酯。在一个特别优选的实施方案中,色谱柱包含选自以下的材料:聚苯乙烯聚合物、非烷基化的聚苯乙烯聚合物、烷基化的聚苯乙烯聚合物、非烷基化的聚苯乙烯二乙烯基苯聚合物、烷基化的聚苯乙烯二乙烯基苯、硅胶、经非极性残基改性的硅胶,特别是经含烷基残基改性的硅胶,更优选经含丁基、辛基和/或十八烷基残基改性的硅胶、经苯基残基改性的多孔硅胶、聚甲基丙烯酸酯。所有这些材料可以是多孔的,优选如本文所述,或者是无孔的。具有聚苯乙烯二乙烯基苯的固定相本身是已知的。可商购获得的已经用于hplc方法的本身已知的聚苯乙烯二乙烯基苯可用于本发明上下文中的色谱方法。在优选的实施方案中,非烷基化的多孔聚苯乙烯二乙烯基苯是特别优选的,但不限于此,其可以特别地具有8.0±1.5μm,特别是8.0±0.5μm的粒径和至尤其是至或至的孔径。在其他的实施方案中,烷基化的大孔整体式聚苯乙烯二乙烯基苯是特别优选的,但不限于此,其可具有约0.1um至10μm,特别是约1um至10μm,更特别是约1um至6μm的孔径分布。在其他实施方案中,使用多孔硅胶。多孔硅胶可以由摩尔比为4∶1的四乙氧基硅烷和双(三乙氧基甲硅烷基)乙烷制备,并且多孔硅胶经十八烷基碳链改性。这种多孔硅胶是可商购获得的,例如来自waters的xbridgetmostc18或来自waters的aquityuplcostc18。硅胶的粒径可以为0.5μm至5μm,优选为0.7μm至4μm,更优选为1μm至3μm,甚至更优选为1.5μm至2μm,最优选为1.7μm。多孔硅胶的孔径可以为至优选为至更优选为至甚至更优选为至最优选为在一个优选的实施方案中,在hplc中使用水性溶剂和有机溶剂的混合物作为洗脱rna的流动相。将缓冲剂用作水性溶剂是有利的,其ph特别为6.0至8.0,例如约7,例如7.0。优选地,缓冲剂是乙酸三乙铵,更优选0.02m至0.5m,特别是0.08m至0.12m,甚至更优选约0.1m的乙酸三乙铵缓冲剂。在一个优选的实施方案中,在流动相中使用的有机溶剂是乙腈、甲醇、乙醇、1-丙醇、2-丙醇和丙酮或其混合物,非常特别优选乙腈。在一个特别优选的实施方案中,流动相是0.1m的ph为7的乙酸三乙铵和乙腈的混合物。本文关于改变rna保留时间的方法所描述的任何单个步骤或特征中的任一个(或此类步骤或特征的组合)也可应用于如本文所述本发明其他方面中的任一个,特别是用于从至少两个rna种类的混合物中纯化至少一个rna种类的方法、用于从至少两个rna种类的混合物中共纯化至少两个rna种类的方法、用于协调至少两个rna种类的序列中a和/或u核苷酸的数目的方法、或用于提供本文所述的调整的rna的方法。从混合物中纯化至少一个rna种类的方法:在另一方面,本发明涉及从至少两个rna种类的混合物中纯化至少一个rna种类的方法。该方法优选特征在于本文就本发明其他方面所描述的任何方法步骤或任何特征(或其组合),特别是用于改变rna的保留时间的方法,或用于从包含至少两个rna种类的混合物中共纯化至少两个rna种类的方法所描述的任何方法步骤或任何特征(或其组合)。在优选的实施方案中,从至少两个rna种类的混合物中纯化至少一个rna种类的方法包括:a)通过相对于原始序列中a和/或u核苷酸的数目改变a和/或u核苷酸的数目来调整至少一个rna种类的序列的步骤;和b)色谱步骤,其中将调整的rna种类与至少一个其他rna种类分开。在本发明的上下文中,术语“纯化”应理解为是指样品中所需的rna(种类)与另一种化合物分开和/或分离,该另一种化合物还存在于通常为溶液的混合物中。这些其他化合物可以是例如待与所需的rna(种类)分离的杂质或其他rna种类。因此,在hplc纯化之后,rna以比在hplc纯化之前最初引入的含rna样品中更纯净的形式存在。因此需要分离的含rna样品的不期望成分尤其可能是衍生自体外转录反应的杂质,例如降解的rna片段或由于转录提前终止而产生的片段,或者也可能是过长质粒未完全线性化的转录体。另外,可以分离诸如酶的杂质例如rna酶和聚合酶、以及核苷酸。使用根据本发明的方法,纯化rna,其在纯化后具有比原料更高的纯度。在这方面,希望纯度尽可能接近100%。以这种方式可以达到大于70%,特别是80%,非常特别地90%,最有利地99%或高于99%的纯度。根据一个优选的实施方案,从至少两个rna种类的混合物中纯化至少一个rna种类的方法包括在步骤b)中的hplc方法,优选rp-hplc方法,如本文所述,并且更详细地,如wo2008/077592中所述。根据优选的实施方案,从至少两个rna种类的混合物中纯化至少一个rna种类的方法用作分析纯化方法,例如,在rna制造中的质量控制期间。优选地,该方法用于确定至少一个rna种类的同一性和/或完整性。例如,可以对混合物中的与另一个rna种类具有相同或基本相同的保留时间并因此与另一个rna种类在一个级分(峰)中洗脱的一种rna的序列进行调整,以使调整的rna种类具有不同的保留时间,从而导致各个rna种类洗脱到不同的级分(峰)中(另参见图1e)。根据一个优选的实施方案,从至少两个rna种类的混合物中纯化至少一个rna种类的方法还包括确定至少一个rna种类的同一性和/或完整性的步骤。术语“完整性”描述了在用于本文所述的分析纯化方法的样品中是否存在完整的rna分子。如果存在完整的rna分子,则至少两个rna种类的混合物中的至少一个rna种类的rna分子具有预期的长度。如果存在不完整的rna分子,则rna分子的长度与预期或已知的长度不同。rna分子长度的低完整性或差异可能是由于降解、切割、错误碱基配对、缺少加帽或不完全加帽、缺少聚腺苷酸化或不完全聚腺苷酸化、或不完全转录等。如本文所述,在分析纯化过程中rna的hplc峰变宽时,这将变得明显。在分析纯化过程中,通常对少量rna进行hplc。经受分析纯化过程的rna的典型量可以小于约5μg,例如约4μg或少于4μg、约3μg或少于3μg、约2μg或少于2μg、约1μg或少于1μg、约500ng或少于500ng、约400ng或少于400ng、约300ng或少于300ng、约200ng或少于200ng、约100ng或少于100ng、或约50ng或少于50ng。优选地,经受分析纯化过程的rna的量选自约1ng至约5μg、约10ng至约4μg、约10ng至约3μg、约10ng至约2μg、约10ng至约1μg、或约50ng至5μg。更优选地,经受分析纯化过程的rna的量为至少约10ng。从至少两个rna种类的混合物中纯化至少一个rna种类的方法也可以在制备规模上使用。特别地,可以使用根据本发明的方法以从混合物中纯化调整的rna序列,该混合物已经在至少一个其他纯化步骤(例如,通过hplc)中进行了纯化。在制备性纯化过程中,通常对大量rna进行hplc。经受制备性纯化过程的rna的典型量可以大于5μg,例如约10μg或大于10μg、约100μg或大于100μg、约1mg或大于1mg、约10mg或大于10mg、约100mg或大于100mg、约1g或大于1g、约10g或大于10g、约100g或大于100g、约1kg或大于1kg、约10kg或大于10kg。优选地,经受制备性纯化过程的rna的量选自约5μg至约10kg、约5μg至约1kg、约5μg至约500g、约5μg至约100g、约5μg至约50g、或约5g至约10g。优选地,所述方法的步骤a)包括改变来自至少两个rna种类的混合物的至少一个rna种类在本文所述的色谱柱上的保留时间的步骤。在某些实施方案中,至少一个待纯化的rna种类(在其未修饰/未调整状态下,对应于原始rna(序列))的保留时间与要与之分离的rna种类的保留时间基本相同,或保留时间非常接近,以致于色谱柱中的rna种类在同一级分(峰)或重叠级分(峰)中洗脱出来,从而不能物理分离rna种类,并且,不能确定至少一个rna种类的完整性。在优选的实施方案中,如本文所述改变待纯化的至少一个rna种类的序列中a和/或u核苷酸的数目,使得通过色谱法,优选通过hplc,更优选通过rp-hplc物理分离至少一个rna种类与混合物中的其他组分是可行的。优选地改变至少一个rna种类的保留时间,以使rna种类在单独级分(峰)中洗脱,该级分不包含要与至少一个rna种类要分离的至少一种其他化合物(例如另一个rna种类或诸如不成功的序列等的杂质)。至少一个调整的rna种类的改变的保留时间不同于混合物中至少一个其他rna种类的保留时间,从而可以优选将其从混合物中物理分离,更优选通过hplc物理分离。根据一个特别优选的实施方案,所述方法的步骤a)包括调整待纯化的至少一个rna种类的序列,以使所述至少一个rna种类的调整的序列中a和/或u核苷酸的数目与存在于混合物中并且待与调整的rna种类分离的至少一个其他rna种类的序列中a和/或u核苷酸的数目相差至少1个,优选至少2个,更优选至少3个,甚至更优选至少4个,甚至更优选至少5个,甚至更优选至少10个,最优选至少15个。或者,至少一个rna种类的调整的序列中a和/或u核苷酸的数目与混合物中另一个rna种类的序列中a和/或u核苷酸的数目可以相差至少5个,优选至少10个,更优选至少20个,甚至更优选至少30个,甚至更优选至少40个,甚至更优选至少50个,最优选至少60个。在优选的实施方案中,例如分析纯化过程中,所述方法的步骤a)包括调整待纯化的至少一个rna种类的序列,以使至少一个rna种类的调整的序列中a和/或u核苷酸的数目与混合物中另一个rna种类的序列中a和/或u核苷酸的数目可以相差至少10个,优选至少20个,更优选至少30个,甚至更优选至少40个,甚至更优选至少50个,甚至更优选至少60个,最优选至少70个。在优选的实施方案中,例如一种制备纯化过程中,所述方法的步骤a)包括调整待纯化的至少一个rna种类的序列,以使至少一个rna种类的调整的序列中a和/或u核苷酸的数目与混合物中另一个rna种类的序列中a和/或u核苷酸的数目可以相差至少80个,优选至少100个,更优选至少120个,甚至更优选至少140个,甚至更优选至少180个,甚至更优选至少200个,最优选至少220个。根据优选实施方案,例如在分析纯化过程中,调整待纯化的至少一个rna种类的序列,以使调整的rna中a和/或u核苷酸的数目与混合物中待与之分离的至少一个其他rna种类的序列中的相应数目不同,相差的数目等于或大于待纯化的至少一种rna序列中核苷酸的总数乘以至少0.05、至少0.06、至少0.07、至少0.08、至少0.09、至少0.1或至少0.15的系数。在一个优选的实施方案中,调整的rna中a和/或u核苷酸的数目与混合物中的待与之分离的至少一个其他rna种类的序列中的相应数目不同,相差的数目等于或大于待纯化的至少一种rna的序列中核苷酸的总数乘以0.065的系数。在这些实施方案中,待纯化的至少一个rna种类优选与待与之分离的rna种类具有相同的长度(即,包含相同的核苷酸总量)。更优选地,rna种类的长度相差不超过约20%、不超过约10%、不超过约5%、不超过约4%、不超过约3%、不超过约2%、或不超过约1%。根据优选实施方案,例如在分析纯化过程中,调整待纯化的至少一个rna种类的序列,以使调整的rna中a和/或u核苷酸的数目与混合物中的待与之分离的至少一个其他rna种类的序列中的相应数目不同,相差的数目等于或大于待纯化的至少一种rna序列中核苷酸的总数乘以至少0.01、至少0.02、至少0.03、至少0.04、或至少0.05的系数。在这些实施方案中,待纯化的至少一个rna种类优选与待与之分离的rna种类具有相同的长度(即,包含相同的核苷酸总量)。更优选地,rna种类的长度相差不超过约20%、不超过约10%、不超过约5%、不超过约4%、不超过约3%、不超过约2%、或不超过约1%。根据优选实施方案,例如在制备纯化中,调整待纯化的至少一个rna种类的序列,以使调整的rna中a和/或u核苷酸的数目与混合物中的待与之分离的至少一个其他rna种类的序列中的相应数目不同,相差的数目等于或大于待纯化的至少一种rna序列中核苷酸的总数乘以至少0.20、至少0.22、至少0.24、至少0.26、至少0.28、至少0.30或至少0.35的系数。在这些实施方案中,待纯化的至少一个rna种类优选与待与之分离的rna种类具有相同的长度(即,包含相同的核苷酸总量)。更优选地,rna种类的长度相差不超过约20%、不超过约10%、不超过约5%、不超过约4%、不超过约3%、不超过约2%、或不超过约1%。从混合物中共纯化至少两个rna种类的方法:根据另一方面,本发明提供了从包含至少两个rna种类的混合物中共纯化至少两个rna种类的方法,其中该方法包括:a)通过相对于原始rna序列中a和/或u核苷酸的数目改变rna中a和/或u核苷酸的数目来调整至少一个rna种类的序列的步骤;和b)色谱步骤,其中将具有调整的序列的至少一个rna种类和至少一个其他rna种类共纯化。该方法优选包括本文关于本发明其他方面所述的任何方法步骤或任何特征(或其组合),特别是关于改变rna的保留时间的方法,或关于从具有至少两个rna种类的混合物中纯化至少一个rna种类的方法所述的任何方法步骤或任何特征(或其组合)。所述方法优选地用于从包含至少两个rna种类的混合物中共纯化至少两个rna种类,其中至少两个rna种类(处于其未修饰/未调整状态)的特征在于保留时间不同,其结果是至少两个rna种类在单独级分(峰)中洗脱,从而无法进行共纯化。在从包含至少两个rna种类的混合物中共纯化至少两个rna种类的方法中,优选改变原始rna序列中a和/或u核苷酸的数目,以使得rna的保留时间基本等于或至少足够接近于与调整的rna一起存在于混合物中的另一种化合物(例如另一个rna种类)的保留时间,从而使调整的rna和另一种化合物(例如另一个rna种类)通过色谱法,优选通过hplc,更优选通过如本文所述的rp-hplc共纯化。调整的rna和另一种化合物(例如另一个rna种类)优选一起在一个级分中从色谱柱中洗脱出来(或在色谱图中分别以一个单峰出现)。为了获得具有与另一个rna种类基本上相同的保留时间的调整的rna,对rna(序列)中a和/或u核苷酸的数目的调整在本文中也可以称为“(峰)协调”或“保留时间的协调”。更优选地,原始rna序列中a和/或u核苷酸的数目优选被改变,以使得rna(种类)的保留时间与还与调整的rna一起存在于混合物中的另一种化合物(例如另一个rna种类)的保留时间相差不超过约20%、优选不超过约10%、不超过约5%、不超过约4%、不超过约3%、不超过约2%、不超过约1%、不超过0.5%或不超过0.1%。在另一方面,本发明因此还提供一种用于协调至少两个rna种类的序列中a和/或u核苷酸的数目的方法,该方法包括通过相对于原始rna序列中a和/或u核苷酸的数目改变rna序列中a和/或u核苷酸的数目来调整至少一个rna种类的序列。所述方法优选地适用本文关于共纯化至少两个rna种类的方法所述的任何一个步骤或任何一个特征(或其组合)。因此,本文所用的协调的rna种类的保留时间优选相差不超过约20%、更优选相差不超过约10%、相差不超过约5%、相差不超过约4%、相差不超过约3%、相差不超过约2%、相差不超过约1%、相差不超过0.5%或相差不超过0.1%。甚至更优选地,协调的rna种类的特征在于基本相同的保留时间。在另一方面,本发明提供了一种用于合成混合物的方法,该混合物包含至少两个协调的rna种类,优选地如本文所述的rna种类,该方法包括a)包括协调至少两个rna种类的序列中a和/或u核苷酸的数目的步骤,其中通过相对于原始rna序列中a和/或u核苷酸数目改变rna中a和/或u核苷酸的数目来调整至少一个rna种类的序列;和b)合成至少两个协调的rna种类的步骤。该方法的步骤a)优选包括通过相对于原始rna序列中a和/或u核苷酸的数目改变rna序列中a和/或u核苷酸的数目来调整至少一个rna序列的rna序列。在这方面以及关于步骤b),参考本发明关于改变rna在色谱柱上的保留时间的方法、从至少两个rna种类的混合物中纯化至少一个rna种类的本发明方法、或从包含至少两个rna种类的混合物中共纯化至少两个rna种类的本发明方法的描述。本文关于一种或多于一种所述方法描述的任何特征优选也适用于本发明的用于合成包含至少两个协调的rna种类的混合物的方法。在一些实施方案中,用于合成包含至少两个协调的rna种类的混合物的方法的步骤a)可以包括:i)任选地,确定原始rna序列中核苷酸的总数;ii)确定原始rna序列中a和/或u核苷酸的数目;iii)在不改变编码的氨基酸序列的情况下,确定可被至少一个替代密码子替换的原始rna序列中的密码子;iv)通过用替代密码子替换至少一个原始密码子,将rna序列中a和/或u核苷酸的数目调节至预设的a和/或u核苷酸的数目,其中替代密码子编码与原始密码子相同的氨基酸,并且替代密码子的特征还在于较高的a和/或u核苷酸含量。用于合成包含至少两个协调的rna种类的混合物的方法的步骤b)优选包括单独合成至少两个协调的rna种类。为了获得协调的rna种类的混合物,优选将至少两个协调的rna种类混合在一起。或者,步骤b)包括在一批中合成至少两个协调的rna种类。可以通过本领域中已知的任何方法,例如通过化学合成来合成至少两个协调的rna种类。优选地,通过rna体外转录合成协调的rna种类。在本文中使用的术语“混合物”优选是指固体、半固体或液体混合物。优选地,包含至少两个协调的rna种类的混合物可以是液体,更优选地是水溶液。其他合适的溶剂、缓冲剂和赋形剂是本领域已知的,并且在本文中也将进一步描述,特别是在关于本发明的组合物中进一步描述。在优选的实施方案中,通过本发明的用于合成包含至少两个协调的rna种类的混合物的方法获得的包含至少两个协调的rna种类的混合物是组合物,其优选特征在于如本文关于组合物(包含至少两个rna种类)所述的任何一种特征。根据一个优选的实施方案,用于共纯化至少两个rna种类的方法(或用于协调至少两个rna种类的序列中的a和/或u核苷酸的数目的方法、或用于合成包含至少两个协调的rna种类的混合物的方法)包括确定a和/或u核苷酸的目标数目的步骤,其中将待共纯化(待协调)的至少两个rna种类中a和/或u核苷酸数目调整为该目标数目。例如,如果混合物包含多个rna种类,所述多个rna种类的特征在于保留时间基本上相同,并且要从剩余的rna种类中分离出两个或多于两个rna种类(即,共纯化),则优选如本文所述,确定a和/或u核苷酸的目标数目,从而使得待共纯化(或协调)的rna种类具有基本上相同的保留时间,因此在相同级分(峰)内从色谱柱洗脱,从而能够将这些rna种类与混合物中不需要的rna种类(共)分离。为了在同一级分(峰)中从色谱柱,例如(反相)hplc柱洗脱两个(或多于两个)rna种类,从而允许对两个(或多于两个)rna种类进行共纯化,优选在分析规模上进行共纯化,两个(或多于两个)rna种类中a和/或u核苷酸的数目彼此优选相差不超过1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、30个或35个。在优选的实施方案中,rna种类中a和/或u核苷酸的数目彼此优选相差不超过2个,更优选不超过3个,甚至更优选不超过4个,甚至更优选不超过5个,最优选不超过6个。在另一个优选的实施方案中,rna种类中a和/或u核苷酸的数目彼此相差不超过10,优选不超过15,更优选不超过20个,甚至更优选不超过25个,最优选不超过30个。特别优选的是,两个或多于两个rna种类中a和/或u核苷酸的数目相同。对于制备规模的纯化,为了在同一级分(峰)中从色谱柱(例如(反相)hplc柱)洗脱两个(或多于两个)rna种类,从而允许对两个(或多于两个)rna种类进行共纯化,两个(或多于两个)rna种类中a和/或u核苷酸的数目彼此优选相差不超过1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、30个、35个、40个、45个、50个、55个、60个、65个、70个、75个、80个、85个、90个、95个、100个、110个、120个、130个、140个、150个。在优选的实施方案中,rna种类中a和/或u核苷酸的数目彼此优选相差不超过2个,更优选不超过3个,甚至更优选不超过4个,甚至更优选不超过5个,最优选不超过6个。在另一个优选的实施方案中,rna种类中a和/或u核苷酸的数目彼此相差不超过10个,优选不超过20个,更优选不超过30个,甚至更优选不超过40个,最优选不超过50个。特别优选的是,两个或多于两个rna种类中a和/或u核苷酸的数目相同。根据一个优选的实施方案,待共纯化并且优选具有相同长度的rna种类中a和/或u核苷酸的数目不同,相差的数目等于或小于rna中核苷酸的总数乘以等于或小于0.008、等于或小于0.0075、等于或小于0.007、等于或小于0.0065、等于或小于0.006、等于或小于0.0055、等于或小于0.005、等于或小于0.0045、等于或小于0.004、等于或小于0.0035或等于或小于0.003的系数。更优选地,待共纯化并且优选地具有相同长度的rna种类中a和/或u核苷酸的数目不同,相差的数目等于或小于rna中核苷酸的总数乘以等于或小于0.0065,优选等于或小于0.0063的系数。根据优选的实施方案,待共纯化并且优选具有相同长度的rna种类中a和/或u核苷酸的数目不同,相差的数目等于或小于rna中核苷酸的总数乘以等于或小于0.030、等于或小于0.025、等于或小于0.020、等于或小于0.015、等于或小于0.014、等于或小于0.013、等于或小于0.012、等于或小于0.011、等于或小于0.010、等于或小于0.009或等于或小于0.008的系数。修饰的rna:根据本发明的优选实施方案,本文所述的rna(种类)可以是修饰的rna的形式,其中可以将本文定义的任何修饰引入rna中。如本文定义的修饰优选产生如本文所述的人工rna,其被进一步稳定化。根据一个实施方案,因此,rna可以作为“稳定化的rna”,优选作为“稳定化的mrna”提供,也就是说,作为基本上抗体内降解(例如通过外切或内切核酸酶的降解)的rna提供。这种稳定化作用可以例如通过人工rna的修饰的磷酸骨架来实现。与本发明有关的骨架修饰是其中rna中所含核苷酸的骨架的磷酸被化学修饰的修饰。可以优选地用于此连接的核苷酸包含例如硫代磷酸酯修饰的磷酸骨架,优选磷酸骨架中包含的磷酸酯氧中的至少一个被硫原子替代。稳定化的rna还可以包括例如非离子磷酸酯类似物,例如烷基和芳基膦酸酯,其中带电荷的膦酸酯氧被烷基或芳基替代,或磷酸二酯和烷基磷酸三酯,其中带电荷的氧残基以烷基化形式存在。这样的骨架修饰通常包括但不限于选自甲基膦酸酯、氨基磷酸酯和硫代磷酸酯(例如胞苷-5′-o-(1-硫代磷酸酯))的修饰。在下文中,描述了具体的修饰,如本文所述,每个修饰优选能够“稳定化”rna,优选mrna。化学修饰:本文所用的术语“核酸修饰”或“rna修饰”可以指包括骨架修饰以及糖修饰或碱基修饰的化学修饰。在这种情况下,本文定义的修饰的rna可以包含核苷酸类似物/修饰,例如,骨架修饰、糖修饰或碱基修饰。与本发明有关的骨架修饰是其中如本文所述的rna中所含核苷酸的骨架的磷酸被化学修饰的修饰。与本发明有关的糖修饰是如本文所述的rna的核苷酸的糖的化学修饰。此外,与本发明有关的碱基修饰是人工rna的核苷酸的碱基部分的化学修饰。在本文中,核苷酸类似物或修饰优选选自核苷酸类似物,其适用于转录和/或翻译。糖修饰:可以掺入如本文所述的修饰的rna中的修饰的核苷和核苷酸可以在糖部分中被修饰。例如,2′羟基(oh)可以被修饰或被许多不同的“氧”或“脱氧”取代基取代。“氧基”-2′羟基修饰的实例包括但不限于烷氧基或芳氧基(-or,例如,r=h、烷基、环烷基、芳基、芳烷基、杂芳基或糖);聚乙二醇(peg)、-o(ch2ch2o)nch2ch2or;“锁”核酸(lna),其中的2′羟基例如通过亚甲基桥连接到同一核糖的4′碳上;和氨基(-o-氨基,其中氨基,例如nrr,可以是烷基氨基、二烷基氨基、杂环基、芳基氨基、二芳基氨基、杂芳基氨基或二杂芳基氨基、乙二胺、聚氨基)或氨基烷氧基。“脱氧”修饰包括氢、氨基(例如nh2;烷基氨基、二烷基氨基、杂环基、芳基氨基、二芳基氨基、杂芳基氨基、二杂芳基氨基或氨基酸);或氨基可通过接头连接至糖,其中该接头包含原子c、n和o中的一个或多于一个。糖基团也可以包含一个或多于一个碳,其碳原子构型与核糖中相应碳的构型相反。因此,rna可以包括含有例如阿拉伯糖作为糖的核苷酸。骨架修饰:磷酸骨架还可以在修饰的核苷和核苷酸中被修饰,其可以掺入到如本文所述的修饰的rna中。可以通过用不同的取代基取代一个或多于一个氧原子来修饰骨架的磷酸基团。此外,修饰的核苷和核苷酸可包括用本文所述的修饰的磷酸完全取代未修饰的磷酸部分。修饰的磷酸基团的实例包括但不限于硫代磷酸盐/酯、硒代磷酸盐/酯(phosphoroselenate)、硼烷磷酸盐、硼烷磷酸酯、氢膦酸盐/酯、氨基磷酸盐/酯、烷基或芳基膦酸盐/酯和磷酸三酯。二硫代磷酸盐/酯的两个非连接氧都被硫取代。磷酸盐/酯接头也可以通过用氮(桥连的氨基磷酸盐/酯)、硫(桥连的硫代磷酸盐/酯)和碳(桥连的亚甲基膦酸盐/酯)代替连接的氧来修饰。碱基修饰:可以掺入修饰的核酸,优选本文所述的mrna中的修饰的核苷和核苷酸可以在核碱基部分中进一步被修饰。在诸如rna的核酸中发现的核碱基的实例包括但不限于腺嘌呤、鸟嘌呤、胞嘧啶和尿嘧啶。例如,本文所述的核苷和核苷酸可以在大沟表面上被化学修饰。在一些实施方案中,大沟的化学修饰可包括氨基、硫醇基、烷基或卤素基团。在本发明特别优选的实施方案中,核苷酸类似物/修饰选自碱基修饰,其优选选自2-氨基-6-氯嘌呤核苷-5′-三磷酸、2-氨基嘌呤核苷-5′-三磷酸;2-氨基腺苷-5′-三磷酸、2′-氨基-2′-脱氧胞苷-三磷酸、2-硫代胞苷-5′-三磷酸、2-硫代尿苷-5′-三磷酸、2′-氟代胸苷-5′-三磷酸,2′-o-甲基肌苷-5′-三磷酸4-硫代尿苷-5′-三磷酸、5-氨基烯丙基胞苷-5′-三磷酸、5-氨基烯基尿苷-5′-三磷酸、5-溴胞嘧啶-5′-三磷酸、5-溴尿苷-5′-三磷酸、5-溴-2′-脱氧胞苷-5′-三磷酸、5-溴-2′-脱氧尿苷-5′-三磷酸、5-碘胞苷-5′-三磷酸、5-碘-2′-脱氧胞苷-5′-三磷酸、5-碘尿苷-5′-三磷酸、5-碘-2′-脱氧尿苷-5′-三磷酸、5-甲基胞嘧啶-5′-三磷酸、5-甲基尿苷-5′-三磷酸、5-丙炔基-2′-脱氧胞苷-5′-三磷酸、5-丙炔基-2′-脱氧尿苷-5′-三磷酸、6-氮杂胞苷-5′-三磷酸、6-氮杂尿苷-5′-三磷酸、6-氯嘌呤核糖核苷-5′-三磷酸、7-脱氮腺苷-5′-三磷酸、7-脱氮鸟苷-5′-三磷酸、8-氮杂腺苷-5′-三磷酸、8-叠氮腺苷-5′-三磷酸、苯并咪唑-核苷-5′-三磷酸、n1-甲基腺苷-5′-三磷酸、n1-甲基鸟苷-5′-三磷酸、n6-甲基腺苷-5′-三磷酸、o6-甲基鸟苷-5′-三磷酸、假尿苷-5′-三磷酸或嘌呤霉素-5′-三磷酸、黄苷-5′-三磷酸。特别优选的核苷酸的碱基修饰选择的碱基修饰的核苷酸包括5-甲基胞嘧啶-5′-三磷酸、7-脱氮鸟苷-5′-三磷酸、5-溴胞苷-5′-三磷酸和假尿苷-5′-三磷酸。在一些实施方案中,修饰的核苷包括吡啶-4-酮核糖核苷、5-氮杂-尿苷、2-硫代-5-氮杂-尿苷、2-硫代尿苷、4-硫代-假尿苷、2-硫代-假尿苷,5-羟基尿苷、3-甲基尿苷、5-羧甲基-尿苷、1-羧甲基-假尿苷、5-丙炔基-尿苷,1-丙炔基-假尿苷、5-牛磺酸甲基尿苷、1-牛磺酸甲基-假尿苷、5-牛磺酸甲基-2-硫代尿苷、1-牛磺酸甲基-4-硫代-尿苷、5-甲基-尿苷、1-甲基-假尿苷、4-硫代-1-甲基-假尿苷、2-硫代-1-甲基-假尿苷、1-甲基-1-脱氮-假尿苷、2-硫代-1-甲基-1-脱氮-假尿苷、二氢尿苷、二氢假尿苷、2-硫代二氢尿苷、2-硫代二氢假尿苷、2-甲氧基尿苷、2-甲氧基-4-硫代-尿苷、4-甲氧基-假尿苷和4-甲氧基-2-硫代假尿苷。在一些实施方案中,修饰的核苷包括5-氮杂-胞苷、假异胞苷、3-甲基胞苷、n4-乙酰胞苷、5-甲酰基胞苷、n4-甲基胞苷、5-羟甲基胞苷、1-甲基-假异胞苷、吡咯并胞苷、吡咯并假异胞苷、2-硫代-胞苷、2-硫代-5-甲基-胞苷、4-硫代-假异胞苷、4-硫代-1-甲基-假异胞苷、4-硫代-1-甲基-1-脱氮-假异胞苷、1-甲基-1-脱氮-假异胞苷、泽布拉林、5-氮杂-泽布拉林、5-甲基-泽布拉林、5-氮杂-2-硫代-泽布拉林、2-硫代-泽布拉林、2-甲氧基-胞苷、2-甲氧基-5-甲基-胞苷、4-甲氧基-假异胞苷和4-甲氧基-1-甲基-假异胞苷。在其他实施方案中,修饰的核苷包括2-氨基嘌呤、2,6-二氨基嘌呤、7-脱氮-腺嘌呤、7-脱氮-8-氮杂-腺嘌呤、7-脱氮-2-氨基嘌呤、7-脱氮-8-氮杂-2-氨基嘌呤、7-脱氮-2,6-二氨基嘌呤、7-脱氮-8-氮杂-2,6-二氨基嘌呤、1-甲基腺苷、n6-甲基腺苷、n6-异戊烯基腺苷、n6-(顺式-羟基异戊烯基)腺苷、2-甲硫基-n6-(顺式-羟基异戊烯基)腺苷、n6-甘氨酰基氨基甲酰基腺苷、n6-苏氨酰基氨基甲酰基腺苷、2-甲硫基-n6-苏氨酰基氨基甲酰基腺苷、n6,n6-二甲基腺苷、7-甲基腺嘌呤、2-甲硫基腺嘌呤和2-甲氧基腺嘌呤。在其他实施方案中,修饰的核苷包括肌苷、1-甲基肌苷、怀俄苷、怀丁苷、7-脱氮-鸟苷、7-脱氮-8-氮杂-鸟苷、6-硫代-鸟苷、6-硫代-7-脱氮-鸟苷、6-硫代-7-脱氮-8-氮杂-鸟苷、7-甲基-鸟苷、6-硫代-7-甲基-鸟苷、7-甲基肌苷、6-甲氧基-鸟苷、1-甲基鸟苷、n2-甲基鸟苷、n2,n2-二甲基鸟苷、8-氧代-鸟苷、7-甲基-8-氧代-鸟苷、1-甲基-6-硫代鸟苷、n2-甲基-6-硫代-鸟苷和n2,n2-二甲基-6-硫代鸟苷。在一些实施方案中,核苷酸可以在大沟表面上被修饰并且可以包括用甲基或卤素基团取代尿嘧啶c-5上的氢。在特定的实施方案中,修饰的核苷是5′-o-(1-硫代磷酸)-腺苷、5′-o-(1-硫代磷酸)-胞苷、5′-o-(1-硫代磷酸)-鸟苷、5′-o-(1-硫代磷酸)-尿苷或5′-o-(1-硫代磷酸)-假尿苷。在其他具体实施方案中,修饰的rna可以包含选自以下的核苷修饰:6-氮杂-胞苷、2-硫代-胞苷、α-硫代-胞苷、假异胞苷、5-氨基烯丙基-尿苷、5-碘代-尿苷、n1-甲基-假尿苷、5,6-二氢尿苷、α-硫代-尿苷、4-硫代-尿苷、6-氮杂-尿苷、5-羟基尿苷、脱氧-胸苷、5-甲基-尿苷、吡咯并胞苷、肌苷、α-硫代-鸟苷、6-甲基-鸟苷、5-甲基胞嘧啶、8-氧代鸟苷、7-脱氮-鸟苷、n1-甲基-腺苷、2-氨基-6-氯-嘌呤、n6-甲基-2-氨基-嘌呤、假异胞苷、6-氯嘌呤、n6-甲基-腺苷、α-硫代-腺苷、8-叠氮-腺苷、7-脱氮-腺苷。在一些实施方案中,本文所用的rna包含本文所定义的至少一个编码区,其中所述编码区包含至少一个修饰的尿苷核苷,优选选自n(1)-甲基假尿苷(m1ψ)、假尿苷(ψ)、5-甲氧基尿苷。替代地或另外地,本文所用的rna包含本文所定义的至少一个编码区,其中所述编码区包含至少一个修饰的胞苷,优选5-甲基胞嘧啶。脂质修饰:根据另外的实施方案,本文定义的修饰的rna可以包含脂质修饰。本文所定义的此类脂质修饰的rna通常还包含与该rna共价连接的至少一个接头,以及与相应的接头共价连接的至少一个脂质。替代地,脂质修饰的rna包含至少一种本文定义的rna和与该rna共价连接(无接头)的至少一种(双功能)脂质。根据第三替代方案,脂质修饰的rna包含本文所定义的rna分子、与该rna共价连接的至少一个接头、和与相应接头共价连接的至少一个脂质、以及与该rna共价连接(无接头)的至少一种(双功能)脂质。在这种情况下,特别优选脂质修饰存在于线性rna的末端。原始rna的优化的编码序列:术语“优化的编码序列”涉及与相应的野生型编码序列相比至少一个密码子(编码一个氨基酸的核苷酸三联体)不同的编码序列。优选地,在本发明的上下文中,密码子“优化的编码序列”可以显示出改进的对体内降解的抗性和/或改进的体内稳定性、和/或改进的体内可翻译性。广义上的密码子优化利用遗传密码的简并性,其中多个密码子可以编码相同的氨基酸,并且可以互换使用以优化/修饰体内应用(例如疫苗接种)的编码序列。在特别优选的实施方案中,至少一种rna或至少一个rna种类是包含编码区的mrna,其中原始rna序列的编码区包含优化的编码序列,其中优化的编码序列选自c最大化的编码序列、g/c增加的编码序列、g/c优化的编码序列、人密码子使用优化的编码序列、cai最大化的编码序列或其任意组合。根据某些实施方案,可以优化rna,特别是原始rna的编码序列,其中与相应的野生型编码序列的c含量相比,至少一个编码序列的c含量可以增加,优选最大化(在此称为“c最大化的编码序列”)。与由相应的野生型核酸编码序列编码的氨基酸序列相比,由核酸序列的c最大化的编码序列编码的氨基酸序列优选未改变。如上所述的胞嘧啶优化的rna的产生可以使用根据wo2015/062738的c最大化方法适当地进行。在此上下文中,wo2015/062738的公开内容通过引用包括在本文中。根据一些实施方案,可以优化rna,特别是原始rna的编码序列,其中与相应的野生型编码序列的g/c含量相比,编码序列的g/c含量可以增加(本文中称为作为“g/c增加的编码序列”)。术语“g/c增加的编码序列”涉及rna,优选本发明的原始rna的编码序列,其与相应的野生型核酸序列相比,包含增加数量的鸟苷和/或胞嘧啶核苷酸。这种数目的增加可以通过用含有鸟苷或胞嘧啶核苷酸的密码子替代含有腺苷或胸苷核苷酸的密码子来产生。如果富集的g/c含量出现在dna或rna的编码序列中,则会利用遗传密码的简并性。特别地,在rna的情况下,具有增加的g(鸟苷)/c(胞嘧啶)含量的序列比具有增加的a(腺苷)/u(尿嘧啶)含量的序列更稳定。与由相应的野生型核酸编码序列编码的氨基酸序列相比,由核酸序列的g/c含量修饰的编码序列编码的氨基酸序列优选未改变。优选地,与相应的野生型核酸编码序列的编码序列的g/c含量相比,本发明的原始rna编码序列的g/c含量增加至少10%,优选至少20%,更优选至少30%,最优选至少40%。根据优选的实施方案,可以优化rna,特别是原始rna的编码序列,其中与相应的野生型编码序列的g/c含量相比,编码序列的g/c含量可被优化(本文中称为“g/c优化的编码序列”)。在上下文中,“优化”是指其中g/c含量优选增加至基本上最大可能的g/c含量的编码序列。与由相应的野生型核酸编码序列编码的氨基酸序列相比,由核酸序列的g/c含量优化的编码序列编码的氨基酸序列优选未改变。如上所述的g/c优化的rna序列的产生可以使用wo2002/098443中解释的g/c优化方法适当地进行。在这种情况下,wo2002/098443的公开内容完全包含在本发明中。在特别优选的实施方案中,至少一种rna或至少一个rna种类是包含编码区的mrna,其中原始rna序列的至少一个编码区包含g/c优化的核酸序列。根据优选的实施方案,可以优化rna,特别是原始rna的编码序列,其中可以针对人密码子使用来优化密码子编码序列(在本文中称为“人密码子使用优化的编码序列”)。编码相同氨基酸的密码子在对象,例如人中出现的频率不同。因此,优选地优化本文定义的rna的编码序列,以使得编码相同氨基酸的密码子的频率对应于该密码子根据人类密码子使用所天然存在的频率。例如,在氨基酸丙氨酸(ala)的情况下,野生型编码序列优选地的调整方式为以0.40的频率使用密码子“gcc”、以频率0.28的频率使用密码子“gct”、以0.22的频率使用密码子“gca”、以0.10的频率使用密码子“gcg”,等。因此,这种程序(如ala所示)适用于由rna的编码序列,优选原始rna的编码序列编码的每个氨基酸。根据优选的实施方案,可以优化rna,特别是原始rna的编码序列,其中可以增加或优选最大化密码子适应指数(cai)(本文称为“cai最大化的编码序列”)。因此,优选将在细胞(例如人)中相对罕见的所有野生型序列密码子替换为在细胞中频繁出现的相应密码子,其中该频繁出现的密码子编码与相对罕见的密码子相同的氨基酸。适当地,最频繁的密码子用于每个编码的氨基酸。适当地,本发明的rna,优选本发明的原始rna包含至少一个编码序列,其中至少一个编码序列的密码子适应指数(cai)为至少0.5、至少0.8、至少0.9或至少0.95。最优选地,至少一个编码序列的密码子适应指数(cai)为1。例如,在由根据本发明的核酸序列的至少一个编码序列编码的氨基酸序列中存在氨基酸丙氨酸(ala)的情况下,对野生型编码序列进行调整,以使得所述氨基酸总是使用最常见的人类密码子“gcc”。因此,这种程序(如ala所示)适用于由rna的编码序列,优选原始rna的编码序列编码的每个氨基酸,以获得cai最大化的编码序列。5’-帽结构根据本发明的另一个优选实施方案,可以通过添加5′-帽结构来修饰本文所用的rna,所述5′-帽结构优选地使本文所述的rna稳定化。如本文中所使用的术语“5′-帽结构”将被本领域普通技术人员所认识和理解,并且例如旨在指添加到rna分子,例如mrna分子的5′末端的修饰的核苷酸(帽类似物),特别是鸟嘌呤核苷酸。优选地,使用5′-5′-三磷酸键(也称为m7gpppn)添加5′-帽。5′-帽结构的其他实例包括甘油基、反向脱氧无碱基残基(部分)、4′,5′亚甲基核苷酸、1-(β-d-赤呋喃糖基)核苷酸、4′-硫代核苷酸、碳环核苷酸、1,5-脱水己糖醇核苷酸、l-核苷酸、α-核苷酸、修饰的碱基核苷酸、苏式-五呋喃糖基核苷酸、无环3′,4′-断核苷酸、无环3,4-二羟基丁基核苷酸、无环3,5-二羟基戊基核苷酸、3′-3′-反向核苷酸部分、3′-3′-反向无碱基部分、3′-2′-反向核苷酸部分、3′-2′-反向碱基部分、磷酸1,4-丁二醇、3′-氨基磷酸酯、磷酸己酯、磷酸氨基己基酯、3′-磷酸酯、3′硫代磷酸酯、二硫代磷酸酯或桥联或非桥连的甲基膦酸酯部分。可以在本发明中使用的其他修饰的5′-帽结构是cap1(m7gpppn的相邻核苷酸的核糖的额外甲基化)、cap2(m7gpppn下游的第二核苷酸的核糖的额外甲基化)、cap3(m7gpppn下游的第3核苷酸的核糖的额外甲基化)、cap4(m7gpppn下游的第4核苷酸的核糖的额外甲基化)、arca(抗反向帽类似物)、修饰的arca(例如,硫代磷酸酯修饰的arca)、肌苷、n1-甲基-鸟苷、2′-氟代-鸟苷、7-脱氮-鸟苷、8-氧代-鸟苷、2-氨基-鸟苷、lna-鸟苷和2-叠氮基-鸟苷。也可以使用帽类似物在化学rna合成或rna体外转录(共转录加帽)中形成5′帽(cap0或cap1)结构。如本文中所使用的术语“帽类似物”将被本领域普通技术人员所认识和理解,并且例如意在指具有帽功能的不可聚合的二核苷酸,当掺入到核酸分子的5′端时,它有助于翻译或定位和/或防止核酸分子特别是rna分子的降解。不可聚合是指帽类似物仅在5′末端掺入,因为它没有5′三磷酸,因此不能通过模板依赖性聚合酶,特别是模板依赖性rna聚合酶沿3′方向延伸。帽类似物的实例包括但不限于选自以下的化学结构:m7gpppg、m7gpppa、m7gpppc;未甲基化的帽类似物(例如gpppg);二甲基化帽类似物(例如m2,7gpppg)、三甲基化帽类似物(例如m2,2,7gpppg)、二甲基化对称帽类似物(例如m7gpppm7g)或抗反向帽类似物(例如arca;m7,2′omegpppg、m7,2′dgpppg、m7,3′omegpppg、m7,3′dgpppg及其四磷酸衍生物)。先前已经描述了另外的帽类似物(wo2008/016473、wo2008/157688、wo2009/149253、wo2011/015347和wo2013/059475)。在该上下文中,其他合适的帽类似物描述于wo2017/066793、wo2017/066781、wo2017/066791、wo2017/066789、wo2017/066782、wo2017/066797,其中涉及帽类似物的公开内容通过引用并入本文。在一个优选的实施方案中,在本文所述的rna体外转录反应中,优选使用如本文所定义的帽类似物共转录添加5′-帽结构。在本发明的上下文中,优选的帽类似物是m7g(5’)ppp(5’)g(m7g)或3′-o-me-m7g(5′)ppp(5′)g。在本发明的上下文中,另外优选的帽类似物是m7g(5′)ppp(5′)(2′omea)pg或m7g(5′)ppp(5′)(2′omeg)pg结构,用于共转录生成cap1结构。在另一个实施方案中,使用加帽酶(例如牛痘病毒加帽酶,可商购获得的加帽试剂盒)通过酶促加帽来添加5’-帽结构,以产生cap0或cap1或cap2结构。在其他实施方案中,使用固定化的加帽酶,例如在加帽反应器中的加帽酶(wo2016/193226),通过酶促加帽来添加5′-帽结构(cap0、cap1)。m7gpppn(cap0)、cap1和cap2是聚合酶ii转录的rna中天然存在的5′-帽结构,因此这些结构在本文中不被视为修饰的rna中所包含的修饰。因此,本发明的修饰的rna序列可以包含cap0、cap1或cap2,但是另外地,该修饰的rna序列可以包含至少一种本文所定义的其他修饰。聚腺苷酸序列根据本发明的另一个优选的实施方案,本文所用的rna可以包含聚腺苷酸序列或聚腺苷酸尾。术语“聚腺苷酸序列”、“聚腺苷酸尾”或“3′-聚腺苷酸尾”是本领域普通技术人员所认识和理解的,并且例如是指腺苷核苷酸序列,其通常位于rna的3′末端,最多约400个腺苷核苷酸。在本发明的上下文中,聚腺苷酸序列可以例如位于mrna或任何其他核酸分子内,例如在载体中,例如在用作通过载体的转录产生rna,优选mrna的模板的载体中。在一个优选的实施方案中,合适地位于3′末端的聚腺苷酸序列通常为约10个至200个腺苷核苷酸,优选为约10个至100个腺苷核苷酸,更优选为约40个至80个腺苷核苷酸,甚至更优选为约50个至70个腺苷核苷酸。优选地,本文中使用的rna中的聚腺苷酸序列通过rna体外转录从dna模板衍生而来。在其他实施方案中,聚腺苷酸序列是通过化学合成的常规方法在体外获得的,而不必从dna模板转录而来。在其他的实施方案中,通过使用可商购获得的的聚腺苷酸化试剂盒和本领域已知的相应方案通过rna的酶促聚腺苷酸化(在rna体外转录后)或者通过使用固定化的聚腺苷酸聚合酶来产生聚腺苷酸序列,例如在聚腺苷酸化反应器中(如wo2016174271中所述)。备选地,本文所用的rna可以包含聚腺苷酸化信号。聚腺苷酸化信号通常包含由腺嘌呤和尿嘧啶/胸腺嘧啶核苷酸组成的六聚体,优选六聚体序列为aauaaa。也可以考虑其他序列,优选六聚体序列。聚腺苷酸化通常发生在前体mrna(也称为成熟前mrna)的加工过程中。在这种情况下,优选包含nn(u/t)ana共有序列的共有聚腺苷酸化信号。在一个特别优选的实施方案中,聚腺苷酸化信号包含以下序列之一:aa(u/t)aaa或a(u/t)(u/t)aaa(其中尿苷通常存在于rna中,而胸苷通常存在于dna中)。在一些实施方案中,本文所用的rna可以包含衍生自载体的聚腺苷酸序列和通过酶促聚腺苷酸化产生的至少一个另外的聚腺苷酸序列,例如如wo2016/091391中所述。聚胞苷酸序列根据其他的优选实施方案,本文所用的rna可以包含聚胞苷酸序列。术语“聚胞苷酸序列序列”必须理解为胞嘧啶核苷酸的长序列,通常为约10个至约200个胞嘧啶核苷酸,优选约10个至约100个胞嘧啶核苷酸,更优选约10个至约70个胞嘧啶核苷酸,甚至更优选约20个至约50个,或甚至约20个至约30个胞嘧啶核苷酸。聚胞苷酸序列可以优选位于核酸所包含的编码序列的3’。优选地,本文中使用的rna中的聚胞苷酸序列通过rna体外转录从dna模板衍生而来。utr在一个优选的实施方案中,至少一种rna或至少一个rna种类包含3’-utr和/或5’-utr。优选地,本文所用的3’-utr或5’-utr分别包含一个或多于一个3’-utr元件或5’-utr元件。因此,本文所用的rna可包含至少一个5’-utr元件和/或至少一个3’-utr元件。在本文中,utr元件包含或组成为核酸序列,其衍生自任何天然存在的基因的5′-utr或3′-utr,或衍生自基因的5′-utr或3′-utr的片段、同源物或变体。优选地,在本发明的上下文中使用的5’-utr元件或3’-utr元件与本文所用的rna的至少一个编码序列是异源的。5’-utr元件或3’-utr元件优选衍生自天然存在的基因。在其他实施例中,可以在本发明的上下文中使用合成设计的5’-utr元件或3’-utr元件。术语“3′-非翻译区(3′-utr)”将被本领域普通技术人员认识和理解,并且例如旨在指位于编码序列3’(即“下游”)的核酸分子的一部分′,其通常不翻译成蛋白质。通常,3′-utr是mrna的一部分,其位于mrna的编码序列(cds)和聚腺苷酸序列之间。在本发明的上下文中,术语3’-utr还可以包含元件,其在转录成rna的dna模板中是未编码的,但在转录后在成熟期间被添加,例如聚腺苷酸序列。术语“5′-非翻译区(5′-utr)”将被本领域普通技术人员认识和理解,并且例如意在指位于编码序列5’(即“上游”)且不翻译成蛋白质的核酸分子的一部分。通常将5′-utr理解为信使rna(mrna)的特定部分,其位于mrna编码序列的5′。通常,5′-utr以转录起始位点开始,并终止于编码序列的起始密码子的前一个核苷酸。优选地,5′-utr的长度大于20个、30个、40个或50个核苷酸。5′-utr可包含用于控制基因表达的元件,也称为调节元件。这样的调节元件可以是例如核糖体结合位点。5′-utr可以在转录后进行修饰,例如通过添加5′-帽进行修饰。3’-utr元件在一个优选的实施方案中,本文所用的rna可包含至少一个3’-utr元件,其通常位于本文所述的rna的3’-utr内。优选地,在本发明的上下文中,3’-utr与编码序列是异源的。更优选地,本文所用的rna,优选本文所用的rna的3′utr,包含至少一个异源3′-utr元件。优选地,至少一个3′-utr元件包含或组成为衍生自脊索动物基因,优选脊椎动物基因,更优选哺乳动物基因,最优选人基因的3′-utr的核酸序列,或衍生自脊索动物基因,优选脊椎动物基因,更优选哺乳动物基因,最优选人基因的3′-utr的变体的核酸序列。优选地,本文所用的rna包含3’-utr元件,优选地如本文所述的3’-utr元件,其可以衍生自与具有延长的半衰期的rna相关的基因(提供稳定的rna)。优选地,3’utr元件是衍生自优选编码稳定rna的基因的3’utr的核酸序列,或衍生自所述基因的同源物、片段或变体的核酸序列。在一个特别优选的实施方案中,3’-utr元件包含或组成为核酸序列,该核酸序列衍生自选自根据专利申请wo2013/143700的seqidno:1369至1393的白蛋白基因、α-珠蛋白基因、β-珠蛋白基因、酪氨酸羟化酶基因、脂氧合酶基因和胶原蛋白α基因例如胶原蛋白α1(i)基因的3’-utr;或衍生自选自白蛋白基因、α-珠蛋白基因、β-珠蛋白基因、酪氨酸羟化酶基因、脂氧合酶基因和胶原α基因例如胶原蛋白α1(i)基因的3′-utr的变体;或衍生自其同源物、片段或变体。特别优选的是根据专利申请wo2013/143700的seqidno:1369(人白蛋白3’-utr)和seqidno:1376(白蛋白73’-utr)的3’-utr序列。在这种情况下,wo2013/143700的公开内容通过引用并入本文。或者,本文所用的rna优选包含3′-utr元件,其包含或组成为核酸序列,该核酸序列选自seqidno:30572、30574、30576、30578、30580、30582或30584或其片段或变体。在其他实施方案中,本文所用的rna包含根据wo2015/101414的seqidno:10至205和wo2015/101415的seqidno:1和2中任一项的3’-utr元件。在此上下文中,wo2015/101414和wo2015/101415的公开内容通过引用并入本文。在一些实施方案中,本文使用的rna包含3’-utr元件,其可以是wo2016/107877中描述的任何3’-utr元件。在此上下文中,与3’-utr元件/序列有关的wo2016/107877的公开内容通过引用并入本文。特别优选的3’-utr元件是专利申请wo2016/107877的seqidno:1至24和seqidno:49至318,或这些序列的片段或变体。在此情况下,特别优选地,根据本发明的rna序列的3′-utr元件包含或组成为根据专利申请wo2016/107877的seqidno:1至24和seqidno:49至318的核酸序列的相应rna序列。在某些实施方案中,本文定义的rna包含3′-utr元件,其可以是如wo2017/036580中所述的任何3′-utr元件。在此上下文中,与3’-utr元件/序列有关的wo2017/036580的公开内容通过引用并入本文。特别优选的3’-utr元件是根据专利申请wo2017/036580的seqidno:152至204的核酸序列,或这些序列的片段或变体。在此情况下,特别优选地,根据本发明的rna序列的3′-utr元件包含或组成为根据专利申请wo2017/036580的seqidno:152至204的核酸序列的相应rna序列。此外,在wo2018172556中公开了特别合适的3’-utr。wo2018172556的公开内容,特别是涉及gnas、casp1、psmb3、alb、cox6b1、ndufa1和rps9的公开内容通过引用包含在本文中。优选的3′-utr元件衍生自gnas、casp1、psmb3、alb、cox6b1、ndufa1或rps9。特别优选的3′-utr元件是wo2018172556中公开的根据seqidno:23至36的核酸序列,或这些序列的片段或变体。5’-utr元件在一个优选的实施方案中,本文所用的rna可包含至少一个5’-utr元件,其通常位于本文所述的rna的5’-utr内。优选地,在本发明的上下文中,5’-utr与编码序列是异源的。更优选地,本文所用的rna,优选本文所用的rna的5′utr,包含至少一个异源5′-utr元件。在优选的实施方案中,本文所用的rna包含至少一个5’-utr元件。优选地,至少一个5′-utr元件包含或组成为衍生自脊索动物基因,优选地脊椎动物基因,更优选地哺乳动物基因,最优选地人基因的5′-utr的核酸序列,或衍生自脊索动物基因,优选地是脊椎动物基因,更优选哺乳动物基因,最优选人基因的5′-utr的变体的核酸序列。在某些实施方案中,本文所用的rna包含至少一个5’-utr元件,其可以是如专利申请wo2013/143700中所述的任何5’-utr元件。合适地,至少一个5′-utr元件衍生自选自专利申请wo2013/143700的seqidno:1至1363、seqidno:1395、seqidno:1421和seqidno:1422的核酸序列。在这种情况下,wo2013/143700的公开内容通过引用并入本文。在优选的实施方案中,本文所用的rna包含至少一个异源5′-utr元件,其包含或组成为核酸序列,该核酸序列衍生自top基因的5′-utr,优选衍生自相应的rna序列,或其同源物、片段或变体,优选缺少5′top基序。更优选地,至少一个异源5′-utr元件包含或组成为核酸序列,该核酸序列衍生自编码核糖体蛋白的top基因的5′-utr,优选衍生自相应的rna序列,或所述核酸序列的同源物、片段或变体,优选缺少5′top基序。在优选的实施方案中,至少一个5′-utr元件包含或组成为核酸序列,所该核酸序列衍生自编码核糖体蛋白的top基因的5′-utr或衍生自编码核糖体蛋白的top基因的5′-utr的变体。例如,5′-utr元件包含或组成为核酸序列,该核酸序列衍生自根据专利申请wo2013/143700的seqidno:67、170、193、244、259、554、650、675、700、721、913、1016、1063、1120、1138和1284至1360中任一项的核酸序列的5′-utr,如本文所述的相应rna序列,其同源物或其变体,优选缺少5′-top基序。在一些实施方案中,至少一个5′-utr元件,优选异源5′-utr元件,包含或组成为核酸序列,该核酸序列衍生自编码核糖体大蛋白(rpl)的top基因的5′-utr,优选衍生自rpl32或rpl35a,或者衍生自选自hsd17b4、atp5a1、aig1、coxc6或abcb7(mdr)的基因,或者衍生自这些基因中任一个的同源物、片段或变体,优选缺少5′top基序。优选地,5′-utr元件包含或组成为核酸序列,该核酸序列衍生自编码核糖体大蛋白(rpl)的top基因的5′-utr或衍生自编码核糖体大蛋白(rpl)的top基因的5′-utr的同源物或变体。例如,5′-utr元件包含或组成为核酸序列,该核酸序列衍生自根据专利申请wo2013/143700的seqidno:67、259、1284至1318、1344、1346、1348至1354、1357、1358、1421和1422中任一项的核酸序列的5′-utr,如本文所述的相应rna序列,其同源物或其变体,优选缺少5′-top基序。在一个优选的实施方案中,5’-utr元件包含或组成为专利申请wo2013/143700的seqidno:1368的核酸序列,或优选相应的rna序列或其片段或变体。在另一个优选的实施方案中,5’-utr元件包含或组成为专利申请wo2013/143700的seqidno:1412至1420的核酸序列,或相应的rna序列或其片段或变体。备选地,5’-utr元件优选包含或组成为如本文公开的根据seqidno:30570的核酸序列或其片段或变体。在一些实施方案中,如本文使用的rna包含5’-utr元件,其可以是wo2016/107877中描述的任何5’-utr元件。在此上下文中,与3’-utr元件/序列有关的wo2016/107877的公开内容通过引用并入本文。特别优选的5’-utr元件是根据专利申请wo2016/107877的seqidno:25至30和seqidno:319至382的核酸序列,或这些序列的片段或变体。在此上下文中,特别优选地,根据本发明的rna序列的5′-utr元件包含或组成为根据专利申请wo2016/107877的seqidno:25至30和seqidno:319至382的核酸序列的相应rna序列。在一些实施方案中,如本文使用的rna包含5’-utr元件,其可以是wo2017/036580中描述的任何5’-utr元件。在此上下文中,与3’-utr元件/序列有关的wo2017/036580的公开内容通过引用并入本文。特别优选的5’-utr元件是根据专利申请wo2017/036580的seqidno:1至151的核酸序列,或这些序列的片段或变体。在此上下文中,特别优选地,根据本发明的rna序列的5′-utr元件包含或组成为根据专利申请wo2017/036580的seqidno:1至151的核酸序列的相应rna序列。此外,在wo2018172556中公开了特别合适的5’-utr。wo2018172556的公开内容,特别是涉及slc7a3、atp5a1、rpl32、hsd17b4、nosip、asah1、rpl31、tubb4b、ubqln2、mp68和ndufa4的公开内容通过引用包含在本文中。优选的3’-utr元件衍生自slc7a3、atp5a1、rpl32、hsd17b4、nosip、asah1、rpl31、tubb4b、ubqln2、mp68或ndufa4。特别优选的3′-utr元件是wo2018172556中公开的根据seqidno:1至22的核酸序列,或这些序列的片段或变体。优选地,如本文所定义的至少一个5′-utr元件和如本文所定义的至少一个3′-utr元件协同作用以增加由如上所述的至少一种rna序列产生蛋白质。组蛋白茎环在一个特别优选的实施方案中,本文所用的rna包含组蛋白茎环序列/结构。如本文所使用的术语“组蛋白茎环”将被本领域普通技术人员所认识和理解,并且例如意在指主要在组蛋白mrna中发现的核酸序列。示例性的组蛋白茎环序列描述于lopez等人(davilalopez,m.,&samuelsson,t.(2008),rna,14(1))中。组蛋白前体mrna中的茎环通常紧随富含嘌呤的序列,称为组蛋白下游元件(hde)。这些前体mrna在细胞核中通过在茎环下游约5个核苷酸的单一内切核酸裂解而被加工,该裂解由u7snrnp通过u7snrna与hde的碱基配对来催化。这样的组蛋白茎环序列优选选自wo2012/019780中公开的组蛋白茎环序列,该公开涉及与组蛋白茎环序列/结构相关的公开内容通过引用并入本文。适用于本发明的组蛋白茎环序列优选衍生自专利申请wo2012/019780的式(i)或(ii)。根据另一个优选的实施方案,如本文所定义的rna可以包含至少一个衍生自专利申请wo2012/019780的特定式(ia)或(iia)中的至少一个的组蛋白茎环序列。特别优选的组蛋白茎环序列是本文公开的根据seqidno:30586的核酸序列,或序列caaaggctcttttcagagccacca(根据专利申请wo2015024667的seqidno:43),或更优选地是相应的rna序列caaaggcucuuuucagagccacca(根据专利申请wo2015024667的seqidno:44)。在本发明的上下文中,上述修饰中的任何一种都可以应用于rna(或rna种类),并且如果合适或必要,可以以任何组合彼此组合,只要这些修饰的组合在各个核酸序列中彼此不干扰即可。本领域技术人员能够相应地进行选择。因此,本文所用的rna可以包含5′-utr和/或3′-utr,优选地包含至少一个组蛋白茎环。本文所用rna的3’-utr优选还包含聚腺苷酸序列和/或聚胞苷酸序列,优选如本文所定义。3’utr的单个元件可以沿着本发明rna序列的5’到3’的任何顺序出现在其中。另外,还可以包含本文所述的其他元件,例如本文定义的稳定化序列(例如衍生自珠蛋白基因的utr的稳定化序列)、ires序列、mirna结合位点等。每个元件也可以在本文所用的rna中重复至少一次(特别是在双顺反子或多顺反子构建体中),优选重复两次或多于两次。在一个优选的实施方案中,本文使用的rna(rna种类)是单顺反子、双顺反子或多顺反子。优选地,rna包含至少两个编码区和至少一个ires序列。因此,在一个优选的实施方案中,本文所用的rna优选在5′至3′方向上包含:a)5′-帽结构(cap0、cap1、cap2),优选m7gpppn(cap0);b)任选地,如本文定义的5′-utr元件;c)至少一个编码序列;d)如本文定义的3’-utr元件;e)任选地,聚腺苷酸序列,其优选包含10个至200个、10个至100个、40个至80个或50个至70个腺嘌呤核苷酸,更优选包含64个腺嘌呤核苷酸;f)任选地,聚胞苷酸序列,其优选由10个至200个、10个至100个、20个至70个、20个至60个或10个至40个胞嘧啶核苷酸组成,更优选包含30个胞嘧啶核苷酸;g)任选地,组蛋白茎环;h)任选地,另外的聚腺苷酸序列;或任何这些核酸序列的片段或变体。在某些实施方案中,本文所用的rna(或rna种类)优选在5′至3′方向上包含以下元件:a)5′帽结构,优选m7gpppn,b)至少一个编码区;c)3′-utr元件,其包含衍生自α-珠蛋白基因的核酸序列,优选地包含根据seqidno:30578的核酸序列,或这些核酸序列中的任一个的同源物、片段或变体,d)聚腺苷酸序列,其优选包含10个至200个、10个至100个、40个至80个或50个至70个腺嘌呤核苷酸,更优选包含64个腺嘌呤核苷酸;e)聚胞苷酸序列,其优选由10个至200个、10个至100个、20个至70个、20个至60个或10个至40个胞嘧啶核苷酸组成,更优选包含30个胞嘧啶核苷酸;和f)组蛋白茎环,其优选包含根据seqidno.30586的核酸序列,或这些核酸序列中任一个的片段或变体。根据以下优选的实施方案,本文所用的rna(或rna种类)优选在5′至3′方向上包含以下元件:a)5′帽结构,优选m7gpppn,b)5′-utr元件,其包含衍生自top基因的5′-utr的核酸序列,优选地包含根据seqidno:30570的核酸序列,或这些核酸序列中任一个的同源物、片段或变体,c)至少一个编码区,d)3′-utr元件,其包含衍生自白蛋白基因的核酸序列,优选包含根据seqidno:30582或30584的核酸序列的相应rna序列,或这些核酸序列中任一个的同源物、片段或变体,e)聚腺苷酸序列,其优选包含10个至200个、10个至100个、40个至80个或50个至70个腺嘌呤核苷酸,更优选包含64个腺嘌呤核苷酸;f)聚胞苷酸序列,其优选由10个至200个、10个至100个、20个至70个、20个至60个或10个至40个胞嘧啶核苷酸组成,更优选地包含30个胞嘧啶核苷酸;和g)组蛋白茎环,其优选包含根据seqidno:30586的核酸序列,或这些核酸序列中任一个的片段或变体。根据本文公开的方法调整的rna(或rna种类)的至少一个编码区(或编码序列)优选编码肽或蛋白质。在优选的实施方案中,至少一个编码区编码衍生自引起感染性疾病的病原体的抗原,或这种抗原的片段或变体。更优选地,至少一个编码区编码病毒抗原、细菌抗原、真菌抗原或原生动物抗原,或这些抗原中任一种的片段或变体。在这种情况下,还优选的是衍生自选自以下病原体的抗原:鲍曼不动杆菌、无形体属、嗜吞噬细胞无形体、巴西钩口线虫、十二指肠钩口线虫、溶血隐秘杆菌、蛔虫、曲霉属、星状病毒科、巴贝虫属、炭疽杆菌、蜡样芽孢杆菌、巴尔通氏菌、bk病毒、人芽囊原虫、皮炎芽生菌、百日咳鲍特菌、伯氏疏螺旋体、疏螺旋体属、疏螺旋体、布鲁氏菌属、马来布鲁线虫、布尼亚病毒科、伯克霍尔德菌和其他伯克霍尔德菌、鼻疽伯克霍尔德氏菌、类鼻疽伯克霍尔德菌、嵌杯病毒科、弯曲菌属、白色假丝酵母、假丝酵母菌、沙眼衣原体、肺炎衣原体、鹦鹉热衣原体、cjd朊病毒、华枝睾吸虫、肉毒杆菌、艰难梭菌、产气荚膜梭菌、产气荚膜梭菌、梭菌、破伤风梭菌、球孢子菌、冠状病毒、白喉杆菌、伯氏考克斯体、克里米亚-刚果出血热病毒、新型隐球菌、隐孢子虫属、巨细胞病毒(cmv)、登革热病毒(den-1、den-2、den-3和den-4)、脆弱双核阿米巴、埃博拉病毒(ebov)、棘球属、查菲埃立克体、伊氏埃立克体、埃里希氏体属、痢疾阿米巴、肠球菌属、肠病毒属、肠病毒、主要柯萨奇a病毒和肠病毒71(ev71)、皮毛癣菌、eb病毒(ebv)、大肠杆菌o157:h7、o111和o104:h4、牛羊肝吸虫和大片吸虫、ffi朊病毒、丝虫目超科、黄病毒、土拉弗朗西斯菌、梭杆菌属、白地霉、肠贾第虫、颚口线虫属、gss朊病毒、瓜纳瑞托病毒、杜克雷嗜血杆菌、流感嗜血杆菌、幽门螺杆菌、亨尼病毒(亨德拉病毒尼帕病毒)、甲型肝炎病毒、乙型肝炎病毒(hbv)、丙型肝炎病毒(hcv)、丁型肝炎病毒、戊型肝炎病毒、单纯疱疹病毒1和2(hsv-1和hsv-2)、组织荚膜胞浆菌、hiv(人类免疫缺陷病毒)、威尼克外瓶霉、人博卡病毒(hbov)、人疱疹病毒6(hhv-6)和人疱疹病毒7(hhv-7)、人偏肺病毒(hmpv)、人乳头瘤病毒(hpv)、人副流感病毒(hpiv)、日本脑炎病毒、jc病毒、胡宁病毒、金氏金杆菌、肉芽肿杆菌、库鲁朊病毒、拉沙病毒、嗜肺军团杆菌、利什曼原虫属、钩端螺旋体属、单核细胞增生李斯特菌、淋巴细胞性脉络丛脑膜炎病毒(lcmv)、马秋博病毒、马拉色菌、马尔堡病毒、麻疹病毒、横川后殖吸虫、微孢子虫门、传染性软疣病毒(mcv)、腮腺炎病毒、麻风分枝杆菌和弥散性麻风结节病分枝杆菌(mycobacteriumlepromatosis)、结核分枝杆菌、溃疡分枝杆菌、支原体肺炎、福氏耐格里阿米巴原虫、美洲钩虫、淋病奈瑟球菌、脑膜炎奈瑟球菌、诺如病毒、星状诺卡菌、诺卡菌、旋盘尾丝虫、恙虫病东方体、正黏病毒科(流感)、巴西芽生菌、并殖吸虫、卫氏并殖吸虫、细小病毒b19、巴斯德氏菌属、疟原虫属、杰氏肺囊虫属、脊髓灰质炎病毒、狂犬病病毒、呼吸道合胞病毒(rsv)、鼻病毒(rhinovirus)、鼻病毒(rhinoviruses)、小蛛立克次氏体、立克次体属、普氏立克次体、立氏立克次体、斑疹伤寒立克次体、裂谷热病毒、轮状病毒、风疹病毒、萨比亚病毒、沙门菌属、疥螨、sars冠状病毒、血吸虫属、志贺菌属、辛诺柏病毒、汉坦病毒、申克氏孢子丝菌、葡萄球菌属、葡萄球菌属、无乳链球菌、肺炎链球菌、酿脓链球菌、粪类圆线虫、绦虫属、猪带绦虫、蜱传脑炎病毒(tbev)、犬弓首蛔虫或猫弓首蛔虫、刚地弓形虫、梅毒螺旋体、旋毛形线虫、阴道毛滴虫、毛癣菌、毛首鞭形线虫、布氏锥虫、克氏锥虫、解脲支原体、水痘带状疱疹病毒(vzv)、水痘带状疱疹病毒(vzv)、重型天花或轻型天花、vcjd朊病毒、委内瑞拉马脑炎病毒、霍乱弧菌、西尼罗病毒、西方马脑炎病毒、班氏吴策线虫、小肠结肠炎耶尔森菌、鼠疫杆菌、和假结核耶尔森菌,优选地,病原体选自流感病毒、呼吸道合胞病毒(rsv)、单纯疱疹病毒(hsv)、人乳头瘤病毒(hpv)、人免疫缺陷病毒(hiv)、疟原虫、金黄色葡萄球菌、登革热病毒、沙眼衣原体、巨细胞病毒(cmv)、乙型肝炎病毒(hbv)、结核分枝杆菌、狂犬病病毒、轮状病毒和黄热病毒、寨卡病毒。根据一个特别优选的实施方案,至少一个编码区编码衍生自流感病毒,更优选衍生自甲型流感病毒、乙型流感病毒或丙型流感病毒(株),或这些中的任一种的变体的抗原或其片段或变体。在本文中,特别优选本文所用rna的至少一个编码区编码至少一种选自以下的抗原或其片段或变体:流感病毒的血凝素(ha)、神经氨酸酶(na)、核蛋白(np)、基质蛋白1(m1)、基质蛋白2(m2)、非结构蛋白1(ns1)、非结构蛋白2(ns2)、核输出蛋白(nep)、聚合酶酸性蛋白(pa)、聚合酶碱性蛋白pb1、pb1-f2或聚合酶碱性蛋白2(pb2)或其变体。在一些实施方案中,本文使用的rna的至少一个编码区编码至少一种衍生自本文提及的任一种流感病毒蛋白质的抗原性肽或蛋白质,或其片段或变体。在一个优选的实施方案中,本文使用的rna的至少一个编码区编码至少一种选自流感病毒的血凝素(ha)和/或神经氨酸酶(na)的抗原,或其片段或变体。更优选地,本文使用的rna的至少一个编码区编码至少一种衍生自流感病毒的血凝素(ha)和/或神经氨酸酶(na)的抗原性肽或蛋白质,或其片段或变体。在这种情况下,血凝素(ha)和神经氨酸酶(na)可以选自相同的流感病毒或不同的流感病毒(或分别不同的流感病毒株)。在国际专利申请pct/ep2016/075862和pct/ep2017/060663中描述了衍生自流感病毒的流感抗原和抗原性肽或蛋白质,其全部内容通过引用并入本文。在优选的实施方案中,本文所用的rna(种类),优选根据本文公开的方法待调整的原始rna(种类)或调整的rna(种类),包含至少一个编码肽或蛋白质的编码区,该肽或蛋白质包含或组成为根据以下seqidno中任一项的氨基酸序列:如pct/ep2017/060663中所述的seqidno:1至30504、213713、213738、213739、213787、213792、213797、213802、213996至214023、214100至214127、214212至214239、214316至214343、214420至214447、214524至214551、214628至214655、214732至214759、214836至214863、214940至214967、215044、215049至215076、215161、215166至215193、215278、215283至215310、215395、215400至215427、215512、215517至215544,或这些氨基酸序列中任一个的片段或变体。根据一些实施方案,本文所用的rna(种类),优选待调整的原始rna(种类),包括至少一个编码区,该编码区包含或组成为如pct/ep2017/060663中所述的根据seqidno:30505至213528、213529至213557、213740至213746、213788、213789、213793、213794、213798、213799、213803、213804、214024至214051、214128至214155、214240至214267、214344至214371、214448至214475、214552至214579、214656至214683、214760至214787、214864至214891、214968至214995、215045、215046、215077至215104、215162、215163、215194至215221、215279、215280、215311至215338、215396、215397、215428至215455、215513、215514、215545至215572、215629、215632、215638至215835、215892、215836至215889中任一项的核酸序列,或这些核酸序列中任一个的片段或变体。根据另一个优选的实施方案,本文所用的rna(种类)包含至少一个编码区,该编码区编码衍生自诺如病毒的抗原或其片段或变体,该诺如病毒优选选自gi.1至gi.17诺如病毒、gii.1至gii.24诺如病毒、giii.1至giii.4诺如病毒、giv.1至giv.4诺如病毒和gv.1至gv.4诺如病毒,更优选地衍生自选自gi.1诺如病毒和gii.4诺如病毒的诺如病毒或其中任一种的变体。在这种情况下,特别优选的是,本文使用的rna的至少一个编码区编码至少一种选自以下的抗原或其片段或变体:诺如病毒非结构蛋白ns1/ns2、ns3、ns4、ns5、ns6、ns7,诺如病毒衣壳蛋白vp1和诺如病毒衣壳蛋白vp2或其变体。在一些实施方案中,本文使用的rna的至少一个编码区编码至少一种衍生自本文提及的任一种诺如病毒蛋白质的抗原性肽或蛋白质,或其片段或变体。在一个优选的实施方案中,本文使用的rna的至少一个编码区编码选自诺如病毒衣壳蛋白vp1或诺如病毒衣壳蛋白vp2或其片段或变体的至少一种抗原。在这种情况下,诺如病毒衣壳蛋白vp1和/或诺如病毒衣壳蛋白vp2可以选自相同的诺如病毒或不同的诺如病毒(或分别不同的诺如病毒株)。在国际专利申请pct/ep2017/060673中也描述了诺如病毒抗原和衍生自诺如病毒的抗原性肽或蛋白质,其通过引用以整体并入本文。在优选的实施方案中,本文所用的rna(种类),优选根据本文公开的方法待调整的原始rna(种类)或调整的rna(种类),包含至少一个编码肽或蛋白质(衍生自诺如病毒)的编码区,该肽或蛋白质包含或组成为如pct/ep2017/060673中所述的根据seqidno:1至4410中任一项的氨基酸序列,或这些氨基酸序列中任一个的片段或变体。根据一些实施方案,本文所用的rna(种类),优选待调整的原始rna(种类),包含至少一个编码区,该编码区包含或组成为如pct/ep2017/060673中所述的根据seqidno:4411至39690、39713至39746中任一项的核酸序列,或这些核酸序列中任一个的片段或变体。根据一些实施方案,本文中使用的rna(种类),优选待调整的原始rna(种类)或调整的rna(种类),包含至少一个编码肿瘤抗原的编码区。合适地,肿瘤抗原选自5t4、707-ap、9d7、afp、albziphpg1、α-5-β-1-整联蛋白、α-5-β-6-整联蛋白、α-肌动蛋白-4/m、α-甲基酰基辅酶a外消旋酶、art-4、artc1/m、b7h4、bage-1、bcl-2、bcr/abl、β-联蛋白/m、bing-4、brca1/m、brca2/m、ca15-3/ca27-29、ca19-9、ca72-4、ca125、钙网蛋白、camel、casp-8/m、组织蛋白酶b、组织蛋白酶l、cd1、cd20、cd22、cd25、cde30、cd33、cd4、cd52、cd55、cd56、cd80、cdc27/m、cdk4/m、cdkn2a/m、cea、clca2、cml28、cml66、coa-1/m、毛状蛋白样蛋白、胶原蛋白xxiii、cox-2、ct-9/brd6、cten、周期蛋白b1、周期蛋白d1、cyp-b、cypb1、dam-10、dam-6、dek-can、eftud2/m、egfr、elf2/m、emmprin、epcam、epha2、epha3、erbb3、etv6-aml1、ezh2、fgf-5、fn、frau-1、g250、gage-1、gage-2、gage-3、gage-4、gage-5、gage-6、gage7b、gage-8、gdep、gnt-v、gploo、gpc3、gpnmb/m、hage、hast-2、hepsin、her2/neu、herv-k-mel、hla-a*0201-r171、hla-a11/m、hla-a2/m、hne、同源异型框nkx3.1、hom-tes-14/scp-1、hom-tes-85、hpv-e6、hpv-e7、hsp70-2m、hst-2、htert、ice、igf-1r、il-13ra2、il-2r、il-5、未成熟层粘连蛋白受体、激肽释放酶-2、激肽释放酶-4、ki67、kiaa0205、kiaa0205/m、kk-lc-1、k-ras/m、lage-a1、ldlr-fut、mage-a1、mage-a2、mage-a3、mage-a4、mage-a6、mage-a9、mage-a10、mage-a12、mage-b1、mage-b2、mage-b3、mage-b4、mage-b5、mage-b6、mage-b10、mage-b16、mage-b17、mage-c1、mage-c2、mage-c3、mage-d1、mage-d2、mage-d4、mage-el、mage-e2、mage-f1、mage-h1、magel2、乳腺珠蛋白a、mart-1/melan-a、mart-2、mart-2/m、基质蛋白22、mc1r、m-csf、mei/m、间皮素、mg50/pxdn、mmp11、mn/caix抗原、mrp-3、muc-1、muc-2、mum-1/m、mum-2/m、mum-3/m、肌球蛋白i类/m、na88-a、n-乙酰氨基葡萄糖氨基转移酶-v、neo-pap、neo-pap/m、nfyc/m、ngep、nmp22、npm/alk、n-ras/m、nse、ny-eso-b、ny-eso-1、oa1、ofa-ilrp、ogt、ogt/m、os-9、os-9/m、骨钙素、骨桥蛋白、pi5、p190次要bcr-ab1、p53、p53/m、page-4、pai-1、pai-2、pap、part-1、pate、pdef、pim-1激酶、pin-1、pml/parα、pote、prame、prdx5/m、前列腺特异性蛋白(prostein)、蛋白酶3、psa、psca、psgr、psm、psma、ptprkm、rage-1、rbaf600/m、rhamm/cd168、ru1、ru2、s-100、sage、sart-1、sart-2、sart-3、scc、sirt2/m、sp17、ssx-1、ssx-2/hom-mel-40、ssx-4、stamp-1、steap-1、存活蛋白、存活蛋白-2b、syt-ssx-1、syt-ssx-2、ta-90、tag-72、tarp、tel-aml1、tgfβ、tgfβrii、tgm-4、tpi/m、trag-3、trg、trp-1、trp-2/6b、trp/int2、trp-p8、酪氨酸酶、upa、vegfr1、vegfr-2/flk-1和wt1。在另一个特别优选的实施方案中,本文中使用的rna(种类),优选待调整的原始rna(种类)或调整的rna(种类),包含至少一个编码区,该编码区包含或组成为编码至少一种治疗性肽或蛋白质的核酸序列,该治疗性肽或蛋白质尤其可用于治疗例如代谢性病症或内分泌失调。这些和其他蛋白质被理解为治疗性的,因为它们意在通过将功能性蛋白质的有缺陷内源性产物替换为足够的量来治疗对象。因此,这样的治疗性蛋白质通常是哺乳动物蛋白质,特别是人蛋白质。优选地,治疗性肽或蛋白质选自或衍生自用于或可用于医学治疗(例如蛋白质替代)、抗体、t细胞受体、基因编辑蛋白质(例如cas9)的任何治疗性肽或蛋白质。在另一个特别优选的实施方案中,本文所用的rna(种类),优选待调整的原始rna(种类)或调整的rna(种类),编码至少一种治疗性抗体,该治疗性抗体选自尤其用于治疗癌症或肿瘤疾病、免疫疾病、感染性疾病、阿尔茨海默病、哮喘的抗体,和用于治疗多种疾病例如骨质疏松、蛀牙、特发性肺纤维化、局灶性节段性肾小球硬化、疼痛、肌肉营养不良和新血管性年龄相关性黄斑变性的抗体。在另一个特别优选的实施方案中,本文使用的rna(种类),优选待调整的原始rna(种类)或调整的rna(种类),包含至少一个编码区,该编码区包含或组成为编码至少一种与变态反应或变应性疾病相关的变应原(变应原或变应原性抗原)和/或至少一种自身免疫性自身抗原(自体抗原)的核酸序列。调整的rna和载体:在另一方面,本发明涉及可通过根据本发明的方法获得的rna。更具体地,本发明提供了一种调整的rna(或分别具有调整的序列的rna(种类)),其可通过如本文所述的改变rna在色谱柱上的保留时间的方法,从至少两个rna种类的混合物中纯化至少一个rna种类的方法,从包含至少两个rna种类的混合物中共纯化至少两个rna种类的方法,协调至少两个rna种类的序列中a和/或u核苷酸的数目的方法,或提供调整的rna的方法获得。优选地,根据本发明的(调整的)rna的特征在于,通过相对于原始rna序列中a和/或u核苷酸的数目改变a和/或u核苷酸的数目来调整其序列。原始rna序列优选为如本文所述的rna序列,优选为相应的野生型rna序列,更优选为如本文所述修饰的相应的rna序列,例如g/c含量修改的序列或密码子优化的序列。在优选的实施方案中,根据本发明的调整的rna的特征在于本文所述的任何特征,特别是关于本发明的方法所述的任何特征。在某些实施方案中,根据本发明的调整的rna的特征在于rna序列中a核苷酸数目与u核苷酸数目之比,其范围为0.2至5,优选0.5至3,更优选1至3,甚至更优选1至2.5,甚至更优选1.2至2,甚至更优选1.4至2,甚至更优选1.5至2,最优选1.6至2。根据一个特别优选的实施方案,根据本发明的rna包含至少一个编码区,该编码区包含或组成为根据seqidno:26至14079、14080至16264、16265至28640、28641至30568中任一个的核酸序列或这些核酸序列中任一个的片段或变体。在另一方面,本发明涉及包含根据本发明的调整的rna序列的载体。在优选的实施方案中,根据本发明的载体是dna载体,其包含对应于根据本发明的调整的rna序列的核酸序列或其片段或变体。或者,根据本发明的载体是dna载体,其包含编码根据本发明的调整的rna序列的核酸序列或其片段或变体。优选地,根据本发明的载体是质粒载体或病毒载体。rna制备根据本发明的rna可以使用本领域中已知的任何方法来制备,这些方法包括合成方法例如固相rna合成,以及体外方法例如rna体外转录反应。特别优选的是rna体外转录。术语“rna体外转录”或“体外转录”是指其中在无细胞体系中(体外)合成rna的过程。dna,特别是质粒dna(或pcr产物)通常用作生成rna转录物的模板。rna可以通过合适的dna模板的dna依赖性体外转录而获得,根据本发明的模板优选为线性化质粒dna模板。用于控制体外转录的启动子可以是任何dna依赖性rna聚合酶的启动子。dna依赖性rna聚合酶的具体实例是t7、t3和sp6rna聚合酶。用于体外rna转录的dna模板可通过以下方法获得:克隆核酸,特别是对应于待体外转录的各个rna的cdna,并将其引入用于体外转录的合适载体,例如引入质粒dna中。在本发明的一个优选实施方案中,在体外转录之前,用合适的限制酶将dna模板线性化。cdna可以通过mrna的逆转录或化学合成获得。此外,用于体外rna合成的dna模板也可以通过基因合成获得。用于rna体外转录的试剂通常包括:具有启动子序列的dna模板(线性化的质粒dna或pcr产物),该启动子序列对其各自的rna聚合酶如噬菌体编码的rna聚合酶(t7、t3、sp6或syn5)具有高结合亲和力;四种碱基(腺嘌呤、胞嘧啶、鸟嘌呤和尿嘧啶)的核糖核苷三磷酸(ntp);任选地,如本文所定义的帽类似物(例如,m7g(5’)ppp(5’)g(m7g));任选地,本文定义的进一步修饰的核苷酸;能够结合dna模板内启动子序列的dna依赖性rna聚合酶(例如t7、t3、sp6或syn5rna聚合酶);任选地,用于使任何污染的rna酶失活的核糖核酸酶(rna酶)抑制剂;任选地,用于降解焦磷酸的焦磷酸酶,其可以抑制转录;mgcl2,其提供mg2+离子作为聚合酶的辅因子;用于维持合适的ph值的缓冲液(tris或hepes),其也可以包含抗氧化剂(例如dtt)和/或多胺,例如最佳浓度的亚精胺,或wo2017/109161中公开的缓冲液系统。在实施方案中,用于rna体外转录的核苷酸混合物可另外包含本文定义的修饰的核苷酸。在实施方案中,可针对给定的rna序列优化核苷酸混合物(即混合物中每个核苷酸的部分),优选如wo2015/188933所述。在必须产生一种以上本文定义的不同rna的实施方案中,例如在必须产生2种、3种、4种、5种、6种、7种、8种、9种、10种或甚至多于10种不同rna分子的实施方案中,可以适当地使用wo2017/109134中所述的程序。在一个优选的实施方案中,根据wo2016/180430,在当前的良好生产规范(gmp)下进行rna生产,在dna和rna水平上实施各种质量控制步骤。所获得的rna产物优选使用(curevac,tübingen,德国;根据wo2008/077592的rp-hplc)和/或蒸汽流动过滤(如wo2016/193206中所述)进行纯化。在一个优选的实施方案中,根据wo2016/165831或wo2011/069586将rna,特别是纯化的rna冻干,以产生如本文所定义的温度稳定的rna。还可以使用根据wo2016/184575或wo2016184576的喷雾干燥或喷雾冷冻干燥将本发明的rna,特别是纯化的rna冻干,以产生本文所定义的温度稳定的rna。提供调整的rna序列的方法根据另一方面,本发明还提供了用于提供调整的rna序列的方法,其中所述方法优选地包括以下步骤:a)任选地,确定原始rna序列中核苷酸的总数;b)确定原始rna序列中a和/或u核苷酸的数目;c)确定可被至少一种替代密码子替换而不改变编码的氨基酸序列的原始rna序列中的密码子;和d)通过用替代密码子替换至少一个原始密码子,将rna序列中a和/或u核苷酸的数目调节至a和/或u核苷酸的预设数目,其中替代密码子与原始密码子编码相同的氨基酸,并且其特征还在于较高的a和/或u核苷酸含量。在优选的实施方案中,该方法的步骤b)还包括确定原始rna序列中g和/或c核苷酸的数目。优选地,根据本发明的用于提供调整的rna的方法还包括步骤e),其包括制备rna。优选地,通过本领域已知的任何合适的方法或通过本文在“rna制备”部分下描述的方法制备rna。更优选地,所述方法包括体外转录的步骤,优选地如本文所述。在一个特别优选的实施方案中,所述方法涉及体外转录和在色谱方法,优选hplc方法,更优选rp-hplc方法,优选如本文所述的色谱方法中纯化获得的rna的步骤。在下文中,通过描述优选的实施方案(参见本文实施例6)进一步说明本发明的提供调整的rna的方法的概念。在图2中示例性地示出了序列调整的基本原理,特别是通过改变密码子使用进行au调整的基本原理。可以使用自动化的计算机方法(算法)来将rna序列中任何核苷酸的数目设置为限定值,而不改变氨基酸序列(所述方法的步骤d))。在本发明的上下文中,自动化的计算机方法可以用于序列调整,特别是rna序列的a和/或u核苷酸的数目(au计数)的调整,以允许协调rna混合物从而用于hplc共分析和/或hplc共纯化。下表1总结了编码序列中的密码子变化(对于每个遗传编码的氨基酸),其可用于增加rna序列的a和/或u核苷酸的数目,而不改变编码的氨基酸序列。表2总结了编码序列中的密码子变化(对于每个遗传编码的氨基酸),其可用于减少rna序列的a和/或u核苷酸的数目,而不改变编码的氨基酸序列。表1:允许增加a和/或u核苷酸数目的密码子变化n.a.=不适用表2:允许减少a和/或u核苷酸数目的密码子变化n.a.=notappllcablen.a.=不适用在该方法的初始阶段,优选为包含在待调整的rna序列中的每个密码子创建矩阵,从而识别可能的密码子交换,这不会导致编码氨基酸的改变(在此称为“交换矩阵”)。式(i)中示出了示例性的“交换矩阵”。式(i):式(i)显示,对于密码子“cga”,更改为替代密码子提供了将a核苷酸的数目增加1(例如:cga->aga)的选项,提供了将c核苷酸的数目增加1(例如cga->cgc)的选项,提供了将g核苷酸的数目增加1(例如cga->cgg)的选项,并且提供了将t核苷酸的数目增加1(例如,cga->cgt)的选项。优选针对待调整的rna序列中每个单独的密码子生成交换矩阵。使用所述交换矩阵,可以确定每个密码子中各个核苷酸的潜在最大数目(分别为a和t(u)计数)(不改变氨基酸序列)。因此,通过逐步迭代分析序列中所有待调整的密码子的潜在密码子交换,其中在每个迭代步骤中,使用各自的交换矩阵(如上所述)分析相应的密码子以进行潜在的核苷酸替换。例如,如果理论上各个密码子可能是没有变化的,例如在“atg”或“tgg”的情况下,则使用式(ii)中示例性示出的相应交换矩阵(交换矩阵的*=0)。式(ii):式(ii)显示,对于密码子“atg”,改变为替代密码子不会增加a核苷酸、c核苷酸、g核苷酸或t核苷酸的数目(因为没有针对atg(met)的替代密码子)。在理论上可以进行根据各个交换矩阵(*>0)的交换的情况下,如果改变可以在例如仅调整提供增加a和/或t(u)核苷酸数目的选项的密码子的前提下实施,则进一步分析密码子。因此,构建了目标核苷酸(例如a和/或t(u))和在当前交换矩阵中可能产生阳性结果(即,a和/或t(u)改变;参见例如式(i))的核苷酸之间的交集。结果,可以将每个密码子归类并分为三个类别之一:类别1(“有利”类):潜在的密码子交换仅允许增加一个目标核苷酸(在本实例中为a或t(u))。例如,可以将密码子“gac”(asp)更改为“gau”(asp),以增加a和t(u)核苷酸的数目。不需要进一步的分析,因为该修饰对a和t(u)核苷酸的数目没有任何进一步的影响(除了上述提到的影响之外)。类别2(“可能”类):潜在的密码子交换允许两个目标核苷酸的增加(在本实例中为a和t(u))。例如,密码子“gca”可以更改为“gcu”,这会增加t(u)计数,但同时会减少a计数。因此,需要针对属于该类别的密码子进行进一步分析,以便决定是否应该以减少另一个目标核苷酸(a)的数目为代价来增加本实例中两个目标核苷酸之一(t(u))的数目。类别3(“不可能”类):rna序列中没有替代密码子的密码子(*=0)。此类别3的实例是atg(met;起始密码子)或“ugg”(trp)。原始序列的所有密码子优选以此方式分类。然后可以优选地计算对于所有目标核苷酸(a、t(u))已经鉴定了多少潜在的核苷酸交换。在优选的实施方案中,所述方法包括仅使用如本文定义的类别1的密码子来调整rna序列。在一些实施方案中,也可以使用来自类别2的密码子(例如,使用了来自类别1的所有密码子之后),从而为a和t(u)计数提供额外的调整可能性。如果需要类别2以实现所需的核苷酸计数,则可以使用以下比率的计算来确定交换核苷酸(核苷酸a或t(u)):其中i代表相应的目标,ci是类别2中i的可能调整位置的计数,xi是i的期望阈值,pi是已经改变的鉴定的调整位置的计数。优选地,对所有计算出的比率进行排名,并从最低比率开始到最高比率,应用类别2的更改,直到达到期望阈值或直到执行了类别2的所有可能的交换。该过程优选地对任何rna序列迭代地进行,其中目标核苷酸计数,例如a和/或u核苷酸的目标数目,不能仅通过使用根据类别1的交换来实现。在不能达到期望的目标核苷酸计数的情况下(因为已经使用了类别1和类别2的所有替代密码子,这意味着不可能有进一步的改变),优选产生与目标核苷酸计数尽可能接近的调整序列。根据所述方法的一些实施方案,可以在其中实施以下改进之一:1.除了在上述实施方案中使用的并且基于交换可能性的基本均等分布之外,还可以设想其他分布模型,例如正态分布、首次出现分布、最后出现分布或基于随机的分布。替代地,可以确定可能变化的平均值或可能变化的中值,并且可以围绕这些值来设置所有交换。2.交换矩阵还可以包含关于目标序列的密码子的额外信息(例如密码子使用等)。这为是否需要密码子交换创建了进一步的标准,从而有助于调整特定的密码子使用或目标序列中不同的核苷酸比。3.第三类别还可以通过应避免被交换的序列或基序(例如,限制酶的识别基序、启动子序列或构建不需要的二级结构的序列等)来实施。4.可以基于输入序列的长度和所需目标核苷酸的出现来执行输入序列的自动化分箱,以便识别用于a和/或u调整的最佳核苷酸计数。关于根据本发明的提供调整的rna的方法所描述的任何一个步骤或步骤的组合可以优选地应用于本文描述的其他方法,特别是改变rna在色谱柱上的保留时间的方法,从至少两个rna种类的混合物中纯化至少一个rna种类的方法,从包含至少两个rna种类的混合物中共纯化至少两个rna种类的方法或协调至少两个rna种类的序列中a和/或u核苷酸的数目的方法。组合物和疫苗在另一方面,本发明提供了一种组合物,其包含至少一个如本文所述的调整的rna序列和任选的药学上可接受的载剂。包含本文所述的至少一种调整的rna的本发明的组合物优选是本文所述的药物组合物或疫苗。根据一个优选的实施方案,本发明的组合物是多价疫苗,优选如本文所述的多价疫苗。在优选的实施方案中,根据本发明的组合物包含可通过本文所述的方法获得的rna,特别是通过如本文所述的改变rna在色谱柱上的保留时间的方法,从至少两个rna种类的混合物中纯化至少一个rna种类的方法,从包含至少两个rna种类的混合物中共纯化至少两个rna种类的方法,协调至少两个rna种类的序列中a和/或u核苷酸的数目的方法,或提供调整的rna的方法获得的rna。根据一个优选的实施方案,根据本发明的组合物包含至少两个rna种类,其中通过相对于原始rna序列中a和/或u核苷酸数目改变至少一个rna种类的序列中a和/或u核苷酸的数目来调整至少一个rna种类的序列。更优选地,所述组合物包含至少两个rna种类,其中至少一个rna种类是通过根据本发明的任一种方法获得的调整的rna,优选通过如本文所述的改变rna在色谱柱上的保留时间的方法,从至少两个rna种类的混合物中纯化至少一个rna种类的方法、从包含至少两个rna种类的混合物中共纯化至少两个rna种类的方法,协调至少两个rna种类的序列中的a和/或u核苷酸的数目的方法,或提供调整的rna的方法获得的调整的rna。更优选地,如本文所述协调本发明组合物中包含的至少两个rna种类的序列中a和/或u核苷酸的数目。在优选的实施方案中,根据本发明的组合物包含至少两个rna种类,例如至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个或至少10个rna种类,其中通过相对于原始rna序列中a和/或u核苷酸的数目改变至少一个rna种类的序列中a和/或u核苷酸的数目来调整只是一个rna种类的序列,其中两个(或多于两个)rna种类中a和/或u核苷酸的数目彼此优选相差不超过1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、30个、35个、40个、45个、50个、55个、60个、65个、70个、75个、80个、85个、90个、95个、100个、110个、120个、130个、140个、150个。在优选的实施方案中,rna种类中的a和/或u核苷酸的数目彼此优选相差不大于2个,更优选相差不大于3个,甚至更优选相差不大于4个,甚至更优选相差不大于5个,最优选不大于6个。在另一个优选的实施方案中,rna种类中a和/或u核苷酸的数目彼此相差不大于10个,优选相差不大于20个,更优选相差不大于30个,甚至更优选相差不大于40个,最优选不大于50个。特别优选的是,两个或多于两个rna种类中a和/或u核苷酸的数目相同。优选地,本发明的组合物包含或组成为至少一种本文所述的调整的rna(种类)和药学上可接受的载剂。本文所用的表述“药学上可接受的载剂”优选包括本发明组合物的液体或非液体基质,其优选是药物组合物或疫苗。如果本发明的组合物以液体形式提供,则载剂优选是水,通常是无热原的水;等渗盐水或缓冲(水性)溶液,例如磷酸盐、柠檬酸盐等缓冲溶液。可以使用水或优选缓冲液,更优选水性缓冲液,其包含钠盐,优选至少50mm的钠盐;钙盐,优选至少0.01mm的钙盐;和任选的钾盐,优选至少3mm的钾盐。根据优选的实施方案,钠盐、钙盐和任选的钾盐可以以它们的卤化物的形式存在,例如氯化物、碘化物或溴化物,以它们的氢氧化物、碳酸盐、碳酸氢盐或硫酸盐等形式存在。不限于此,钠盐的实例包括例如nacl、nai、nabr、na2co3、nahco3、na2so4,任选的钾盐的实例包括例如kcl、ki、kbr、k2co3、khco3、k2so4,钙盐的实例包括例如cacl2、cai2、cabr2、caco3、caso4、ca(oh)2。此外,在缓冲液中可以包含上述阳离子的有机阴离子。此外,也可以使用适合于对人施用的一种或多于一种相容的固体或液体填充剂或稀释剂或包封化合物。这里使用的术语“相容的”是指本发明组合物的成分能够以不发生相互作用的方式与组合物的至少一种(调整的)rna(种类)混合,这将显著降低本发明组合物在典型使用条件下的生物活性或药物有效性。当然,药学上可接受的载剂、填充剂和稀释剂必须具有足够高的纯度和足够低的毒性,以使它们适合施用于待治疗的人。可用作药学上可接受的载剂、填充剂或其成分的化合物的一些实例是糖,例如乳糖、葡萄糖、海藻糖和蔗糖;淀粉,例如玉米淀粉或马铃薯淀粉;葡萄糖;纤维素及其衍生物,例如羧甲基纤维素钠、乙基纤维素、乙酸纤维素;黄芪粉;麦芽;明胶;脂;固体助流剂,例如硬脂酸、硬脂酸镁;硫酸钙;植物油,例如花生油、棉籽油、芝麻油、橄榄油、玉米油和可可豆油;多元醇,例如聚丙二醇、甘油、山梨糖醇、甘露糖醇和聚乙二醇;海藻酸。可以包含在组合物中的其他添加剂是乳化剂,例如吐温;润湿剂,例如月桂基硫酸钠;着色剂;调味剂、药物载剂;片形成剂;稳定剂;抗氧化剂;防腐剂。在一个优选的实施方案中,包含在本本文定义的组合物、药物组合物、疫苗中的本文定义的(调整的)rna与一种或多于一种阳离子或聚阳离子化合物复合或至少部分复合或结合,优选与阳离子或聚阳离子聚合物、阳离子或聚阳离子多糖、阳离子或聚阳离子脂质、阳离子或聚阳离子蛋白质、阳离子或聚阳离子肽或其任意组合复合或至少部分复合或结合。如本文所用的术语“阳离子或聚阳离子化合物”将被本领域普通技术人员所认识和理解,并且例如意在指带电荷的分子,其在约1至9的ph值下、在约3至8的ph值下、在约4至8的ph值下、在约5至8的ph值下,更优选在约6至8的ph值下,更优选在约7至8的ph值下,最优选在生理ph下例如在约7.2至约7.5的ph值下带正电荷。因此,阳离子组分,例如阳离子肽、阳离子蛋白质、阳离子聚合物、阳离子多糖、阳离子脂质可以是在生理条件下带正电荷的任何带正电荷的化合物或聚合物。“阳离子或聚阳离子肽或蛋白质”可包含至少一种带正电荷的氨基酸,或多于一种带正电荷的氨基酸,例如选自arg、his、lys或orn的氨基酸。因此,“聚阳离子”组分也在给定条件下处于具有多于一个正电荷的范围内。在本文中特别优选的阳离子或聚阳离子化合物可以选自下列阳离子或聚阳离子肽或蛋白质或其片段:鱼精蛋白、核苷酸、精胺或亚精胺、或其他阳离子肽或蛋白质例如聚-l-赖氨酸(pll)、聚精氨酸、碱性多肽、细胞穿透肽(cpp),包括hiv结合肽、hiv-1tat(hiv)、tat衍生肽、穿膜肽(penetratin)、vp22衍生肽或类似肽、hsvvp22(单纯疱疹)、map、kala或蛋白质转导域(ptd)、ppt620、富含脯氨酸的肽、富含精氨酸的肽、富含赖氨酸的肽、mpg肽、pep-1、l-寡聚物、降钙素肽、触角足基因衍生的肽、pantp、pis1、fgf、乳铁蛋白、转运素、抗菌肽-2、bac715-24、synb、synb(1)、pvec、hct衍生的肽、sap或组蛋白。更优选地,本文定义的核酸,优选本文定义的mrna与一种或多于一种聚阳离子,优选与鱼精蛋白或oligofectamine,最优选与鱼精蛋白复合。在这种情况下,鱼精蛋白是特别优选的。可以用作转染剂或复合剂的其他优选的阳离子或聚阳离子化合物可以包括阳离子多糖,例如壳聚糖、聚芳烃等;阳离子脂质,例如dotma、dmrie、二-c14-脒、dotim、saint、dc-chol、bgtc、ctap、dopc、dodap、dope:二油基磷脂酰乙醇胺、dospa、dodab、doic、dmepc、dogs、dimri、dotap、dc-6-14、clip1、clip6、clip9、oligofectamine;或阳离子或聚阳离子聚合物,例如改性的聚氨基酸如β-氨基酸聚合物或反向聚酰胺等、改性的聚乙烯如pvp等、改性的丙烯酸酯如pdmaema等、改性的酰胺基胺如pamam等、改性的聚β氨基酯(pbae)如二胺端基改性的1,4-丁二醇二丙烯酸酯-co-5-氨基-1-戊醇聚合物等、树枝状聚合物如聚丙烯胺树枝状聚合物或基于pamam的树枝状聚合物等、聚亚胺如pei、聚(丙烯亚胺)等、聚烯丙胺、基于糖骨架的聚合物如基于环糊精的聚合物、基于葡聚糖的聚合物等、基于silan骨架的聚合物如pmoxa-pdms共聚物等、由一种或多于一种阳离子嵌段(例如选自如上所述的阳离子聚合物)和一种或多于一种亲水或疏水嵌段(例如聚乙二醇)的组合组成的嵌段聚合物;等。在实施方案中,组合物或疫苗包含至少一种本文所述的(调整的)rna,其与一种或多于一种聚阳离子化合物和/或聚合物运载体,以及至少一种游离rna复合,其中至少一种复合的rna优选与本发明的至少一个rna种类相同。如本文中所使用的术语“聚合物运载体”将被本领域普通技术人员所认识和理解,并且例如旨在指促进另一种化合物(货物)的运输和/或复合的化合物。聚合物运载体通常是由聚合物形成的运载体。聚合物运载体可以通过共价或非共价相互作用与其货物(核酸,rna)结合。在这种情况下,特别优选的是,本发明组合物的至少一种rna至少部分地与阳离子或聚阳离子化合物和/或聚合物运载体,优选阳离子蛋白质或肽复合。在这种情况下,wo2010/037539和wo2012/113513的公开内容通过引用并入本文。部分地是指仅一部分人工核酸与阳离子化合物复合,而其余的人工核酸为非复合形式(“游离”)(包含在本发明的药物组合物、免疫原性组合物中)。还优选的阳离子或聚阳离子蛋白或肽可以衍生自专利申请wo2009/030481的式(arg)l;(lys)m;(his)n;(orn)o;(xaa)x,与其相关的wo2009/030481的公开内容通过引用并入本文。根据一个优选的实施方案,本发明的组合物包含本文定义的rna和聚合物运载体。根据本发明使用的聚合物运载体可以是由二硫键交联的阳离子组分形成的运载体。二硫键交联的阳离子组分可以彼此相同或不同。运载体还可包含其他组分。还特别优选地,根据本发明使用的聚合物运载体还包含阳离子肽、蛋白质或聚合物和任选的如本文定义的其他组分的混合物,它们通过如本文所述的二硫键交联。在本文中,优选的是专利申请wo2012/013326的根据式{(arg)1;(lys)m;(his)n;(orn)o;(xaa′)x(cys)y}和式cys,{(arg)1;(lys)m;(his)n;(orn)o;(xaa)x}cys2,与其相关的wo2012/013326的公开内容通过引用并入本文。在另一个具体实施方案中,可用于复合本文所定义的rna或包含在本发明(药物)组合物或疫苗中的任何其他核酸的聚合物运载体可衍生自专利申请wo2011/026641的式(l-p1-s-[s-p2-s]n-s-p3-l)的聚合物运载体分子,wo2011/026641的公开内容通过引用并入本文。在其他实施方案中,组合物(优选为组合物、药物组合物或疫苗)包含至少一种本文所述的人工核酸,其中所述至少一种人工核酸与聚合物运载体和任选的至少一种脂质组分复合或结合,该脂质组分如pct申请pct/ep2016/06322、pct/ep2016/063227、pct/ep2016/063229、pct/ep2016/063226中所述。在此上下文中,pct/ep2016/06322、pct/ep2016/063227、pct/ep2016/063229、pct/ep2016/063226的公开内容通过引用并入本文。在优选的实施方案中,聚合物运载体化合物包含肽元件cysarg12cys或cysarg12或trparg12cys或由其形成或组成。在特别优选的实施方案中,聚合物运载体化合物由(r12c)-(r12c)二聚体、(wr12c)-(wr12c)二聚体或(cr12)-(cr12c)-(cr12)三聚体组成,其中各个二聚体(例如(wr12c))或三聚体(例如(cr12))中的肽元件通过-sh基团连接。在实施方案中,当复合的(调整的)rna与作为运载体化合物的阳离子或聚阳离子肽或蛋白质复合时,复合的rna的氮/磷酸比为约0.1至约20、或约0.2至约15、或约2至约15、或约2至约12,其中n/p比定义为阳离子肽或聚合物的碱性基团的氮原子与核酸,优选rna的磷酸基团的摩尔比。因此,本文定义的组合物包含至少一种本文定义的rna,其中至少一种人工核酸,优选本文定义的rna,与一种或多于一种本文定义的阳离子或聚阳离子化合物,优选鱼精蛋白的n/p比为约0.1至20,包括约0.3至4、约0.5至2、约0.7至2和约0.7至1.5。合适地,本文所定义的至少一种rna与本文所定义的一种或多于一种阳离子或聚阳离子化合物复合,其中核酸和阳离子或聚阳离子化合物和/或聚合物运载体的重量比选自约6∶1(重量/重量)至约0.25∶1(重量/重量),更优选约5∶1(重量/重量)至约0.5∶1(重量/重量),甚至更优选约4∶1(重量/重量)至约1∶1(重量/重量)或约3∶1(重量/重量)至约1∶1(重量/重量),最优选约3∶1(重量/重量)至约2∶1(重量/重量);或者任选地,核酸与阳离子或聚阳离子组分和/或聚合物运载体的氮/磷酸比为约0.1至10,优选约0.3至4或0.3至1,最优选约0.5至1或0.7至1,甚至最优选约0.3至0.9或0.5至0.9。在这种情况下,特别优选将本文定义的至少一个rna种类与鱼精蛋白复合。合适地,通过以2∶1的rna与鱼精蛋白重量/重量比(重量/重量)将鱼精蛋白-海藻糖溶液添加到rna样品中来将复合的rna与鱼精蛋白复合。在优选的实施方案中,本文定义的组合物、药物组合物、疫苗包含与一种或多于一种阳离子或聚阳离子化合物(例如鱼精蛋白)复合的至少一种本文定义的rna和至少一种游离rna。在优选的实施方案中,至少一种复合的rna(例如与鱼精蛋白复合的rna)与至少一种游离rna相同。优选地,辅助组分的rna(例如与鱼精蛋白复合的rna)与游离核酸,特别是游离rna的摩尔比可以选自约0.001∶1至约1∶0.001的摩尔比,包括约1∶1的比。优选地,辅助组分的复合的rna(例如与鱼精蛋白复合的rna)与游离核酸,特别是游离rna的比可以选自约5∶1(重量/重量)至约1∶10(重量/重量),更优选选自约4∶1(重量/重量)至约1∶8(重量/重量),甚至更优选约3∶1(重量/重量)至约1∶5(重量/重量)或1∶3(重量/重量),其中该比例最优选为约1∶1(重量/重量)。关于本文定义的包含辅助组分(例如,与鱼精蛋白复合的rna)和游离rna组分的组合物,wo2009/144230的公开内容通过引用并入本文。可以使用wo2016/165825中公开的手段和方法产生包含本文定义的辅助组分(例如与鱼精蛋白复合的rna)和本文定义的游离rna组分的此类组合物。在优选的实施方案中,组合物(优选药物组合物、疫苗)包含至少一种如本文所述的(调整的)rna,其中至少一种rna与一种或多于一种脂质(例如阳离子脂质和/或中性脂质)复合或结合,从而形成脂质体、脂质纳米颗粒(lnp)、脂质复合体(lipoplex)和/或纳米脂质体。在本发明上下文中,术语“脂质纳米颗粒”,也称为“lnp”,不限于任何特定的形态,并且包括当阳离子脂质和任选的一种或多于一种其他脂质在例如水性环境中和/或存在rna的情况下组合时生成的任何形态。例如,脂质体、脂质复合物、脂质复合体等在脂质纳米颗粒(lnp)的范围内。lnp通常包含阳离子脂质和一种或多于一种选自中性脂质、带电荷脂质、类固醇和聚合物缀合脂质(例如peg化脂质)的赋形剂。rna可以被包封在lnp的脂质部分中或被包封在lnp的一些或整个脂质部分包围的水性空间中。rna或其一部分也可以与lnp结合并复合。lnp可以包含能够形成颗粒的任何脂质,该脂质与核酸连接或该脂质内包封有一个或多于一个核酸。优选地,包含核酸的lnp包含一种或多于一种阳离子脂质和一种或多于一种稳定化脂质。稳定化脂质包括中性脂质和peg化脂质。在一个实施方案中,lnp基本上组成为(i)至少一种阳离子脂质;(ii)中性脂质;(iii)固醇,例如胆固醇;(iv)peg脂质,例如peg-dmg或peg-cdma,其中摩尔比为约20%至60%阳离子脂质:5%至25%中性脂质:25%至55%固醇;0.5%至15%peg脂质。在这种情况下,优选的固醇是胆固醇。固醇可以是脂质颗粒的约10摩尔%至约60摩尔%或约25摩尔%至约40摩尔%。在一个实施方案中,固醇占脂质颗粒中存在的总脂质的约10摩尔%、15摩尔%、20摩尔%、25摩尔%、30摩尔%、35摩尔%、40摩尔%、45摩尔%、50摩尔%、55摩尔%或约60摩尔%。在另一个实施方案中,lnp包含约5%至约50%以摩尔基准计的固醇,例如约15%至约45%、约20%至约40%、约48%、约40%、约38.5%、约35%、约34.4%、约31.5%或约31%以摩尔基准计的固醇(基于脂质纳米颗粒中脂质的100%总摩尔)。lnp的阳离子脂质可以是可阳离子化的,即当ph降低到脂质的可电离基团的pk以下时,脂质会质子化,但在较高的ph值下逐渐变为中性。在低于pk的ph值下,脂质能够与带负电荷的核酸结合。在某些实施方案中,阳离子脂质包括在ph降低时呈现正电荷的两性离子脂质。lnp可以包含任何其他阳离子或可阳离子化的脂质,即,在选择性ph,例如生理ph下带有净正电荷的多种脂质中的任一种。这样的脂质包括但不限于n,n-二油基-n,n-二甲基氯化铵(dodac);和n-(2,3-二油基氧基)丙基)-n,n,n-三甲基氯化铵(dotma);n,n-二硬脂基-n,n-二甲基溴化铵(ddab);n-(2,3-二油酰基氧基)丙基)-n,n,n-三甲基氯化铵(dotap);3-(n-(n′,n′二甲基氨基乙烷)-氨基甲酰基)胆固醇(dc-chol)、n-(1-(2,3-二油酰氧基)丙基)n-2-(精胺羧酰胺基)乙基-n,n-二甲基三氟乙酸铵(dospa)、二十八烷基酰胺基糖基羧精胺(dogs)、1,2-二油酰基-3-二甲基铵丙烷(dodap)、n,n-二甲基-2,3-二油酰氧基)丙胺(dodma)和n-(1,2-二肉豆蔻基氧基丙-3-基)-n,n-二甲基-n-羟乙基溴化铵(dmrie)。另外,可获得许多可用于本发明的阳离子脂质的商业制剂。这些包括例如,(可商购获得的阳离子脂质体,其包含dotma和1,2-二油酰基-sn-3磷酸乙醇胺(dope),购自纽约州格兰德岛的gibco/brl);(可商购获得的阳离子脂质体,其包含n-(1-(2,3-二油酰基氧基)丙基)-n-(2-(精胺甲酰氨基)乙基)-n,n-二甲基三氟乙酸铵(dospa)和(dope),购自gibco/brl);和(可商购获得的阳离子脂质,其包含在乙醇中的二十八烷基酰胺基糖基羧基精胺(dogs),购自威斯康星州麦迪逊市的promegacorp.)。以下脂质为阳离子型,并且在低于生理ph值的情况下具有正电荷:dodap、dodma、dmdma、1,2-二亚油基氧基-n,n-二甲基氨基丙烷(dlindma)、1,2-二亚麻基氧基-n,n-二甲基氨基丙烷(dlendma)。阳离子脂质还可以是氨基脂质。代表性的氨基脂质包括但不限于,1,2-二亚油基氧基-3-(二甲基氨基)乙酰氧基丙烷(dlin-dac)、1,2-二亚油基氧基-3吗啉代丙烷(dlin-ma)、1,2-二亚油基-3-二甲基氨基丙烷(dlindap)、1,2-二亚油基硫代-3-二甲基氨基丙烷(dlin-s-dma)、1-亚油基-2-亚油基氧基-3二甲基氨基丙烷(dlin-2-dmap)、1,2-二亚油基氧基-3-三甲基氨基丙烷氯化物盐(dlin-tma.cl)、1,2-二亚油基-3-三甲基氨基丙烷氯化物盐(dlin-tap.cl)、1,2-二亚油酰氧基-3-(n-甲基哌嗪)丙烷(dlin-mpz)、3-(n,n-二亚油基氨基)-1,2-丙二醇(dlinap)、3-(n,n-二油酰基氨基)-1,2-丙二醇(doap)、1,2-二亚油基氧基-3-(2-n,n-二甲基氨基)乙氧基丙烷(dlin-eg-dma)和2,2-二亚油基-4-二甲基氨基甲基-[1,3]-二氧戊环(dlin-k-dma)、2,2-二亚油基-4-(2-二甲基氨基乙基)-[1,3]-二氧戊环(dlin-kc2-dma);二亚油基-甲基-4-二甲基氨基丁酸酯(dlin-mc3-dma);mc3(us20100324120)。在wo2009/086558、wo2009/127060、wo2010/048536、wo2010/054406、wo2010/088537、wo2010/129709、wo2011/153493、us2011/0256175、us2012/0128760、us2012/0027803、和us8158601中公开了其他适合的(阳离子)脂质。在该上下文中,wo2009/086558、wo2009/127060、wo2010/048536、wo2010/054406、wo2010/088537、wo2010/129709、wo2011/153493、us2011/0256175、us2012/0128760、us2012/0027803、和us8158601的公开内容通过引用并入本文。在一个特别优选的实施方案中,lnp包含根据专利申请pct/ep2016/075929的具有式(iii)的阳离子脂质。在此上下文中,关于阳离子脂质的pct/ep2016/075929的公开内容通过引用并入本文。可以根据核酸货物的量来选择永久性阳离子脂质或类脂质的量。在一个实施方案中,选择这些量以使得纳米颗粒或组合物的n/p比为约0.1至约20。在本文中,n/p比定义为脂质或类脂质的碱性含氮基团的氮原子(“n”)与用作货物的rna的磷酸基团(“p”)的摩尔比。n/p比可以基于例如1μgrna通常包含约3nmol磷酸残基来计算,条件是该rna表现出碱基的统计分布。脂质或类脂质的“n”值可基于其分子量和永久性阳离子基团和可阳离子化基团(如果存在)的相对含量进行计算。在某些实施方案中,lnp包含一种或多于一种另外的脂质,其在颗粒形成期间稳定化颗粒的形成。适合的稳定化脂质包括中性脂质和阴离子脂质。术语“中性脂质”是指在生理ph下以不带电荷或中性两性离子形式存在的多种脂质中的任一种。代表性的中性脂质包括二酰基磷脂酰胆碱、二酰基磷脂酰乙醇胺、神经酰胺、鞘磷脂、二氢鞘磷脂、脑磷脂和脑苷脂。示例性的中性脂质包括例如,二硬脂酰磷脂酰胆碱(dspc)、二油酰磷脂酰胆碱(dopc)、二棕榈酰磷脂酰胆碱(dppc)、二油酰磷脂酰甘油(dopg)、二棕榈酰磷脂酰甘油(dppg)、二油酰磷脂酰乙醇胺(dope)、棕榈酰油酰磷脂酰胆碱(popc)、棕榈酰油酰磷脂酰乙醇胺(pope)和二油酰基磷脂酰乙醇胺4-(n-马来酰亚胺基甲基)-环己烷-1-羧酸酯(dope-mal)、二棕榈酰磷脂酰乙醇胺(dppe)、二肉豆蔻酰磷脂酰乙醇胺(dmpe)、二硬脂酰基-磷脂酰乙醇胺(dspe)、16-o-单甲基pe、16-o-二甲基pe、18-1-反式pe、1-硬脂酰基-2-油酰基磷脂酰乙醇胺(sope)和1,2-二反油酰基-sn-甘油-3-磷酸乙醇胺(反式dope)。在一个实施方案中,中性脂质是1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(dspc)。在一些实施方案中,lnp包含选自dspc、dppc、dmpc、dopc、popc、dope和sm的中性脂质。在各种实施方案中,阳离子脂质与中性脂质的摩尔比为约2∶1至约8∶1。通过在lnp表面添加亲水性聚合物涂层例如聚乙二醇(peg),以赋予空间稳定性可以改变lnp体内特性和行为。此外,通过将配体(例如抗体、肽和碳水化合物)附着于lnp表面或附着于附着的peg链的末端(例如通过peg化脂质),可将lnp用于特异性靶向。在一些实施方案中,lnp包含聚合物缀合的脂质。术语“聚合物缀合的脂质”是指既包含脂质部分又包含聚合物部分的分子。聚合物缀合的脂质的实例是peg化脂质。术语“peg化脂质”是指既包含脂质部分又包含聚乙二醇部分的分子。peg化脂质是本领域已知的,并且包括1-(单甲氧基-聚乙二醇)-2,3-二肉豆蔻基甘油(peg-s-dmg)等。在某些实施方案中,lnp包含另外的稳定化脂质,其是聚乙二醇脂质(peg化脂质)。合适的聚乙二醇脂质包括peg改性的磷脂酰乙醇胺、peg改性的磷脂酸、peg改性的神经酰胺(例如peg-cerc14或peg-cerc20)、peg改性的二烷基胺、peg改性的二酰基甘油、peg改性的二烷基甘油。代表性的聚乙二醇脂质包括peg-c-domg、peg-c-dma和peg-s-dmg。在一个实施方案中,聚乙二醇脂质是n-[(甲氧基聚(乙二醇)2000)氨基甲酰基]-1,2-二肉豆蔻基氧丙基-3-胺(peg-c-dma)。在一个实施方案中,聚乙二醇脂质是peg-c-domg。在其他实施方案中,lnp包含peg化的二酰基甘油(peg-dag),例如1-(单甲氧基-聚乙二醇)-2,3-二肉豆蔻基甘油(peg-dmg)、peg化的磷脂酰乙醇胺(peg-pe)、peg琥珀酸二酰基甘油(peg-s-dag),例如4-o-(2′,3′-二(十四烷酰氧基)丙基-1-o-(ω-甲氧基(聚乙氧基)乙基)丁二酸酯(peg-s-dmg)、聚乙二醇化神经酰胺(peg-cer)、或peg二烷氧基丙基氨基甲酸酯,例如ω-甲氧基(聚乙氧基)乙基-n-(2,3二(十四烷氧基)丙基)氨基甲酸酯或2,3-二(十四烷氧基)丙基-n-(ω-甲氧基(聚乙氧基)乙基)氨基甲酸酯。在各种实施方案中,阳离子脂质与peg化脂质的摩尔比为约100∶1至约25∶1。核酸的总量,特别是脂质纳米颗粒中的rna的总量是变化的,并且可以根据例如rna与总脂质的重量/重量比来确定。在本发明的一个实施方案中,rna与总脂质的比小于0.06重量/重量,优选为0.03重量/重量至0.04重量/重量。包含至少一种(调整的)rna的本发明的组合物、药物组合物或疫苗可以以液体和/或干燥(例如冻干)形式提供。在一个优选的实施方案中,本发明的rna或组合物以冻干形式提供。因此,rna和组合物提供了储存rna和组合物的可能性(不考虑环境温度,也不需要冷却),所述rna和组合物适合于针对例如感染性疾病如流感病毒或诺如病毒感染进行疫苗接种。优选地,至少一种冻干的rna或组合物在使用前,例如向对象施用前,在合适的缓冲液中重构,有利地基于水性载剂,例如林格乳酸溶液进行重构。在一个优选的实施方案中,组合物是药物组合物或疫苗,其通常包含安全有效量的至少一种本文定义的(调整的)rna。如本文所用,“安全有效量”是指如上所定义的组合物或疫苗的rna的量,其足以显著诱导针对例如本文所述感染性疾病,例如流感病毒感染的免疫应答。然而,同时,“安全有效量”足够小以避免严重的副作用,也就是说,获得优势和风险之间的合理关系。这些限制的确定通常在合理的医学判断范围之内。就疫苗或组合物而言,表述“安全有效量”优选是指适于刺激适应性免疫系统的rna的量,其方式是不产生过度或破坏性免疫反应,但优选也不产生低于可测量水平的免疫反应。如上定义的组合物或疫苗的rna的这种“安全有效量”可以进一步选择,例如根据rna的类型,例如单顺反子、双顺反子或甚至多顺反子的mrna进行选择,因为双顺反子或甚至多顺反子mrna可以导致编码多肽的表达显著高于使用等量的单顺反子mrna。在随行医生的知识和经验范围内,上述组合物或疫苗的rna的“安全有效量”还可以根据治疗的具体目的以及待治疗患者的年龄和身体状况以及类似因素而变化。根据本发明的疫苗或组合物可以根据本发明用于人类以及用于兽医医学目的,作为药物组合物或作为疫苗。在一个优选的实施方案中,根据本发明的组合物、疫苗或试剂盒的rna以冻干形式提供。优选地,冻干的rna在施用前在合适的缓冲液中重构,有利地基于水性载剂,例如乳酸林格溶液(其是优选的)、林格溶液、磷酸盐缓冲液进行重构。根据一个优选的实施方案,适于注射的缓冲液可以用作本发明的疫苗或组合物的载剂或用于重悬本发明的疫苗或本发明的组合物。适于注射的这种缓冲液可以是例如本文所述的液体或非液体基质/载剂。乳酸林格溶液特别优选作为液体基质。药学上可接受的载剂的选择原则上取决于疫苗或组合物的施用方式。疫苗或组合物可以例如全身或局部施用。全身性施用途径通常包括例如透皮、经口、胃肠外途径,包括皮下、静脉内、肌内、动脉内、真皮内和腹膜内注射和/或鼻内施用途径。局部施用途径一般包括例如局部施用途径,但也包括真皮内、透皮、皮下或肌内注射或病变内、颅内、肺内、心内、和舌下注射。更优选地,疫苗或组合物可以通过皮内、皮下或肌内途径,优选通过注射施用,其可以是无针和/或有针注射。因此,组合物/疫苗优选以液体或固体形式配制。可以通过动物模型的常规实验来确定待施用的疫苗或组合物的合适量。这样的模型包括但不限于兔、绵羊、小鼠、大鼠、狗和非人灵长类动物模型。用于注射的优选的单位剂型包括水、生理盐水或其混合物的无菌溶液。这种溶液的ph值应调节到约7.4。合适的注射用载剂包括水凝胶、控释或缓释系统、聚乳酸和胶原蛋白基质。用于局部施用的合适的药学上可接受的载剂包括那些适合用于洗剂、乳霜、凝胶等的载剂。如果疫苗是经口施用,则片剂、胶囊剂等是优选的单位剂型。可用于经口施用的用于制备单位剂型的药学上可接受的载剂是现有技术中众所周知的。其选择将取决于次要考虑因素,例如味道、成本和可储存性,这对于本发明的目的不是关键的,并且本领域技术人员可以容易地选择。根据另一个实施方案,(药物)组合物或疫苗可以包含佐剂。可以使用佐剂,例如以增强疫苗或组合物的免疫刺激特性。在本文中,佐剂可以理解为适合于支持施用和递送根据本发明的疫苗或组合物的任何化合物。此外,此类佐剂可以但不限于,引发或增加先天性免疫系统的免疫应答,即非特异性免疫应答。换句话说,当施用时,由于疫苗或组合物中包含的至少一种抗原性肽或蛋白质,根据本发明的疫苗或组合物通常引发适应性免疫应答。另外,由于将如本文所定义的佐剂添加到根据本发明的疫苗或组合物中,因此根据本发明的疫苗或组合物可以产生(支持性)先天免疫应答。这样的佐剂可以选自技术人员已知的并且适合于当前情况的任何佐剂,即支持在哺乳动物中诱导免疫应答的佐剂。优选地,佐剂可以选自但不限于,tdm、mdp、胞壁酰二肽、普朗尼克、明矾溶液、氢氧化铝、adjumertm(聚磷腈);磷酸铝凝胶;来自海藻的葡聚糖;algammulin;氢氧化铝凝胶(明矾);高蛋白吸附氢氧化铝凝胶;低黏度氢氧化铝凝胶;af或spt(角鲨烷(5%)、吐温80(0.2%)、普朗尼克l121(1.25%)、磷酸盐缓冲盐水的乳液,ph7.4);avridinetm(丙二胺);bayr1005tm((n-(2-脱氧-2-l-亮氨酰氨基-b-d-吡喃葡萄糖基)-n-十八烷基-十二烷酰-酰胺氢乙酸盐);calcitrioltm(1-α,25-二羟基维生素d3);磷酸钙凝胶;captm(磷酸钙纳米颗粒);霍乱全毒素、霍乱毒素-a1-蛋白-ad-片段融合蛋白、霍乱毒素的亚基b;crl1005(嵌段共聚物p1205);含细胞因子的脂质体;dda(二甲基二十八烷基溴化铵);dhea(脱氢表雄酮);dmpc(二肉豆蔻酰磷脂酰胆碱);dmpg(二肉豆蔻酰磷脂酰甘油);doc/铝复合物(脱氧胆酸钠盐);弗氏完全佐剂;弗氏不完全佐剂;γ菊粉;gerbu佐剂(下述的混合物:i)n-乙酰基氨基葡萄糖氨基-(p1-4)-n-乙酰基胞壁酰-l-丙氨酰-d-谷氨酰胺(gmdp)、ii)二甲基二十八烷基氯化铵(dda)、iii)锌-l-脯氨酸盐复合物(znpro-8);gm-csf);gmdp(n-乙酰基氨基葡萄糖基-(b1-4)-n-乙酰基胞壁酰-l-丙氨酰基-d-异谷氨酰胺);咪喹莫特(1-(2-甲基丙基)-1h-咪唑并[4,5-c]喹啉-4-胺);immthertm(n-乙酰氨基葡糖基-n-乙酰基胞壁酰-l-ala-d-异glu-l-ala-甘油二棕榈酸酯);drv(由脱水-再水合囊泡制备的免疫脂质体);干扰素γ;白介素1β;白介素2;白介素7;白介素12;iscomstm;iscoprep7.0.3.tm;脂质体;loxoribinetm(7-烯丙基-8-氧代鸟苷);lt口服佐剂(大肠杆菌不稳定肠毒素-原毒素);任何组成的微球和微粒;mf59tmtm;(角鲨烯水乳液);montanideisa51tm(纯化的不完全);montanideisa720tm(可代谢的油性佐剂);mpltm(3-q-脱酰基-4’-单磷酰基脂质a);mtp-pe和mtp-pe脂质体((n-乙酰基-l-丙氨酰-d-异谷氨酰基-l-丙氨酸-2-(1,2-二棕榈酰-sn-甘油-3-(羟基磷酰氧基))-乙基酰胺、单钠盐);murametidetm(nac-mur-l-ala-d-gln-och3);murapalmitinetm和d-murapalmitinetm(nac-mur-l-thr-d-异gin-sn-甘油二棕榈酰);nago(神经氨酸酶-半乳糖氧化酶);任何组成的纳米球体或纳米颗粒;nisv(非离子表面活性剂囊泡);pleurantm(β-葡聚糖);plga、pga和pla(乳酸和乙醇酸的均聚物和共聚物;微球体/纳米球体);pluronicl121tm;pmma(聚甲基甲基丙烯酸酯);poddstm(类蛋白微球体);聚乙烯氨基甲酸酯衍生物;聚-ra:聚-ru(多聚腺苷酸-多聚尿苷酸复合物);聚山梨酸酯80(吐温80);蛋白螺旋体(proteincochleate)(avantipolarlipids,inc.,alabaster,al);stimulontm(qs-21);quil-a(quil-a皂苷);s-28463(4-氨基-otec-二甲基-2-乙氧基甲基-1h-咪唑并[4,5-c]喹啉-1-乙醇);saf-1tm(“syntex佐剂制剂”);仙台脂蛋白体和包含仙台的脂质基质;司盘-85(三油酸山梨坦);specol(marcol52、司盘85和吐温85的乳液);角鲨烯或(2,6,10,15,19,23-六甲基二十四烷和2,6,10,15,19,23-六甲基-2,6,10,14,18,22-二十四碳己烷);硬脂酰酪氨酸(十八烷基酪氨酸盐酸盐);(n-乙酰基葡糖胺基-n-乙酰基胞壁酰-l-ala-d-异glu-l-ala二棕榈氧基丙酰胺);theronyl-mdp(termurtidetm或[thrl]-mdp;n-乙酰基胞壁酰-l-苏氨酰-d-异谷氨酰胺);ty颗粒(ty-vlp或病毒样颗粒);walter-reed脂质体(包含吸附在氢氧化铝上的脂质a的脂质体)、和脂肽,包括pam3cys,特别是铝盐,例如adju-phos、alhydrogel、rehydragel;乳液,包括cfa、saf、ifa、mf59、provax、titermax、montanide、vaxfectin;共聚物,包括optivax(crl1005)、l121、泊洛沙姆4010)等;脂质体,包括stealth、螺旋体(cochleate),包括bioral;植物衍生的佐剂,包括qs21、quila、iscomatrix、iscom;适合于共刺激的佐剂,包括番茄素(tomatine)、生物聚合物,包括plg、pmm、菊粉;微生物衍生的佐剂,包括罗莫肽(romurtide)、detox、mpl、cws、甘露糖、cpg核酸序列、cpg7909、人tlr1-10的配体、鼠tlr1-13的配体、iss-1018、35ic31、咪唑并喹啉、安普利近、ribi529、imoxine、iriv、vlp、霍乱毒素、热不稳定的毒素、pam3cys、鞭毛蛋白、gpi锚、lnfpiii/lewisx、抗菌肽、uc-1v150、rsv融合蛋白、cdigmp;和适合作为拮抗剂的佐剂,包括cgrp神经肽。wo2016/203025中还提供了可以适合使用的其他佐剂。关于为了增强根据本发明组合物的免疫刺激性而可能包含的合适佐剂,根据wo2016/203025的权利要求7和/或权利要求17的佐剂以及与之相关的公开内容通过引用包含于本文。在某些实施方案中,如本文所定义的组合物、药物组合物、免疫原性组合物可包含至少一种佐剂,其中至少一种佐剂可以是分别在wo2008014979和wo2009095226中公开的具有式glxmgn的核酸佐剂或具有式clxmcn的核酸佐剂,相关公开内容通过引用并入本文。疫苗或组合物可以另外包含一种或多于一种辅助物质,以进一步提高免疫原性。由此优选地实现了如本文所定义的组合物或疫苗的rna和辅助物质的协同作用,所述辅助物质可以任选地与如上所述的疫苗或组合物共同配制(或单独配制)。在这方面,取决于各种类型的辅助物质,可以考虑各种机制。例如,允许树突状细胞(dc)成熟的化合物,例如脂多糖、tnf-α或cd40配体,形成第一类合适的辅助物质。通常,可以将任何以“危险信号”(lps,gp96等)或细胞因子例如gm-cfs的方式影响免疫系统的试剂用作辅助物质,该“危险信号”或细胞因子可以有针对性地增强和/或影响由根据本发明的免疫刺激性佐剂所产生的免疫应答。特别优选的辅助物质是细胞因子,例如单核因子、淋巴因子、白介素或趋化因子,除了通过编码的至少一种抗原诱导适应性免疫应答之外,其也促进先天免疫应答,细胞因子例如为il-1、il-2、il-3、il-4、il-5、il-6、il-7、il-8、il-9、il-10、il-12、il-13、il-14、il-15、il-16、il-17、il-18、il-19、il-20、il-21、il-22、il-23、il-24、il-25、il-26、il-27、il-28、il-29、il-30、il-31、il-32、il-33、inf-α、ifn-β、inf-γ、gm-csf、g-csf、m-csf、lt-β或tnf-α、生长因子例如hgh。优选地,这样的免疫原性增强剂或化合物是分开提供的(不与本发明的疫苗或组合物共同配制),并且是分开施用的。疫苗或组合物还可以额外含有任何其他化合物,该化合物已知由于其对人toll样受体tlr1、tlr2、tlr3、tlr4、tlr5、tlr6、tlr7、tlr8、tlr9、tlr10的结合亲和力(作为配体),或由于其对鼠toll样受体tlr1、tlr2、tlr3、tlr4、tlr5、tlr6、tlr7、tlr8、tlr9、tlr10、tlr11、tlr12或tlr13的结合亲和力(作为配体),因此是免疫刺激性的。在本文中可以添加到疫苗或组合物中的另一类化合物可以是cpg核酸,特别是cpg-rna或cpg-dna。cpg-rna或cpg-dna可以是单链cpg-dna(sscpg-dna)、双链cpg-dna(dsdna)、单链cpg-rna(sscpg-rna)或双链cpg-rna(dscpg-rna)。cpg核酸优选为cpg-rna的形式,更优选为单链cpg-rna(sscpg-rna)的形式。cpg核酸优选包含至少一个或多于一个(促有丝分裂)胞嘧啶/鸟嘌呤二核苷酸序列(cpg基序)。根据第一优选替代方案,包含在这些序列中的至少一个cpg基序,即cpg基序的c(胞嘧啶)和g(鸟嘌呤),是未甲基化的。这些序列中任选包含的所有其他胞嘧啶或鸟嘌呤可以是甲基化的或未甲基化的。然而,根据另一个优选的替代方案,cpg基序的c(胞嘧啶)和g(鸟嘌呤)也可以甲基化形式存在。优选地,将上述化合物与包含根据本发明的rna的上述组合物或疫苗(本发明的疫苗)分开配制和施用。根据一个优选的实施方案,根据本发明的组合物包含至少两个rna种类,其中通过相对于原始rna序列中a和/或u核苷酸的数目改变至少一个rna种类的序列中a和/或u核苷酸的数目来调整至少一个rna种类的序列,其中至少一个rna种类包含至少一个编码区,该编码区编码至少一种衍生自诺如病毒的肽或蛋白质、或所述肽或蛋白质的片段或变体。优选地,本发明组合物中的至少一种调整的rna包含至少一个编码区,其编码衍生自诺如病毒的肽或蛋白质、或所述肽或蛋白质的片段或变体。更优选地,至少一个编码区编码衍生自如本文所述的诺如病毒的肽或蛋白质、或其片段或变体。在一些实施方案中,本发明的组合物是诺如病毒疫苗,更优选多价诺如病毒疫苗。合适的诺如病毒抗原和衍生自诺如病毒的抗原性肽或蛋白质在国际专利申请pct/ep2017/060673中描述,该专利申请通过引用整体并入本文。在优选的实施方案中,本文所用的rna(种类),优选待调整的原始rna(种类)或已调整的rna(种类),包含至少一个编码区,该编码区编码包含或组成为如pct/ep2017/060673中所述的seqidno:1至4410中任一个的氨基酸序列或这些氨基酸序列中任一个的片段或变体的肽或蛋白质(衍生自诺如病毒)。根据一些实施方案,本文所用的rna(种类),优选待调整的原始rna(种类),包含至少一个编码区,该编码区包含或组成为如pct/ep2017/060673中所述的seqidno:4411至39690、39713至39746中任一个的核酸序列或这些核酸序列中任一个的片段或变体。在进一步优选的实施方案中,根据本发明的组合物是多价诺如病毒疫苗,其包含至少两个rna种类,其中通过相对于原始rna序列中a和/或u核苷酸的数目改变至少一个rna种类序列中a和/或u核苷酸的数目来调整至少一个rna种类的序列,其中至少一个rna种类包含至少一个编码区,该编码区编码至少一种来衍生自诺如病毒的肽或蛋白质或所述肽或蛋白质的片段或变体,并且其中至少一个rna种类包含至少一个编码区,该编码区编码不同的衍生自诺如病毒的肽或蛋白质或所述肽或蛋白质的片段或变体。在一个特别优选的实施方案中,根据本发明的组合物是多价诺如病毒疫苗,其包含a)至少一个、或多个、或至少多于一个rna种类,其包含至少一个编码区,该编码区包含或组成为至少一个如在pct/ep2017/060673中描述的seqidno:4411至39690、39713至39746中任一个的核酸序列、或这些核酸序列中任一个的片段或变体;和b)至少一个、或多个、或至少多于一个的调整rna种类,其包含至少一个编码区,该编码区编码至少一种衍生自诺如病毒的肽或蛋白质、或所述肽或蛋白质的片段或变体,至少一个编码区优选包含或组成为编码如pct/ep2017/060673中所述的seqidno:1至4410的氨基酸序列的至少一种调整的核酸序列、或这些核酸序列中任一个的片段或变体。根据一个特别优选的实施方案,根据本发明的组合物包含至少两个rna种类,其中通过相对于原始rna序列中a和/或u核苷酸的数目改变至少一个rna种类的序列中a和/或u核苷酸的数目来调整至少一种rna种类的序列,其中至少一个rna种类包含至少一个编码区,该编码区编码至少一种衍生自流感病毒的肽或蛋白质、或所述肽或蛋白质的片段或变体。优选地,本发明组合物中的至少一种调整的rna包含至少一个编码区,其编码衍生自流感病毒的肽或蛋白质、或所述肽或蛋白质的片段或变体。更优选地,至少一个编码区编码衍生自如本文所述的流感病毒的肽或蛋白质、或其片段或变体。在一些实施方案中,本发明的组合物是流感病毒疫苗,更优选多价流疫苗。在一个优选的实施方案中,组合物包含至少两个如本文所述的rna种类,其中至少一个rna种类包含至少一个编码区,其编码至少一种选自流感病毒的血凝素(ha)和/或神经氨酸酶(na)的抗原、或其片段或变体。更优选地,rna的至少一个编码区编码至少一种衍生自流感病毒的血凝素(ha)和/或神经氨酸酶(na)的抗原性肽或蛋白质、或其片段或变体。在这种情况下,血凝素(ha)和神经氨酸酶(na)可以选自相同的流感病毒或不同的流感病毒(或分别选自不同的流感病毒株)。在国际专利申请pct/ep2016/075862和pct/ep2017/060663中描述了衍生自流感病毒的合适的流感抗原和抗原性肽或蛋白质,其通过引用整体并入本文。优选地,本发明组合物中的至少一个rna(种类),优选待调整的原始rna(种类)或调整的rna(种类)包含至少一个编码区,其编码包含或组成为根据pct/ep2017/060663中所述的seqidno:1至30504、213713、213738、213739、213787、213792、213797、213802、213996至214023、214100至214127、214212至214239、214316至214343、214420至214447、214524至214551、214628至214655、214732至214759、214836至214863、214940至214967、215044、215049至215076、215161、215166至215193、215278、215283至215310、215395、215400至215427、215512、215517至215544中任一个的氨基酸序列或这些氨基酸序列中任一个的片段或变体的肽或蛋白质。根据一些实施方案,本发明组合物中的至少一个rna(种类),优选待调整的原始rna(种类)包含至少一个编码区,该编码区包含或组成为根据pct/ep2017/060663中所述的seqidno:30505至213528、213529至213557、213740至213746、213788、213789、213793、213794、213798、213799、213803、213804、214024至214051、214128至214155、214240至214267、214344至214371、214448至214475、214552至214579、214656至214683、214760至214787、214864至214891、214968至214995、215045、215046、215077至215104、215162、215163、215194至215221、215279、215280、215311至215338、215396、215397、215428至215455、215513、215514、215545至215572、215629、215632、215638至215835、215892、215836至215889中任一个的核酸序列,或这些核酸序列中任何一个的片段或变体。根据一个特别优选的实施方案,本发明组合物中的至少一个rna种类,优选调整的rna种类包含至少一个编码区,该编码区包含或组成为如本文所公开的seqidno:26至14079、14080至16264、16265至28640、28641至30568中任一个的核酸序列、或这些核酸序列中的任一个的片段或变体。在进一步优选的实施方案中,根据本发明的组合物是多价流感病毒疫苗,其包含至少两个rna种类,其中通过相对于原始rna序列中a和/或u核苷酸的数目改变至少一个rna种类序列中a和/或u核苷酸的数目来调整至少一个rna种类的序列,其中至少一个rna种类包含至少一个编码区,该编码区编码至少一种衍生自流感病毒的肽或蛋白质或所述肽或蛋白质的片段或变体,并且其中至少一个rna种类包含至少一个编码区,该编码区编码不同的衍生自流感病毒的肽或蛋白质或所述肽或蛋白质的片段或变体。更优选地,组合物包含至少一个编码衍生自流感病毒ha的肽或蛋白质或其片段或变体的rna种类、和至少一个编码衍生自流感病毒na的肽或蛋白质或其片段或变体的rna种类,其中至少一个所述rna种类是本文所述的调整的rna。在一个特别优选的实施方案中,根据本发明的组合物是多价流感病毒疫苗,其包含a)至少一个、或多个、或至少多于一个的rna种类,其包含至少一个编码区,该编码区包含或组成为至少一个如pct/ep2017/060663中所述的根据seqidno:30505至213528、213529至213557、213740至213746、213788、213789、213793、213794、213798、213799、213803、213804、214024至214051、214128至214155、214240至214267、214344至214371、214448至214475、214552至214579、214656至214683、214760至214787、214864至214891、214968至214995、215045、215046、215077至215104、215162、215163、215194至215221、215279、215280、215311至215338、215396、215397、215428至215455、215513、215514、215545至215572、215629、215632、215638至215835、215892、215836至215889中任一个的核酸序列,或这些核酸序列中任何一个的片段或变体;和b)至少一个、或多个、或至少多于一个调整的rna种类,其包含至少一个编码区,该编码区编码至少一种衍生自流感病毒的肽或蛋白质,或所述肽或蛋白质的片段或变体,至少一个编码区优选包含或组成为至少一个根据本文公开的seqidno:26至14079、14080至16264、16265至28640、28641至30568中任一个的核酸序列、或这些核酸序列中任一个的片段或变体。制备rna组合物的方法本发明的另一个方面涉及一种用于制备本文所述的rna组合物的方法。该方法优选用于产生包含至少两个rna种类的rna组合物,优选(多价)疫苗,其中至少一个rna种类的序列已经通过改变至少一个调整的rna种类的序列中a和/或u核苷酸的数目而被调整,该序列的调整优选如本文所述,更优选如本文关于改变rna在色谱柱上的保留时间的方法、从至少两个rna种类的混合物中纯化至少一个rna种类的方法、从包含至少两个rna种类的混合物中共纯化至少两个rna种类的方法、协调至少两个rna种类的序列中a和/或u核苷酸的数目的方法、提供调整的rna的方法、或本文所述的组合物或疫苗所述的。在一个优选的实施方案中,该方法提供了一种系统,其允许快速和有效地制备包含至少两个rna种类的组合物,所述rna种类选自rna种类库。从rna种类/序列的库开始,可以通过本文提出的方法快速地变换组合物的至少两个rna种类。图3和实施例7也说明了这一概念。例如,在多价流感疫苗的情况下,根据au调整的rna序列库,可以容易地被变换编码抗原,例如ha和/或na抗原的rna种类(“+”:向rna混合物中加入新的rna种类;“-”:从混合物中除去rna种类)以用于例如季节性流感疫苗的制备(见图3;a:季节a;b:季节b;c:季节c)。以这种方式,该方法允许流感疫苗的快速季节性调整。概述的概念也适用于其他快速调整的病原体,例如诺如病毒,并且可用于基于快速调整的rna的诺如病毒疫苗。因此,该方法可以优选地包括调整包含在组合物中的至少一个rna序列的序列的步骤。制备rna的方法是本领域已知的并且在本文中描述。试剂盒根据另一方面,本发明还提供了试剂盒,特别是试剂盒套装,其包含至少一种根据本发明的(调整的)rna(种类)、包含至少一种根据本发明的(调整的)rna(种类)的组合物、任选的用于增溶的液体载剂、和任选的关于本文所述的(调整的)rna(种类)的施用和剂量的信息技术说明。优选地,在试剂盒的单独部分中提供如本文所述的(调整的)rna(种类)或包含至少一种根据本发明的(调整的)rna(种类)的组合物,其中优选将如本文所述的(调整的)rna(种类)或包含至少一种(调整的)rna(种类)的组合物冻干。更优选地,试剂盒还包含用于溶解如本文所述的rna、包含至少一种根据本发明的rna(种类)的组合物的载剂作为一部分,载剂优选为乳酸林格溶液。以上任何试剂盒均可用于本文定义的治疗或预防。更优选地,上述试剂盒中的任何一种都可以用作疫苗,优选用于抵抗感染性疾病如流感病毒感染或诺如病毒感染的疫苗。(医学)用途和应用:此外,本发明提供了根据本发明的(调整的)rna(种类)、包含至少一种根据本发明的(调整的)rna(种类)的组合物/疫苗或包含其的试剂盒的几种应用和用途。特别地,(药物)组合物或疫苗可用于人类,也可用于兽类医药学目的,优选用于人类医药学目的,一般作为药物组合物或作为疫苗。因此,在另一方面,本发明涉及如本文定义的根据本发明的(调整的)rna(种类),包含至少一种根据本发明的(调整的)rna(种类)的组合物/疫苗或试剂盒或试剂盒套装作为药物的第一药用。特别地,本发明提供了如本文所定义的至少一种(调整的)rna(种类)或如本文所述的其片段或变体在制备药物中的用途。根据另一方面,本发明涉及如本文所述的根据本发明的(调整的)rna(种类)、包含至少一种根据本发明的(调整的)rna(种类)的组合物或试剂盒或试剂盒套装用于治疗流感病毒感染的第二药用。特别地,本发明提供了用于制备药物的本文所述的至少一种(调整的)rna(种类),其中如本文所述的(调整的)rna(种类)优选与药学上可接受的载剂和任选的附加佐剂以及任选的如本文所定义的其他附加组分一起配制。进一步,本发明涉及如本文所述的根据本发明的(调整的)rna(种类)、包含至少一种根据本发明的(调整的)rna(种类)的组合物或试剂盒或试剂盒套装用于治疗诺如病毒感染的第二药用。特别地,本发明提供了用于制备药物的本文所述的至少一种(调整的)rna(种类),其中如本文所述的(调整的)rna(种类)优选与药学上可接受的载剂和任选的附加佐剂以及任选的如本文所定义的其他附加组分一起配制。可以例如全身或局部施用包含至少一种根据本发明的(调整的)rna(种类)的组合物或疫苗。全身性施用途径通常包括例如透皮、经口、胃肠外途径,包括皮下、静脉内、肌内、动脉内、真皮内和腹膜内注射和/或鼻内施用途径。局部施用途径一般包括例如局部施用途径,但也包括真皮内、透皮、皮下或肌内注射或病变内、颅内、肺内、心内、和舌下注射。更优选地,可以通过皮内、皮下或肌内途径施用疫苗。在另一方面,本发明提供了一种治疗或预防疾病的方法,其中所述疾病优选为流感病毒或诺如病毒的感染、或与流感病毒或诺如病毒的感染有关的疾病,其中所述方法包括对有需要的对象施用根据本发明的(调整的)rna(种类)、包含至少一种根据本发明的(调整的)rna(种类)的本发明的组合物、或本发明的试剂盒或试剂盒套装。特别地,这种方法可以优选地包括以下步骤:a)提供如本文所述的根据本发明的(调整的)rna(种类)、包含至少一种根据本发明的(调整的)rna(种类)的疫苗/组合物、或本发明的试剂盒或试剂盒套装;和b)将如本文所述的本发明的(调整的)rna(种类)、包含至少一种本发明的(调整的)rna(种类)的疫苗/组合物、或试剂盒或试剂盒套装应用于或施用于组织或生物体。附图说明图1:说明了与hplc共纯化和/或共分析rna混合物相关的技术问题。显示了hplc直方图(包含不同rna分子种类的rna混合物)的示意图。图1a和图1b:rna混合物的rna分子种类的区别在于保留时间不同。杂质如流产序列不能彼此分离。另外,由于直方图部分重叠,因此无法确定质量属性,例如各个种类的完整性。图1a显示了混合物中每个rna种类的单独直方图。图1c和图1d:在极少数情况下,rna混合物中的三个rna种类可能具有相似的保留时间,并且杂质如流产序列可能会彼此分离。另外,由于峰完全重叠,因此可以确定质量属性,例如整个rna混合物的完整性。图1c显示了混合物中每个rna种类的独立直方图。图1e:rna种类具有不同的保留时间。由于直方图彼此完全分开,因此可以确定质量属性,例如rna混合物中单个rna种类的完整性。图2:说明了调整编码短蛋白(氨基酸序列:awhpvac)的给定核酸序列以增加au计数或减少au计数的基本原理。图2a:作为调整方法/算法的第一步,对核酸序列的所有密码子进行分类,并为每个单独的密码子分配具有替代密码子的潜在交换(表1和表2列出了允许增加或减少au计数的密码子变化)。在图2a中,如果相应的密码子发生了相应的变化,则标有星号(*)的密码子可增加au计数;如果相应的密码子发生了相应的变化,则标有井号(#)的密码子可减少au计数;标有叉号(“x”)的密码子不会导致au计数的变化。图2b显示了将输入核酸序列调整为au计数增加的目标序列。可能被替代密码子替换的所有四个密码子都被更改为具有更大au计数的密码子(突出显示的密码子)。图2c显示了将输入核酸序列调整为au减少的目标序列。可能被替代密码子替换的所有三个密码子都被更改为具有更小au计数的密码子(突出显示的密码子)。图3:说明了本发明的多价/多功能mrna疫苗平台(例如流感)的模块化设计原理,其中rna种类可以快速变化而无需改变制备条件(hplc纯化和/或hplc分析)。根据au调整的rna序列库,编码抗原的rna种类,例如ha和/或na抗原,可以容易地被交换(“+”:向rna混合物中加入新的rna种类;“-”:从混合物中除去rna种类)以用于例如季节性流感疫苗的生产(a:季节a;b:季节b;c:季节c)。总体构思也可以用于例如诺如病毒抗原。图4:显示了rna序列中腺嘌呤核苷酸的数目与hplc保留时间相关。制备编码其中多聚腺嘌呤核苷酸大小不同的萤火虫萤光素酶的rna种类(1-4),并通过hplc进行单独分析。hplc色谱图叠加。1=a25;2=a35;3=a50;4=a64。实施例1中提供了实验的详细说明。图5:显示了rna序列中腺嘌呤核苷酸数目的调整实现了hplc保留时间的协调。图5a:显示了编码ha-b布里斯班的腺嘌呤调整的rna序列(叠加)。图5b:显示了编码ha-b普吉岛的腺嘌呤调整的rna序列(叠加)。(1)未调整的序列;(2)在cds中引入了9个腺嘌呤;(3)在utr中添加了9个腺嘌呤片段或(4)在多聚腺苷酸中添加了9个腺嘌呤。实施例2中提供了实验的详细说明。图6:显示了调整腺嘌呤计数使编码ha-a的rna序列和编码ha-b的rna序列的hplc保留时间达到协调。通过相应地增加a计数,使编码ha-b的rna序列被调整至匹配ha-arna序列的a计数。星号表示hplc峰完全重叠(峰的下降斜率决定了保留时间)。注:出于图6的目的,不需要区分各个色谱图。实施例2中提供了实验的详细说明。图7:表明hplc是用于rna混合物共分析的一种特别合适的方法。通过hplc分析不同比例的完整rna和降解rna的rna混合物。图7a:不同rna混合物的hplc色谱图的重叠显示了完整rna的量。图7b:不同rna混合物的hplc色谱图的重叠显示了降解rna的量。注:出于图7的目的,不需要区分各个色谱图。实施例3中提供了实验的详细说明。图8:显示了腺嘌呤调整的rna混合物(编码三种不同的na抗原)产生一个离散的hplc峰,适用于共分析和共纯化。图8a:显示了各个未调整的rna序列(1-3)和所得未调整的rna混合物(4)的hplc直方图。图8b:显示了单个序列的调整的rna序列(1-3)的hplc直方图和所得协调的rna混合物(4)的hplc直方图。实施例4中提供了实验的详细说明。图9:进一步显示了技术问题。由于au计数不同,编码甲型流感病毒和乙型流感病毒的ha和na的rna种类具有部分重叠的hplc色谱图,这说明了本领域中的问题,即这种rna混合物(包括所有七个rna种类)的共纯化和/或共分析在技术上是不可能的。1=编码乙型流感病毒的神经氨酸酶(na-b,布里斯班)的rna种类;2=两个编码甲型流感病毒的神经氨酸酶(na-a,香港、加利福尼亚)的rna种类;3=两个编码乙型流感病毒的血凝素(ha-b,布里斯班、普吉岛)的rna种类;两种编码甲型流感病毒的血凝素(ha-a,香港、加利福尼亚)的rna分子。实施例5中提供了实验的详细说明。图10:显示了腺嘌呤和/或尿嘧啶计数与hplc保留时间相关。图10a:显示了不同ha和narna种类的a和/或u的总数/计数和au含量(%)相对于hplc上rna保留时间的关系。a和/或u的总数/计数与hplc保留时间相关,而au含量与hplc保留时间不相关。图10b:显示了不同ha和narna种类的g和/或c的总数/计数和gc含量(%)相对于hplc上rna保留时间的关系。鸟嘌呤/胞嘧啶(g/c)计数和含量(%)均与hplc保留时间无关。实施例5中提供了实验的详细说明。图11:显示了包含三个不同rna分子种类的rna混合物的序列调整策略。必须将两个产物峰移动17个au或40个au(移动的峰:虚线)以获得序列调整的rna混合物,其中三个成分中的每一个都可以在hplc上共分析(调整序列的au计数差:70个au)。实施例6中提供了实验的详细说明。图12:具有不同au计数的构建体在整体式乙基乙烯基苯-二乙烯基苯共聚物上的hplc色谱图的重叠。显示了流速和梯度曲线。第一个峰对应于au计数为824的构建体,第二个峰对应于au计数为894的构建体,第三个峰对应于au计数为1137的构建体,第四个峰对应于au计数为1139的构建体,最后一个峰对应于一个au计数为1424的构建体。实施例8中提供了实验的详细说明。图13:具有不同au计数的构建体在颗粒型聚(苯乙烯)-二乙烯基苯(pvd)柱上的hplc色谱图的叠加。显示了流速和梯度曲线。第一个峰对应于au计数为824的构建体,第二个峰对应于au计数为894的构建体,第三个峰对应于au计数为1137的构建体,第四个峰对应于au计数为1139的构建体,最后一个峰对应于au计数为1424的构建体。实施例8中提供了实验的详细说明。图14:具有不同au计数的构建体在基于二氧化硅的c4色谱柱上的hplc色谱图的叠加。显示了流速和梯度曲线。第一个峰对应于au计数为824的构建体,第二个峰对应于au计数为894的构建体,第三个峰对应于au计数为1137的构建体,第四个峰对应于au计数为1139的构建体,最后一个峰对应于一个au计数为1424的构建体。实施例8中提供了实验的详细说明。图15:具有不同au计数的构建体在plpr-s色谱柱上的hplc色谱图的叠加。显示了流速和梯度曲线。第一个峰对应于au计数为824的构建体,第二个峰对应于au计数为894的构建体,第三个峰对应于au计数为1137的构建体,第四个峰对应于au计数为1139的构建体,最后一个峰对应于一个au计数为1424的构建体。实施例8中提供了实验的详细说明。图16:实施例8的代表性hplc运行的分离因子α相对于au计数差异的图。整体:流速为0.5的针对整体式乙基乙烯基苯-二乙烯基苯共聚物的值和相应趋势线,参见图12;pvd:流速为0.3的针对颗粒型聚苯乙烯-二乙烯基苯(pvd)色谱柱的值和相应趋势线,参见图13;c4-f1:流速为1.0的针对基于二氧化硅的c4色谱柱的值和相应趋势线,参见图14;plpr-s:流速为1.0的针对plpr-s色谱柱的值和相应趋势线,参见图15。实施例8中提供了实验的详细说明。实施例以下所示的实施例仅是示例性的,并且将进一步描述本发明。这些实施例不应解释为将本发明限制于此。表3:所用材料u3000uhplc系统thermoscientifichplc柱聚(苯乙烯-二乙烯基苯)基质)thermoscientificwfifreseniuskabi,ampuwa乙腈(ms级)fisherscientificwfi中的0.1mteaa(洗脱液a)0.1mteaa中的25%acn(洗脱液b)实施例1:检查核苷酸的均聚物片段与hplc保留时间之间的相关性发明人出人意料地发现,不是rna的大小,而是rna的腺嘌呤核苷酸(a核苷酸)和/或尿嘧啶核苷酸(u核苷酸)的总数影响hplc保留时间。下面提供了更多详细信息。1.1.制备编码包含不同腺嘌呤片段的萤火虫萤光素酶的dna:将编码萤火虫萤光素酶蛋白的dna序列导入修饰的puc19衍生的载体骨架中,以包含衍生自32l4核糖体蛋白的5′-utr(32l4top5′-utr)和衍生自白蛋白的3′-utr、组蛋白茎环结构、以及在3′末端的不同数目的腺嘌呤核苷酸片段(以下也称为“多聚腺嘌呤核苷酸片段”或“a均聚物”)。序列表中提供了完整的rna序列(请参见下表4)。表4:实验中使用的构建体使用ecori将dna质粒线性化,并在适当的缓冲液条件下,在核苷酸混合物和帽类似物存在的情况下,使用dna依赖性t7rna聚合酶进行体外转录。如wo2008/077592a1中所述使用纯化获得的各个rna产物,随后使用hplc进行分析。1.2hplc保留时间的确定:使用注射用水(wfi)将各个rna样品稀释至0.1g/l。将10μl稀释的rna样品注入hplc柱(整体式聚(苯乙烯-二乙烯基苯)基质)中。使用以下条件进行rphplc分析:梯度1:缓冲液a(0.1mteaa(ph7.0));缓冲液b(0.1mteaa(ph7.0),含有25%乙腈)。从30%的缓冲液b开始,在2分钟内使梯度扩展到32%的缓冲液b,然后在15分钟内以1ml/min的流速扩展到55%的缓冲液b(根据wo2008/077592进行调整)。在260nm的波长处记录色谱图。一方面为了检查核苷酸均聚物片段的存在与存在程度,另一方面为了检查其与hplc保留时间之间的最终相关性,将每个hplc分析运行的色谱图进行叠加。图4显示了具有不同腺嘌呤核苷酸片段的rna的hplc运行叠加图。结果如图4所示,对不同的rna分子种类(区别仅在于a核苷酸均聚物片段长度(即a核苷酸总数)的hplc保留时间的分析表明,rna序列中a核苷酸的总数和hplc保留时间之间存在明显的相关性。较长的a均聚物导致保留时间增加,这表明观察到的对hplc保留时间的影响是由于a核苷酸数目的增加(+25个腺嘌呤核苷酸;+35个腺嘌呤核苷酸;+50个腺嘌呤核苷酸;+64个腺嘌呤核苷酸)引起的。值得注意的是,胞嘧啶核苷酸(c核苷酸)总数的变化对hplc保留时间没有影响(未显示)。因为仅a核苷酸的数目而不是c核苷酸的数目影响hplc保留时间,所以可以排除仅由rna分子种类的延长所引起的作用。实施例2:通过调整腺嘌呤计数来协调不同harna序列的hplc保留时间以进行共纯化和/或共分析发明人出人意料地发现,对两个或多于两个不同rna种类(例如,包含编码流感ha-b的不同序列的rna分子)中a核苷酸总数的调整适合于协调hplc保留时间,从而使共纯化和/或共分析分析变得可行。下面提供了更多详细信息。2.1.调整a核苷酸的总数:如前面的实施例所示,rna序列中a核苷酸的数目与相应的hplc保留时间之间存在相关性,因此对编码ha抗原的rna序列(编码流感ha的四种不同rna序列)进行了调整,以使它们包含(基本上)相同数目的a核苷酸。通过利用遗传密码的简并性(与表1和表2相比)或通过将腺嘌呤片段引入多聚腺苷酸尾部或rna分子种类的utr中,可以以编码的氨基酸序列保持不变的方式进行序列调整。目的是通过在hplc中获得四个色谱图的完全重叠(协调),以有助于共纯化和/或共分析包含不同harna分子种类的rna混合物的方式来调整序列,这是基于rna混合物的流感疫苗的成本有效和快速生产的先决条件(例如,用于开发多价流感rna疫苗平台,参见图3)。为了协调编码不同ha抗原(ha-a和ha-b)的所有rna分子种类的保留时间,通过调整编码序列(通过密码子变换)、延长聚腺苷酸序列、或将另外的a核苷酸引入utr区中来增加a核苷酸的数目,从而调整编码流感病毒b的不同ha蛋白的gc优化的dna序列(请参见下表5)。通过使ha-b序列中的a核苷酸的总数增加9个来进行调整,以使ha-b序列中a核苷酸的总数更接近ha-a序列中a核苷酸的数目。如实施例1所述制备dna构建体和rna。表5:实验中使用的ha构建体*rna的a计数:各个rna中a核苷酸的总数**rna的au计数:各个rna中a和u核苷酸的总数2.2.a核苷酸的总数对hplc保留时间的影响:如实施例1所述进行hplc样品制备和hplc分析。为了检查a核苷酸数目对hplc保留时间的影响,对每个rna种类的色谱图进行叠加和分析。图5a显示了编码ha-b/布里斯班的rna分子种类的四个叠加色谱图(一个未调整序列(1)和三个调整的序列(分别为2、3和4))。图5b显示了编码ha-b/普吉岛的rna分子种类的四个叠加色谱图(一个未调整序列(1)和三个调整的序列(分别为2、3和4))。图6显示了编码ha-b/布里斯班的调整rna分子种类(通过密码子变换将9个腺嘌呤引入cds中)、编码ha-b/普吉特的调整的rna分子种类、和编码ha-a的两个未调整的rna分子种类(ha-a加利福尼亚州;ha-a香港)的叠加色谱图。结果:结果表明,通过添加9个腺嘌呤对rna序列中a核苷酸数目的调整(见图5a和图5b)导致了hplc保留时间的改变。如图5a和图5b所示,a片段的作用(无论是引入utr中还是引入聚腺苷酸尾中)对保留时间的影响略微更强。图6显示,ha-b序列已成功调整,并且ha-a峰和ha-b峰是协调的。序列的这种调整产生完全重叠的hplc峰,从而可以对混合物中单个rna种类进行共分析,并可以同时确定混合物中rna的完整性。此外,hplc保留时间的协调允许同时进行rna纯化(共纯化)。值得注意的是,如实施例5中进一步分析和解释的,如图6所观察到的,ha-a序列和调整的ha-b序列出乎意料的精确重叠也可以解释为各个rna序列的a核苷酸和u核苷酸数目(au计数)的紧密匹配(ha-b布里斯班:au计数732;ha-b普吉岛:au计数726;ha-a加利福尼亚:au计数737;ha-a香港:au计数729;参见表4)。实施例3:评价hplc对rna混合物进行共分析的适用性发明人表明,hplc是用于rna混合物的共分析的特别合适的方法。下面提供了更多详细信息。3.1.测试rna的制备:根据实施例1制备用于测试hplc系统的rna。3.2.rna的直接降解和不同完整性的rna混合物的制备:rna样品在90℃下降解140分钟。随后,将完整的rna和降解的rna以不同的完整rna:降解的rna的比例(90∶10、80∶20、70∶30、60∶40、50∶50、40∶60、30∶70、20∶80、和10∶90)混合并将完整性不相同的各个rna混合物应用于分析型hplc。如实施例1所述进行分析型hplc。为了分析,将不同rna混合物的hplc运行叠加。结果示于表7。结果:如图7所示,可以在以下情况下确定rna混合物的rna完整性:rna混合物具有相同的保留时间(协调的rna峰;在完整的rna和降解的rna的情况下的各个rna组分的峰完全重叠)。因此,该分析系统适用于分析根据本发明的(多价)rna混合物。实施例4:通过调整a核苷酸的数目来协调narna序列的hplc保留时间以进行共纯化和/或共分析发明人出人意料地发现,包含具有调整数目的a核苷酸的rna种类的rna混合物(编码三种不同的na抗原)产生了一个适合于共分析和共纯化的协调的hplc峰。下面提供了更多详细信息。4.1.编码几种流感病毒株na蛋白的dna中a核苷酸数目的调整:目的是通过获得三个色谱图的完全重叠图以促进不同narna分子种类的rna混合物的共纯化和/或共分析的方式来调整narna序列,这是基于rna混合物的流感疫苗的低成本和快速有效生产的先决条件(例如,用于开发多价流感rna疫苗,请参见图3)。为了协调编码不同na抗原的所有rna分子种类的保留时间,通过改变编码序列(密码子变换;请参见下表6)来减少a核苷酸的数目,从而调整编码流感病毒的不同na蛋白的gc优化的dna序列。为了减少编码nah3n2的rna和编码nah1n1的mrna中a核苷酸的数目以使其基本匹配编码na流感b的rna中a核苷酸的数目,进行了调整。如实施例1中所述制备dna构建体和rna。表6:实验中使用的na构建体4.2.a核苷酸数目对hplc保留时间的影响:如实施例1所述进行hplc样品制备和hplc分析。为了检查a核苷酸数目对hplc保留时间的影响,对未调整的rna种类的色谱图进行叠加和分析。此外,将未调整的rna分子种类混合(各100ng),作为混合物应用,并通过hplc进行分析(请参见图8a)。另外,将调整的nah3n2(香港)rna、调整的nah3n2(加利福尼亚)rna和na流感b(布里斯班)rna混合(各100ng),作为混合物应用,并通过hplc进行分析(见图8b)。图8a显示了编码na的未调整的rna分子种类的叠加色谱图(1、2、3),紧邻相应的rna混合物的色谱图(4)。图8b显示了协调的narna混合物的色谱图(4)。结果结果表明,rna混合物的各个rna序列中a核苷酸数目的调整导致了rna混合物的保留时间的调整和离散的hplc峰(见图8b),这允许进行共分析和共纯化(即使各个hplc峰显示出轻微变化)。相比之下,未调整的rna混合物产生不适合共分析和共纯化的宽的非离散的hplc双峰(请参见图8b)。值得注意的是,seqidno:17和19中的a核苷酸数目的调整(减少)是通过将丝氨酸密码子agc改变为密码子ucc来实现的,这导致了a计数的减少和u计数的增加(因此au计数是稳定的;a∶u之比降低),这表明观察到的单独分析的调整序列的hplc色谱图的轻微变化是由a∶u之比的变化引起的。因此,a∶u之比的调整也可以用于根据本发明的序列调整。实施例5:检查核苷酸对hplc保留时间的影响如前面的实施例所示,rna序列中a核苷酸数目的调整实现了hplc色谱图的协调,这是共分析和/或共纯化的要求。发明人进一步发现,a和/或u核苷酸的数目与hplc保留时间相关。这一发现为调整rna序列和协调rna混合物的hplc色谱图提供了更多选择。下面提供了更多详细信息。5.1.制备编码几种流感病毒株ha蛋白的dna:如实施例1所述,生成了编码不同的血凝素(ha)和神经氨酸酶(na)蛋白(在流感病毒(流感a和流感b)表面上发现的两种糖蛋白)的dna序列,并制备rna。表7:实验中使用的ha构建体:编码的抗原seqidno:ha-a加利福尼亚13ha-a香港14ha-b布里斯班5ha-b普吉岛9nah1n1(加利福尼亚)18nah3n2(香港)16na流感b(布里斯班)155.2.核苷酸总数和/或核苷酸相对含量与hplc保留时间之间的相关性:如实施例1所述进行hplc样品制备和hplc分析。第一步,在hplc上分别分析单独制备的编码ha和na抗原的rna构建体(rna种类)。叠加的hplc色谱图如图9所示。七个不同rna种类的色谱图叠加表明,所有色谱图部分重叠,这使得通过hplc进行共纯化和共分析在技术上是不可能的(比较说明本领域中的问题,图1)。为了更好地理解核苷酸序列对hplc保留时间的影响,检查了每个rna分子种类的核苷酸计数(a、u、g和c)和核苷酸含量与hplc保留时间之间的相关性。图10a显示了不同ha和narna种类的a和u核苷酸的数目和含量(au%)与它们各自的hplc保留时间之间的相关性。图10b显示了不同ha和narna种类的鸟嘌呤(g)和胞嘧啶(c)核苷酸的数目和含量(gc%)与它们各自的hplc保留时间之间的相关性。结果:图10a显示了a和/或u核苷酸的数目与各自的保留时间的明确相关性。对于a和u核苷酸的含量(au%),未发现这种相关性。图10b显示了hplc保留时间既不受g和/或c核苷酸数目的影响,也不受g和/或c核苷酸含量(gc%)的影响。值得注意的是,a核苷酸数目与保留时间之间的相关性强于u核苷酸数目与保留时间之间的相关性;与此相应,实施例4的结果还表明,a核苷酸对保留时间的影响强于u核苷酸对保留时间的影响。总体而言,a和u核苷酸的数目显示出最佳的相关性,并且将为调整rna序列提供最精确的方法,以协调rna混合物以进行共分析和共纯化。实施例6:开发自动化核苷酸调整方法(算法)发明人开发了一种自动化计算机模拟方法(算法),以将rna序列中任何核苷酸的数目设置为某个确定的值,而不改变氨基酸序列。在本发明的上下文中,将自动化的计算机方法用于rna序列的序列调整(a和/或u核苷酸的数目(au计数)的调整),以允许协调rna混合物,从而用于hplc共分析和/或hplc共纯化。下面提供了更多详细信息。6.1序列分析和目标au计数的定义:该实验的目的是为适合使用hplc进行共分析的调整rna混合物(包含编码抗体的三种不同rna分子种类)生成rna序列。必须在所有rna分子中调整au数目,以使它们各自的hplc色谱图完全分开(au数目相差至少70),以便对其完整性进行共分析。选择三个抗体序列(seqidno:20至22),并产生gc优化的dna(seqidno:23至25)序列(基本上根据实施例1)。确定各个gc优化序列(产物1、产物2、产物3;参见下表8)的核苷酸数目,以能够确定用于hplc共分析的最佳a和u(t)核苷酸数目。表8:gc优化的构建体的核苷酸数目:产物长度a计数t(u)计数at(au)计数seqidno:181191332232258592685243429775513225为了使rna混合物中包含的rna分子种类适合进行hplc共分析,将产物2和产物3的目标au计数设置为以下值,以便在以rna混合物形式进行分析时可以在hplc上进行完整性分析:表9:用于rna混合物共分析的调整策略:如表9所示,每个产物rna的目标au计数以下列方式设置:三个rna序列的au计数相差至少70个核苷酸(图11所示的策略)。6.2au序列调整方法:在下文中,示例性地描述了产物2(+17个au)(seqidno:24)的序列调整方法。由于序列中a核苷酸的数目大于t(u)核苷酸的数目,因此将调整值设置为+8a和+9t(u),以保持a和u核苷酸在所得au调整顺序中的分布。在该方法的初始阶段(算法),为序列中包含的每个密码子创建矩阵,以识别可能的变化(在此称为“交换矩阵”)。式(i)中示出了示例性的“交换矩阵”。式(i):式(i)显示,对于密码子“cga”,变换为替代密码子提供了将a核苷酸的数目增加1(例如:cga->aga)的选项、提供了将c核苷酸的数目增加1(例如cga->cgc)的选项、提供了将g核苷酸的数目增加1(例如cga->cgg)的选项、且提供了将t核苷酸的数目增加1(例如,cga->cgt)的选项。为序列中的每个单个密码子生成交换矩阵。使用所述交换矩阵,确定每个密码子中各个核苷酸的潜在最大数目(分别为a和t(u)计数)(不改变氨基酸序列)。因此,分析了序列的所有63个密码子,并且潜在的替代密码子以如表10所示的表结构的形式组合。表10:能够改变核苷酸数目的替代密码子的示例性表密码子替代密码子cgacgt,cgc,cgg,aga,agggatgacgacgatatg无替代密码子……接下来,将根据seqidno:24的序列迭代地划分为单独的密码子并以表格式存储,这产生了如表11中示例性示出的列表(指示了序列的位置1、2、3、4......86和87)。表11:seqidno:24的密码子列表:密码子位置密码子1atg2agc3atc4atc……85gag87agc接下来,通过逐步迭代来分析密码子列表(参见表11)的可能的密码子变化,其中在每个迭代步骤中,使用各自的交换矩阵(如上所述)分析相应的密码子潜在的核苷酸变化。例如,如果各个密码子理论上不可能有变化,例如,如在“atg”或“tgg”的情况下,则使用式(ii)中示例性示出的相应交换矩阵(交换矩阵的*=0)。式(ii):式(ii)显示,对于密码子“atg”,变换为替代密码子不会增加a核苷酸、c核苷酸、g核苷酸或t核苷酸的数目(因为没有针对atg(met)的替代密码子)。在理论上可以进行根据各个交换矩阵(*>0)的改变的情况下,如果这些改变可以在例如仅调整提供增加a和/或t(u)核苷酸数目的选项的密码子的前提下实施,则进一步分析密码子。因此,构建了目标核苷酸(例如a和/或t(u))和在当前矩阵中可能产生阳性结果(即,a和/或t(u)改变;参见例如式(i))的核苷酸之间的交集。结果,每个密码子被归类并分为三类:类别1(“有利”类):潜在的密码子交换仅允许增加一个目标核苷酸(在本实施例中为a或t(u))。例如,可以将密码子“gac”(asp)更改为“gau”(asp),以增加a和t(u)核苷酸的数目。不需要进一步的分析,因为该修饰对a和t(u)核苷酸的数目没有任何进一步的影响(除了上述提到的影响之外)。类别2(“可能”类):潜在的密码子交换允许两个目标核苷酸的增加(在本示例中为a和t(u))。例如,密码子“gca”可以更改为“gcu”,这会增加t(u)计数,但同时会减少a计数。因此,将需要针对属于该类别的密码子进行进一步分析,以便决定是否应该以减少另一个目标核苷酸(a)的数目为代价来增加本实施例中两个目标核苷酸之一(t(u))的数目。类别3(“不可能”类):rna序列中没有替代密码子的密码子(*=0)。此类别3的实例是atg(met;起始密码子)或“ugg”(trp)。原始序列的所有密码子以此方式分类。在此步骤之后,存在三个类别,共有87个条目(针对seqidno:24中存在的87个密码子)。下一步,不再考虑类别3,因为密码子变化不会影响目标核苷酸计数(a,t(u))。接下来,计算针对所有目标核苷酸(a,t(u))鉴定出了多少潜在的核苷酸变化。对于seqidno:24,列出了可能的核苷酸变化(类别1,类别2;参见表12)。表12:可潜在应用于seqidno24的核苷酸变化核苷酸潜在变化分类a221t151a,t472因此,确定了a的22个有利变化(参见上述类别1/“有利”),t(u)的15个有利变化。由于将调整值设置为+8a和+9t(u),因此密码子位置的调整均来自类别1。表13总结了引入的密码子交换,其在整个序列中平均分布。表13:引入seqidno24中的密码子交换a位置交换a增加t位置交换t(u)增加30aag->aaa+13agc->agt+148aag->aaa+112agc->agt+178aag->aaa+163gac->gat+1141cag->caa+190agc->agt+1165gag->gaa+1102agc->agt+1213gag->gaa+1117aac->aat+1234gag->gaa+1138agc->agt+1252gag->gaa+1150aac->aat+1180agc->agt+1这些交换产生了以下根据seqidno:25的调整序列。在上述实施例中,未实施来自类别2的潜在核苷酸交换。但是,在需要例如大于15的t(u)计数的情况下,使用了类别1的所有密码子后,使用类别2的密码子,以获得针对a和t(u)计数的其他调整可能性。如果需要类别2以实现所需的核苷酸计数,则按以下比例的计算将确定交换核苷酸(核苷酸a或t(u)):其中i代表相应的目标,ci是类别2中i的可能调整位置的计数,xi是i的期望阈值,pi是已经改变的鉴定的调整位置的计数。对所有计算出的比率进行排名,并从最低比率开始到最高比率,应用类别2的更改,直到达到期望阈值或直到执行了类别2的所有可能的交换。当仅通过使用根据类别1进行的交换无法获得期望数目时,将迭代执行此过程以实现所有目标。例如,类别2包含47个密码子(参阅表12),从而可以潜在地进行交换以增加a或t数目。因此,根据类别2实施进一步的改变,直到达到期望阈值或直到也已经使用了来自类别2的所有密码子为止。对于seqidno:24,通过使用下列来自类别2的替代密码子(来自类别1的其他密码子交换未显示):6=att、9=att、21=ctt、144=cct、183=tct,将t(u)计数改变为例如20将导致额外的调整。在不能达到期望的目标核苷酸计数的情况下(因为已经使用了类别1和类别2的所有替代密码子,这意味着不可能有进一步的改变),产生与目标核苷酸计数尽可能接近的调整序列。为了进一步优化上述方法(算法),实施了以下改进:1.在上述实验中使用的基本均等分布是基于交换可能性的。也可以设想其他分布模型,例如正态分布、首次出现分布、最后出现分布或基于随机的分布。替代地,可以确定可能变化的平均值或可能变化的中值,并且可以围绕这些值来设置所有交换。2.交换矩阵包含关于目标序列的密码子的额外信息(例如密码子使用等)。这为是否需要密码子交换创建了进一步的标准,从而有助于调整特定的密码子使用或目标序列中不同的核苷酸比。3.通过应避免被交换的序列或基序(例如限制酶的识别基序、启动子序列或构建不需要的二级结构的序列等)来实施第三类别。4.基于输入序列的长度和所需目标核苷酸的出现,对输入序列进行自动化分箱,以便识别用于a和/或u调整的最佳核苷酸计数。实施例7:用于快速可调的流感疫苗制备的多价流感病毒rna平台的产生和使用将编码ha抗原的gc优化的编码序列库经au调整至612个au(360个a和252个t)的计数,这产生了au调整的ha序列库(seqidno:26至16263)。将编码na抗原的gc优化的编码序列库经au调整至488个au(271个a和217个u)的计数,这产生了au调整的na序列库(seqidno:16264至30567)。基本上如实施例6所述,根据本发明进行了au调整。所述调整使得可以共纯化包含调整的harna序列的rna混合物,并且可以共纯化包含调整的na序列的rna混合物。此外,由于编码ha的rna序列(au计数612个)和编码na的rna序列(au计数488个)产生分离的峰(au计数差:124个),因此该调整允许对包含调整的harna种类和narna种类的rna混合物进行共分析,适合使用hplc分析完整性。harna混合物是根据pct申请wo2017/109134中公开的程序使用gc优化的at调整的dna模板(如实施例1中所述生成)而产生的。简而言之,将dna构建体混合物(每个构建体包含不同的ha编码序列和t7启动子)用作模板,以同时进行rna体外转录从而生成hamrna构建体混合物。随后,将获得的协调rna混合物用于使用rp-hplc的共纯化。在平行反应中,使用gc优化的at调整的dna模板,根据pct申请wo2017/109134中公开的步骤制备narna混合物。简而言之,将dna构建体混合物(每个构建体包含不同的na编码序列和t7启动子)用作模板,以同时进行rna体外转录从而生成hamrna构建体混合物。随后,将获得的协调rna混合物用于使用rp-hplc的共纯化。将纯化的编码ha抗原的mrna混合物和纯化的编码na抗原的mrna混合物混合以制备ha/narna混合物。如本文所述,通过hplc共分析混合物的完整性(即na峰和ha峰的完整性)。有利的是,根据本发明,为了协调色谱峰以用于基于hplc的共纯化和共分析而进行的ha序列和na序列的au调整促进了基于mrna的多价流感疫苗的制备,该疫苗可快速根据需求而调整,例如在季节性流感疫苗设计中或在大流行情况下(与图3相比)。实施例8:方法在各种反相hplc基质上的适用性发明人发现,通过调整a和/或u计数来改变rna的保留时间不限于特定的反相色谱柱化学过程。为了测试是否还可以在其他反相色谱柱上观察到通过调整a和/或u计数而改变保留时间(在实施例1至7中,使用了整体式聚(苯乙烯-二乙烯基苯)基质),以下列柱进行了测试:-整体式乙基乙烯基苯-二乙烯基苯共聚物(thermofisherscientific)(见图13)-颗粒型聚苯乙烯-二乙烯基苯色谱柱(thermofisherscientific)(见图14)-基于二氧化硅的c4柱(thermofisherscientific)(见图15)-plrps,非烷基化多孔聚(苯乙烯-二乙烯基苯)基质(见图16)产生了编码黄热病病毒抗原的rna。构建体编码相同的抗原(yfv(17d)-prme),包含相同的utr元件,并具有相同的大小。每个构建体的au计数通过编码序列调整进行了更改。构建体列于表14中。表14:au调整的yfv构建体为了评估au调整对保留时间的影响,将500ug每种构建体分别置于各个色谱柱中。此外,对于每个色谱柱,测试了两种不同的流速。结果如图12至15所示。此外,在每个测试的色谱柱上确定每种构建体的分离因子α。在色谱中,分离因子α表示两种化合物的保留时间之比。因此,分离因子的值大于1.0表示发生了两种化合物的分离。在本分析中,seqidno:30592(具有1424个au)被用作分离因子计算的参考。表15中显示了计算得出的分离因子。将获得的分离因子值相对于构建体的au计数差异作图(seqidno:30592,具有1424个au,作为参考)。图示于图16中。表15:au调整的yfv构建体seqidnorna大小au计数au差异α整体αpvdαc4αplpr-s305922311142401.001.001.001.0030591231111392851.071.051.051.0830590231111372871.091.071.061.113058923118945301.151.121.101.183058823118246001.191.151.121.24结论:如图13所示,保留时间的调整在整体式乙基乙烯基苯-二乙烯基苯共聚物中起作用。所有四种构建体在不同的保留时间洗脱,并且可以明确地被分离。在当前情况下,具有824个au的构建体与具有894个au的构建体的分离足够强,从而可以进一步分析峰。如图14所示,保留时间的调整在颗粒型聚(苯乙烯)-二乙烯基苯色谱柱上起作用。所有四种构建体在不同的保留时间洗脱,并且可以明确地被分离。在当前情况下,具有824个au的构建体与具有894个au的构建体的分离足够强,从而可以进一步分析峰。如图15所示,保留时间的调整在基于二氧化硅的c4色谱柱上起作用。所有四种构建体在不同的保留时间洗脱,并且可以明确地被分离。在当前情况下,具有824个au的构建体与具有1139个au的构建体的分离足够强,从而可以进一步分析峰。图16总结了本发明的发明构思。调整不同rna构建体的au计数(换句话说:增加构建体之间au计数的差异)导致保留时间发生变化,从而可以在hplc上分离。值得注意的是,观察到的效果与所使用的柱基质无关。当然,au计数的协调(换句话说:减少构建体之间au计数的差异)也将导致保留时间的改变,从而允许在hplc上进行共纯化。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1