用于生产寡核苷酸的新型方法与流程
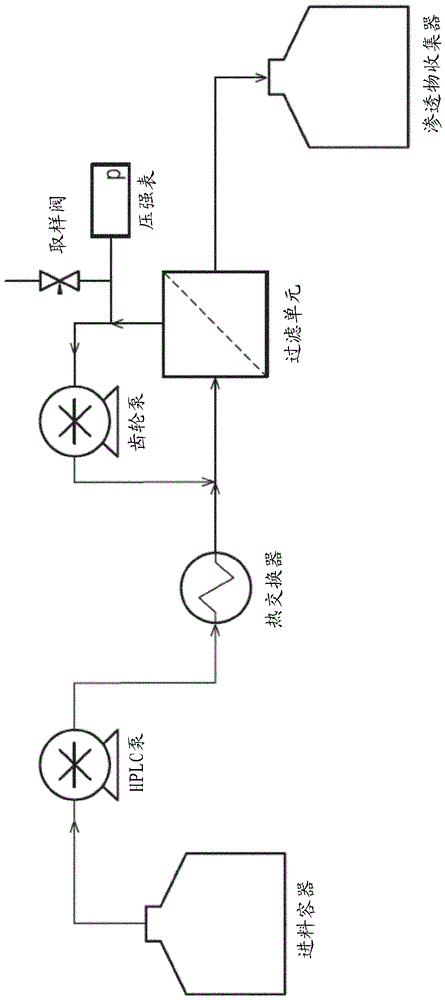
本发明涉及使用酶用于生产寡核苷酸的新型方法,其中所述方法适合用于生产化学修饰的寡核苷酸,诸如在治疗中使用的那些。发明背景经由亚磷酰胺化学法化学合成寡核苷酸和修饰的寡核苷酸是充分确定的,且几十年来已经成为合成这些确定序列生物聚合物的选择方法。所述合成方法通常作为固相合成来运行,其中依次添加各种核苷酸,其中每种核苷酸的添加需要几个化学步骤的循环来在后续步骤的准备中添加和脱保护生长中的寡核苷酸(“寡聚物”)。在核苷酸的依次添加结束时,将所述寡聚物从固相支持物释放,发生进一步脱保护,且然后将粗制的寡核苷酸通过柱色谱法进一步纯化。尽管该方法可以被视作常规的且可以是自动化的,但是该方法存在几个缺点,特别当目标是大规模制备寡核苷酸时,如寡核苷酸治疗剂所需要的。这些缺点包括、但不限于:1)在色谱法的应用中固有的实际限制,使它不适合用于纯化大量寡核苷酸。色谱法的大规模应用是昂贵的,且由于对柱大小和性能的限制而难以实现。2)错误的数目随着合成的寡核苷酸的长度而积累。因此,当前方法的线性连续性质导致产率的几何下降。例如,如果核苷酸添加的每个循环的产率是99%,则20聚体的产率将是83%。3)使用合成寡核苷酸合成仪和下游纯化和分离设备的规模限制:目前,在单个批次中可以生产的产物的最大量是在10kg的量级。因此,需要减少(或理想地消除)柱色谱法和以非完全依次的方式进行合成以便增加产率。dna聚合酶经常被用于合成用在分子生物学和类似应用中的寡核苷酸。但是,因为相对短的寡核苷酸长度和在具有不同脱氧核糖或核糖修饰的核苷酸之间区分的需要,dna聚合酶不适合用于合成治疗性寡核苷酸。例如,治疗性寡核苷酸经常是在20-25个核苷酸的范围内。dna聚合酶需要至少7或8个核苷酸、且最佳地18-22个核苷酸作为每个方向的引物,所以如果引物在大小上类似于期望的产物,在设法合成治疗性寡聚物中所获甚少。并且,dna聚合酶需要所有核苷酸存在于反应物中,并且它依赖于沃森-克里克碱基配对来比对新来的核苷酸。因此,dna聚合酶不能在脱氧核糖或核糖修饰的任何排序之间区分,诸如被gapmer需要的那些,并且结果将是在给定位置处的脱氧核糖或核糖修饰的混合物。发明概述本发明提供了用于生产具有至少一个修饰的核苷酸残基的单链寡核苷酸产物的方法,其包括:a)提供包含产物序列的区段的寡核苷酸的合并物(i),其中所述产物序列的至少一种区段含有至少一个修饰的核苷酸残基,且其中每种区段已经通过酶促合成或固相合成产生;b)提供与所述单链寡核苷酸产物的序列互补的模板寡核苷酸(ii),所述模板具有允许其与所述产物分离并再循环以用于将来的反应中的特性;c)在允许区段寡核苷酸与所述模板寡核苷酸退火的条件下使(i)和(ii)接触;d)通过使用连接酶连接所述区段寡核苷酸以形成所述产物;e)改变所述条件以使退火的模板和任何杂质寡核苷酸链变性,和分离所述杂质;f)改变所述条件以使所述退火的模板和产物寡核苷酸链变性,和分离所述单链寡核苷酸产物;和g)将所述模板寡核苷酸再循环以用于将来的反应中。本发明还提供了用于生产双链寡核苷酸产物的方法,其中将通过上述用于生产单链寡核苷酸产物的方法生产的两种互补的单链寡核苷酸在允许退火的条件下混合。附图描述图1区段寡核苷酸的酶促生产的示意图:a)用于区段合成的3'-延伸,包括两步反应:添加和脱保护。示例性的添加步骤涉及将核苷酸-3',5'-双(硫代)磷酸酯atp依赖性连接至单链核酸引物的3'-oh上,且然后通过磷酸酶将单链寡核苷酸上的3'-磷酸酯脱保护;和b)示例性的3'-延伸(添加和脱保护)以产生区段序列,随后使用位点特异性核酸酶(例如,内切核酸酶v–在肌苷后一个碱基处、即在肌苷的3'的第二个磷酸二酯键处切割)进行链切割释放区段。图2本发明的方法的示意图,包括连接区段寡核苷酸以形成产物和改变所述条件以除去杂质的步骤。图3多种模板构型的示意图。图4在流系统中实施的本发明的方法的基本示意图。图5在流系统中实施的本发明的方法的详细示意图:a)连接化学段,b)连接纯化段,和c)交替连接化学段,和d)交替纯化段。n.b.段a)和b)(可替换地c)和d))可以在单个步骤中进行,例如在a)中的收集容器=来自b)中的连接步骤的输出。图6在本发明的方法期间可以产生的杂质的实例。图7显示使用市售nebt4连接酶(seqidno:3)和未修饰的dna(实施例1)的连接反应的结果的色谱图。图8显示使用perloza结合的t4连接酶(seqidno:4)和未修饰的dna(实施例1)的连接反应的结果的色谱图。图9显示使用perloza结合的t4连接酶(根据实施例2表达)和2'-ome修饰的寡核苷酸片段的连接反应的结果的色谱图。图10实施例4的hplc迹线:上迹线(a)-无连接酶对照。下迹线(b)-克隆a4。产物和模板在该hplc方法中共洗脱。可以在克隆a4迹线中在10.3和11.2分钟见到两种中间连接片段(区段)。图11在实施例13中使用的“三-模板hub’”的示意图,所述“三-模板hub’”包含被称作“hub’”的支持材料和三个模板序列。图12在实施例13中使用的半连续连接装备(rig)的示意图。图13在实施例14中使用的盲端过滤装备的示意图。图14在实施例14中使用的横向流过滤装备的示意图。图15显示来自在实施例14中在60℃使用10kdamwconadir膜的盲端过滤实验的结果的色谱图。图a)是在2个渗滤体积之后渗余物溶液的色谱图,所述渗余物溶液保留在过滤单元中且主要含有三-模板hub;且色谱图b)属于在2个渗滤体积之后的渗透物,即富含产物的溶液。图16显示来自在实施例14中在50℃和3.0巴压强使用5kdamwcosnyder膜的横向流过滤实验的结果的色谱图。图a)是在20个渗滤体积之后渗余物溶液的色谱图,所述渗余物溶液主要含有三-模板hub和产物;且图b)是在20个渗滤体积之后渗透物的色谱图,所述渗透物主要含有区段寡核苷酸。图17显示来自在实施例14中在80℃和3.1巴压强使用5kdamwcosnyder膜的横向流过滤实验的结果的色谱图。图17显示a)在20个渗滤体积之后渗余物溶液的色谱图,所述渗余物溶液仅含有三-模板hub;且图b)是在2个渗滤体积之后渗透物溶液的色谱图,所述渗透物仅含有产物。发明详述定义如本文所用,术语“寡核苷酸”或简写的“寡聚物”意指核苷酸残基的聚合物。这些可以是脱氧核糖核苷酸(其中得到的寡核苷酸是dna)、核糖核苷酸(其中得到的寡核苷酸是rna)、修饰的核苷酸或其混合物。寡核苷酸可以完全由在自然界中发现的核苷酸残基组成,或可以含有至少一个已经被修饰的核苷酸、或至少一个在核苷酸之间的连接。寡核苷酸可以是单链的或双链的。本发明的寡核苷酸可以缀合至另一种分子,例如n-乙酰基半乳糖胺(galnac)或其多聚体(galnac簇)。如本文所用,术语“治疗性寡核苷酸”意指具有治疗用途(例如,在人或动物中的病况或疾病的预防或治疗)的寡核苷酸。这样的寡核苷酸通常含有一个或多个修饰的核苷酸残基或连接。治疗性寡核苷酸经由几种不同机制之一起作用,所述机制包括、但不限于反义、剪接-交换或外显子跳跃、免疫刺激和rna干扰(rnai),例如经由微rna(mirna)和小干扰rna(sirna)。治疗性寡核苷酸可以是适体。治疗性寡核苷酸经常、但不总是具有确定的序列。如本文所用,术语“模板”意指这样的寡核苷酸:其序列与靶标(或产物)寡核苷酸的序列具有100%互补性。除非另外指出,否则如本文所用的术语“互补的”意指100%互补的。如本文所用,术语“产物”意指具有特定序列的期望的寡核苷酸,在本文中也被称作“靶寡核苷酸”。如本文所用,术语“合并物(pool)”表示一组寡核苷酸,其可能在序列上不同,可能短于或长于靶序列,且可能不具有与靶序列相同的序列。寡核苷酸的合并物可以是寡核苷酸合成(例如经由亚磷酰胺化学或酶促合成的固相化学合成)的产物,所述寡核苷酸合成与或不与纯化一起使用。寡核苷酸的合并物可以由靶序列的区段组成。每个区段本身可以作为该区段的合并物存在,且可以是寡核苷酸合成(例如经由亚磷酰胺化学或酶促合成的固相化学合成)的产物。如本文所用,术语“退火”意指互补寡核苷酸以序列特异性的方式杂交,例如两个单链寡核苷酸经由watson和crick碱基配对的氢键配对,以形成双链寡核苷酸。“允许退火的条件”将依赖于杂交的互补寡核苷酸的tm,且将是本领域技术人员容易明白的。例如,退火温度可以低于杂交的寡核苷酸的tm。或者,退火温度可以接近杂交的寡核苷酸的tm,例如±1、2或3℃。一般而言,退火温度不高于杂交的寡核苷酸的tm以上10℃。允许退火的具体条件如在实施例部分中所述。如本文所用,与双链寡核苷酸有关的术语“变性”用于指互补链不再退火,即watson和crick碱基配对已经被破坏且所述链已经解离。变性作为改变条件的结果而发生,例如通过升高温度、改变ph或改变缓冲溶液的盐浓度而发生。用于变性的条件是本领域技术人员众所周知的。使如本文所述的双链寡核苷酸(“双链体”)变性产生单链产物或杂质寡核苷酸和单链模板寡核苷酸。如本文所用,术语“杂质(impurity)”或“杂质(impurities)”意指不具有期望的产物序列的寡核苷酸。这些寡核苷酸可以包括短于产物(例如短1、2、3、4、5个或更多个核苷酸残基)或长于产物(例如长1、2、3、4、5个或更多个核苷酸残基)的寡核苷酸。在生产方法包括在区段之间形成连接的步骤的情况下,杂质包括当一个或多个连接未能形成时所剩下的寡核苷酸。杂质也包括其中已经并入不正确核苷酸的寡核苷酸,因此当与模板对比时产生错配。杂质可以具有一个或多个上述特征。图6显示了一些可能存在的杂质。如本文所用,术语“区段”是较长寡核苷酸的较小部分,尤其是产物或靶寡核苷酸的较小部分。对于给定的产物,当所有其区段与它的模板退火并连接在一起时,形成所述产物。如本文所用,术语“酶促连接”意指,酶促地(即通过酶)形成两个邻近核苷酸之间的连接。该连接可以是天然存在的磷酸二酯键(po)或修饰的连接,包括、但不限于,硫代磷酸酯(ps)或氨基磷酸酯(pa)。如本文所用,术语“酶促合成”意指使用酶、例如连接酶、转移酶、磷酸酶和核酸酶、尤其是内切核酸酶产生寡核苷酸,包括区段和最终产物。这些酶可以是野生型酶或突变型酶。在本发明的范围内的是能够作用于修饰的核苷酸或寡核苷酸底物的突变型酶。如本文所用,术语“连接酶”意指这样的酶:其催化两个寡核苷酸分子的连接,即共价连接,例如通过在一个寡核苷酸(或区段)的3'末端与相同或另一个寡核苷酸(或区段)的5'末端之间形成磷酸二酯键。这些酶经常被称作dna连接酶或rna连接酶并利用辅因子:atp(真核、病毒和古细菌(archael)dna连接酶)或nad(原核dna连接酶)。尽管它们存在于所有生物中,dna连接酶显示氨基酸序列、分子大小和特性的宽泛多样性(nucleicacidsresearch,2000,第28卷,第21期,4051-4058)。它们通常是由国际生物化学与分子生物学联合会(internationalunionofbiochemistryandmolecularbiology)定义的酶类别ec6.5的成员,即用于形成磷酸酯键的连接酶。在本发明的范围内的是能够将未修饰的寡核苷酸连接至另一个未修饰的寡核苷酸的连接酶,能够将未修饰的寡核苷酸连接至修饰的寡核苷酸(即将修饰的5'寡核苷酸连接至未修饰的3'寡核苷酸,和/或将未修饰的5'寡核苷酸连接至修饰的3'寡核苷酸)的连接酶,以及能够将修饰的寡核苷酸连接至另一种修饰的寡核苷酸的连接酶。如本文所用,术语“单链连接酶”或“ss连接酶”意指酶,例如rna连接酶,其能够催化以下的atp依赖性连接:(i)5'-磷酸化的单链rna与单链受体rna链的3'-oh的连接,以及(ii)单个残基(包括修饰的残基),例如核苷酸-3',5'-双磷酸酯、3',5'-硫代双磷酸酯或3'-磷酸酯-5'硫代磷酸酯与rna或修饰寡核苷酸的3'末端的连接(modifiedoligoribonucleotides:17(11),2077-2081,1978)。ss连接酶的一个实例是t4rna连接酶,也已显示其在某些条件下作用于dna底物(nucleicacidsresearch7(2),453-464,1979)。t4rna连接酶在t4细菌噬菌体感染的大肠杆菌中的天然功能是修复由针对病毒攻击的细菌防御机制引起的对细菌trna的单链断裂。在本发明的范围内的是能够将未修饰的核苷酸连接至未修饰的寡核苷酸的ss连接酶,能够将未修饰的核苷酸连接至修饰的寡核苷酸的ss连接酶,能够将修饰的核苷酸连接至未修饰的寡核苷酸的ss连接酶,以及能够将修饰的核苷酸连接至修饰的寡核苷酸的ss连接酶。根据本发明的ss连接酶是不需要模板寡核苷酸进行连接的连接酶,即,连接酶的连接活性是不依赖模板的。如本文所用,“热稳定的连接酶”是在升高的温度(即高于人体温,即高于37℃)有活性的连接酶。热稳定的连接酶可以在例如40℃-65℃;或40℃-90℃;等等有活性。如本文所用,“转移酶”意指催化一个核苷酸与另一个核苷酸或寡核苷酸的不依赖于模板的连接的酶。如本文所述的转移酶包括末端核苷酸基转移酶(tdt),也称为dna核苷酸基外切转移酶(dntt)或末端转移酶。tdt是一种专门的dna聚合酶,其在未成熟的、前b、前t-淋巴样细胞中表达,在所述细胞中,其实现v-d-j抗体基因连接多样化。tdt催化将核苷酸添加至dna分子的3'末端。如本文所述的转移酶包括非天然存在的或突变的tdt。在本发明的范围内的是能够将未修饰的核苷酸连接至未修饰的寡核苷酸的转移酶,能够将未修饰的核苷酸连接至修饰的寡核苷酸的转移酶,能够将修饰的核苷酸连接至未修饰的寡核苷酸的转移酶,以及能够将修饰的核苷酸连接至修饰的寡核苷酸的转移酶。如本文所用,术语“磷酸酶”意指催化磷酸酯水解以产生醇的酶。碱性磷酸酶非特异性地催化dna和rna(和修饰的寡核苷酸)的5'和3'末端的脱磷酸化,并且还水解三磷酸核苷酸(ntp和dntp),并且在碱性ph环境下具有最佳活性。如本文所用,术语“序列特异性内切核酸酶”或“位点特异性内切核酸酶”可互换使用,并且意指在特定位置处特异性切割单链寡核苷酸的核酸酶。例如,内切核酸酶v在肌苷后一个碱基处、即在肌苷的3'的第二个磷酸二酯键处切割rna。位点特异性内切核酸酶的其它实例包括大范围核酸酶、锌指核酸酶、talen和cas9的家族。如本文所用,术语“引物”意指用作用于合成本发明的区段寡核苷酸的起点的寡核苷酸序列。引物包含至少3个核苷酸,并且可以附接至支持材料。如本文所用,术语“修饰的核苷酸残基”或“修饰的寡核苷酸”意指这样的核苷酸残基或寡核苷酸:其含有不同于天然存在的核苷酸残基或寡核苷酸的化学性质的至少一个方面。这样的修饰可以存在于核苷酸残基的任何部分,例如糖、碱基或磷酸酯。在下面公开了核苷酸的修饰的实例。如本文所用,术语“修饰的连接酶”意指与天然存在的“野生型”连接酶相差一个或多个氨基酸残基的连接酶。这样的连接酶在自然界中不存在。这样的连接酶在本发明的新型方法中是有用的。在下面公开了修饰的连接酶的实例。术语“修饰的连接酶”和“突变体连接酶”可互换使用。如本文所用,术语“修饰的转移酶”意指与天然存在的“野生型”转移酶相差一个或多个氨基酸残基的转移酶。这样的转移酶在自然界中不存在。这样的转移酶在本发明的新型方法中是有用的。术语“修饰的转移酶”和“突变体转移酶”可互换使用。如本文所用,术语“gapmer”意指这样的寡核苷酸:其具有侧接两个外部“翼区段”的内部“缺口区段”,其中所述缺口区段由多个支持rna酶h切割的核苷酸组成,且每个翼区段由一个或多个在化学上不同于缺口区段内的核苷酸的核苷酸组成。如本文所用,术语“支持材料”意指这样的高分子量化合物或材料:其增加寡核苷酸(例如,模板或引物)的分子量,由此例如当从反应混合物分离杂质和产物时允许它被保留。如本文所用,查询核酸序列和目标核酸序列之间的“同一性百分比”是,在进行逐对blastn比对之后,当目标核酸序列与查询核酸序列具有100%查询覆盖度时,通过blastn算法计算的表达为百分比的“同一性”值。通过使用在国家生物技术研究所中心(nationalcenterforbiotechnologyinstitute)的网站上可得到的blastn算法的默认设置,将低复杂性区域的过滤器关闭,进行在查询核酸序列和目标核酸序列之间的这样的逐对blastn比对。重要的是,通过在本文的一个或多个权利要求中鉴别的核酸序列可以描述查询核酸序列。查询序列可以与目标序列具有100%同一性,或它可以相对于目标序列包括多达某个整数数目的核苷酸改变,使得%同一性小于100%。例如,查询序列与目标序列具有至少80%、85%、90%、95%、96%、97%、98%或99%同一性。发明陈述在本发明的一个方面,提供了用于生产具有至少一个修饰的核苷酸残基的单链寡核苷酸产物的方法,所述方法包括:a)提供包含产物序列的区段的寡核苷酸的合并物(i),其中所述产物序列的至少一种区段含有至少一个修饰的核苷酸残基,且其中每种区段已经通过酶促合成或固相合成产生;b)提供与所述单链寡核苷酸产物的序列互补的模板寡核苷酸(ii),所述模板具有允许其与所述产物分离并再循环以用于将来的反应中的特性;c)在允许区段寡核苷酸与所述模板寡核苷酸退火的条件下使(i)和(ii)接触;d)通过使用连接酶连接所述区段寡核苷酸以形成所述产物;e)改变所述条件以使退火的模板和任何杂质寡核苷酸链变性,和分离所述杂质;f)改变所述条件以使所述退火的模板和产物寡核苷酸链变性,和分离所述单链寡核苷酸产物;和g)将所述模板寡核苷酸再循环以用于将来的反应中。在本发明的一个实施方案中,酶促产生一种或多种或所有区段寡核苷酸。在本发明的一个实施方案中,使用单链连接酶(ss连接酶)产生一种或多种或所有区段寡核苷酸。在一个实施方案中,所述ss连接酶是rna连接酶。在一个实施方案中,所述ss连接酶是t4rna连接酶或修饰的t4rna连接酶。在另一个实施方案中,用于使用ss连接酶产生区段寡核苷酸的方法包括:(i)通过使用ss连接酶将核苷酸、二核苷酸、三核苷酸或四核苷酸;(在3'末端具有磷酸酯、硫代磷酸酯或二硫代磷酸酯部分;且在5'末端具有磷酸酯、硫代磷酸酯或二硫代磷酸酯部分;)添加至单链寡核苷酸引物的3'-oh;(ii)通过使用磷酸酶除去3'-磷酸酯部分、3'-硫代磷酸酯部分或3'二硫代磷酸酯部分;(iii)重复步骤(i)和(ii)以延伸所述寡核苷酸以产生所述区段序列;和(iv)使用序列特异性内切核酸酶从所述寡核苷酸引物释放所述区段寡核苷酸。在本发明的一个实施方案中,使用ss连接酶产生区段寡核苷酸的方法包括通过在步骤(i)中使用ss连接酶将磷酸酯氧中任一个的一个或多个被硫取代的3',5'核苷酸双磷酸酯添加至单链寡核苷酸引物的3'-oh。在本发明的一个实施方案中,使用ss连接酶产生区段寡核苷酸的方法包括通过在步骤(i)中使用ss连接酶将3',5'核苷酸双磷酸酯、3',5'核苷酸硫代磷酸酯(例如,3',5'双硫代磷酸酯或3'-磷酸酯-5'-硫代磷酸酯或3'-硫代磷酸酯-5'-磷酸酯)或3',5'核苷酸二硫代磷酸酯(例如,3',5'双二硫代磷酸酯或3'-磷酸酯-5'-二硫代磷酸酯或3'-二硫代磷酸酯-5'-磷酸酯)连接至单链寡核苷酸引物的3'-oh。在本发明的一个实施方案中,使用转移酶产生一种或多种区段寡核苷酸。在本发明的一个实施方案中,用于使用转移酶产生区段寡核苷酸的方法包括:(i)通过使用转移酶将在其3'-oh上具有保护基团的核苷酸-5'-三磷酸酯、α-硫代三磷酸酯或α二硫代三磷酸酯添加至单链寡核苷酸引物的3'-oh;(ii)将3'-位置脱保护以再生3'-oh;(iii)重复步骤(i)和(ii)以延伸所述寡核苷酸以产生所述区段序列;(iv)使用序列特异性内切核酸酶从所述寡核苷酸引物释放所述区段寡核苷酸。在本发明的一个实施方案中,通过酶促合成产生每种区段。在本发明的一个实施方案中,通过使用ss连接酶产生每种区段。在本发明的一个实施方案中,通过使用转移酶产生每种区段。使用ss连接酶、例如rna连接酶、转移酶或能够以不依赖于模板的方式将单个核苷酸添加至单链寡核苷酸的任何其它酶,允许合成具有定义序列的寡核苷酸。这样的方法可用于通过迭代添加单个碱基来产生完整的寡核苷酸产物。然而,除非每个合成循环都以100%产率运行,否则序列缺失错误将并入最终产物。例如,如果寡核苷酸在合成循环中以99%产率延伸一个核苷酸,则剩余1%将可在随后的合成循环中反应,但形成的产物将比期望产物短一个核苷酸。随着循环数增加,则错误率是复合的,因此,在该实例中,对于20聚体的产生,99%循环产率将导致形成20%的单碱基缩短序列。根据本发明,通过以下避免错误的依次累积。首先,通过添加单个核苷酸,仅合成通常5-8个核苷酸长的短序列。该过程导致短序列比长序列具有更高的纯度,因为它们暴露于更少循环的错误累积。其次,将这些短序列组装在互补的dna模板上,且然后连接在一起。互补模板与连接酶的结合使用确保仅组装具有正确长度和正确序列两者的短寡核苷酸。因此,本发明的方法导致更高的总体产率,以及重要地,更高的总体序列保真度。本发明的一个实施方案提供了如本文先前所述的方法,其中使模板和杂质双链体变性和/或使模板和产物双链体变性是由温度升高导致的。在一个实施方案中,变性由于改变ph而发生。在另一个实施方案中,变性通过改变缓冲溶液中的盐浓度而发生。本发明的另一个实施方案提供了前文公开的方法,其中所述区段寡核苷酸是3-15个核苷酸长。在本发明的另一个实施方案中,所述区段是5-10个核苷酸长。在本发明的另一个实施方案中,所述区段是5-8个核苷酸长。在本发明的另一个实施方案中,所述区段是4、5、6、7或8个核苷酸长。在一个具体实施方案中,存在三个区段寡核苷酸:7个核苷酸长的5'区段,6个核苷酸长的中央区段,和7个核苷酸长的3'区段,它们当连接在一起时形成20个核苷酸长的寡核苷酸(“20-聚体”)。在一个具体实施方案中,存在三个区段寡核苷酸:6个核苷酸长的5'区段,8个核苷酸长的中央区段,和6个核苷酸长的3'区段,它们当连接在一起时形成20个核苷酸长的寡核苷酸(“20-聚体”)。在一个具体实施方案中,存在三个区段寡核苷酸:5个核苷酸长的5'区段,10个核苷酸长的中央区段,和5个核苷酸长的3'区段,它们当连接在一起时形成20个核苷酸长的寡核苷酸(“20-聚体”)。在一个具体实施方案中,存在三个区段寡核苷酸:4个核苷酸长的5'区段,12个核苷酸长的中央区段,和4个核苷酸长的3'区段,它们当连接在一起时形成20个核苷酸长的寡核苷酸(“20-聚体”)。在一个具体实施方案中,存在四个区段寡核苷酸:5个核苷酸长的5'区段,5个核苷酸长的5'-中央区段,5个核苷酸长的中央-3'区段,和5个核苷酸长的3'区段,它们当连接在一起时形成20个核苷酸长的寡核苷酸(“20-聚体”)。本发明的一个实施方案提供了前文描述的方法,其中所述产物是10-200个核苷酸长。在本发明的另一个实施方案中,所述产物是15-30个核苷酸长。在本发明的一个实施方案中,所述产物是21、22、23、24、25、26、27、28、29或30个核苷酸长。在本发明的一个实施方案中,所述产物是20个核苷酸长,一种“20-聚体”。在本发明的一个实施方案中,所述产物是21个核苷酸长,一种“21-聚体”。在本发明的一个实施方案中,所述产物是22个核苷酸长,一种“22-聚体”。在本发明的一个实施方案中,所述产物是23个核苷酸长,一种“23-聚体”。在本发明的一个实施方案中,所述产物是24个核苷酸长,一种“24-聚体”。在本发明的一个实施方案中,所述产物是25个核苷酸长,一种“25-聚体”。在本发明的一个实施方案中,所述产物是26个核苷酸长,一种“26-聚体”。在本发明的一个实施方案中,所述产物是27个核苷酸长,一种“27-聚体”。在本发明的一个实施方案中,所述产物是28个核苷酸长,一种“28-聚体”。在本发明的一个实施方案中,所述产物是29个核苷酸长,一种“29-聚体”。在本发明的一个实施方案中,所述产物是30个核苷酸长,一种“30-聚体”。在本发明的一个实施方案中,所述方法是用于生产治疗性寡核苷酸的方法。在本发明的一个实施方案中,所述方法是用于生产单链治疗性寡核苷酸的方法。在本发明的一个实施方案中,所述方法是用于生产双链治疗性寡核苷酸的方法。本发明的另一个实施方案提供了前文公开的方法,其中所述允许模板与产物分离的特性是,所述模板附接至支持材料。在本发明的另一个实施方案中,所述支持材料是可溶性支持材料。在本发明的另一个实施方案中,所述可溶性支持材料选自:聚乙二醇、可溶性的有机聚合物、dna、蛋白、树枝状聚合物、多糖、寡糖和碳水化合物。在本发明的一个实施方案中,所述支持材料是聚乙二醇(peg)。在本发明的另一个实施方案中,所述支持材料是不溶性支持材料。在本发明的另一个实施方案中,所述支持材料是固体支持材料。在另一个实施方案中,所述固体支持材料选自:玻璃珠粒、聚合物珠粒、纤维支持物、膜、链霉抗生物素蛋白包被的珠粒和纤维素。在一个实施方案中,所述固体支持材料是链霉抗生物素蛋白包被的珠粒。在另一个实施方案中,所述固体支持材料是反应容器本身的部分,例如反应壁。本发明的一个实施方案提供了前文公开的方法,其中所述模板的多个重复拷贝经由单个附接点以连续方式附接至所述支持材料。所述模板的多个重复拷贝可以被接头隔开,例如如在图3中所示。所述模板的多个重复拷贝可以是直接重复序列,即它们没有被接头隔开。在本发明的另一个实施方案中,所述模板在多个附接点处附接至所述支持材料。本发明的另一个实施方案提供了前文公开的方法,其中所述允许模板与产物分离的特性是所述模板的分子量。例如,所述模板序列的重复拷贝可以存在于单个寡核苷酸上,具有或没有接头序列。本发明的另一个实施方案提供了前文公开的方法,其中将所述模板、或所述模板和支持材料再循环用于将来的反应中,例如如下面详述的。本发明的另一个实施方案提供了前文公开的方法,其中使用连续或半连续流方法实施所述反应,例如如在图4或图5中所示。在本发明的一个实施方案中,所述方法用于大规模制备寡核苷酸,尤其是治疗性寡核苷酸。在本发明的上下文中,寡核苷酸的大规模制备意指在大于或等于1升的规模的制备,例如在1l或更大的反应器中实施所述方法。可替换地或另外,在本发明的上下文中,寡核苷酸的大规模制备意指在克规模的产物制备,尤其是大于或等于10克产物的生产。在本发明的一个实施方案中,生产的寡核苷酸产物的量是在克规模。在本发明的一个实施方案中,生产的产物的量大于或等于:1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90或100克。在本发明的一个实施方案中,生产的寡核苷酸产物的量大于或等于:150、200、250、300、350、400、450、500、550、600、650、700、750、800、850、900、950克。在本发明的一个实施方案中,生产的寡核苷酸产物的量是500克或更大。在本发明的一个实施方案中,生产的寡核苷酸产物是在千克规模。在本发明的一个实施方案中,生产的寡核苷酸产物的量是1kg或更多。在本发明的一个实施方案中,生产的寡核苷酸产物的量大于或等于:1、2、3、4、5、6、7、8、9、10kg。在本发明的一个实施方案中,生产的寡核苷酸产物的量大于或等于:15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100kg。在本发明的一个实施方案中,生产的产物的量是在10克和100kg之间。在本发明的一个实施方案中,生产的产物的量是在10克和50kg之间。在本发明的一个实施方案中,生产的产物的量是在100克和100kg之间。在本发明的一个实施方案中,生产的产物的量是在100克和50kg之间。在本发明的一个实施方案中,生产的产物的量是在500克和100kg之间。在本发明的一个实施方案中,生产的产物的量是在500克和50kg之间。在本发明的一个实施方案中,生产的产物的量是在1kg和50kg之间。在本发明的一个实施方案中,生产的产物的量是在10kg和50kg之间。在本发明的一个实施方案中,寡核苷酸制备在大于或等于2、3、4、5、6、7、8、9、10升的规模发生,例如在2、3、4、5、6、7、8、9或10l反应器中。在本发明的一个实施方案中,寡核苷酸制备在大于或等于20、25、30、35、40、45、50、55、60、6570、75、80、85、90、95、100升的规模发生,例如在20、25、30、35、40、45、50、55、60、6570、75、80、85、90、95、100l反应器中。在本发明的一个实施方案中,寡核苷酸制备在大于或等于150、200、250、300、350、400、450、500、550、600、650、700、750、800、850、900、950、1000升的规模发生,例如在150、200、250、300、350、400、450、500、550、600、650、700、750、800、850、900、950、1000l反应器中。在本发明的一个实施方案中,所述反应器体积是约10,000l、约5000l、约2000l、约1000l、约500l、约125l、约50l、约20l、约10l或约5l。在本发明的一个实施方案中,所述反应器体积是在5-10,000l之间,在10-5000l之间,在20-2000l之间,或在50-1000l之间。与基于rna或dna的寡核苷酸相比,根据本发明的寡核苷酸可以具有至少一个主链修饰、和/或至少一个糖修饰和/或至少一个碱基修饰。在本发明的一个实施方案中,与基于rna或dna的寡核苷酸相比,一种或多种区段寡核苷酸可以具有至少一个主链修饰、和/或至少一个糖修饰和/或至少一个碱基修饰。在一个实施方案中,所述区段寡核苷酸全部具有至少一个主链修饰。在一个实施方案中,所述区段中的至少一个具有完全修饰的主链。在本发明的一个实施方案中,所述区段全部具有完全修饰的主链。在一个实施方案中,所有区段寡核苷酸的主链由硫代磷酸酯键组成。在一个实施方案中,与基于rna或dna的寡核苷酸相比,所述区段中的两个或更多个具有至少一个糖修饰和/或至少一个碱基修饰。在一个实施方案中,在一个实施方案中,“翼”区段包含至少一个糖修饰。在一个实施方案中,“翼”区段完全由修饰的糖组成。在一个实施方案中,“翼”区段完全由2'-moe-修饰的糖组成。本发明的一个实施方案提供了前文公开的方法,其中所述产物包含至少1个修饰的核苷酸残基。在另一个实施方案中,所述修饰是在所述糖部分的2'位置。在本发明的方法中使用的寡核苷酸可以包括糖修饰,即核糖基部分的一种修饰形式,诸如2'-o-修饰的rna,诸如2'-o-烷基或2'-o-(取代的)烷基,例如2'-o-甲基、2'-o-(2-氰基乙基)、2'-o-(2-甲氧基)乙基(2'-moe)、2'-o-(2-硫甲基)乙基、2'-o-丁酰基、2'-o-炔丙基、2'-o-烯丙基、2'-o-(3-氨基)丙基、2'-o-(3-(二甲基氨基)丙基)、2'-o-(2-氨基)乙基、2'-o-(2-(二甲基氨基)乙基);2'-脱氧(dna);2'-o-(卤代烷氧基)甲基(araik.等人.bioorg.med.chem.2011,21,6285)、例如2'-o-(2-氯乙氧基)甲基(mcem),2'-o-(2,2-二氯乙氧基)甲基(dcem);2'-o-烷氧基羰基、例如2'-o-[2-(甲氧基羰基)乙基](moce)、2'-o-[2-(n-甲基氨甲酰基)乙基](mce)、2'-o-[2-(n,n-二甲基氨甲酰基)乙基](dcme);2'-卤代、例如2'-f、fana(2'-f阿拉伯糖基核酸);碳环糖(carbasugar)和氮杂糖(azasugar)修饰;3'-o-烷基、例如3'-o-甲基、3'-o-丁酰基、3'-0-炔丙基;和它们的衍生物。在本发明的一个实施方案中,所述糖修饰选自:2'-氟(2'-f)、2'-o-甲基(2'-ome)、2'-o-甲氧基乙基(2'-moe)和2'-氨基。在另一个实施方案中,所述修饰是2'-moe。其它糖修饰包括“桥连的”或“二环的”核酸(bna),例如锁核酸(lna)、木-lna、α-l-lna、β-d-lna、cet(2'-o、4'-c约束的乙基)lna、cmoet(2'-o、4'-c约束的甲氧基乙基)lna、亚乙基-桥连核酸(ena)、三环dna;解锁核酸(una);环己烯基核酸(cena)、altriol(阿卓糖醇)核酸(ana)、己糖醇核酸(hna)、氟代hna(f-hna)、吡喃糖基-rna(p-rna)、3'-脱氧吡喃糖基-dna(p-dna);吗啉代(例如在pmo、ppmo、pmoplus、pmo-x中);和它们的衍生物。在本发明的方法中使用的寡核苷酸可以包括其它修饰,诸如肽-碱基核酸(pna)、硼修饰的pna、基于吡咯烷的氧基-肽核酸(popna)、基于乙二醇或丙三醇的核酸(gna)、基于苏糖的核酸(tna)、无环的基于苏氨醇的核酸(atna)、具有集成的碱基和主链的寡核苷酸(onib)、吡咯烷-酰胺寡核苷酸(poms);和它们的衍生物。在本发明的一个实施方案中,所述修饰的寡核苷酸包含磷酰二胺吗啉代寡聚物(pmo)、锁核酸(lna)、肽核酸(pna)、桥连核酸(bna)诸如(s)-cet-bna或spiegelmer。在另一个实施方案中,所述修饰是在所述核碱基中。碱基修饰包括天然嘌呤和嘧啶碱基(例如腺嘌呤、尿嘧啶、鸟嘌呤、胞嘧啶和胸腺嘧啶)的修饰形式,诸如肌苷、次黄嘌呤、乳清酸、agmatidine、lysidine、2-硫嘧啶(例如2-硫尿嘧啶、2-硫胸腺嘧啶)、g-夹及其衍生物、5-取代的嘧啶(例如5-甲基胞嘧啶、5-甲基尿嘧啶、5-卤代尿嘧啶、5-丙炔基尿嘧啶、5-丙炔基胞嘧啶、5-氨基甲基尿嘧啶、5-羟基甲基尿嘧啶、5-氨基甲基胞嘧啶、5-羟基甲基胞嘧啶、supert)、2,6-二氨基嘌呤、7-脱氮鸟嘌呤、7-脱氮腺嘌呤、7-氮杂-2,6-二氨基嘌呤、8-氮杂-7-脱氮鸟嘌呤、8-氮杂-7-脱氮腺嘌呤、8-氮杂-7-脱氮-2,6-二氨基嘌呤、superg、supera和n4-乙基胞嘧啶或其衍生物;n2-环戊基鸟嘌呤(cpent-g)、n2-环戊基-2-氨基嘌呤(cpent-ap)和n2-丙基-2-氨基嘌呤(pr-ap)或其衍生物;和简并或通用碱基,如2,6-二氟甲苯或缺乏碱基如脱碱基位点(例如1-脱氧核糖、1,2-二脱氧核糖、1-脱氧-2-o-甲基核糖;或吡咯烷衍生物,其中环氧已经被氮替代(氮杂核糖))。supera、superg和supert的衍生物的实例可以见于us6683173。显示cpent-g、cpent-ap和pr-ap当并入sirna中时减轻免疫刺激效应(peacockh.等人.j.am.chem.soc.(2011),133,9200)。在本发明的一个实施方案中,所述核碱基修饰选自:5-甲基嘧啶、7-脱氮鸟苷和脱碱基核苷酸。在一个实施方案中,所述修饰是5-甲基胞嘧啶。在本发明的方法中使用的寡核苷酸可以包括主链修饰,例如存在于rna中的磷酸二酯的一种修饰形式,诸如硫代磷酸酯(ps)、二硫代磷酸酯(ps2)、膦酰基乙酸酯(pace)、膦酰基乙酰胺(paca)、硫代膦酰基乙酸酯、硫代膦酰基乙酰胺、硫代磷酸酯前药、h-膦酸酯、膦酸甲酯、硫代膦酸甲酯、磷酸甲酯、硫代磷酸甲酯、磷酸乙酯、硫代磷酸乙酯、硼代磷酸酯、硼代硫代磷酸酯、硼代磷酸甲酯、硼代硫代磷酸甲酯、硼代膦酸甲酯、硼代硫代膦酸甲酯和它们的衍生物。另一种修饰包括亚磷酰胺、氨基磷酸酯、n3'→p5'氨基磷酸酯、磷酰二胺、硫代磷酰二胺、氨基磺酸酯、二亚甲基亚砜、磺酸酯、三唑、草酰基、氨基甲酸酯、亚甲基亚氨基(mmi)和硫代乙酰氨基核酸(tana);和它们的衍生物。在另一个实施方案中,所述修饰是在所述主链中且选自:硫代磷酸酯(ps)、氨基磷酸酯(pa)和磷酰二胺。在本发明的一个实施方案中,所述修饰的寡核苷酸是磷酰二胺吗啉代寡聚物(pmo)。pmo具有含磷酰二胺连接的亚甲基吗啉环主链。在本发明的一个实施方案中,所述产物具有硫代磷酸酯(ps)主链。在本发明的一个实施方案中,所述寡核苷酸包含如上公开的两种或更多种修饰的组合。本领域技术人员会明白,存在许多合成的寡核苷酸衍生物。在本发明的一个实施方案中,所述产物是gapmer。在本发明的一个实施方案中,所述翼区段包含主链和糖修饰,且中央或‘缺口’区段包含主链修饰,但不包含糖修饰。在本发明的一个实施方案中,所述gapmer的5'和3'翼包含2'-moe修饰的核苷酸或由其组成。在本发明的一个实施方案中,所述gapmer的缺口区段包含在所述糖部分的2'位含有氢的核苷酸(即是dna-样的)或由其组成。在本发明的一个实施方案中,所述gapmer的5'和3'翼由2'moe修饰的核苷酸组成,且所述gapmer的缺口区段由在所述糖部分的2'位含有氢的核苷酸(即脱氧核苷酸)组成。在本发明的一个实施方案中,所述gapmer的5'和3'翼由2'moe修饰的核苷酸组成,且所述gapmer的缺口区段由在所述糖部分的2'位含有氢的核苷酸(即脱氧核苷酸)组成,且在所有核苷酸之间的连接是硫代磷酸酯键。本发明的一个实施方案提供了前文描述的方法,其中得到的产物是大于90%纯的。在另一个实施方案中,所述产物是大于95%纯的。在另一个实施方案中,所述产物是大于96%纯的。在另一个实施方案中,所述产物是大于97%纯的。在另一个实施方案中,所述产物是大于98%纯的。在另一个实施方案中,所述产物是大于99%纯的。使用任何合适的方法,例如高效液相色谱法(hplc)或质谱法(ms),尤其是液相色谱法-ms(lc-ms)、hplc-ms或毛细管电泳质谱法(cems),可以确定寡核苷酸的纯度。在本发明的一个实施方案中,生产的寡核苷酸是反义寡核苷酸。在本发明的一个实施方案中,生产的寡核苷酸是适体。在本发明的一个实施方案中,生产的寡核苷酸是mirna。在本发明的一个实施方案中,所述产物是治疗性寡核苷酸。本发明的另一个实施方案提供了用于生产双链寡核苷酸的方法,其中通过任何前述实施方案的方法生产2种互补的单链寡核苷酸,且然后在允许退火的条件下混合,这样的条件是技术人员显而易见的。在一个实施方案中,所述产物是sirna。在本发明的一个实施方案中,在用于连接区段的反应容器中基本上没有核苷酸。在本发明的一个实施方案中,在用于连接区段的反应容器中没有核苷酸。在本发明的另一个实施方案中,用于连接区段的反应容器不包含核苷酸的合并物,即该反应基本上不含至完全不含核苷酸。本文公开的发明利用寡核苷酸结合的特性来提供改进的它们的生产方法。通过给模板寡核苷酸提供与靶序列的100%互补性和控制反应条件使得产物可以在特定条件下被释放和分离,可以得到具有高纯度的产物。使产物(或杂质):模板双链体变性和从模板分离所述产物(或杂质)从模板释放产物(或任何杂质)要求破坏模板寡核苷酸链和产物(或杂质)之间的沃森-克里克碱基配对(即使所述双链体变性)。然后可以将产物(或杂质)从模板分离,其可以作为两个单独步骤发生,或作为一个组合的步骤发生。如果在柱反应器中实施所述方法,则释放和分离产物(或杂质)可以作为一个步骤发生。在改变ph或盐浓度或者含有破坏碱基配对的化学试剂(诸如甲酰胺或尿素)的缓冲液中运行,将造成寡核苷酸链的变性,且将在所述缓冲液中洗脱所述产物(或杂质)。当在其它反应容器中实施所述方法时,所述产物(或杂质)的释放和分离可以作为两步方法发生。首先,将沃森-克里克碱基对破坏以使所述链变性,且然后从所述模板分离、例如从所述反应容器取出所述产物(或杂质)。当释放和分离所述产物作为两步方法实施时,通过改变缓冲液条件(ph、盐)或通过并入化学破坏试剂(甲酰胺、尿素)可以实现沃森-克里克碱基对的破坏。或者,升高温度也将造成两条链的解离,即变性。然后可以经由方法分离(且如果期望,还从所述反应容器取出)产物(或杂质),所述方法包括基于分子量的分离、基于电荷的分离、基于疏水性的分离、基于特定序列的分离或这些方法的组合。当在连续或半连续流反应器中实施所述方法时,所述产物(或杂质)的释放和分离可以是在一个步骤或两个步骤中。例如,通过增加温度以造成两条链的解离和在用于升高温度的反应器的相同部分中基于分子量来分离释放的链,可以实现在一个步骤中释放和分离所述产物(或杂质)。通过在反应器的一个部分中增加温度以造成两条链的解离和在反应器的不同部分中基于分子量来分离释放的链,可以实现在两个步骤中释放和分离所述产物(或杂质)。从模板特异性地释放和分离杂质,但将产物保留在模板上当在链延伸期间将不正确的核苷酸并入寡核苷酸链中时,或当链延伸反应过早终止时,产生杂质。当反应包括连接区段寡核苷酸的步骤和一个或多个连接步骤没有发生时,也产生杂质。在图6中图示了可以产生的杂质的种类。沃森-克里克碱基配对的特性可以用于在产物释放之前特异性地释放与模板结合的任何杂质。每种双链寡核苷酸将在特定条件下解离,且当与具有100%互补性的序列相比时,那些条件对于不具有100%互补性的序列而言是不同的。确定这样的条件是在技术人员的能力范围(remit)内。使寡核苷酸变性的一种常见方式是升高温度。一半的碱基对发生解离(即当50%的双链体处于单链状态时)的温度被称作解链温度tm。确定解链温度的最可靠和准确的方式是凭经验。但是,这是麻烦的且通常不是必要的。几个公式可以用于计算tm值(nucleicacidsresearch1987,15(13):5069-5083;pnas1986,83(11):3746-3750;biopolymers1997,44(3):217-239),且可以在线找到许多解链温度计算器,其主机归试剂供应商和大学。已知的是,对于给定的寡核苷酸序列,具有所有硫代磷酸酯键的变体将在比具有所有磷酸二酯键的变体更低的温度解链。增加寡核苷酸中的硫代磷酸酯键的数目倾向于降低所述寡核苷酸对其预期靶标的tm。为了从反应混合物特异性地分离杂质,首先计算产物:模板双链体的解链温度。然后,将反应容器加热至第一温度,例如低于产物:模板双链体的解链温度的温度,例如比解链温度低1、2、3、4、5、6、7、8、9或10摄氏度。该加热步骤造成不是来自模板的产物的寡核苷酸(即不是与模板100%互补)的变性。然后可以使用上面公开的方法之一(例如基于分子量的分离、基于电荷的分离、基于疏水性的分离、基于特定序列的分离或这些方法的组合)从反应容器除去这些变性的寡核苷酸。然后,将反应容器升高至第二个更高的温度,例如高于计算的解链温度,例如比解链温度高1、2、3、4、5、6、7、8、9或10摄氏度,以造成来自所述模板的产物的变性。然后可以使用上面公开的方法之一(例如基于分子量的分离、基于电荷的分离、基于疏水性的分离、基于特定序列的分离或这些方法的组合)分离(且从所述反应容器取出)产物。当破坏试剂是造成ph或盐浓度的变化的试剂或者是化学破坏试剂时,可以使用类似的方法。使破坏试剂的浓度增加,直到刚好低于产物可以解离时的浓度,以造成不是来自模板的产物的寡核苷酸的变性。然后可以使用上面公开的方法之一从反应容器除去这些杂质。然后将破坏试剂的浓度增加至高于使产物从模板解离的浓度。然后可以使用上面公开的方法之一从所述反应容器取出产物。从方法(诸如上面公开的方法)得到的产物具有高的纯度,而不需要另外的纯化步骤。例如,得到的产物是大于95%纯的。模板的特性所述模板需要当取出产物时允许它保留在反应容器中的特性,以防止它变成产物中的杂质。换而言之,所述模板具有允许它与产物分离的特性。在本发明的一个实施方案中,通过将所述模板偶联至支持材料,实现该保留。该偶联产生具有高分子量的模板-支持物复合物,且因此当取出杂质和产物(例如通过过滤)时可以保留在反应容器中。可以将所述模板偶联至固体支持材料诸如聚合物珠粒、纤维支持物、膜、链霉抗生物素蛋白包被的珠粒和纤维素。还可以将所述模板偶联至可溶性支持材料诸如聚乙二醇、可溶性的有机聚合物、dna、蛋白、树枝状聚合物、多糖、寡糖和碳水化合物。每种支持材料可以具有多个可以附接模板的点,且每个附接点可以具有多个附接的模板,例如以图3中所示的方式。在不附接至支持材料的情况下,所述模板本身可以具有高分子量,例如,它可以是具有模板的多个拷贝的分子,例如以图3所示的方式被接头隔开。将模板保留在反应容器中的能力也允许通过回收或通过用在连续或半连续流方法中将模板再循环用于将来的反应。将模板与产物(或杂质)分离的方法如上公开的模板的特性允许分离模板和产物,或分离模板结合的产物和杂质。可以使用基于分子量的分离、基于电荷的分离、基于疏水性的分离、基于特定序列的分离或这些方法的组合。在所述模板附接至固体支持物的情况下,通过在适当的条件下洗涤固体支持物而实现模板与产物的分离或杂质与结合至模板的产物的分离,如本领域技术人员所显而易见。在模板偶联至可溶性支持物或本身由重复模板序列组成的情况下,模板与产物的分离或模板结合的产物与杂质的分离,可以借助于基于分子量的分离、例如通过使用技术诸如超滤或纳米过滤(其中选择过滤材料,使得较大的分子被过滤器保留且较小的分子穿过)来实现。在杂质与模板产物复合物的单个分离步骤或产物与模板的分离不够有效的情况下,可以采用多个依次过滤步骤来增加分离效率和如此产生满足期望的纯度的产物。合乎需要的是,提供分离这样的寡核苷酸的方法,其在工业生产规模上是有效的和适用的。“therapeuticoligonucleotides:thestateoftheartinpurificationtechnologies”sanghvi等人.currentopinionindrugdiscovery(2004)第7卷第8期综述了用于寡核苷酸纯化的方法。wo01/55160a1公开了如下纯化寡核苷酸:与污染物形成亚胺键,且然后用色谱法或其它技术除去亚胺连接的杂质。“sizefractionationofdnafragmentsrangingfrom20to30000basepairsbyliquid/liquidchromatography”muller等人.eur.j.biochem(1982)128-238公开了在其上面已经沉积了peg/葡聚糖相的微晶纤维素的固体柱用于分离核苷酸序列的应用。“separationandidentificationofoligonucleotidesbyhydrophilicinteractionchromatography.”easter等人.theanalyst(2010);135(10)公开了使用hplc的变体分离寡核苷酸,其采用固体二氧化硅支持相。“fractionationofoligonucleotidesofyeastsolubleribonucleicacidsbycountercurrentdistribution”doctor等人.biochemistry(1965)4(1)49-54公开了用干燥的deae-纤维素填充的干燥固体柱的应用。“oligonucleotidecompositionofayeastlysinetransferribonucleicacid”madison等人;biochemistry,1974,13(3)公开了固相色谱法用于分离核苷酸序列的应用。液体-液相色谱法是一种已知的分离方法。“countercurrentchromatographythesupport-freeliquidstationaryphase”billardello,b.;berthod,a;wilson&wilson'scomprehensiveanalyticalchemistry38;berthod,a.,编;elsevierscienceb.v.:amsterdam(2002)第177-200页提供了液体-液相色谱法的有用的一般描述。各种液体-液相色谱法技术是已知的。一种这样的技术是液体-液体反流色谱法(在本文中称作“ccc”)。另一种已知的技术是离心分配色谱法(在本文中称作“cpc”)。以上公开的方法和在wo2013/030263中描述的那些方法可以用于分离产物寡核苷酸,例如与模板和/或杂质分离。用于本发明的方法、即连接步骤(d)中的连接酶在本发明的一个实施方案中,所述连接酶是atp依赖性连接酶。atp依赖性连接酶是在从30至>100kda的大小范围内。在本发明的一个实施方案中,所述连接酶是nad依赖性连接酶。nad依赖性酶是高度同源的且是70-80kda的单体蛋白。在本发明的一个实施方案中,所述连接酶是热稳定的连接酶。一种热稳定的连接酶可以源自嗜热细菌。在本发明的一个实施方案中,所述连接酶是模板依赖性连接酶。在本发明的一个实施方案中,所述连接酶是野生型肠杆菌噬菌体cc31dna连接酶(seqidno:6)或野生型志贺氏菌噬菌体shf125875dna连接酶(seqidno:8)。在本发明的一个实施方案中,所述连接酶是修饰的连接酶。例如,修饰的连接酶包括修饰的t4dna连接酶、修饰的肠杆菌噬菌体cc31连接酶、修饰的志贺氏菌噬菌体shf125875连接酶和修饰的小球藻连接酶。在一个实施方案中,在seqidno:3的氨基酸位置368或氨基酸位置371处修饰野生型t4dna连接酶。在一个实施方案中,所述突变体连接酶包含seqidno:3(其中在位置368处的氨基酸是r或k)或由seqidno:3(其中在位置368处的氨基酸是r或k)组成。在一个实施方案中,所述突变体连接酶包含seqidno:3(其中在位置371处的氨基酸是以下氨基酸中的任一个:l、k、q、v、p、r)或由seqidno:3(其中在位置371处的氨基酸是以下氨基酸中的任一个:l、k、q、v、p、r)组成。在一个实施方案中,在上面关于t4dna连接酶公开的对应残基在肠杆菌噬菌体cc31连接酶、志贺氏菌噬菌体shf125875连接酶和小球藻连接酶中的任一个中发生突变。dna连接酶的保守区公开在chem.rev.2006,106,687-699和nucleicacidsresearch,2000,第28卷,第21期,4051-4058中。在一个实施方案中,在接头区域中修饰所述连接酶。在本发明的一个实施方案中,所述连接酶包含seqidno:23或与其具有至少90%序列同一性的连接酶或者由seqidno:23或与其具有至少90%序列同一性的连接酶组成,不包括野生型连接酶例如肠杆菌噬菌体cc31连接酶。在本发明的一个实施方案中,所述连接酶包含下述氨基酸序列中的任一个或由其组成:seqidno:10-28。在本发明的一个实施方案中,所述连接酶被固定化例如在珠粒上。用作起始原料的寡核苷酸用作本发明的方法的起始原料的寡核苷酸在本文中被描述为是“合并物”且在上面提供了其定义。所述合并物是寡核苷酸的非同质组。形成合并物的寡核苷酸已经通过其它寡核苷酸生产方法(例如,固相或酶促合成)来生产,且因此可能含有杂质。所述合并物由产物寡核苷酸的区段组成,所述区段然后当在模板上组装时连接在一起。每种区段将是含有不同长度的杂质和/或不正确地并入的残基的非同质组。使用酶产生区段寡核苷酸1)ss连接酶,例如rna连接酶ss连接酶催化atp驱动的以不依赖模板的方式向短寡核苷酸(引物)的3'-oh添加例如3',5'核苷酸双磷酸酯、3',5'核苷酸硫代磷酸酯(例如,3',5'双硫代磷酸酯或3'-磷酸酯-5'-硫代磷酸酯或3'-硫代磷酸酯-5'-磷酸酯)或3'5'核苷酸二硫代磷酸酯(例如,3',5'双二硫代磷酸酯或3'-磷酸酯-5'-二硫代磷酸酯或3'-二硫代磷酸酯-5'-磷酸酯)。技术人员将明白,尽管不需要额外的磷酸酯(或硫代磷酸酯)部分,也可以在糖部分的3'位置使用二磷酸酯(或二硫代磷酸酯)或三磷酸酯(或其它低聚磷酸酯,其中一个或多个氧原子已经被硫取代)。可以使用等效地修饰的二核苷酸、三核苷酸或四核苷酸代替上述单独的核苷酸。寡核苷酸引物通常最少为三个核苷酸长。该添加反应的得到的寡核苷酸比起始寡核苷酸长一个核苷酸(或如果分别使用二核苷酸、三核苷酸或四核苷酸,则比起始寡核苷酸长两个、三个或四个核苷酸)。现在,新的3'位置被磷酸化。为了添加随后的核苷酸,通过水解除去生长中的寡核苷酸的3'磷酸酯,以生成3'-oh。该水解通常使用磷酸酶完成,如图1中所示。2)转移酶末端脱氧核苷酸基转移酶(tdt)酶催化以不依赖模板的方式向短寡核苷酸(引物)的3'-oh添加3'-保护的核苷酸三磷酸酯,例如被3'-o-叠氮基甲基、3'-氨基氧基或3'-o-烯丙基基团保护。该寡核苷酸引物通常最少为三个核苷酸长。合适的方法阐述于例如ep2796552、us8808989、wo16128731a1和wo16139477a1中。上述用于产生区段寡核苷酸的ss连接酶和转移酶方法中使用的引物寡核苷酸可以:(1)如果期望,保留为区段寡核苷酸的一部分,或(2)从产物寡核苷酸切割,以允许分离期望的产物,并且允许有可能再循环以制备另外的区段寡核苷酸。可以使用序列特异性核酸酶以及引物和片段的适当设计来进行从区段寡核苷酸的引物的切割,使得该切割既有效又精确。实施例缩写omeo-甲基moeo-甲氧基乙基(dna主链)或甲氧基乙基(rna主链)cbd纤维素结合结构域hplc高效液相色谱法pbs磷酸盐缓冲盐水haa己基乙酸铵sdspage十二烷基硫酸钠聚丙烯酰胺凝胶电泳lcms液相色谱法质谱法po磷酸二酯dtt二硫苏糖醇ni-nta次氮基三乙酸镍/3phos/3'-磷酸酯基团/5phos/5'磷酸酯基团(p)磷酸酯基团ps或*硫代磷酸酯/ideoxyl/2'脱氧肌苷5mc5-甲基胞嘧啶bsa牛血清白蛋白lna锁定核酸wt野生型。实施例1:用野生型t4dna连接酶的寡核苷酸(dna)区段组装和连接1.1开始和控制序列的化学合成为了证明多个短寡核苷酸(“区段”)可以在互补模板链上以正确的次序组装并连接以产生期望的终产物(“靶标”),使用标准方法化学地合成在表1中详述的区段、靶标和模板序列。1.2hplc分析使用在0.2ml/min运行的agilentzorbaxeclipseplusxdb-c18柱(4.6x150mm,5μmdp.agilentp/n993967-902)实施hplc分析,同时在258nm监测吸光度。将柱维持在60℃。注射20µl样品,并在20分钟中运行20-31%缓冲液b的梯度,然后步增至80%缓冲液b持续5分钟。缓冲液a:75ml1mhaa,300ml异丙醇,200ml乙腈,4425ml水缓冲液b:650ml异丙醇,350ml乙腈。表1名称序列%hplc纯度量(mg)5'区段5'-ggccaa-3'100.021.6中央区段5'-(p)acctcggc-3'96.958.13'区段5'-(p)ttacct-3'98.839.8靶标5'-ggccaaacctcggcttacct-3'(seqidno:1)98.4101.7生物素化的模板5'-生物素tttaggtaagccgaggtttggcc-3'(seqidno:2)96.9130.7(p)磷酸酯。1.3用市售t4dna连接酶(seqidno:3)的寡核苷酸组装和连接方法在模板上组装5'区段、中央区段和3'区段:将每种区段和模板以1mg/ml的浓度溶解在水中且然后如下混合。5'区段2µl中央区段2µl3'区段2µl生物素化的模板2µlh2o36µl。将组合的寡核苷酸溶液在94℃孵育5分钟并冷却至37℃,然后在37℃孵育另外5分钟以允许所述区段与模板退火。然后加入2µl(等同于2µg)t4dna连接酶(neb)和4µl1xt4dna连接缓冲液(neb),并将反应物(总反应体积50µl)在室温孵育1小时。此后,加入40µl链霉抗生物素蛋白包被的磁珠,并将悬浮液在室温孵育10分钟以允许生物素化的模板结合链霉抗生物素蛋白珠粒。将链霉抗生物素蛋白珠粒用2x100µlpbs洗涤以除去未结合的区段。通过hplc分析洗液。然后将反应混合物在94℃孵育10分钟以与模板分离结合的连接产物(或任何结合的区段),然后在冰上快速冷却以‘解链’dna和停止寡核苷酸产物(或区段)与模板的重新退火。然后通过hplc实施连接反应的分析。1.4使用自制(in-house)t4dna连接酶珠粒浆的寡核苷酸组装和连接方法1.4.1珠粒浆产生使用标准的克隆、表达和提取方法产生在n-末端与纤维素结合结构域(cbd)融合的t4连接酶(seqidno:4)。该t4连接酶氨基酸序列与市售t4连接酶序列(seqidno:3)的差别在于,n-末端甲硫氨酸(m)已经被甘氨酸和丝氨酸(gs)替换。进行这些氨基酸取代以辅助cbd融合蛋白的产生和表达。在bl21a1细胞(invitrogen)中表达cbd-t4连接酶融合蛋白。收获上清液并加入600µlperloza100(perloza)珠粒中,并在26℃摇动1小时。然后收集perloza纤维素珠粒,并用2ml缓冲液(50mmtrisph8.0,200mmnacl,0.1%吐温20,10%甘油)洗涤,随后用5mlpbs洗涤,并最后重新悬浮在200µlpbs(10mmpo43-,137mmnacl,2.7mmkclph7.4)中。为了分析蛋白表达,将15µlperloza珠粒浆与5µlsds加载缓冲液混合并在80℃孵育10分钟,然后根据标准方案在sdspage梯度凝胶(4-20%)上运行。1.4.2使用珠粒浆的寡核苷酸组装和连接对于与perloza珠粒结合的t4连接酶,如下修改在上面1.3中的组装和连接方法。在最初的区段混合物中,将36µlh2o减少至8µlh2o。退火之后,将2µl市售t4dna连接酶用20µlperloza珠粒浆替换。在加入链霉抗生物素蛋白磁珠之前,将perloza珠粒离心并取出上清液。将链霉抗生物素蛋白磁珠加入上清液并在室温孵育10分钟以允许生物素化的模板结合链霉抗生物素蛋白珠粒。1.5结果和结论产物、模板和所有三个区段寡核苷酸在对照色谱图中明显地解析。连接酶反应的hplc分析显示,一些未连接的寡核苷酸区段得到保留,但是市售t4dna连接酶(neb)能够催化三个区段的连接以产生期望的产物寡核苷酸(图7)。perloza珠粒结合的t4dna连接酶看起来在连接寡核苷酸区段中不太有效,其中寡核苷酸区段出现在对照洗液样品和反应样品中(图8)。但是,难以确保与市售酶相比在珠粒上是否添加相同量的酶,所以连接效率的直接比较是不可能的。实施例2:用野生型t4dna连接酶的2'-ome核糖修饰的寡核苷酸区段组装和连接2.1在每个区段中在每个核苷酸位置处的2'ome为了确定t4dna连接酶是否能够连接在核糖环的2'位置处具有修饰的寡核苷酸区段,合成了具有与实施例1相同的序列的寡核苷酸区段,但是核糖环的2'位置被ome基团取代,且胸苷被如下所示的尿苷替换。表2名称序列%hplc纯度量(mg)5'区段2'-ome5'-ggccaa-3'2197.8中央区段2'-ome5'-(p)accucggc-3'15.597.73'区段2'-ome5'-(p)uuaccu-3'21.298.1靶标2'-ome5'-ggccaaaccucggcuuaccu-3'(seqidno:5)8896.9(p)=磷酸酯。用与perloza珠粒结合的市售neb连接酶和t4连接酶cbd融合体,使用实施例1的方法实施组装、连接和hplc分析。在市售t4dna连接酶(neb)实验的反应混合物中使用的水的量是26µl,而不是36µl,使得最终的反应体积是40µl。在自制t4dna连接酶珠粒浆实验的反应混合物中使用的水的量是23µl,且使用的珠粒的量是5µl,使得最终的反应体积也是40µl。平行地进行使用未修饰的dna(而不是2'-omedna)的对照实验。来自对照实验的结果是根据实施例1。对于2'-ome实验,使用hplc没有检测到产物,从而指示t4dna连接酶不能完全连接2'-ome修饰的寡核苷酸区段,不论是否使用与perloza珠粒结合的市售t4dna连接酶或自制t4dna连接酶cbd融合体。2.2在单个区段中在每个核苷酸位置处的2'-ome使用1mg/ml的每种寡核苷酸的溶液,建立如在表3中详述的反应。表3实验1(无连接酶对照)实验2(单个2'-ome区段-3')实验3(单个2'-ome区段-5')实验4(所有2'-ome)实验5(所有未修饰的)体积(µl)模板模板模板模板模板25'区段5'区段2'-ome取代的5'区段2'-ome取代的5'区段5'区段23'区段2'-ome取代的3'区段3'区段2'-ome取代的3'区段3'区段2中央区段中央区段中央区段2'-ome取代的中央区段中央区段2h2oh2oh2oh2oh2o直到总共40用市售neb连接酶和自制perloza结合的t4dna连接酶,使用实施例1的方法实施组装和连接。将反应物在94℃孵育5分钟,随后在37℃孵育5分钟以允许退火。将4µl1xnebt4dna连接缓冲液与5µl(大约2µg)自制t4dna连接酶或2µl(大约2µg)市售t4dna连接酶(除了实验1以外,它是无连接酶对照)一起加入每个反应物,并允许连接反应在室温进行2小时。然后将链霉抗生物素蛋白磁珠加入每个反应物,并将反应物加热至94℃,然后如在实施例1中所述在冰上快速冷却以与起始原料和产物分离模板。将处理过的反应物分成两半:如关于实施例1(部分1.2)所述通过hplc分析一半。保留另一半样品用于质谱法以证实hplc结果。未修饰的寡核苷酸区段的连接(实验5)按预期进行以产生全长产物。如在图9中所示,当5'区段被2'-ome取代时看到少量连接(实验3),但是当3'区段被2'-ome取代时没有看到连接(实验2)。根据2.1,当所有三个区段被2'-ome取代时,没有看到显著产物(实验4)。2.3结论野生型t4dna连接酶在连接2'-ome取代的寡核苷酸区段中是差的,但是与3'区段相比对5'寡核苷酸区段的修饰稍微不太敏感。实施例3:用野生型和突变体连接酶的2'-ome核糖修饰的寡核苷酸区段组装和连接3.1材料使用标准的克隆、表达和提取方法,生产野生型肠杆菌噬菌体连接酶cc31(seqidno:6)、野生型志贺氏菌噬菌体shf125875连接酶(seqidno:8)和seqidno:10-19的10种突变体t4连接酶(各自在n-末端处融合至cbd)。如在1.4.1中公开的,为了产生和表达cbd融合蛋白,在每种情况下用甘氨酸和丝氨酸(gs)替换n-末端甲硫氨酸(m)(例如肠杆菌噬菌体连接酶cc31的seqidno:7和志贺氏菌噬菌体shf125875连接酶的seqidno:9)。通过标准固相方法合成下述寡核苷酸。表4名称序列%hplc纯度量(mg)5'区段*5'-(ome)g(ome)g(ome)c(ome)c(ome)aa-3'99.3524.7中央区段5'-(p)acctcggc-3'96.958.13'区段5'-(p)ttacct-3'97.8829.5生物素化的模板5'-生物素tttaggtaagccgaggtttggcc-3'(seqidno:2)96.9130.7n.b.ome指示在核糖环上的2'甲氧基取代(p)=磷酸酯。*应当指出,前5个核苷酸是2'-ome修饰的(ggcca),但是最终的a不是。3.2用连接酶珠粒浆的寡核苷酸组装和连接方法3.2.1珠粒浆产生如在1.4中所述使与cbd融合的连接酶结合至perloza珠粒以产生珠粒浆。3.2.2使用珠粒浆的寡核苷酸组装和连接在96孔板中用下面的组分制备连接反应物至50µl的终体积:2µl~1mg/ml5'(2'-ome)区段2µl~1mg/ml中央区段2µl~1mg/ml3'区段2µl~1mg/ml模板5µlnebt4dna连接酶缓冲液22µlh2o15µlperloza结合的珠粒浆。在加入perloza珠粒浆之前将反应物在室温孵育15分钟以允许区段与模板退火。加入perloza珠粒浆,并将反应物在室温孵育1小时。1小时孵育之后,将溶液转移进acoprepadvance350滤板(pn8082),并将滤板放在abgenesuperplate(thermoscientific,#ab-2800)的上面并在4,000rpm离心10分钟以除去perloza珠粒浆。然后使用在实施例1(部分1.2)中描述的方法通过hplc分析溶液。对于每种连接酶,将每次寡核苷酸组装和连接重复6次。3.3结果和结论野生型肠杆菌噬菌体cc31连接酶(seqidno:6)和野生型志贺氏菌噬菌体shf125875连接酶(seqidno:8)能够将2'ome取代的5'区段(其含有5个2'-ome核碱基和1个脱氧核碱基)连接至仅含有未修饰的dna的区段。另外,尽管野生型t4dna连接酶(seqidno:3和4)难以进行该反应,如在实施例2中所示和在这里再次证实的,但是许多在位置368和371处的突变为连接酶赋予将2'-ome取代的5'区段(其含有5个2'ome核碱基和1个脱氧核碱基)连接至仅含有未修饰的dna的区段的能力(seqidno:10-19)。实施例4:用突变体dna连接酶的2'moe核糖修饰的和5-甲基嘧啶修饰的寡核苷酸区段组装和连接4.1材料通过标准的基于固相的方法合成如下面表5所述的修饰的寡核苷酸区段。表5区段序列分子量质量(mg)%纯度中央区段5'-(p)dcdcdtdcdgdg-3'2044.1223998.96moe3'-区段5'-(p)dcdtmtmamcmcmt-3'2699.6795297.79moe5'-区段5'-mgmgmcmcmadada-3'2644.7714899.13(p)=磷酸酯,mx=moe碱基,dx=dna碱基所有5-甲基嘧啶。使用标准的克隆、表达和提取方法将基于野生型肠杆菌噬菌体cc31连接酶、野生型t4连接酶和野生型志贺氏菌噬菌体shf125875连接酶的突变体dna连接酶(seqidno:20-28)各自在n-末端融合至纤维素结合结构域(cbd)。如在1.4中所述将与cbd融合的连接酶结合至perloza珠粒以产生珠粒浆。为了从perloza珠粒释放连接酶,将2µltev蛋白酶加入浆并在4℃孵育过夜。将切割的蛋白(现在缺乏纤维素结合结构域)通过以4000rpm离心10min进行收集。4.2方法如下建立反应:中央区段 最终20µmmoe3'区段 最终20µmmoe5'区段 最终20µm模板 最终20µmnebt4dna连接酶缓冲液 5µl突变体dna连接酶 15µlh2o 以制备最终的反应体积50µl。在加入dna连接酶之前将所有组分混合和涡旋。将反应物在35℃孵育1小时。1小时之后,通过在pcr区块中在95℃加热5分钟,停止反应。根据在实施例1(部分1.2)中使用的hplc方案,通过hplc和lcms分析样品以证实产物身份。包括市售nebt4dna连接酶的对照和阴性对照(h2o替代任何连接酶)。4.3结果和结论图10显示了对照反应和由seqidno:23(克隆a4-突变体肠杆菌噬菌体cc31连接酶)催化的反应的hplc迹线。产物和模板使用该hplc方法共洗脱,所以产物随着产物+模板峰的峰面积的增加而出现。在突变体连接酶迹线(b)中,不仅产物+模板峰增加,而且两个新峰出现在10.3和11.2分钟。这些峰对应于中央区段与moe5'区段或moe3'区段的连接。并且,输入区段峰实质上小于对照,与产物和中间体峰增加一致。neb市售t4连接酶迹线(a)显示模板+产物的峰面积的轻微增加,少量中间连接产物以及输入寡核苷酸区段的伴随减少。但是,突变体连接酶(seqidno:23)显示实质上更大的产物+模板峰面积和输入寡核苷酸区段的峰面积的伴随减少。因此,就2'moe取代的区段而言,突变体连接酶(seqidno:23)是比市售t4dna连接酶远远更有效的连接酶。对于其它突变体连接酶(seqidno:20、21、24-28),显示类似的改善。实施例5:不同的核苷酸配对在连接位点处的影响5.1材料使用标准的克隆、表达和提取方法,生产了在n-末端与纤维素结合结构域(cbd)融合的突变体肠杆菌噬菌体cc31连接酶(seqidno:23)。将提取的cbd-突变体肠杆菌噬菌体cc31连接酶融合蛋白添加至25mlperloza100(perloza)纤维素珠粒并在20℃摇动1小时。然后收集perloza珠粒,并用250ml缓冲液(50mmtrisph8.0,200mmnacl,0.1%吐温20,10%甘油)洗涤,随后用250mlpbs洗涤,最后重新悬浮在10mlpbs(10mmpo43-,137mmnacl,2.7mmkclph7.4)中。为了分析蛋白表达,将15µlperloza珠粒浆与5µlsds加载缓冲液混合并在80℃孵育10分钟,然后根据标准方案在sdspage梯度凝胶(4-20%)上运行。为了从珠粒释放连接酶,加入70µltev蛋白酶并在摇动下在4℃孵育过夜。通过用80mlpbs洗涤消化过的珠粒来收集连接酶。然后使用amicon30kdmco过滤器将连接酶浓缩至1.2ml。通过标准固相方法合成了下述生物素化的dna模板寡核苷酸(表6)和dna区段寡核苷酸(表7)。请注意,粗体的核苷酸是存在于连接位点处的核苷酸(即在连接反应中连接在一起的那些核苷酸-表7;和与经由连接反应连接在一起的那些互补的那些核苷酸-表6)。表6:模板编号序列(与连接核苷酸互补的核苷酸呈粗体)seqidno15'-生物素tttggtgcgaagcagactgaggc-3'3025'-生物素tttggtgcgaagcagagtgaggc-3'3135'-生物素tttggtgcgaagcagattgaggc-3'3245'-生物素tttggtgcgaagcagaatgaggc-3'3355'-生物素tttggtgcgaagcagtctgaggc-3'3465'-生物素tttggtgcgaagcagtgtgaggc-3'3575'-生物素tttggtgcgaagcagtttgaggc-3'3685'-生物素tttggtgcgaagcagtatgaggc-3'3795'-生物素tttggtgcgaagcagcctgaggc-3'38105'-生物素tttggtgcgaagcagcgtgaggc-3'39115'-生物素tttggtgcgaagcagcttgaggc-3'40125'-生物素tttggtgcgaagcagcatgaggc-3'41135'-生物素tttggtgcgaagcaggctgaggc-3'42145'-生物素tttggtgcgaagcagggtgaggc-3'43155'-生物素tttggtgcgaagcaggttgaggc-3'44165'-生物素tttggtgcgaagcaggatgaggc-3'45表7区段标识符序列(连接核苷酸呈粗体)5'a5'-gcctcag-3'5'b5'-gcctcac-3'5'c5'-gcctcaa-3'5'd5'-gcctcat-3'3'e5'-(p)tctgct-3'3'f5'-(p)actgct-3'3'g5'-(p)cctgct-3'3'h5'-(p)gctgct-3'(p)=磷酸酯。n.b.请注意,不同于以前的实施例,在该实施例中的连接反应涉及将两个区段连接在一起:5'-区段和3'-区段,即不存在中央区段。5.2方法如下建立反应:表8模板5'-区段3'-区段1ae2be3ce4de5af6bf7cf8df9ah10bh11ch12dh13ag14bg15cg16dg对于每50µl反应:3'区段(1mm储备物,最终20µm) 1µl5'区段(1mm储备物,最终20µm) 1µl模板(1mm储备物,最终20µm) 1µlnebdna连接酶缓冲液(对于t4连接酶) 5µl突变体cc31dna连接酶(0.45mm储备物,最终90µm) 10µlh2o 补至50µl。将每种反应混合物在35℃孵育30分钟和1小时。通过在95℃加热5分钟,终止每种反应。实施hplc分析。5.3结果和结论在hplc分析中,所有反应在1小时孵育后产生产物峰。因此,所述连接方法对于在待连接的接头处的所有核苷酸组合都起作用。提高产物产率的优化是可能的,但并非必需的,因为结果是明确的,且显然所述反应对于在待连接的接头处的所有核苷酸组合都起作用。实施例6:不同的修饰在连接位点处的影响6.1材料如在5.1中所述生产突变体肠杆菌噬菌体cc31连接酶(seqidno:23),并购买小球藻病毒dna连接酶(seqidno:29,作为splintr连接酶商购可得,neb)。通过标准固相方法合成了下述生物素化的模板寡核苷酸和区段寡核苷酸(表9)。表9名称序列(连接部修饰呈粗体)模板5'-生物素tttaggtaagccgaggtttggcc-3'(seqidno:2)5'区段(wt)5'-ggccaaa-3'5'区段(mo1)5'-ggccaa(ome)a-3'5'区段(mo2)5'-ggccaa(f)a-3'中央区段(wt)5'-(p)cctcgg-3'中央区段(mo4a)5'-(p)(ome)cctcgg-3'中央区段(mo5a)5'-(p)(f)cctcgg-3'中央区段(mo7)5'(p)(me)cctcgg-3'3'区段(wt)5'-(p)cttacct-3'3'区段(mo8)5'-(p)(me)cttacct3'ome指示在核糖环上的2'甲氧基取代f指示在核糖环上的2'氟取代所有剩余的糖残基是脱氧核糖残基me指示5-甲基胞嘧啶。6.2方法如下建立反应:表10反应5'区段中央区段3'区段1wtwtwt2wtmo4awt3wtmo5awt4wtmo7wt5mo1wtwt6mo1mo4awt7mo1mo5awt8mo1mo7wt9mo2wtwt10mo2mo4awt11mo2mo5awt12mo2mo7wt13wtwtmo814wtmo4amo815wtmo5amo816wtmo7mo817mo1wtmo818mo1mo4amo819mo1mo5amo820mo1mo7mo821mo2wtmo822mo2mo4amo823mo2mo5amo824mo2mo7mo8对于每50µl反应:3'-区段(1mm,储备物,最终20µm) 1µl中央区段(1mm,储备物,最终20µm) 1µl5'-区段(1mm,储备物,最终20µm) 1µl模板(1mm,储备物,最终20µm) 1µlh2o 补至50µl。对于突变体肠杆菌噬菌体cc31连接酶(seqidno:23)dna连接酶缓冲液(50mmtris-hcl,1mmdtt) 5µl突变体cc31dna连接酶(0.45mm) 10µlmncl2(50mm) 5µlatp(10mm) 10µl。然而对于小球藻病毒dna连接酶(seqidno:29,作为splintr连接酶商购可得,neb)nebdna连接酶缓冲液(对于小球藻) 5µl小球藻病毒dna连接酶 2µl。将每种反应混合物在20℃孵育1小时。通过在95℃加热10分钟,终止每个反应。使用实施例1的方法实施hplc分析。6.3结果和结论在hplc分析中,所有反应产生产物峰。因此,所述连接方法对于在待连接的接头处测试的所有修饰组合都起作用。提高产物产率的优化是可能的,但并非必需的,因为结果是明确的,且显然所述反应对于在待连接的接头处测试的所有修饰组合都起作用。实施例7:使用不同数目的区段构建较大寡核苷酸的能力7.1材料如在5.1中所述生产突变体肠杆菌噬菌体cc31连接酶(seqidno:23)。通过标准固相方法合成下述生物素化的模板dna寡核苷酸和dna区段寡核苷酸(表11)。表11名称序列模板5'-生物素tttggtgcgaagcagaaggtaagccgaggtttggcc-3' (seqidno:47)5'区段(1)5'-ggccaaa-3'中央区段(2)5'-(p)cctcgg-3'中央区段/3'区段(5)5'-(p)tctgct-3'中央区段(3)5'-(p)cttacct-3'3'区段(4)5'-(p)tcgcacc-3'(p)=磷酸酯,7.2方法如下建立反应:表125'区段中央区段3'区段区段的总数12和35412、3和545在磷酸盐缓冲盐水(ph=7.04)中以100µl的总体积运行反应并如下建立:-模板(最终20µm)每个区段(最终20µm)mgcl2(最终10mm)atp(最终100µm)突变体cc31dna连接酶(最终25µm)。将每种反应物在28℃孵育过夜,然后通过在94℃加热1分钟进行终止。通过hplc质谱法分析产物。7.3结果和结论使用4个区段的反应产生了27个碱基对长度的完全连接的产物。使用5个区段的反应产生了33个碱基对长度的产物。在两种情况下,观察到的产物的质量与对于期望的序列预期的质量一致。综上所述,显然可能组装多个区段以产生期望长度的寡核苷酸和由适当的互补模板序列定义的序列。实施例8:5-10-5区段的组装和连接以形成gapmer,其中5'和3'区段包含:(i)2'-ome核糖糖修饰,(ii)硫代磷酸酯键,或(iii)2'-ome核糖糖修饰和硫代磷酸酯键;且其中所述中央区段是未修饰的dna。8.1材料如在5.1中所述生产突变体肠杆菌噬菌体cc31连接酶(seqidno:23)。通过标准固相方法合成下述生物素化的模板dna寡核苷酸和区段寡核苷酸(表13)。表13名称序列模板5'-生物素tttggtgcgaagcagactgaggc-3'(seqidno:30)3'区段(3ome)5'-(p)(ome)g(ome)c(ome)c(ome)t(ome)c-3'3'区段(3ps+ome)5'-(p)(ome)g*(ome)c*(ome)c*(ome)t*(ome)c-3'3'区段(3ps)5'-(p)g*c*c*t*c-3'中央区段(d)5'-(p)agtctgcttc-3'5'区段(5ome)5'-(ome)g(ome)c(ome)a(ome)c(ome)c-3'5'区段(5ps+ome)5'-(ome)g*(ome)c*(ome)a*(ome)c*(ome)c-3'5'区段(5ps)5'-g*c*a*c*c-3'ome指示在核糖环上的2'甲氧基取代所有剩余的糖残基是脱氧核糖残基*硫代磷酸酯。8.2方法如下建立反应:表14反应3'区段中央区段5'区段13psd5ps23omed5ome33ps+omed5ps+ome以100µl终体积在磷酸盐缓冲盐水中用下述组分建立反应1、2和3中的每一个:-3'区段 最终20µm中央区段 最终20µm5'区段 最终20µm模板 最终20µmmgcl2 最终10mmatp 最终50µm酶 最终25µm。将每种反应混合物在20℃孵育过夜。通过在95℃加热10分钟,终止每个反应。实施hplc质谱法分析。8.3结果和结论在所有三个反应中产生了与所有三个片段的成功连接对应的产物寡核苷酸。因此,突变体肠杆菌噬菌体cc31连接酶(seqidno:23)能够将3个区段连接在一起以形成‘gapmer',其中5'和3'‘翼’具有硫代磷酸酯主链,而中央区域具有磷酸二酯主链,且在gapmer中的所有糖残基是脱氧核糖残基。肠杆菌噬菌体cc31连接酶(seqidno:23)也能够将3个区段连接在一起以形成‘gapmer’,其中5'和3'‘翼’具有2'-甲氧基核糖(2'-ome)残基,而中央区域具有脱氧核糖残基,且所有连接是磷酸二酯键。最后,肠杆菌噬菌体cc31连接酶(seqidno:23)能够将3个区段连接在一起以形成‘gapmer’,其中5'和3'‘翼’具有组合的修饰(硫代磷酸酯主链和2'-甲氧基核糖残基),而中央区域具有脱氧核糖残基和磷酸二酯键。实施例9:包含锁核酸(lna)的区段的组装和连接9.1材料如在5.1中所述生产突变体肠杆菌噬菌体cc31连接酶(seqidno:23)。如在13.1中所述生产突变体金黄色葡萄球菌nad依赖性连接酶(nad-14)。通过标准固相方法合成了下述生物素化的模板dna寡核苷酸和区段寡核苷酸(表15)。表15名称序列模板5'-生物素tttggtgcgaagcagactgaggc-3'(seqidno:30)5'-区段5'-gcctcag-3'lna5'-区段(寡聚物1)5'-gcctca(lna)g-3'中央区段5'-(p)tctgct-3'lna中央区段(寡聚物2)5'-(p)(lna)tctgct-3'(p)=磷酸酯lna=锁核酸。9.2方法如下建立反应:反应体积100µl模板 最终20µm酶 最终25µm所有寡核苷酸区段 最终20µm。在表16中所述,使用不同的酶(突变体肠杆菌噬菌体cc31连接酶(seqidno:23)或nad-14)、二价阳离子(mg2+或mn2+)和寡核苷酸区段的组合,建立反应。表16酶seqidno:23seqidno:23nad-14nad-14二价阳离子10mmmgcl210mmmncl210mmmgcl210mmmncl2辅因子100µmatp100µmatp100µmnad100µmnad缓冲液pbs,ph=7.04pbs,ph=7.0450mmkh2po4,ph7.550mmkh2po4,ph7.55'区段+中央区段产物产物产物产物寡聚物1+中央区段产物产物产物产物5'区段+寡聚物2产物产物产物产物寡聚物1+寡聚物2无产物无产物无产物无产物将每种反应混合物在28℃孵育过夜。通过在94℃加热1分钟,终止每个反应。实施hplc质谱法分析。9.3结果和结论在对照反应中生产产物寡核苷酸(仅未修饰的寡核苷酸),且其中将单个锁核酸包括在一个区段中在连接连接部处,不论它是否是在所述连接部的3'或5'侧。当将锁核酸包括在两侧(寡聚物1+寡聚物2)时,没有检测到产物。数据对于两种酶是类似的,且不论是否使用mg2+或mn2+。可以实施酶突变和/或选择筛选以鉴别能够连接在连接部的3'和5'侧具有锁核酸的区段的酶。实施例10:在mg2+或mn2+存在的情况下使用肠杆菌噬菌体cc31连接酶的变体组装和连接3个区段(7-6-7)以形成gapmer,其中5'和3'区段包含2'moe核糖糖修饰,且所有连接是硫代磷酸酯键。10.1硫代磷酸酯键形成为了确定突变体肠杆菌噬菌体cc31连接酶(seqidno:23)是否能够连接具有硫代磷酸酯主链、2'moe核糖糖修饰和5-甲基化的嘧啶碱基的修饰的寡核苷酸区段,使用在表15中所示的寡核苷酸区段进行反应。在mg2+和mn2+离子的情况存在下进行反应。10.2材料使用如下所示的标准方法化学合成寡核苷酸:表17名称序列5'区段2'-moeps5'-mg*mg*mc*mc*ma*da*da-3'中央区段ps5'-(p)*dc*dc*dt*dc*dg*dg-3'3'区段2'-moeps5'-(p)*dc*dt*mu*ma*mc*mc*mu-3'生物素化的模板5'-生物素dtdtdtdadgdgdtdadadgdcdcdgdadgdgdtdtdtdgdgdcdc-3'(seqidno:2)(p)*=5'-硫代磷酸酯,*=硫代磷酸酯键,mx=moe碱基,dx=dna碱基所有区段和产物具有5-甲基嘧啶(除了模板以外)认为mt和m(me)u是等同的。n.b.当与表17中所示的生物素化的模板杂交时,通过连接表17中的区段所产生的靶2'moeps分子是:5'-mg*mg*mc*mc*ma*da*da*dc*dc*dt*dc*dg*dg*dc*dt*mu*ma*mc*mc*mu-3'(seqidno:1)。如在实施例5.1中所述制备纯化的突变体肠杆菌噬菌体cc31连接酶(seqidno:23)。实施hplc分析。10.3用肠杆菌噬菌体cc31连接酶变体(seqidno:23)的寡核苷酸组装和连接方法如下制备反应物:mgcl2反应10xt4dna连接酶缓冲液(neb)* 5µl模板 20µm最终浓度5'区段2'moeps 20µm最终浓度中央区段ps 20µm最终浓度3'区段2'moeps 20µm最终浓度连接酶(24.3µm) 10µl水 补至50µl*1x缓冲液含有50mmtris-hcl,10mmmgcl2,1mmatp,10mmdtt,ph7.5。mncl2反应10x连接酶缓冲液* 5µlatp(10mm) 5µlmncl2(50mm) 5µl模板 20µm最终浓度5'区段2'moeps 20µm最终浓度中央区段ps 20µm最终浓度3'区段2'moeps 20µm最终浓度连接酶(24.3µm) 10µl水 补至50µl*1x缓冲液含有50mmtris-hcl,10mmdtt,ph7.5。最终的反应物含有20µm每种区段和模板、5mmmgcl2或5mmmncl2、1mmatp、50mmtris-hcl、10mmdtt(ph7.5)和4.9µm连接酶。制备不含酶的额外的反应并用作阴性对照。将反应物在25℃孵育16小时,且然后通过加热至95℃持续5分钟来淬灭。将沉淀的蛋白通过离心进行澄清,并通过hplc分析样品。10.4结果和结论产物、模板和区段寡核苷酸在对照色谱图中明显地解析且没有观察到连接。在5mmmgcl2存在的情况下进行的连接酶反应导致从5'区段和中央区段的连接形成的中间产物的形成,但是没有检测到全长产物。在mncl2存在的情况下进行的连接酶反应产生了全长产物和中间体(5'区段+中央区段中间体)。两种连接酶反应显示,未连接的寡核苷酸区段被保留。但是,为了使产物产率最大化,方案的优化是可能的。实施例11:在天然mg2+存在的情况下使用野生型小球藻病毒dna连接酶组装和连接三个区段(7-6-7)以形成gapmer,其中5'和3'区段包含2'moe核糖糖修饰,且所有连接是硫代磷酸酯键11.1材料为了确定小球藻病毒dna连接酶(seqidno:29,作为splintr连接酶商购可得,neb)是否能够连接具有硫代磷酸酯主链、2'moe核糖糖修饰和5-甲基化的嘧啶碱基的修饰的寡核苷酸区段,使用在实施例10.2表17中所示的寡核苷酸区段进行反应。在25℃、30℃和37℃进行反应以研究温度对酶活性的影响。11.2用市售小球藻病毒dna连接酶(seqidno:29)的寡核苷酸组装和连接方法如下面详述的,将每种寡核苷酸区段和模板溶解在不含核酸酶的水中:生物素化的模板 249.6ng/µl5'区段2'moeps 182.0ng/µl中央区段ps 534.0ng/µl3'区段2'moeps 531.0ng/µl。如下制备反应物:10x缓冲液(neb)* 6µl模板 3.8µl5'区段2'moeps 18.1µl中央区段ps 4.8µl3'区段2'moeps 6.3µl水 15µlsplintr连接酶(25u/µl) 6µl*1x缓冲液含有50mmtris-hcl,10mmmgcl2,1mmatp,10mmdtt,ph7.5。最终的反应物含有20µm每种区段和模板、50mmtris-hcl、10mmmgcl2、1mmatp、10mmdtt(ph7.5)和2.5u/µl连接酶。在25℃、30℃和37℃孵育反应物。制备不含酶的额外的反应并用作阴性对照。在16小时孵育之后,通过加热至95℃持续10分钟,淬灭反应。将沉淀的蛋白通过离心进行澄清,并通过hplc分析样品。11.3结果和结论产物、模板和区段寡核苷酸在对照色谱图中明显地解析且没有观察到连接。连接酶反应的hplc分析显示,未连接的寡核苷酸区段被保留,但是小球藻病毒dna连接酶能够成功地连接所述区段。所述连接酶的活性随着温度升高而增加。在25℃,小球藻病毒dna连接酶能够成功地连接5'区段和中央区段,但是没有观察到全长产物。在30℃和37℃,除了从5'区段和中央区段形成的中间体以外,检测到全长产物。实施例12:针对连接三个区段(7-6-7)以形成gapmer的活性筛选一组15种atp和nad连接酶,其中5'和3'区段包含2'moe核糖糖修饰,且所有连接是硫代磷酸酯键12.1材料将在表18和19中描述的野生型atp和nad依赖性连接酶各自在n-末端融合至cbd。使用标准的克隆、表达和提取方法合成基因,克隆至pet28a中并在大肠杆菌bl21(de3)中表达。表18atp依赖性连接酶。表19nad依赖性连接酶。经以下修改如在1.4中所述使cbd-连接酶融合体结合至perloza珠粒。从bl21(de3)细胞(neb)的单个集落生长cbd-连接酶融合蛋白,并在50ml表达培养物中生长。将细胞通过离心收获,重新悬浮在5-10mltris-hcl(50mm,ph7.5)中并通过声处理裂解。将裂解物通过离心澄清,并将1mlperloza100(perloza)珠粒(50%浆,用50mmtris-hclph7.5预平衡)加入上清液,将其在20℃摇动1小时。然后将perloza纤维素珠粒收集,并用30ml缓冲液(50mmtrisph8.0,200mmnacl,0.1%吐温20,10%甘油)洗涤,随后用10mltris-hcl(50mm,ph7.5)洗涤,并最后重新悬浮在1mltris-hcl(50mm,ph7.5)中。为了分析蛋白表达,将20µlperloza珠粒浆与20µlsds加载缓冲液混合并在95℃孵育5分钟,然后根据标准方案在sdspage梯度凝胶(4-20%)上运行。12.22'moe和硫代磷酸酯修饰的寡核苷酸组装和连接方法使用在实施例10.2表17中所示的具有硫代磷酸酯主链、2'moe核糖糖修饰和5-甲基化的嘧啶碱基的修饰的寡核苷酸区段。如下面详述的,将每种寡核苷酸区段和模板溶解在不含核酸酶的水中:生物素化的模板 1500ng/µl5'区段2'moeps 1008ng/µl中央区段ps 725ng/µl3'区段2'moeps 1112ng/µl。如下制备atp测定混合物:模板 85.6µl5'区段2'moeps 43.5µl中央区段ps 46.8µl3'区段2'moeps 40.1µldtt1m 8µlmgcl21m 4µlatp(50mm) 16µltris0.5m 80µl水 476µl。如下制备nad测定混合物:模板 85.6µl5'区段2'moeps 43.5µl中央区段ps 46.8µl3'区段2'moeps 40.1µldtt1m 8µlmgcl21m 4µlnad(50mm) 1.6µltris0.5m 80µl水 490.4µl。将每种固定化的蛋白(40µl,50%perloza珠粒浆)抽吸入pcr管中。将珠粒通过离心沉淀,并将上清液通过抽吸除去。将测定混合物(40µl)加入每种反应物(最终的反应物含有20µm每种区段和模板、50mmtris-hcl、10mmmgcl2、1mmatp或100µmnad、10mmdtt(ph7.5)和40µl在perloza珠粒上的连接酶)。不含蛋白的反应用作阴性对照。将反应物在30℃孵育18小时,且然后通过加热至95℃持续10分钟进行淬灭。将沉淀的蛋白通过离心进行澄清,并通过hplc分析样品。12.3结果和结论产物、模板和区段寡核苷酸在对照色谱图中明显地解析且没有观察到连接。连接酶反应的hplc分析显示,所有蛋白催化5'区段和中央区段的成功连接以形成中间产物,但是仅一些连接酶催化所有三个区段的连接以产生全长产物,如表20中所述。来自金黄色葡萄球菌的nad依赖性连接酶(sanad,seqidno:61)产生了最多的全长产物。提高产物产率的优化是可能的且在技术人员的技能内。表20*相对于模板从hplc峰面积计算转化率,所述模板在反应中没有消耗且用作内部标准品。转化率=产物面积/(模板+产物面积)*100。实施例13:半连续连接反应13.1材料使用标准的克隆、表达和提取方法产生在n-末端与cbd融合的突变体金黄色葡萄球菌连接酶(nad-14)。然后使cbd-nad-14突变体连接酶结合至perloza珠粒:将50ml蛋白裂解物添加至7.5mlperloza珠粒,在室温孵育1小时,且然后将珠粒收集在玻璃柱(bioradecono-column10cm长度,2.5cm直径#7372512)中。将珠粒用200ml缓冲液y(50mmtris8,500mmnacl,0.1%吐温20,10%甘油)洗涤,然后用200ml缓冲液z(50mmtris8,200mmnacl,0.1%吐温20,10%甘油)和200mlpbs洗涤。在珠粒上的突变体nad-14连接酶的估计浓度是69µm连接酶/ml珠粒。通过标准固相方法合成了下述模板dna寡核苷酸和区段寡核苷酸(表21)。表21区段序列分子量%hplc纯度模板35'tttggtgcgaagcagactgaggc-3'(seqidno:30)中央区段5'-(p)dtdcdtdgdcdt-3'1865.497.5moe3'-区段5'-(p)dtdcmgmcmamcmc-3'2546.798.0moe5'-区段5'-mgmcmcmumcdadg-3'2492.798.3(p)=磷酸酯,mx=moe碱基,dx=dna碱基所有5-甲基嘧啶所有连接是磷酸二酯键。生产了“三-模板hub’”(大约24kda),其包含被称作“hub’”的支持材料和三个模板序列(图11)。每个模板拷贝在它自己的单独附接点处共价地附接至“hub”。“三-模板hub”分子具有比靶标(产物)寡核苷酸(与模板序列100%互补)更高的分子量,由此当从反应混合物分离杂质和产物时允许它被保留。应当指出,在该特定情况下,模板序列是seqidno:30,且将三个拷贝附接至hub。在下述实施例中,也生产了三-模板hub,但是具有不同的模板序列。因此,随着模板序列在实施例之间变化,所以三-模板hub也变化。制备了下述反应混合物(总体积5ml):250µl 1mkh2po4,ph7.5 (最终50mm)108µl 0.07011m中央区段 (最终1.5mm)137µl 0.05481m3'-区段 (最终1.5mm)168µl 0.04461m5'-区段 (最终1.5mm)750µl 0.00387mhub(模板) (最终0.55mm)350µl 50mmnad+ (最终3.5mm)1000µl 50mmmgcl2 (最终10mm)2237µl 无核酸酶的h2o。13.2方法如在图12中所示建立半连续系统。将4mlperloza珠粒和固定化的突变体nad-14连接酶填充进pharmaciaxk16柱(b)中。使用柱水隔室,使用水浴和蠕动泵(c)保持柱温在30℃。通过使120ml(30x柱体积)的含有50mmkh2po4的缓冲液(在ph7.5)以1ml/min运行120分钟,使珠粒平衡。使用akta探测泵a1(a)建立穿过pharmaciaxk16柱的流。在柱平衡之后,将5ml反应混合物(通过涡旋混合均匀)加载到柱上,收集在蓄池管(d)中并使用akta探测泵a1穿过柱再循环。将反应混合物以连续循环模式以1ml/min的流速通过所述系统再循环16小时。在30分钟、60分钟、90分钟、4小时、5小时、6小时、7小时、14小时和16小时之后收集样品用于hplc分析。13.3结果和结论表22样品5'-区段(%)中央区段(%)3'-区段(%)5'+中央中间体(%)产物(%)30min7.8011.0024.0039.404.4060min3.304.5018.8041.5018.9090min2.102.8015.1033.8034.404hr1.802.409.6019.2056.805hr1.722.408.3015.7061.506hr1.692.508.6015.9069.407hr1.702.408.3014.8070.9014hr2.002.701.605.4088.1016hr0.801.901.703.3089.50将每个区段、中间体和产物的百分比表示为相对于三-模板hub峰面积的峰面积分数。综上所述,半连续流反应起作用,且在16小时之后,反应几乎结束。实施例14:通过过滤分离不同大小的寡核苷酸:a)分离20-聚体寡核苷酸(seqidno:1)和包含三个非互补的20-聚体寡核苷酸的hub(seqidno:30);(b)从区段6-聚体和8-聚体寡核苷酸(参见表1)以及包含三个互补20-聚体寡核苷酸的hub(seqidno:2)分离20-聚体寡核苷酸(seqidno:1)。14.1材料通过标准固相方法合成了所有使用的寡核苷酸。使用如在13.1中所述的三-模板hub(图11)。如在表23和24中所示,使用多种具有不同分子量截止值且来自不同生产商的过滤器。14.2方法14.2.1用于筛选聚合物膜的盲端过滤设置和方案:(方案1)如在图13中所示建立盲端过滤装备,其包含置于水浴中的met盲端过滤单元,所述水浴安置在磁力搅拌器和加热板上。从氮气流提供所述单元内的压强。首先将待测试的膜的试样(coupon)(14cm2)切割至适当大小并放在所述单元中。首先将所述膜用hplc级水(200ml)调节,且然后用pbs缓冲液(200ml)调节。然后将所述单元泄压,将剩余的pbs溶液除去并用含有寡核苷酸的溶液(40ml寡核苷酸在pbs中,1g/l浓度)替换。将所述单元放在热搅拌板上并将所述溶液加热至期望的温度,同时使用磁力搅拌进行搅拌。将压强应用于所述单元(达到大约3.0巴;在每种情况下记录实际压强)。停止或继续溶液的搅拌,并收集渗透物溶液(大约20ml)和通过hplc进行分析。记录流量。然后将系统泄压以允许渗余物溶液的取样和hplc分析。然后将更多的pbs缓冲液(20ml)加入过滤单元并将前面的程序重复3次。最后用pbs缓冲液洗涤所述膜。在没有任何稀释下通过hplc分析所有样品。14.2.2用于筛选聚合物膜的横向流过滤设置和方案:(方案2)如在图14中所示建立横向流过滤装备。由圆锥形烧瓶组成的进料容器(1)含有待纯化的寡核苷酸溶液。使用hplc泵(2)将所述溶液泵送至横向流过滤单元(4),同时使用加热板(3)维持所述单元内的温度。使用齿轮泵(6)使所述单元内的溶液再循环。压强表(5)在实验期间使得压强能够读出。从取样阀(7)取渗余物溶液的样品,并从渗透物收集容器(8)对渗透物溶液取样。首先将待测试的膜的试样切割至适当大小并放在所述单元中。将所述系统用pbs溶液(100ml)洗涤。将所述溶液的温度调至期望的设定点。将含有在pbs中的寡核苷酸产物的溶液(7.5ml,在1g/l)进料进所述系统中。然后使用hplc泵以与渗透物溶液的流速匹配的流速(通常,3ml/min)将pbs溶液泵入所述系统。使用压强表记录压强。每5个渗滤体积将渗余物溶液取样用于hplc分析。每个渗滤体积将渗透物溶液取样用于hplc分析。在20个渗滤体积之后停止实验。在使用具有5kda分子量截止值的snyder膜(批号120915r2)和seqidno:46和seqidno:30的实验的情况下,如下修改上述方法。首先将待测试的膜的试样切割至适当大小并放在所述单元中。将所述系统用磷酸钾溶液(100ml,50mm,ph7.5)洗涤。将溶液的温度调至期望的设定点。将含有在磷酸钾中的寡核苷酸产物的溶液(大约1g/l)加入乙二胺四乙酸(edta)(230µl,500mm溶液)。然后将所述溶液进料进所述系统。然后使用hplc泵以与渗透物溶液的流速匹配的流速(通常4ml/min)将磷酸钾缓冲液泵入所述系统。使用压强表记录压强。每5个渗滤体积将渗余物溶液取样用于hplc分析。每个渗滤体积将渗透物溶液取样用于hplc分析。在15个渗滤体积之后停止实验。14.3结果表23:按照方案1(14.2.1)的盲端过滤实验的结果mwco=分子量截止值。在60℃使用10kdamwconadir膜的实验中,证实了产物序列(seqidno:1)和非互补的三-模板hub(包含seqidno:30)之间的明显分离。图15显示了a)在2个渗滤体积之后渗余物溶液的色谱图,所述渗余物溶液被保留在过滤单元中且主要含有三-模板hub;和b)在2个渗滤体积之后富含产物的渗透物溶液的色谱图。在50℃和3.0巴压强使用5kdamwcosnyder膜的实验中,证实了区段序列(参见表1)和互补三-模板hub(包含seqidno:2)和产物(seqidno:1)之间的明显分离。图16显示了a)在20个渗滤体积之后渗余物溶液的色谱图,所述渗余物溶液主要含有三-模板hub和产物;和b)在20个渗滤体积之后渗透物的色谱图,所述渗透物主要含有区段寡核苷酸。在80℃和3.1巴压强使用5kdamwcosnyder膜的实验中,证实了互补三-模板hub(包含seqidno:2)和产物(seqidno:1)之间的明显分离。图17显示了a)在20个渗滤体积之后渗余物溶液的色谱图,所述渗余物溶液仅含有三-模板hub;和b)在2个渗滤体积之后渗透物溶液的色谱图,所述渗透物溶液仅含有产物。14.4结论使用过滤可以分离不同长度和分子量的寡核苷酸。如上所示,膜的类型和条件(诸如温度)影响分离水平。对于给定组的不同长度/分子量的寡核苷酸,可以选择合适的膜和条件以允许所需的分离。例如,我们已经证实,如在表1中所示的区段寡核苷酸(6和8个核苷酸长度的短聚体)可以与产物寡核苷酸(具有seqidno:1的20-聚体寡核苷酸)和三-模板hub(包含3个seqidno:2的20-聚体,其附接至固体支持物)分离,且所述产物寡核苷酸和三-模板hub又可以彼此分离。实施例15:用于合成具有2'-ome碱基修饰和磷酸酯键的寡核苷酸的通过单碱基连接的3'延伸将野生型ss连接酶(seqidno:63至83)各自在n-末端与由6xhis组成的组氨酸标签融合。使用标准的克隆、表达和提取方法,合成基因,将其克隆至pet28a中,并在大肠杆菌bl21(de3)star中产生该基因编码的蛋白。使用标准方法,使用ni-nta纯化蛋白并直接使用。根据下表25建立反应,其中最后添加连接酶。将反应物在25℃下孵育20小时。然后通过加热至95℃持续15min来淬灭反应物,以4000xg离心15min,并将10µl上清液转移至hplc小瓶中。然后通过hplc分析反应物的seqidno:85的存在。表25反应中的最终浓度(mm)每个反应的体积(µl)引物:(2'-ome)–seqidno:840.1252.5单体:腺苷-3,5-二磷酸酯(2'omepap)12三磷酸腺苷三钠(atp)0.250.5氯化镁(mgcl2)100.2连接酶–seqidno:63至835缓冲液(20mmtris,30mmnacl,ph8)9.8最终反应体积:20表26:来自反应的结果:基因名称sedidno向产物的转化率(%)*肠杆菌噬菌体t4rna连接酶1–‘rnl1’6323.9肠杆菌噬菌体t4rna连接酶2-‘rnl2’6412.1气单胞菌病毒aeh1连接酶-‘rna3’6515.7克雷伯氏菌噬菌体jd18连接酶-‘rna6’6625.5寡氧单胞菌噬菌体ime13连接酶-‘rna8’6729.9埃希氏杆菌噬菌体jse连接酶-‘rna9’6816.7不动杆菌噬菌体acj61连接酶-‘rna16’6918.0弧菌噬菌体vh7d连接酶-‘rna20’7014.4埃希氏杆菌噬菌体js98连接酶-‘rna22’7123.9埃希氏杆菌噬菌体vb_ecom_112连接酶-‘rna23’7224.7气单胞菌噬菌体cc2连接酶-‘rna28’7319.3肠杆菌噬菌体rb69连接酶-‘rna29’7419.1不动杆菌噬菌体ac42连接酶-‘rna317524.2果胶杆菌噬菌体cbb连接酶-‘rna33’760.0气单胞菌噬菌体phias5连接酶-‘rna357722.4沙门氏菌噬菌体vb_senms16连接酶-‘rna367822.0弧菌噬菌体kvp40连接酶-‘rna39’7920.2弯曲杆菌病毒cp220连接酶-‘rna49’8010.4假单胞菌噬菌体phipmw连接酶-‘rna59’812.2假单胞菌噬菌体vb_paem_c2-10_ab1连接酶-‘rna61’823.4butyrivibrioproteoclasticus连接酶-‘rna82’832.3*向产物的转化率(%)-波长258nm处引物n峰vs.产物n+1(pi)峰的%面积。实施例16:用于合成具有2'-ome碱基修饰和硫代磷酸酯键的寡核苷酸的通过单碱基连接的3'延伸将野生型ss连接酶(seqidno:63至83)各自在n-末端与由6xhis组成的组氨酸标签融合。使用标准的克隆、表达和提取方法,合成基因,将其克隆至pet28a中,并在大肠杆菌bl21(de3)star中产生该基因编码的蛋白。使用标准方法,使用ni-nta纯化蛋白并直接使用。根据下表27建立反应,其中最后添加连接酶。将反应物在25℃下孵育20小时。然后通过加热至95℃持续15min来淬灭反应物,以4000xg离心15min,并将10µl上清液转移至hplc小瓶中。然后通过hplc分析反应物的seqidno:85的存在。表27反应中的最终浓度(mm)每个反应的体积(µl)引物:(2'-ome)–seqidno:840.1252.5单体:腺苷-3-磷酸酯-5-硫代磷酸酯(2'omepsap)12三磷酸腺苷三钠(atp)0.250.5氯化镁(mgcl2)100.2连接酶–seqidno:63至835缓冲液(20mmtris,30mmnacl,ph8)9.8最终反应体积:20表28:来自反应的结果:基因名称sedidno向产物的转化率(%)*肠杆菌噬菌体t4rna连接酶1–‘rnl1’630肠杆菌噬菌体t4rna连接酶2-‘rnl2’640气单胞菌病毒aeh1连接酶-‘rna3’650克雷伯氏菌噬菌体jd18连接酶-‘rna6’660.8寡氧单胞菌噬菌体ime13连接酶-‘rna8’672.8埃希氏杆菌噬菌体jse连接酶-‘rna9’681.5不动杆菌噬菌体acj61连接酶-‘rna16’690弧菌噬菌体vh7d连接酶-‘rna20’700埃希氏杆菌噬菌体js98连接酶-‘rna22’710埃希氏杆菌噬菌体vb_ecom_112连接酶-‘rna23’720气单胞菌噬菌体cc2连接酶-‘rna28’730肠杆菌噬菌体rb69连接酶-‘rna29’740不动杆菌噬菌体ac42连接酶-‘rna31751.2果胶杆菌噬菌体cbb连接酶-‘rna33’760气单胞菌噬菌体phias5连接酶-‘rna35770沙门氏菌噬菌体vb_senms16连接酶-‘rna36780弧菌噬菌体kvp40连接酶-‘rna39’790弯曲杆菌病毒cp220连接酶-‘rna49’800假单胞菌噬菌体phipmw连接酶-‘rna59’810假单胞菌噬菌体vb_paem_c2-10_ab1连接酶-‘rna61’820butyrivibrioproteoclasticus连接酶-‘rna82’830*向产物的转化率(%)-波长258nm处引物n峰vs.产物n+1(pi)峰的%面积。实施例17:用于合成具有2'moe碱基修饰和硫代磷酸酯键的寡核苷酸的通过单碱基连接的3'延伸将野生型ss连接酶(seqidno:63至83)各自在n-末端与由6xhis组成的组氨酸标签融合。使用标准的克隆、表达和提取方法,合成基因,将其克隆至pet28a中,并在大肠杆菌bl21(de3)star中产生该基因编码的蛋白。使用标准方法,使用ni-nta纯化蛋白并直接使用。根据下表29建立反应,其中最后添加连接酶。将反应物在25℃下孵育20小时。然后通过加热至95℃持续15min来淬灭反应物,以4000xg离心15min,并将10µl上清液转移至hplc小瓶中。然后通过hplc分析反应物的seqidno:87的存在。表29反应中的最终浓度(mm)每个反应的体积(µl)引物:(2-'moe)–seqidno:860.1252.5单体:腺苷-3-磷酸酯-5-硫代磷酸酯(2'moepsap)12三磷酸腺苷三钠(atp)0.250.5氯化镁(mgcl2)100.2连接酶–seqidno:63至835缓冲液(20mmtris,30mmnacl,ph8)9.8最终反应体积:20表30:来自反应的结果:基因名称sedidno向产物的转化率(%)*肠杆菌噬菌体t4rna连接酶1–‘rnl1’630肠杆菌噬菌体t4rna连接酶2-‘rnl2’640气单胞菌病毒aeh1连接酶-‘rna3’650克雷伯氏菌噬菌体jd18连接酶-‘rna6’660寡氧单胞菌噬菌体ime13连接酶-‘rna8’670.4埃希氏杆菌噬菌体jse连接酶-‘rna9’680不动杆菌噬菌体acj61连接酶-‘rna16’690弧菌噬菌体vh7d连接酶-‘rna20’700埃希氏杆菌噬菌体js98连接酶-‘rna22’710埃希氏杆菌噬菌体vb_ecom_112连接酶-‘rna23’720气单胞菌噬菌体cc2连接酶-‘rna28’730肠杆菌噬菌体rb69连接酶-‘rna29’740不动杆菌噬菌体ac42连接酶-‘rna31750.2果胶杆菌噬菌体cbb连接酶-‘rna33’760气单胞菌噬菌体phias5连接酶-‘rna35770沙门氏菌噬菌体vb_senms16连接酶-‘rna36780弧菌噬菌体kvp40连接酶-‘rna39’790弯曲杆菌病毒cp220连接酶-‘rna49’800假单胞菌噬菌体phipmw连接酶-‘rna59’810假单胞菌噬菌体vb_paem_c2-10_ab1连接酶-‘rna61’820.5butyrivibrioproteoclasticus连接酶-‘rna82’830*向产物的转化率(%)-波长258nm处引物n峰vs.产物n+1(pi)峰的%面积。实施例18:用于合成具有2'h碱基修饰和磷酸酯键的寡核苷酸的通过单碱基连接的3'延伸将野生型ss连接酶(seqidno:63至83)各自在n-末端与由6xhis组成的组氨酸标签融合。使用标准的克隆、表达和提取方法,合成基因,将其克隆至pet28a中,并在大肠杆菌bl21(de3)star中产生该基因编码的蛋白。使用标准方法,使用ni-nta纯化蛋白并直接使用。根据下表31建立反应,其中最后添加连接酶。将反应物在25℃下孵育20小时。然后通过加热至95℃持续15min来淬灭反应物,以4000xg离心15min,并将10µl上清液转移至hplc小瓶中。然后通过hplc分析反应物的seqidno:87的存在。表31反应中的最终浓度(mm)每个反应的体积(µl)引物:(2'h)–seqidno:860.1252.5单体:腺苷-3-磷酸酯-5-硫代磷酸酯(2'moepsap)12三磷酸腺苷三钠(atp)0.250.5氯化镁(mgcl2)100.2连接酶–seqidno:63至835缓冲液(20mmtris,30mmnacl,ph8)9.8最终反应体积:20表32:来自反应的结果:基因名称sedidno向产物的转化率(%)*肠杆菌噬菌体t4rna连接酶1–‘rnl1’636.3肠杆菌噬菌体t4rna连接酶2-‘rnl2’640气单胞菌病毒aeh1连接酶-‘rna3’650克雷伯氏菌噬菌体jd18连接酶-‘rna6’662.3寡氧单胞菌噬菌体ime13连接酶-‘rna8’675.1埃希氏杆菌噬菌体jse连接酶-‘rna9’681.1不动杆菌噬菌体acj61连接酶-‘rna16’690弧菌噬菌体vh7d连接酶-‘rna20’700埃希氏杆菌噬菌体js98连接酶-‘rna22’710埃希氏杆菌噬菌体vb_ecom_112连接酶-‘rna23’720气单胞菌噬菌体cc2连接酶-‘rna28’732.3肠杆菌噬菌体rb69连接酶-‘rna29’740不动杆菌噬菌体ac42连接酶-‘rna31750果胶杆菌噬菌体cbb连接酶-‘rna33’762.2气单胞菌噬菌体phias5连接酶-‘rna35770沙门氏菌噬菌体vb_senms16连接酶-‘rna36780弧菌噬菌体kvp40连接酶-‘rna39’790弯曲杆菌病毒cp220连接酶-‘rna49’800假单胞菌噬菌体phipmw连接酶-‘rna59’810假单胞菌噬菌体vb_paem_c2-10_ab1连接酶-‘rna61’821.3butyrivibrioproteoclasticus连接酶-‘rna82’830*向产物的转化率(%)-波长258nm处引物n峰vs.产物n+1(pi)峰的%面积。实施例19:用于合成具有2'moe碱基修饰和磷酸酯键的寡核苷酸的通过单碱基连接的3'延伸将野生型ss连接酶(seqidno:63至83)各自在n-末端与6xhis融合。使用标准的克隆、表达和提取方法,合成基因,将其克隆至pet28a中,并在大肠杆菌bl21(de3)star中产生该基因编码的蛋白。使用标准方法,使用ni-nta纯化蛋白并直接使用。根据表33建立反应,其中最后添加连接酶。将反应物在25℃下孵育20小时。然后通过加热至95℃持续15min来淬灭反应物,以4000xg离心15min,并将10µl上清液转移至hplc小瓶中。然后通过hplc分析反应物的seqidno:87的存在。表33反应中的最终浓度(mm)每个反应的体积(µl)引物:(2'moe)–seqidno:860.1252.5单体:腺苷-3,5-二磷酸酯(2'moepap)12三磷酸腺苷三钠(atp)0.250.5氯化镁(mgcl2)100.2连接酶–seqidno:63至835缓冲液(20mmtris,30mmnacl,ph8)9.8最终反应体积:20表34:来自反应的结果:基因名称seqidno向产物的转化率(%)*肠杆菌噬菌体t4rna连接酶1–‘rnl1’631.4肠杆菌噬菌体t4rna连接酶2-‘rnl2’640气单胞菌病毒aeh1连接酶-‘rna3’650克雷伯氏菌噬菌体jd18连接酶-‘rna6’663.9寡氧单胞菌噬菌体ime13连接酶-‘rna8’678.8埃希氏杆菌噬菌体jse连接酶-‘rna9’680不动杆菌噬菌体acj61连接酶-‘rna16’690弧菌噬菌体vh7d连接酶-‘rna20’700埃希氏杆菌噬菌体js98连接酶-‘rna22’710埃希氏杆菌噬菌体vb_ecom_112连接酶-‘rna23’721.2气单胞菌噬菌体cc2连接酶-‘rna28’730肠杆菌噬菌体rb69连接酶-‘rna29’741.1不动杆菌噬菌体ac42连接酶-‘rna31754.0果胶杆菌噬菌体cbb连接酶-‘rna33’760气单胞菌噬菌体phias5连接酶-‘rna35770沙门氏菌噬菌体vb_senms16连接酶-‘rna36780弧菌噬菌体kvp40连接酶-‘rna39’790弯曲杆菌病毒cp220连接酶-‘rna49’800假单胞菌噬菌体phipmw连接酶-‘rna59’810假单胞菌噬菌体vb_paem_c2-10_ab1连接酶-‘rna61’821.3butyrivibrioproteoclasticus连接酶-‘rna82’830*向产物的转化率(%)-波长258nm处的引物n峰vs.产物n+1(pi)峰的%面积。实施例20:用于合成具有2'ome碱基修饰和磷酸酯键的寡核苷酸的通过单碱基连接的3'延伸的优化将野生型ss连接酶(seqidno:67)在n-末端与6xhis融合。使用标准的克隆、表达和提取方法,合成基因,将其克隆至pet28a中,并在大肠杆菌bl21(de3)star中产生该基因编码的蛋白。使用标准方法,使用ni-nta纯化蛋白并直接使用。经由微流体毛细管电泳测定蛋白浓度。根据表35建立反应,其中最后添加连接酶。将反应物在25℃下孵育18小时。然后通过加热至95℃持续15min来淬灭反应物,以4000xg离心15min,并将10µl上清液转移至hplc小瓶中。然后通过hplc分析反应物的seqidno:85的存在。表35反应中的最终浓度(mm)每个反应的体积(µl)引物:(2'ome)–seqidno:840.1252.5单体:腺苷-3,5-二磷酸酯(2'omepap)12三磷酸腺苷三钠(atp)0.250.5氯化镁(mgcl2)100.2连接酶–seqidno:670.02510缓冲液(20mmtris,30mmnacl,ph8)4.8最终反应体积:20表36:来自反应的结果:基因名称seqidno向产物的转化率(%)*寡氧单胞菌噬菌体ime13连接酶-‘rna8’6766.9*向产物的转化率(%)-波长258nm处的引物n峰vs.产物n+1(pi)峰的%面积。实施例21:用于合成具有2'moe碱基修饰和磷酸酯键的寡核苷酸的通过单碱基连接的3'延伸的优化将野生型ss连接酶(seqidno:67)在n-末端与6xhis融合。使用标准的克隆、表达和提取方法,合成基因,将其克隆至pet28a中,并在大肠杆菌bl21(de3)star中产生该基因编码的蛋白。使用标准方法,使用ni-nta纯化蛋白并直接使用。经由微流体毛细管电泳测定蛋白浓度。根据表37建立反应,其中最后添加连接酶。将反应物在25℃下孵育12小时。然后通过加热至95℃持续15min来淬灭反应物,以4000xg离心15min,并将10µl上清液转移至hplc小瓶中。然后通过hplc分析反应物的seqidno:87的存在。表37反应中的最终浓度(mm)每个反应的体积(µl)引物:(2'moe)–seqidno:860.1252.5单体:腺苷-3,5-二磷酸酯(2'moepap)12三磷酸腺苷三钠(atp)0.250.5氯化镁(mgcl2)100.2连接酶–seqidno:670.02510缓冲液(20mmtris,30mmnacl,ph8)4.8最终反应体积:20表38:来自反应的结果:基因名称seqidno向产物的转化率(%)*寡氧单胞菌噬菌体ime13连接酶-‘rna8’6726.0*向产物的转化率(%)-波长258nm处的seqidno:86峰vs.seqidno:87峰的%面积。实施例22:比较wt与突变体的反应-用于合成具有2'moe碱基修饰和磷酸酯键的寡核苷酸的通过单碱基连接的3'延伸将野生型或突变型ss连接酶(seqidno:67和88至92)各自在n-末端与6xhis融合。使用标准的克隆、表达和提取方法,合成基因,将其克隆至pet28a中,并在大肠杆菌bl21(de3)star中产生该基因编码的蛋白。使用标准方法,使用ni-nta纯化蛋白并直接使用。经由微流体毛细管电泳测定蛋白浓度。根据表39建立反应,其中最后添加连接酶。将反应物在25℃下孵育24小时。然后通过加热至70℃持续30min来淬灭反应物,以4000xg离心15min,并将10µl上清液转移至hplc小瓶中。然后通过hplc分析反应物的seqidno:87的存在。表39反应中的最终浓度(mm)每个反应的体积(µl)引物:(2'moe)–seqidno:860.13单体:腺苷-3,5-二磷酸酯(2'moepap)13三磷酸腺苷三钠(atp)0.250.68氯化镁(mgcl2)100.3连接酶–seqidno:67或88至920.017.5缓冲液(20mmtris,ph8)15.53最终反应体积:30表40:来自反应的结果:基因名称seqidno向产物的转化率(%)*寡氧单胞菌噬菌体ime13连接酶-‘rna8’6718.34突变体连接酶(寡氧单胞菌噬菌体ime13主链)蛋白序列8874.18突变体连接酶(寡氧单胞菌噬菌体ime13主链)蛋白序列8972.34突变体连接酶(寡氧单胞菌噬菌体ime13主链)蛋白序列9075.75突变体连接酶(寡氧单胞菌噬菌体ime13主链)蛋白序列9173.99突变体连接酶(寡氧单胞菌噬菌体ime13主链)蛋白序列9255.05*向产物的转化率(%)-波长258nm处的seqidno:86vs.seqidno:87峰的%面积。实施例23:比较wt与突变体的反应-用于合成具有2'moe碱基修饰和硫代磷酸酯键的寡核苷酸的通过单碱基连接的3'延伸将野生型或突变型ss连接酶(seqidno:67和88至92)各自在n-末端与6xhis融合。使用标准的克隆、表达和提取方法,合成基因,将其克隆至pet28a中,并在大肠杆菌bl21(de3)star中产生该基因编码的蛋白。使用标准方法,使用ni-nta纯化蛋白并直接使用。经由微流体毛细管电泳测定蛋白浓度。根据表41建立反应,其中最后添加连接酶。将反应物在25℃下孵育24小时。然后通过加热至70℃持续30min来淬灭反应物,以4000xg离心15min,并将10µl上清液转移至hplc小瓶中。然后通过hplc分析反应物的seqidno:87的存在。表41反应中的最终浓度(mm)每个反应的体积(µl)引物:(2'moe)–seqidno:860.13单体:腺苷-3-磷酸酯-5-硫代磷酸酯(2'omepsap)13三磷酸腺苷三钠(atp)0.250.68氯化镁(mgcl2)100.3连接酶–seqidno:67或88至920.017.5缓冲液(20mmtris,ph8)15.53最终反应体积:30表42:来自反应的结果:基因名称seqidno向产物的转化率(%)*寡氧单胞菌噬菌体ime13连接酶-‘rna8’670突变体连接酶(寡氧单胞菌噬菌体ime13主链)蛋白序列8819.81突变体连接酶(寡氧单胞菌噬菌体ime13主链)蛋白序列896.05突变体连接酶(寡氧单胞菌噬菌体ime13主链)蛋白序列9012.56突变体连接酶(寡氧单胞菌噬菌体ime13主链)蛋白序列9112.44突变体连接酶(寡氧单胞菌噬菌体ime13主链)连接酶蛋白序列920*向产物的转化率(%)-波长258nm处的seqidno:86vs.seqidno:87峰的%面积。实施例24:用于合成具有2'moe碱基修饰和硫代磷酸酯键的寡核苷酸的通过单碱基连接的3'延伸–腺苷将突变型ss连接酶(seqidno:88)在n-末端与6xhis融合。使用标准的克隆、表达和提取方法,合成基因,将其克隆至pet28a中,并在大肠杆菌bl21(de3)star中产生该基因编码的蛋白。使用标准方法,使用ni-nta纯化蛋白并直接使用。经由微流体毛细管电泳测定蛋白浓度。根据表43建立反应,其中最后添加连接酶。将反应物在25℃下孵育24小时。然后通过加热至70℃持续30min来淬灭反应物,以4000xg离心15min,并将10µl上清液转移至hplc小瓶中。然后通过hplc和lcms分析反应物的seqidno:87的存在。表43反应中的最终浓度(mm)每个反应的体积(µl)引物:(2'moe)–seqidno:860.0510单体:腺苷-3-磷酸酯-5-硫代磷酸酯(2'omepsap)0.510三磷酸腺苷三钠(atp)240氯化镁(mgcl2)102连接酶–seqidno:880.0121.7缓冲液(20mmtris,ph8)116.3最终反应体积:200表44:来自反应的结果:基因名称seqidno向产物的转化率(%)*突变体连接酶(寡氧单胞菌噬菌体ime13主链)蛋白序列8894.39*向产物的转化率(%)-波长258nm处的seqidno:86峰vs.seqidno:87峰的%面积。实施例25:用于合成具有2'moe碱基修饰和硫代磷酸酯键的寡核苷酸的通过单碱基连接的3'延伸–5-甲基胞苷将突变型ss连接酶(seqidno:88)在n-末端与6xhis融合。使用标准的克隆、表达和提取方法,合成基因,将其克隆至pet28a中,并在大肠杆菌bl21(de3)star中产生该基因编码的蛋白。使用标准方法,使用ni-nta纯化蛋白并直接使用。经由微流体毛细管电泳测定蛋白浓度。根据表45建立反应,其中最后添加连接酶。将反应物在25℃下孵育24小时。然后通过加热至70℃持续30min来淬灭反应物,以4000xg离心15min,并将10µl上清液转移至hplc小瓶中。然后通过hplc和lcms分析反应物的seqidno:93的存在。表45反应中的最终浓度(mm)每个反应的体积(µl)引物:(2'moe)–seqidno:860.0510单体:5-甲基胞苷-3-磷酸酯-5-硫代磷酸酯(2'omepscp)0.510三磷酸腺苷三钠(atp)240氯化镁(mgcl2)102连接酶–seqidno:880.0121.7缓冲液(20mmtris,ph8)116.3最终反应体积:200表46:来自反应的结果:基因名称seqidno向产物的转化率(%)*突变体连接酶(寡氧单胞菌噬菌体ime13主链)蛋白序列8869.27*向产物的转化率(%)-波长258nm处的seqidno:86峰vs.seqidno:93峰的%面积。实施例26:用于合成具有2'moe碱基修饰和硫代磷酸酯键的寡核苷酸的通过单碱基连接的3'延伸–胸苷将突变型ss连接酶(seqidno:88)在n-末端与6xhis融合。使用标准的克隆、表达和提取方法,合成基因,将其克隆至pet28a中,并在大肠杆菌bl21(de3)star中产生该基因编码的蛋白。使用标准方法,使用ni-nta纯化蛋白并直接使用。经由微流体毛细管电泳测定蛋白浓度。根据表47建立反应物,其中最后添加连接酶。将反应物在25℃下孵育24小时。然后通过加热至70℃持续30min来淬灭反应物,以4000xg离心15min,并将10µl上清液转移至hplc小瓶中。然后通过hplc和lcms分析反应物的seqidno:94的存在。表47反应中的最终浓度(mm)每个反应的体积(µl)引物:(2'moe)–seqidno:860.0510单体:胸苷-3-磷酸酯-5-硫代磷酸酯(2'omepscp)0.510三磷酸腺苷三钠(atp)240氯化镁(mgcl2)102连接酶–seqidno:880.0121.7缓冲液(20mmtris,ph8)116.3最终反应体积:200表48:来自反应的结果:基因名称seqidno向产物的转化率(%)*突变体连接酶(寡氧单胞菌噬菌体ime13主链)蛋白序列8894.38*向产物的转化率(%)-波长258nm处的seqidno:86峰vs.seqidno:94峰的%面积。实施例27:通过单碱基连接的3'延伸,用于合成具有2'moe碱基修饰和硫代磷酸酯键的寡核苷酸,随后为3'脱磷酸化和第二单碱基连接和第二脱磷酸化–反应序列。将突变型ss连接酶(seqidno:88)和野生型磷酸酶(seqidno:95)在n-末端与6xhis融合。使用标准的克隆、表达和提取方法,合成基因,将其克隆至pet28a中,并在大肠杆菌bl21(de3)star中产生该基因编码的蛋白。使用标准方法,使用ni-nta纯化蛋白并直接使用。经由微流体毛细管电泳测定蛋白浓度。根据表49建立第一连接反应物,其中最后添加连接酶。将反应物在25℃下孵育24小时。然后通过加热至70℃持续30min来淬灭反应物,以4000xg离心15min,并将10µl上清液转移至hplc小瓶中。然后通过hplc和lcms分析反应物的seqidno:87的存在。剩余反应物通过离子交换色谱法纯化,冻干并直接用于第一脱保护(即脱磷酸化)中。表49反应中的最终浓度(mm)每个反应的体积(µl)引物:(2'moe)–seqidno:860.0510单体:腺苷-3-磷酸酯-5-硫代磷酸酯(2'moepsap)0.510三磷酸腺苷三钠(atp)240氯化镁(mgcl2)102连接酶–seqidno:880.0121.7缓冲液(20mmtris,ph8)116.3最终反应体积:200表50:来自第一连接反应的结果:基因名称seqidno向产物的转化率(%)*突变体连接酶(寡氧单胞菌噬菌体ime13主链)蛋白序列8894.99*向产物的转化率(%)-波长258nm处的seqidno:86峰vs.seqidno:87峰的%面积。根据表51建立第一脱保护/脱磷酸化反应物,其中最后添加磷酸酶。将反应物在37℃下孵育24小时。然后通过加热至70℃持续30min来淬灭反应物,以4000xg离心15min,并将10µl上清液转移至hplc小瓶中。然后通过hplc和lcms分析反应物的seqidno:96的存在。剩余反应物通过离子交换色谱法纯化,冻干并直接用于第二连接反应中。表51反应中的最终浓度(mm)每个反应的体积(µl)第一连接产物:(2'moe)–seqidno:840.0510磷酸酶–seqidno950.0003620缓冲液(20mmtris,ph8)170最终反应体积:200表52:来自第一脱磷酸化反应的结果:基因名称seqidno向产物的转化率(%)*野生型磷酸酶(北极甜虾(pandalusborealis))蛋白序列-‘sap’9596.44*向产物的转化率(%)-波长258nm处的seqidno:85峰vs.seqidno:96峰的%面积。根据表53建立第二连接反应,其中最后添加连接酶。将反应物在25℃下孵育24小时。然后通过加热至70℃持续30min来淬灭反应物,以4000xg离心15min,并将10µl上清液转移至hplc小瓶中。然后通过hplc和lcms分析反应物的seqidno:96的存在。剩余反应物通过离子交换色谱法纯化,冻干并直接用于第二脱保护/脱磷酸化反应中。表53反应中的最终浓度(mm)每个反应的体积(µl)第一脱保护产物:(2'moe)–seqidno:960.0510单体:腺苷-3-磷酸酯-5-硫代磷酸酯(2'moepsap)0.510三磷酸腺苷三钠(atp)240氯化镁(mgcl2)102连接酶–seqidno:880.0121.7缓冲液(20mmtris,ph8)116.3最终反应体积:200表54:来自第二连接反应的结果:基因名称seqidno向产物的转化率(%)*突变体连接酶(寡氧单胞菌噬菌体ime13主链)蛋白序列8891.15*向产物的转化率(%)-波长258nm处的seqidno:97峰vs.seqidno:96峰的%面积。根据表55建立第二脱保护/脱磷酸化反应,其中最后添加磷酸酶。将反应物在37℃下孵育24小时。然后通过加热至70℃持续30min来淬灭反应物,以4000xg离心15min,并将10µl上清液转移至hplc小瓶中。然后通过hplc和lcms分析反应物的seqidno:98的存在。表55反应中的最终浓度(mm)每个反应的体积(µl)第二连接产物:(2'moe)–seqidno:970.0510磷酸酶–seqidno:940.0003620缓冲液(20mmtris,ph8)170最终反应体积:200表56:来自第二脱磷酸化反应的结果:基因名称seqidno向产物的转化率(%)*野生型磷酸酶(北极甜虾(pandalusborealis))蛋白序列-‘sap’9592.63*向产物的转化率(%)-波长258nm处的seqidno:97峰vs.seqidno:98峰的%面积。实施例28:通过内切核酸酶的特异性链切割,用于释放具有2'moe碱基修饰和硫代磷酸酯键的区段或产物寡核苷酸序列将野生型内切核酸酶(seqidno:100)在n-末端与cbd融合。使用标准的克隆、表达和提取方法,合成基因,将其克隆至pet28a中,并在大肠杆菌bl21(de3)a1中产生该基因编码的蛋白。通过与珠状纤维素结合来纯化蛋白,随后使用标准方法用tev蛋白酶切割,并直接使用。根据表58建立反应,其中最后添加内切核酸酶。将反应物在65℃下孵育16小时。然后通过加热至95℃持续5min来淬灭反应物,以4000xg离心15min,并将10µl上清液转移至hplc小瓶中。然后通过hplc和lcms分析反应物的seqidno:101和actia(表57中所示的特定修饰)的存在。表57seqidno序列99act/ideoxyl/a*g*a*5mc(moe)*5mc(moe)*a(moe)*5mc(moe)*g(moe)101/5phos/g*a*5mc(moe)*5mc(moe)*a(moe)*5mc(moe)*g(moe)n/aactia表58反应中的最终浓度(mm)每个反应的体积(µl)寡核苷酸:(2'moe,ps)–seqidno:99202内切核酸酶–seqidno:10088缓冲液(50mm氯化钠,10mmtris-hcl,10mm氯化镁,100μg/mlbsa,ph7.9)10最终反应体积:100表59:来自反应的结果:基因名称seqidno向产物的转化率(%)*野生型闪烁古生球菌(archaeoglobusfulgidus)内切核酸酶v内切核酸酶10047.69*向产物的转化率(%)-波长258nm处的seqidno:100峰vs.seqidno:101和actia峰的%面积。总体结论发明人已经显示,有可能在溶液中酶促地合成寡核苷酸,包括具有一系列治疗相关的化学修饰的寡核苷酸,其从简单的水和空气稳定的核苷衍生物开始,首先通过使用rna连接酶来产生短寡核苷酸区段,且其次通过在互补模板上组装短区段。然后可将所述区段连接在一起以产生产物寡核苷酸,其可以在可扩展且适合大规模治疗性寡核苷酸制备的有效过程中与杂质及其互补模板两者分离。通过在溶液中合成寡核苷酸,发明人已经避免了由固相方法产生的放大约束。在使用dna的固有特性来特异性地识别互补序列和以反映互补序列的保真度和互补序列的长度的亲和力结合互补序列中,发明人已经能够生产高纯度的寡核苷酸,不需要色谱法,这提高生产方法的效率和所述方法的可放大性。通过在分离方法期间回收处于未改变状态的模板,发明人能够重复使用所述模板用于将来轮次的合成,且所以已经避免必须为每当量的形成的产物寡核苷酸制备1当量的模板的经济后果。最后,尽管已知野生型连接酶有效地连接正常dna和rna,我们已经显示,对dna或rna的修饰导致降低的连接效率,且对dna或rna的多个修饰在它们对降低连接效率的影响方面是累加性的,这在一些情况下可以使dna或rna连接酶完全无效。我们已经显示,通过dna和rna连接酶的适当突变和进化,可以恢复连接效率,且适当地修饰的dna和rna连接酶是用于合成含有多个修饰的寡核苷酸的有效催化剂。序列表seqidno序列标识符1实施例1期望的产物寡核苷酸序列(“靶标”)2实施例1-4、6、10和11模板寡核苷酸序列3野生型t4dna连接酶蛋白序列4野生型t4dna连接酶蛋白序列(当与cbd融合时)5实施例2靶序列6野生型肠杆菌噬菌体cc31dna连接酶蛋白序列7野生型肠杆菌噬菌体cc31dna连接酶蛋白序列(当与cbd融合时)8野生型志贺氏菌噬菌体shf125875dna连接酶蛋白序列9野生型志贺氏菌噬菌体shf125875dna连接酶蛋白序列(当与cbd融合时)10突变体连接酶(t4主链)蛋白序列11突变体连接酶(t4主链)蛋白序列12突变体连接酶(t4主链)蛋白序列13突变体连接酶(t4主链)蛋白序列14突变体连接酶(t4主链)蛋白序列15突变体连接酶(t4主链)蛋白序列16突变体连接酶(t4主链)蛋白序列17突变体连接酶(t4主链)蛋白序列18突变体连接酶(t4主链)蛋白序列19突变体连接酶(t4主链)蛋白序列20突变体连接酶(t4主链)蛋白序列21突变体连接酶(t4主链)蛋白序列22突变体连接酶(t4主链)蛋白序列23突变体连接酶(肠杆菌噬菌体cc31主链-克隆a4)蛋白序列24突变体连接酶(肠杆菌噬菌体cc31主链)蛋白序列25突变体连接酶(肠杆菌噬菌体cc31主链)蛋白序列26突变体连接酶(肠杆菌噬菌体cc31主链)蛋白序列27突变体连接酶(肠杆菌噬菌体cc31主链)蛋白序列28突变体连接酶(志贺氏菌噬菌体shf125875主链)蛋白序列29野生型小球藻连接酶蛋白序列30实施例5、8和9模板寡核苷酸序列31实施例5模板寡核苷酸序列32实施例5模板寡核苷酸序列33实施例5模板寡核苷酸序列34实施例5模板寡核苷酸序列35实施例5模板寡核苷酸序列36实施例5模板寡核苷酸序列37实施例5模板寡核苷酸序列38实施例5模板寡核苷酸序列39实施例5模板寡核苷酸序列40实施例5模板寡核苷酸序列41实施例5模板寡核苷酸序列42实施例5模板寡核苷酸序列43实施例5模板寡核苷酸序列44实施例5模板寡核苷酸序列45实施例5模板寡核苷酸序列46实施例14“20聚体”寡核苷酸序列47实施例7模板寡核苷酸序列48绿草履虫小球藻病毒ne-jv-4连接酶49绿草履虫小球藻病毒nys1连接酶50绿草履虫小球藻病毒ne-jv-1连接酶51刺胞虫(acanthocystisturfacea)小球藻病毒canal-1连接酶52刺胞虫(acanthocystisturfacea)小球藻病毒br0604l连接酶53刺胞虫(acanthocystisturfacea)小球藻病毒ne-jv-2连接酶54刺胞虫(acanthocystisturfacea)小球藻病毒tn603.4.2连接酶55刺胞虫(acanthocystisturfacea)小球藻病毒gm0701.1连接酶56聚球藻噬菌体s-crm01连接酶57海洋沉积物宏基因组连接酶58结核分枝杆菌(菌株atcc25618/h37rv)连接酶59粪肠球菌(菌株atcc700802/v583)连接酶60流感嗜血杆菌(菌株atcc51907/dsm11121/kw20/rd)连接酶61金黄色葡萄球菌连接酶62肺炎链球菌(菌株p1031)连接酶63野生型肠杆菌噬菌体t4rna连接酶1蛋白序列-‘rnl1’64野生型肠杆菌噬菌体t4rna连接酶2蛋白序列-‘rnl2’65野生型气单胞菌病毒aeh1连接酶蛋白序列-‘rna3’66野生型克雷伯氏菌噬菌体jd18连接酶蛋白序列-‘rna6’67野生型寡氧单胞菌噬菌体ime13连接酶蛋白序列-‘rna8’68野生型埃希氏杆菌噬菌体jse连接酶蛋白序列-‘rna9’69野生型不动杆菌噬菌体acj61连接酶蛋白序列-‘rna16’70野生型弧菌噬菌体vh7d连接酶蛋白序列-‘rna20’71野生型埃希氏杆菌噬菌体js98连接酶蛋白序列-‘rna22’72野生型埃希氏杆菌噬菌体vb_ecom_112连接酶蛋白序列-‘rna23’73野生型气单胞菌噬菌体cc2连接酶蛋白序列-‘rna28’74野生型肠杆菌噬菌体rb69连接酶蛋白序列-‘rna29’75野生型不动杆菌噬菌体ac42连接酶蛋白序列-‘rna3176野生型果胶杆菌噬菌体cbb连接酶蛋白序列-‘rna33’77野生型气单胞菌噬菌体phias5连接酶蛋白序列-‘rna3578野生型沙门氏菌噬菌体vb_senms16连接酶蛋白序列-‘rna3679野生型弧菌噬菌体kvp40连接酶蛋白序列-‘rna39’80野生型弯曲杆菌病毒cp220连接酶蛋白序列-‘rna49’81野生型假单胞菌噬菌体phipmw连接酶蛋白序列-‘rna59’82野生型假单胞菌噬菌体vb_paem_c2-10_ab1连接酶蛋白序列-‘rna61’83野生型butyrivibrioproteoclasticus连接酶蛋白序列-‘rna82’84实施例15和16引物寡核苷酸序列85实施例15和16产物寡核苷酸序列86实施例17引物寡核苷酸序列87实施例17产物寡核苷酸序列88突变体连接酶(寡氧单胞菌噬菌体ime13主链)蛋白序列89突变体连接酶(寡氧单胞菌噬菌体ime13主链)蛋白序列90突变体连接酶(寡氧单胞菌噬菌体ime13主链)蛋白序列91突变体连接酶(寡氧单胞菌噬菌体ime13主链)蛋白序列92突变体连接酶(寡氧单胞菌噬菌体ime13主链)蛋白序列93实施例26产物寡核苷酸序列94实施例26产物寡核苷酸序列95野生型磷酸酶(北极甜虾(pandalusborealis))蛋白序列-‘sap’96实施例27产物寡核苷酸序列97实施例27产物寡核苷酸序列98实施例27产物寡核苷酸序列99实施例28产物寡核苷酸序列100野生型闪烁古生球菌(archaeoglobusfulgidus)内切核酸酶v内切核酸酶101实施例28产物寡核苷酸序列当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1