一株根瘤菌寻配专一性高效共生苜蓿品种的方法与流程
本发明属于农业领域,具体涉及一株根瘤菌寻配专一性高效共生苜蓿品种的方法。
背景技术:
根瘤菌与豆科植物的共生固氮作用具有巨大的经济和生态效益,在农业生产中,人工接种根瘤菌来促进作物生长和提高种子产量成为一种常见的农业措施。根瘤菌-苜蓿共生体系的建立和发展是一个多阶段的过程,二者要经过无数的信号协调交换和监管途径才能形成根瘤,但是部分苜蓿品种即使与根瘤菌結瘤也不易高效地进行固氮,难以达到应有的增产效果。已有研究表明根瘤菌-苜蓿共生具有专一性,受到宿主植物类黄酮等信号因子以及根瘤菌結瘤因子、表面多糖和分泌蛋白的影响。根瘤菌与不同的苜蓿品种共生产生的促进效果有明显差异。针对根瘤菌选择专一性共生苜蓿品种,筛选适宜的苜蓿品种,有利于根瘤菌与苜蓿共生体的成功构建,同时也是提高苜蓿产量的有效途径。但目前,对于根瘤菌专一性共生的苜蓿品种的选择没有明确的指导方法。生产上施用高效根瘤菌的苜蓿品种由于适应性和亲属关系的差异,并不一定能产生好的結瘤固氮效果。而选自根瘤菌株来源地区的苜蓿品种或适宜种植的苜蓿品种是专一性共生苜蓿品种的主要来源。目前大多数研究对共生效应的衡量没有统一标准,采用結瘤数量、固氮酶活性、粗蛋白含量、生物量等多指标来衡量的根瘤菌与苜蓿品种的共生效应,与实际结果往往不一致,没有合理的指导意义。在研究大量的根瘤菌和苜蓿品种组合共生效率方面也缺乏一种快速简便的方法。同时以往的共生效应只关注了高效共生组合,而实际生产中大量为根瘤菌配置的苜蓿品种组合对植物生长是无显著影响的,只有少量品种与根瘤菌株共生能促进产量增长,表现出共生特性;甚至有些会抑制产量增长,表现出负效应特性。这样的根瘤菌-苜蓿品种组合均属于专一性范畴,但对这种正向和负向专一性的明确划分方面尚属空白。故选择与根瘤菌高效共生的苜蓿品种,采用合理的共生效应指标鉴定苜蓿品种与根瘤菌的专一性共生正效应和专一性共生负效应,促使根瘤菌与苜蓿品种配置合理,实现优良根瘤菌与优良苜蓿品种的精准高效组合。
技术实现要素:
本发明的目的就是针对上述现有技术中的缺陷,提供了一株根瘤菌寻配专一性高效共生苜蓿品种的方法。
为了实现上述目的,本发明提供的技术方案为:一株根瘤菌寻配专一性高效共生苜蓿品种的方法,包括以下步骤:
1)菌株:高效结瘤固氮根瘤菌株。
2)苜蓿品种:根瘤菌株来源地区长期种植或适宜种植的紫花苜蓿品种。
3)培育苜蓿幼苗:挑选子粒饱满、健康的紫花苜蓿品种种子数粒,在生物安全柜内用碘伏溶液(有效碘含量0.45%~0.55%(w·v-1))震荡灭菌3min,用无菌水冲洗5~6次,于清水琼脂中28℃催芽48h。将河沙洗净,过筛(2-mm),ph调至中性后105℃烘干,121℃灭菌6h,冷却。在直径13.2cm、高10cm的塑料盆中装入河沙450g,并均匀植入60粒发芽种子,深度为2cm。之后将塑料小盆放入29cm×20cm×9.5cm的塑料面盆中,每个面盆内放2个小盆,并浇灌500ml灭菌水。实验室培养条件为:光照时间12h·d-1,有光照时温度21~25℃,无光照时温度16~20℃,相对湿度45±5%。在第7d浇灌500mlhoagland有氮营养液。
4)制备菌液:将步骤1)中根瘤菌株ty平板活化后转接入50mlty液体培养基,28℃、180rpm·min-1振荡培养至菌液光密度od600nm值为0.5~1,4000rpm·min-1离心5min,抛去上清液后用等体积的无菌水冲洗菌体,并用涡旋振荡器将其打散,最后用无菌水调制成od600nm为0.5的根瘤菌液。
5)接种根瘤菌株:在幼苗生长至第15d左右时(第1片真叶出现),用移液器将制备好的菌液加入幼苗根部,每小盆30ml,以不含根瘤菌的ty液体培养基为对照。每个菌株处理4个小盆作为重复。接种后每隔7d在塑料面盆中浇灌hoagland无氮营养液500ml。其余时间用灭菌蒸馏水补充水分。
6)测定指标:根瘤菌株接种45d后(植株已生长60d),收获紫花苜蓿植株并清洗干净,用滤纸吸干水分。每盆随机取10株,测定单株结瘤数、有效根瘤重、根瘤直径、根瘤等级、根瘤固氮酶活性、单株叶片数、株高、根长、地上鲜重、地下鲜重、地上干重、地下干重、叶绿素含量和粗蛋白含量。
7)确定共生效应代表性指标:对6)测定的14个指标进行主成分分析,选择第一主成分中贡献率最大的指标,代表根瘤菌株接种紫花苜蓿品种的共生效应。
8)共生效应类型划分:当根瘤菌株接种紫花苜蓿品种的结瘤共生效应指标值显著高于未接种处理(ck)时(p<0.05),其效应标记为“正效应”,表明根瘤菌接种紫花苜蓿品种产生显著的生长正效应;当根瘤菌株接种紫花苜蓿品种的结瘤共生效应与ck差异不显著时(p>0.05),其共生效应标记为“无效应”,表明根瘤菌株接种紫花苜蓿品种共生结瘤后,对苜蓿生长不产生效应。当根瘤菌株接种紫花苜蓿品种的结瘤共生效应显著低于ck时(p<0.05),其共生效应标记为“负效应”,表明根瘤菌接种紫花苜蓿品种植株生长产生负效应。
9)确定专一性共生苜蓿品种:当根瘤菌株接种的紫花苜蓿品种共生效应标记为“正效应”时,确定该紫花苜蓿品种为根瘤菌株的专一性共生正效应紫花苜蓿品种;标记为“无效应”时,确定该紫花苜蓿品种为根瘤菌株的共生无效应紫花苜蓿品种;标记为“负效应”时,确定该紫花苜蓿品种为根瘤菌株的专一性共生负效应紫花苜蓿品种。
本发明的有益效果为:本发明提供的一株根瘤菌寻配专一性高效共生苜蓿品种的方法,其主要优点有:
1)寻配的紫花苜蓿品种来自根瘤菌筛选分离地区或根瘤菌筛选分离地区适宜种植的苜蓿品种,处于同一生长环境,匹配适应性强;
2)配置紫花苜蓿品种的共生效应指标筛选,简单有效,易于操作;
3)根瘤菌株与紫花苜蓿品种的共生效应划分,客观简便,不受紫花苜蓿品种数量的影响,直观表现了根瘤菌株与紫花苜蓿品种的专一性效应,易于应用;
4)此方法将根瘤菌与紫花苜蓿品种的共生效应分为专一性共生“正效应”、专一性共生“无效应”和专一性共生“负效应”,有利于精准利用共生“正效应”,克服共生“负效应”,对一株根瘤菌匹配专一性高效共生的紫花苜蓿品种具有重要的指导意义。
附图说明
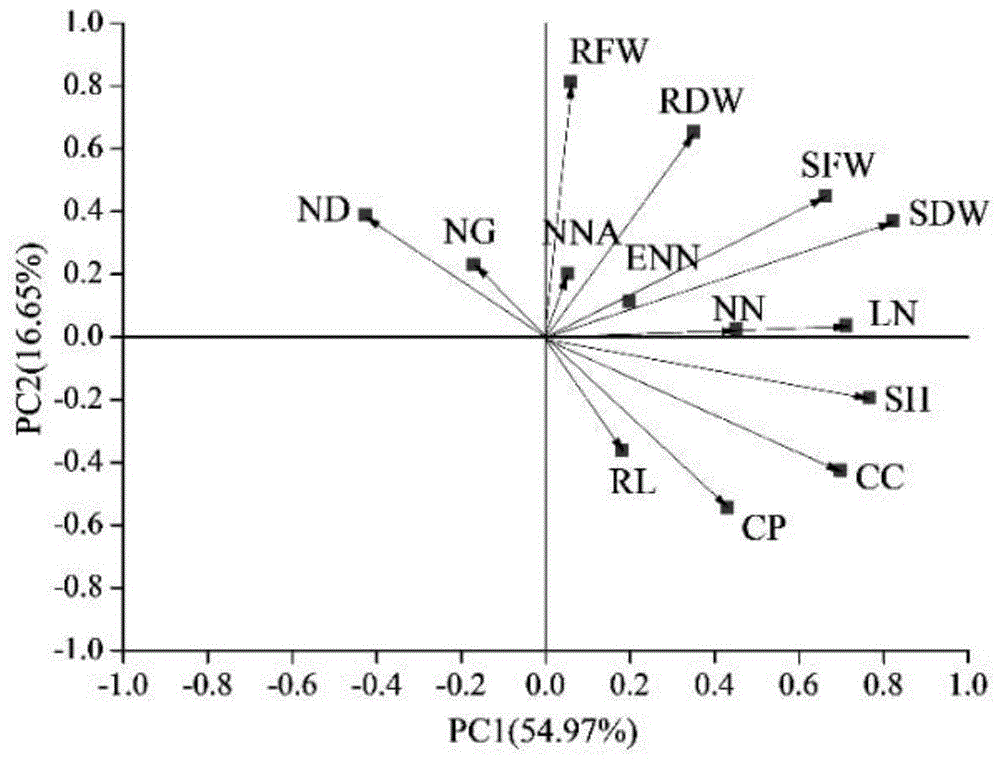
图1基于14个指标主成分分析的共生效应代表性指标筛选图:第一主成分(pc1)占总体方差的54.97%,第二主成分(pc2)则占总体方差的16.65%;nd,单株结瘤数;enw,有效根瘤重;nd,根瘤直径;ng,根瘤等级;nnc,根瘤固氮酶活性;ln,单株叶片数;sh,株高;rl,根长;sfw,地上鲜重;rfw,地下鲜重;sdw,地上干重;rdw,地下干重;cc,叶绿素含量;cp,粗蛋白含量;每个箭头表示对应于单个变量的特征向量。
图2根瘤菌株接种5个紫花苜蓿品种的结瘤专一性效应水印图:根瘤菌株接种苜蓿品种后,当筛选的结瘤共生效应代表性指标值分别显著高于未接种处理ck、显著低于ck或与ck差异不显著时,分别标记共生效应为共生“正效应”(effective,e)、共生“负效应”(ineffective,i)和共生“无效应”(undifferentiated,o)。
具体实施方式
实施例1:
一种给根瘤菌配置专一性苜蓿品种的方法,包括以下步骤:
1)菌株:32株ensifermeliloti菌,现保存于甘肃农业大学草业生态系统教育部重点实验室。
2)苜蓿品种:种植于甘肃省武威市凉州区黄羊镇牧草试验站的甘农3号(m.sativa‘gannongno.3’)和甘农9号(m.sativa‘gannongno.9’)紫花苜蓿品种;种植于甘肃省白银市会宁县会师镇牧草试验基地的陇中(m.sativa‘longzhong’)和清水(m.sativa‘qingshui’)紫花苜蓿品种;种植于甘肃农业大学兰州牧草试验站的wl168hq(m.sativa‘wl168hq’)紫花苜蓿品种。成熟期田间收集种子,人工清选。
3)培育幼苗:挑选子粒饱满、健康的紫花苜蓿品种种子数粒,在生物安全柜内用碘伏溶液(有效碘含量0.45%~0.55%(w·v-1))震荡灭菌3min,用无菌水冲洗5~6次,于清水琼脂中28℃催芽48h。将河沙洗净,过筛(2-mm),ph调至中性后105℃烘干,121℃灭菌6h,冷却。在直径13.2cm、高10cm的塑料盆中装入河沙450g,并均匀植入60粒发芽种子,深度为2cm。之后将塑料小盆放入29cm×20cm×9.5cm的塑料面盆中,每个面盆内放2个小盆,并浇灌500ml灭菌水。实验室培养条件为:光照时间12h·d-1,有光照时温度21~25℃,无光照时温度16~20℃,相对湿度45±5%。在第7d浇灌500mlhoagland有氮营养液。
4)制备菌液:将步骤1)中根瘤菌株ty平板活化后转接入50mlty液体培养基,28℃、180rpm·min-1振荡培养至菌液光密度od600nm值为0.5~1,4000rpm·min-1离心5min,抛去上清液后用等体积的无菌水冲洗菌体,并用涡旋振荡器将其打散,最后用无菌水调制成od600nm为0.5的根瘤菌液。
5)接种根瘤菌株:在幼苗生长至第15d时(第1片真叶出现),用移液器将制备好的菌液加入幼苗根部,每小盆30ml,以不含根瘤菌的ty液体培养基为对照。每个菌株处理4个小盆作为重复。接种后每隔7d在塑料面盆中浇灌hoagland无氮营养液500ml。其余时间水分用灭菌蒸馏水补充。
6)测定指标:根瘤菌株接种45d后(植株已生长60d),收获紫花苜蓿植株并清洗干净,用滤纸吸干水分。每盆随机取10株,测定单株结瘤数、有效根瘤重、根瘤直径、根瘤等级、根瘤固氮酶活性、单株叶片数、株高、根长、地上鲜重、地下鲜重、地上干重、地下干重、叶绿素含量和粗蛋白含量。
7)筛选确定共生效应代表性指标:对6)测定的14个指标进行主成分分析,选择第一主成分上贡献率最大的指标-地上干重(sdw),代表根瘤菌株接种紫花苜蓿品种的共生效应。
8)共生效应类型划分:用数理统计学方法进行根瘤菌株接种紫花苜蓿品种共生效应的差异性分析。当根瘤菌株接种紫花苜蓿品种的结瘤共生效应显著高于未接种处理(ck)时(p<0.05),其效应标记为共生“正效应”,表明根瘤菌接种紫花苜蓿品种产生显著地生长正效应;当根瘤菌株接种紫花苜蓿品种的结瘤共生效应与ck差异不显著时(p>0.05),其效应标记为共生“无效应”,表明根瘤菌株接种紫花苜蓿品种共生结瘤后,对苜蓿生长不产生效应。当根瘤菌株接种紫花苜蓿品种的结瘤共生效应显著低于ck时(p<0.05),其效应标记为共生“负效应”,表明根瘤菌接种紫花苜蓿品种植株生长产生负效应,或根瘤菌存在“寄生”效应。
9)确定专一性共生苜蓿品种:当根瘤菌株接种的紫花苜蓿品种共生效应标记为共生“正效应”时,确定该紫花苜蓿品种为根瘤菌株的专一性正效应紫花苜蓿品种;标记为共生“无效应”时,确定该紫花苜蓿品种为根瘤菌株的共生无效应苜蓿品种;标记为共生“负效应”时,确定该紫花苜蓿品种为根瘤菌株的专一性负效应紫花苜蓿品种。
本发明采用数理统计学方法,在根瘤菌株来源地区适宜种植的5个紫花苜蓿品种中,为32株e.meliloti菌寻配高效共生苜蓿品种。共生效应表现为共生“正效应”时,根瘤菌株在对应紫花苜蓿品种上产生結瘤正效应,表现出强的共生能力和适应性,为二者的亲属关系提供了证据。而共生效应表现为共生“负效应”时,根瘤菌株在对应苜蓿品种上以“寄生”的方式存在,根瘤对植株营养的消耗大于供给,表现出結瘤负效应,固氮能力弱,共生能力和适应性差,亲属关系弱。共生效应表现为共生“无效应”时,根瘤菌株与对应紫花苜蓿品种共生結瘤后的正负效应达到平衡,贡献与索取相等。
共生效应模型(图2)中当共生“正效应”e组分占比等于2时(eeooo和oeoeo,2:3:0),根瘤菌株对相应两个苜蓿品种植株生长的正效应最强;当共生“正效应”e组分占比等于1时(ooeoo、oooeo、eoooo、oeooo,1:4:0),根瘤菌株对相应一个苜蓿品种植株生长产生正效应,且存在强烈的結瘤固氮专一性;当共生“负效应”i组分占比等于1时(ooooi、oiooo、oooio,0:4:1),根瘤菌株对相应的一个苜蓿品种植株生长产生专一性负效应;当共生“负效应”i组分占比等于2时(oooii,0:3:2),根瘤菌株对相应两个苜蓿品种植株生长产生负效应;当共生“正效应”e和共生“负效应”i组分占比均等于0时(ooooo,0:5:0),根瘤菌株对所有苜蓿品种植株生长产生的正效应和负效应相互抵消,表现为共生“无效应”;当共生“正效应”e和共生“负效应”i组分占比均等于1时(oioeo,1:3:1),根瘤菌株在对应两个苜蓿品种上分别产生正效应和负效应,专一性最强。此发明为根瘤菌筛选配置了高效共生正效应专一和负效应专一的苜蓿品种,对根瘤菌株与苜蓿品种互作效应的应用有重要指导意义。
图1为利用主成分分析法确定共生效应代表性指标的图示,图2为利用数理统计方法确定根瘤菌株接种5个紫花苜蓿品种结瘤专一性效应的热图。
由于所采用的试验和分析方法简便合理,易于实验者操作。因此本发明具有很好的实用性和可靠性。
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!