一种基于直接电化学的细菌漆酶传感器及其应用的制作方法
本发明设计生物传感领域,更具体是一种基于直接电化学的细菌漆酶传感器及其应用。
背景技术:
胆红素(bilirubin)是一种人胆汁中的主要色素,作为体内铁卟啉化合物的主要代谢产物,具有毒性,可对大脑和神经系统引起不可逆的损害,也是肝功能的重要指标之一,是临床上判定黄疸的重要依据。
一般胆红素检测使用重氮法、钒酸氧化法、氧化酶法等,这些方法处理样品繁琐、检测精度不够、测试结果受多种因素影响较大导致结果不够可靠等。因此,在胆红素检测方面,拥有响应快速、检测精度高等特点的电化学传感器被大量研究、开发和应用。然而,使用胆红素氧化酶的传感电极虽然对胆红素响应灵敏,特异性高,但检测环境要求较高,受制于中性或碱性和高浓度氯离子等限制。
因此,本领域需开发出一种基于直接电化学的细菌漆酶传感器,能够实现对胆红素测定较高的准确性,同时克服检测环境要求较高,受制于中性或碱性和高浓度氯离子的限制。
技术实现要素:
为了解决上述技术问题,本发明的第一方面提供了一种基于直接电化学的细菌漆酶传感器的制备方法,包含如下步骤:
s1:细菌漆酶cota的表达获取;
s2:直接电化学型细菌漆酶传感电极的构建。
作为一种优选的技术方案,所述细菌漆酶cota的表达获取,包含如下步骤:
a1:对细菌漆酶进行全基因提取,利用设计引物对目的基因cota的pcr扩增获得目的基因序列;
a2:利用一部克隆方法对a1所获得的目的基因与出发载体连接构建表达载体;
a3:用宿主菌构建含有cota基因的基因工程菌,高效表达细菌漆酶基因;
a4:采用镍离子柱对重组细菌漆酶cota形成纯化后,浓缩获得cota蛋白纯酶。
作为一种优选的技术方案,所述直接电化学型细菌漆酶传感电极的构建,包含如下步骤:
b1:将金电极进行预处理,进行电化学测试。达到电化学实验要求后,将金电极进行清洗;
b2:将b1所得到的金电极置于半胱氨酸溶液中进行表面修饰,使金电极表面固载一层致密的半胱氨酸修饰层;
b3:将b2所得到的金电极进行表面固定。
作为一种优选的技术方案,所述细菌漆酶选自bacillussubtilis168。
作为一种优选的技术方案,所述出发载体为pet-28a(+),所述表达载体为pet-cota。
作为一种优选的技术方案,所述宿主菌为e.colibl21(de3),所述基因工程菌为e.colibl21(de3-pet-cota)。
作为一种优选的技术方案,所述e.colibl21(de3-pet-cota)的构建方法,包含如下步骤:
c1:将含细菌漆酶cota基因的pet-28a(+)重组质粒转化到表达宿主菌e.colibl21(de3)获得重组微生物e.colibl21(de3-pet-cota);
c2:将c1所获得的重组微生物转接到含有abts、卡那霉素和iptg的平板,培养,挑取阳性转化子,保存。
作为一种优选的技术方案,所述培养的条件为35-39℃下培养14-18h。
作为一种优选的技术方案,所述表面固定的方法为:将b2所得到的金电极置于edc/nhs试剂中,在2-6℃下静置4-8h。
本发明的第二方面提供了一种用于胆红素检测的细菌漆酶传感器,用上述制备方法得到。
作为一种优选的技术方案,所述检测环境ph为7.0-9.0。
本发明的有益效果是:
在偏碱性条件和一定浓度钠盐存在下检测胆红素,不仅弥补了传统传感器对检测环境要求较高的缺陷,也为今后开发胆红素在线检测传感器提供新的工具。
附图说明
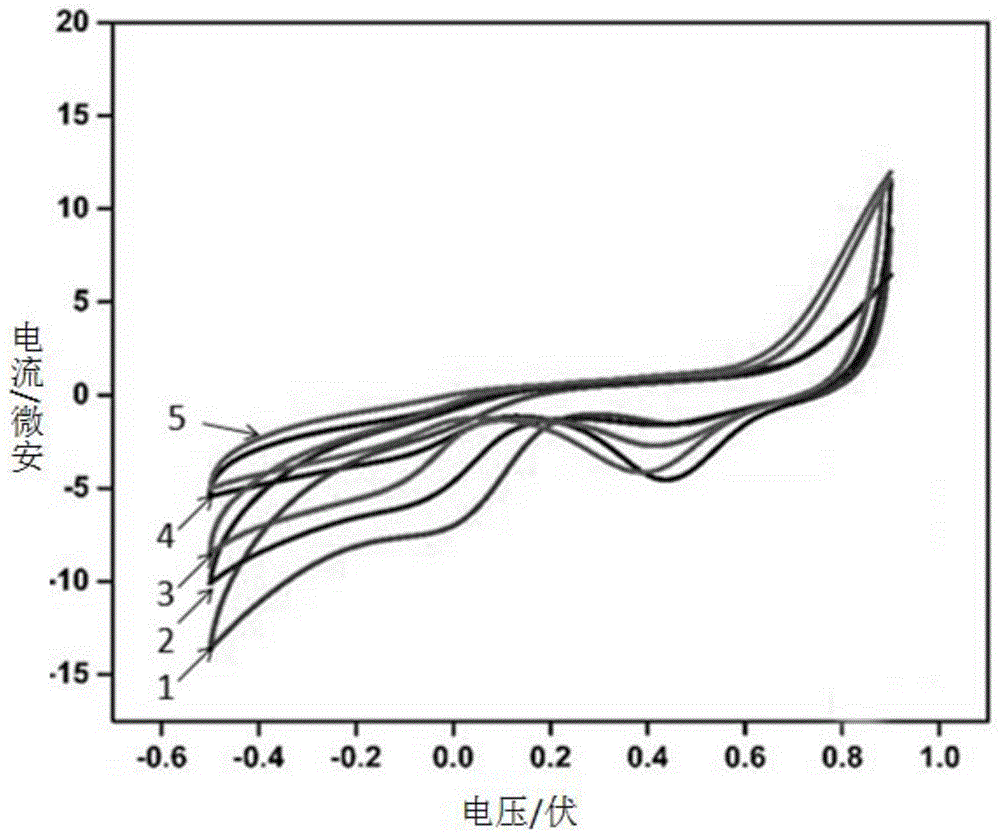
图1是构建的传感电极对胆红素的检测性能表征图;1代表ph=6.0;2代表ph=7.0;3代表ph=8.0;4代表ph=8.5;5代表ph=9.0。
图2是构建的传感电极在不同ph条件下胆红素的响应性能表征图。
图3是构建的细菌漆酶传感电极与真菌来源胆红素氧化酶电极在不同钠盐存在下对胆红素的响应性能比较;1表示对比例1,即真菌来源胆红素氧化酶电极;2代表实施例1,即细菌漆酶传感电极。
具体实施方式
为了下面的详细描述的目的,应当理解,本发明可采用各种替代的变化和步骤顺序,除非明确规定相反。此外,除了在任何操作实例中,或者以其他方式指出的情况下,表示例如说明书和权利要求中使用的成分的量的所有数字应被理解为在所有情况下被术语“约”修饰。因此,除非相反指出,否则在以下说明书和所附权利要求中阐述的数值参数是根据本发明所要获得的期望性能而变化的近似值。至少并不是试图将等同原则的适用限制在权利要求的范围内,每个数值参数至少应该根据报告的有效数字的个数并通过应用普通舍入技术来解释。
尽管阐述本发明的广泛范围的数值范围和参数是近似值,但是具体实例中列出的数值尽可能精确地报告。然而,任何数值固有地包含由其各自测试测量中发现的标准偏差必然产生的某些误差。
此外,应当理解,本文所述的任何数值范围旨在包括归入其中的所有子范围。例如,“1至10”的范围旨在包括介于(并包括)所述最小值1和所述最大值10之间的所有子范围,即具有等于或大于1的最小值和等于或小于10的最大值。说明书中,bod代表胆红素氧化酶。
为了解决上述问题,本发明的第一方面提供了一种基于直接电化学的细菌漆酶传感器的制备方法,包含如下步骤:
s1:细菌漆酶cota的表达获取;
s2:直接电化学型细菌漆酶传感电极的构建。
细菌漆酶cota是指具细菌漆酶活性的芽孢外壁蛋白cota基因。
在具体的实施方式中,所述细菌漆酶cota的表达获取,包含如下步骤:
a1:对细菌漆酶进行全基因提取,利用设计引物对目的基因cota的pcr扩增获得目的基因序列;
a2:利用一部克隆方法对a1所获得的目的基因与出发载体连接构建表达载体;
a3:用宿主菌构建含有cota基因的基因工程菌,高效表达细菌漆酶基因;
a4:采用镍离子柱对重组细菌漆酶cota形成纯化后,浓缩获得cota蛋白纯酶。
所述a1中,引物的设计采用的是本领域常规技术手段。pcr技术是指对特定基因进行体外合成,并用于以检测dna/rna为目的的各种基因。
所述a4中,使用分子截留量为50kda的超滤管进行浓缩获得cota蛋白纯酶。所述cota蛋白醇酶为浓度为20mg/ml的蛋白浓缩液。
在具体的实施方式中,所述目的基因cota的pcr扩增具体的反应条件如下:
细菌漆酶cota基因的pcr扩增:
根据ncbi公布的bacillussubtilis168中cota的基因序列(对应的genbankaccessionno.为bsu_06300);
使用引物设计软件primerpremier设计了扩增cota的引物cota-28f(agcaaatgggtcgcggatccatgacacttgaaaaatttgtgga)和cota-28r(cggagctcgaattcggatccgctttatggggatcagttatatccat)。以bacillussubtilis168全基因组为模板,扩增cota基因,pcr反应条件:
利用琼脂糖凝胶电泳鉴定pcr产物的正确性,鉴定完成后用胶纯化试剂盒进行纯化回收,置于-20℃储存备用。
在优选的实施方式中,所述直接电化学型细菌漆酶传感电极的构建,包含如下步骤:
所述目的基因cota的pcr扩增具体的反应条件如下:
细菌漆酶cota基因的pcr扩增:
根据ncbi公布的bacillussubtilis168中cota的基因序列(对应的genbankaccessionno.为bsu_06300);
使用引物设计软件primerpremier设计了扩增cota的引物cota-28f(agcaaatgggtcgcggatccatgacacttgaaaaatttgtgga)和cota-28r(cggagctcgaattcggatccgctttatggggatcagttatatccat)。以bacillussubtilis168全基因组为模板,扩增cota基因,pcr反应条件:
利用琼脂糖凝胶电泳鉴定pcr产物的正确性,鉴定完成后用胶纯化试剂盒进行纯化回收,置于-20℃储存备用。
在具体的实施方式中,所述直接电化学型细菌漆酶传感电极的构建,包含如下步骤:
b1:将金电极进行预处理,进行电化学测试。达到电化学实验要求后,将金电极进行清洗;
b2:将b1所得到的金电极置于半胱氨酸溶液中进行表面修饰,使金电极表面固载一层致密的半胱氨酸修饰层;
b3:将b2所得到的金电极进行表面固定。
所述电化学测试方式为分析化学领域常用的测试方法,例如循环伏安法,电化学阻抗谱,计时电流曲线法。
所述清洗过程为使用蒸馏水冲洗干净,再依次在二次蒸馏水、无水乙醇、丙酮、二次蒸馏水中清洗。
在具体的实施方式中,所述细菌漆酶选自bacillussubtilis168。
在具体的实施方式中,所述出发载体为pet-28a(+),所述表达载体为pet-cota。pet-28a(+)载体购买紫背景百奥莱博科技有限公司。
在具体的实施方式中,所述宿主菌为e.colibl21(de3),所述基因工程菌为e.colibl21(de3-pet-cota)。宿主菌e.colibl21(de3)菌种购买自上海泽叶生物科技有限公司。
在具体的实施方式中,所采用的固定的方法为本领域常规技术手段。在这里不做细述。
在具体的实施方式中,所述e.colibl21(de3-pet-cota)的构建方法,包含如下步骤:
c1:将含细菌漆酶cota基因的pet-28a(+)重组质粒转化到表达宿主菌e.colibl21(de3)获得重组微生物e.colibl21(de3-pet-cota);
c2:将c1所获得的重组微生物转接到含有abts、卡那霉素和iptg的平板,培养,挑取阳性转化子,保存。
在具体的实施方式中,所述培养的条件为35-39℃下培养14-18h;在优选的实施方式中,所述培养的条件为36-38℃下培养15-17h;在进一步优选的实施方式中,所述培养的条件为37℃下培养16h。
在具体的实施方式中,所述阳性转化子为表面有蓝绿色晕圈的阳性转化子。
在具体的实施方式中,所述表面固定的方法为:将b2所得到的金电极置于edc/nhs试剂中,在2-6℃下静置4-8h;在优选的实施方式中,所述表面固定的方法为:将b2所得到的金电极置于edc/nhs试剂中,在3-5℃下静置5-7h;在进一步优选的实施方式中,所述表面固定的方法为:将b2所得到的金电极置于edc/nhs试剂中,在4℃下静置6h。
在具体的实施方式中,所述edc的cas号为25952-53-8,所述nhs的cas号为6606-82-6。edc/nhs试剂中,edc和nhs的重量比为(1-5):(5-1);在优选的实施方式中,所述edc与nhs的重量比为2:1。
在具体的实施方式中,所述平板为含有200mg/labts、50mg/l卡那霉素和24mg/liptg的平板。abts是一种介体物质,中文名为2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸。所述的iptg为异丙基硫代半乳糖苷。
在具体的实施方式中,所述重组质粒pet28(+)-cota的构建
pet-28a(+)质粒用限制性内切酶bamhi进行酶切,鉴定其总长。酶切反应体系(20μl)如下:
反应条件为37℃酶切4h,在体系中加入10×loadingbuffer终止液后利用1.0%琼脂糖凝胶电泳分离,紫外快速切胶纯化并参照北京庄盟公司提供的胶回收试剂盒说明书回收目的片段。
将(1)中得到的pcr产物为cota基因全长,需要在pcr产物的两端加上质粒片段用于一步克隆与质粒连接,构建原理为图1。连接条件为:
所述重组菌株e.colibl21/pet28(+)-cota的构建
加入构建的重组质粒溶液至装有200ml感受态细胞的悬液,混合均匀后冰浴30min。取出后于42℃下水浴准确热激计时90s,冰浴2min。加入一定量的lb培养基,在37℃、150r/min条件下孵化培养1~2h。取适量孵化好的菌液涂布于含有200mg/labts、50mg/l卡那霉素和24mg/liptg的lb固体平板上,37℃培养12h,挑选有蓝色变色圈的阳性克隆子,经测序验证基因序列无误。
所述重组细菌漆酶cota的诱导表达及纯化:
平板培养:将菌液涂布到平板培养基上,放置于恒温培养箱中,37℃恒温培养12h。
菌种有氧活化培养:将保存于-80℃超低温冰箱的菌种解冻后,以1%的接种量接至含有5mllb液体培养基的试管中,在37℃,200r/min条件下培养12h。
有氧摇瓶培养:将经试管培养12h后的菌液按1%的接种量接种到含有50mllb液体培养基的500ml规格的三角瓶中,在37℃,200r/min条件下培养。
有氧诱导培养:同有氧摇瓶培养,在菌体od600达到0.6左右时,添加iptg(isopropyl-β-d-1-thiogalactopyranpside,异丙基-β-d-1-硫代半乳糖苷)至终浓度为0.1mmol/l,在20℃、170r/min,添加0.25mm浓度的cuso4,微好氧诱导24h。
发酵液经离心后使用50ml预冷的缓冲液(pbsph5.0)重悬,4℃,10000rpm,30min离心沉淀。运用超声细胞破碎法(220v,超声3s,间隔5s,30-50分钟)破碎细胞悬浊液直至浑浊变为清亮。收集上清液备用。
参照
1)将超声破碎后的样品用0.22μm的滤膜过滤上清。
2)开机,按操作使用说明安装调试纯化系,安装gehistrapff5ml组氨酸蛋白纯化柱。清洗后,使用2ml注射器从样品环进样,运行仪器,同时按要求更换缓冲液。
3)使用10ml离心管收集纯化蛋白,使用50kda分子量截留超滤管浓缩收集纯蛋白,将蛋白缓冲液置换成0.1mmph5.0pbs,存于4℃备用。
上述样品通过12%sds聚丙烯凝胶电泳(sds-page)检测cota的表达和纯化情况,并初步判断其分子量。
在优选的实施方式中,所述重组质粒pet28(+)-cota的构建
pet-28a(+)质粒用限制性内切酶bamhi进行酶切,鉴定其总长。酶切反应体系(20μl)如下:
反应条件为37℃酶切4h,在体系中加入10×loadingbuffer终止液后利用1.0%琼脂糖凝胶电泳分离,紫外快速切胶纯化并参照北京庄盟公司提供的胶回收试剂盒说明书回收目的片段。
将(1)中得到的pcr产物为cota基因全长,需要在pcr产物的两端加上质粒片段用于一步克隆与质粒连接,构建原理为图1。连接条件为:
所述重组菌株e.colibl21/pet28(+)-cota的构建
加入构建的重组质粒溶液至装有200ml感受态细胞的悬液,混合均匀后冰浴30min。取出后于42℃下水浴准确热激计时90s,冰浴2min。加入一定量的lb培养基,在37℃、150r/min条件下孵化培养1~2h。取适量孵化好的菌液涂布于含有200mg/labts、50mg/l卡那霉素和24mg/liptg的lb固体平板上,37℃培养12h,挑选有蓝色变色圈的阳性克隆子,经测序验证基因序列无误。
所述重组细菌漆酶cota的诱导表达及纯化:
平板培养:将菌液涂布到平板培养基上,放置于恒温培养箱中,37℃恒温培养12h。
菌种有氧活化培养:将保存于-80℃超低温冰箱的菌种解冻后,以1%的接种量接至含有5mllb液体培养基的试管中,在37℃,200r/min条件下培养12h。
有氧摇瓶培养:将经试管培养12h后的菌液按1%的接种量接种到含有50mllb液体培养基的500ml规格的三角瓶中,在37℃,200r/min条件下培养。
有氧诱导培养:同有氧摇瓶培养,在菌体od600达到0.6左右时,添加iptg(isopropyl-β-d-1-thiogalactopyranpside,异丙基-β-d-1-硫代半乳糖苷)至终浓度为0.1mmol/l,在20℃、170r/min,添加0.25mm浓度的cuso4,微好氧诱导24h。
发酵液经离心后使用50ml预冷的缓冲液(pbsph5.0)重悬,4℃,10000rpm,30min离心沉淀。运用超声细胞破碎法(220v,超声3s,间隔5s,30-50分钟)破碎细胞悬浊液直至浑浊变为清亮。收集上清液备用。
参照
1)将超声破碎后的样品用0.22μm的滤膜过滤上清。
2)开机,按操作使用说明安装调试纯化系,安装gehistrapff5ml组氨酸蛋白纯化柱。清洗后,使用2ml注射器从样品环进样,运行仪器,同时按要求更换缓冲液。
3)使用10ml离心管收集纯化蛋白,使用50kda分子量截留超滤管浓缩收集纯蛋白,将蛋白缓冲液置换成0.1mmph5.0pbs,存于4℃备用。
上述样品通过12%sds聚丙烯凝胶电泳(sds-page)检测cota的表达和纯化情况,并初步判断其分子量。
本发明的第二方面提供了一种用于胆红素检测的细菌漆酶传感器,采用上述方法制备得到。
在具体的实施方式中,所述胆红素包括直接胆红素,间接胆红素和总胆红素。
在具体的实施方式中,所述检测环境ph为7.0-9.0。
本发明的细菌漆酶传感器能够在碱性条件下具有优异的稳定性,从而实现对胆红素精确而稳定的测试。
此外,本发明构建的传感器达到了在碱性条件下对较低浓度的胆红素进行浓度测定效果。
下面以具体的实施例来说明。
实施例
实施例1
实施例1的第一方面提供了一种基于直接电化学的细菌漆酶传感器的制备方法,包含如下步骤:
s1:细菌漆酶cota的表达获取;
s2:直接电化学型细菌漆酶传感电极的构建;
所述细菌漆酶cota的表达获取,包含如下步骤:
a1:对细菌漆酶进行全基因提取,利用设计引物对目的基因cota的pcr扩增获得目的基因序列;
a2:利用一部克隆方法对a1所获得的目的基因与出发载体连接构建表达载体;
a3:用宿主菌构建含有cota基因的基因工程菌,高效表达细菌漆酶基因;
a4:采用镍离子柱对重组细菌漆酶cota形成纯化后,浓缩获得cota蛋白纯酶;
所述细菌漆酶选自bacillussubtilis168;所述出发载体为pet-28a(+),所述表达载体为pet-cota;所述宿主菌为e.colibl21(de3),所述基因工程菌为e.colibl21(de3-pet-cota);
所述目的基因cota的pcr扩增具体的反应条件如下:
细菌漆酶cota基因的pcr扩增:
根据ncbi公布的bacillussubtilis168中cota的基因序列(对应的genbankaccessionno.为bsu_06300);
使用引物设计软件primerpremier设计了扩增cota的引物cota-28f(agcaaatgggtcgcggatccatgacacttgaaaaatttgtgga)和cota-28r
(cggagctcgaattcggatccgctttatggggatcagttatatccat)。
以bacillussubtilis168全基因组为模板,扩增cota基因,pcr反应条件:
利用琼脂糖凝胶电泳鉴定pcr产物的正确性,鉴定完成后用胶纯化试剂盒进行纯化回收,置于-20℃储存备用。
所述直接电化学型细菌漆酶传感电极的构建,包含如下步骤:
b1:将金电极进行预处理,进行电化学测试。达到电化学实验要求后,将金电极进行清洗;
b2:将b1所得到的金电极置于半胱氨酸溶液中进行表面修饰,使金电极表面固载一层致密的半胱氨酸修饰层;
b3:将b2所得到的金电极进行表面固定;
所述e.colibl21(de3-pet-cota)的构建方法,包含如下步骤:
c1:将含细菌漆酶cota基因的pet-28a(+)重组质粒转化到表达宿主菌e.colibl21(de3)获得重组微生物e.colibl21(de3-pet-cota);
c2:将c1所获得的重组微生物转接到含有abts、卡那霉素和iptg的平板,培养,挑取阳性转化子,保存;
所述培养的条件为37℃下培养16h;所述阳性转化子为表面有蓝绿色晕圈的阳性转化子;所述表面固定的方法为:将b2所得到的金电极置于edc/nhs试剂中,在4℃下静置6h;所述edc与nhs的重量比为2:1;
所述重组质粒pet28(+)-cota的构建
pet-28a(+)质粒用限制性内切酶bamhi进行酶切,鉴定其总长。酶切反应体系(20μl)如下:
反应条件为37℃酶切4h,在体系中加入10×loadingbuffer终止液后利用1.0%琼脂糖凝胶电泳分离,紫外快速切胶纯化并参照北京庄盟公司提供的胶回收试剂盒说明书回收目的片段。
将(1)中得到的pcr产物为cota基因全长,需要在pcr产物的两端加上质粒片段用于一步克隆与质粒连接,构建原理为图1。连接条件为:
所述重组菌株e.colibl21/pet28(+)-cota的构建
加入构建的重组质粒溶液至装有200ml感受态细胞的悬液,混合均匀后冰浴30min。取出后于42℃下水浴准确热激计时90s,冰浴2min。加入一定量的lb培养基,在37℃、150r/min条件下孵化培养1~2h。取适量孵化好的菌液涂布于含有200mg/labts、50mg/l卡那霉素和24mg/liptg的lb固体平板上,37℃培养12h,挑选有蓝色变色圈的阳性克隆子,经测序验证基因序列无误。
所述重组细菌漆酶cota的诱导表达及纯化:
平板培养:将菌液涂布到平板培养基上,放置于恒温培养箱中,37℃恒温培养12h。
菌种有氧活化培养:将保存于-80℃超低温冰箱的菌种解冻后,以1%的接种量接至含有5mllb液体培养基的试管中,在37℃,200r/min条件下培养12h。
有氧摇瓶培养:将经试管培养12h后的菌液按1%的接种量接种到含有50mllb液体培养基的500ml规格的三角瓶中,在37℃,200r/min条件下培养。
有氧诱导培养:同有氧摇瓶培养,在菌体od600达到0.6左右时,添加iptg(isopropyl-β-d-1-thiogalactopyranpside,异丙基-β-d-1-硫代半乳糖苷)至终浓度为0.1mmol/l,在20℃、170r/min,添加0.25mm浓度的cuso4,微好氧诱导24h。
发酵液经离心后使用50ml预冷的缓冲液(pbsph5.0)重悬,4℃,10000rpm,30min离心沉淀。运用超声细胞破碎法(220v,超声3s,间隔5s,30-50分钟)破碎细胞悬浊液直至浑浊变为清亮。收集上清液备用。
参照
1)将超声破碎后的样品用0.22μm的滤膜过滤上清。
2)开机,按操作使用说明安装调试纯化系,安装gehistrapff5ml组氨酸蛋白纯化柱。清洗后,使用2ml注射器从样品环进样,运行仪器,同时按要求更换缓冲液。
3)使用10ml离心管收集纯化蛋白,使用50kda分子量截留超滤管浓缩收集纯蛋白,将蛋白缓冲液置换成0.1mmph5.0pbs,存于4℃备用。
上述样品通过12%sds聚丙烯凝胶电泳(sds-page)检测cota的表达和纯化情况,并初步判断其分子量。
实施例1的第二方面提供了一种用于胆红素检测的细菌漆酶传感器,采用上述制备方法得到。
实施例2
实施例2提供了一种基于直接电化学的细菌漆酶传感器的制备方法,包含如下步骤:
s1:细菌漆酶cota的表达获取;
s2:直接电化学型细菌漆酶传感电极的构建;
所述细菌漆酶cota的表达获取,包含如下步骤:
a1:对细菌漆酶进行全基因提取,利用设计引物对目的基因cota的pcr扩增获得目的基因序列;
a2:利用一部克隆方法对a1所获得的目的基因与出发载体连接构建表达载体;
a3:用宿主菌构建含有cota基因的基因工程菌,高效表达细菌漆酶基因;
a4:采用镍离子柱对重组细菌漆酶cota形成纯化后,浓缩获得cota蛋白纯酶;
所述目的基因cota的pcr扩增具体的反应条件如下:
细菌漆酶cota基因的pcr扩增:
根据ncbi公布的bacillussubtilis168中cota的基因序列(对应的genbankaccessionno.为bsu_06300);
使用引物设计软件primerpremier设计了扩增cota的引物cota-28f(agcaaatgggtcgcggatccatgacacttgaaaaatttgtgga)和cota-28r(cggagctcgaattcggatccgctttatggggatcagttatatccat)。以bacillussubtilis168全基因组为模板,扩增cota基因,pcr反应条件:
利用琼脂糖凝胶电泳鉴定pcr产物的正确性,鉴定完成后用胶纯化试剂盒进行纯化回收,置于-20℃储存备用。
所述直接电化学型细菌漆酶传感电极的构建,包含如下步骤:
b1:将金电极进行预处理,进行电化学测试。达到电化学实验要求后,将金电极进行清洗;
b2:将b1所得到的金电极置于半胱氨酸溶液中进行表面修饰,使金电极表面固载一层致密的半胱氨酸修饰层;
b3:将b2所得到的金电极进行表面固定;
所述细菌漆酶选自bacillussubtilis168;所述出发载体为pet-28a(+),所述表达载体为pet-cota;所述宿主菌为e.colibl21(de3),所述基因工程菌为e.colibl21(de3-pet-cota);
所述e.colibl21(de3-pet-cota)的构建方法,包含如下步骤:
c1:将含细菌漆酶cota基因的pet-28a(+)重组质粒转化到表达宿主菌e.colibl21(de3)获得重组微生物e.colibl21(de3-pet-cota);
c2:将c1所获得的重组微生物转接到含有abts、卡那霉素和iptg的平板,培养,挑取阳性转化子,保存;
所述培养的条件为36℃下培养15h;所述阳性转化子为表面有蓝绿色晕圈的阳性转化子;所述表面固定的方法为:将b2所得到的金电极置于edc/nhs试剂中,在3℃下静置5h;所述edc与nhs的重量比为2:1。
所述重组质粒pet28(+)-cota的构建
pet-28a(+)质粒用限制性内切酶bamhi进行酶切,鉴定其总长。酶切反应体系(20μl)如下:
反应条件为37℃酶切4h,在体系中加入10×loadingbuffer终止液后利用1.0%琼脂糖凝胶电泳分离,紫外快速切胶纯化并参照北京庄盟公司提供的胶回收试剂盒说明书回收目的片段。
将(1)中得到的pcr产物为cota基因全长,需要在pcr产物的两端加上质粒片段用于一步克隆与质粒连接,构建原理为图1。连接条件为:
所述重组菌株e.colibl21/pet28(+)-cota的构建
加入构建的重组质粒溶液至装有200ml感受态细胞的悬液,混合均匀后冰浴30min。取出后于42℃下水浴准确热激计时90s,冰浴2min。加入一定量的lb培养基,在37℃、150r/min条件下孵化培养1~2h。取适量孵化好的菌液涂布于含有200mg/labts、50mg/l卡那霉素和24mg/liptg的lb固体平板上,37℃培养12h,挑选有蓝色变色圈的阳性克隆子,经测序验证基因序列无误。
所述重组细菌漆酶cota的诱导表达及纯化:
平板培养:将菌液涂布到平板培养基上,放置于恒温培养箱中,37℃恒温培养12h。
菌种有氧活化培养:将保存于-80℃超低温冰箱的菌种解冻后,以1%的接种量接至含有5mllb液体培养基的试管中,在37℃,200r/min条件下培养12h。
有氧摇瓶培养:将经试管培养12h后的菌液按1%的接种量接种到含有50mllb液体培养基的500ml规格的三角瓶中,在37℃,200r/min条件下培养。
有氧诱导培养:同有氧摇瓶培养,在菌体od600达到0.6左右时,添加iptg(isopropyl-β-d-1-thiogalactopyranpside,异丙基-β-d-1-硫代半乳糖苷)至终浓度为0.1mmol/l,在20℃、170r/min,添加0.25mm浓度的cuso4,微好氧诱导24h。
发酵液经离心后使用50ml预冷的缓冲液(pbsph5.0)重悬,4℃,10000rpm,30min离心沉淀。运用超声细胞破碎法(220v,超声3s,间隔5s,30-50分钟)破碎细胞悬浊液直至浑浊变为清亮。收集上清液备用。
参照
1)将超声破碎后的样品用0.22μm的滤膜过滤上清。
2)开机,按操作使用说明安装调试纯化系,安装gehistrapff5ml组氨酸蛋白纯化柱。清洗后,使用2ml注射器从样品环进样,运行仪器,同时按要求更换缓冲液。
3)使用10ml离心管收集纯化蛋白,使用50kda分子量截留超滤管浓缩收集纯蛋白,将蛋白缓冲液置换成0.1mmph5.0pbs,存于4℃备用。
上述样品通过12%sds聚丙烯凝胶电泳(sds-page)检测cota的表达和纯化情况,并初步判断其分子量。
实施例2的第二方面提供了一种用于胆红素检测的细菌漆酶传感器,采用上述制备方法得到。
实施例3
实施例3提供了一种基于直接电化学的细菌漆酶传感器的制备方法,包含如下步骤:
s1:细菌漆酶cota的表达获取;
s2:直接电化学型细菌漆酶传感电极的构建;
所述细菌漆酶cota的表达获取,包含如下步骤:
a1:对细菌漆酶进行全基因提取,利用设计引物对目的基因cota的pcr扩增获得目的基因序列;
a2:利用一部克隆方法对a1所获得的目的基因与出发载体连接构建表达载体;
a3:用宿主菌构建含有cota基因的基因工程菌,高效表达细菌漆酶基因;
a4:采用镍离子柱对重组细菌漆酶cota形成纯化后,浓缩获得cota蛋白纯酶;
所述细菌漆酶选自bacillussubtilis168;所述出发载体为pet-28a(+),所述表达载体为pet-cota;所述宿主菌为e.colibl21(de3),所述基因工程菌为e.colibl21(de3-pet-cota);
所述目的基因cota的pcr扩增具体的反应条件如下:
细菌漆酶cota基因的pcr扩增:
根据ncbi公布的bacillussubtilis168中cota的基因序列(对应的genbankaccessionno.为bsu_06300);
使用引物设计软件primerpremier设计了扩增cota的引物cota-28f(agcaaatgggtcgcggatccatgacacttgaaaaatttgtgga)和cota-28r(cggagctcgaattcggatccgctttatggggatcagttatatccat)。以bacillussubtilis168全基因组为模板,扩增cota基因,pcr反应条件:
利用琼脂糖凝胶电泳鉴定pcr产物的正确性,鉴定完成后用胶纯化试剂盒进行纯化回收,置于-20℃储存备用。
所述直接电化学型细菌漆酶传感电极的构建,包含如下步骤:
b1:将金电极进行预处理,进行电化学测试。达到电化学实验要求后,将金电极进行清洗;
b2:将b1所得到的金电极置于半胱氨酸溶液中进行表面修饰,使金电极表面固载一层致密的半胱氨酸修饰层;
b3:将b2所得到的金电极进行表面固定;
所述e.colibl21(de3-pet-cota)的构建方法,包含如下步骤:
c1:将含细菌漆酶cota基因的pet-28a(+)重组质粒转化到表达宿主菌e.colibl21(de3)获得重组微生物e.colibl21(de3-pet-cota);
c2:将c1所获得的重组微生物转接到含有abts、卡那霉素和iptg的平板,培养,挑取阳性转化子,保存;
所述培养的条件为37℃下培养16h;所述阳性转化子为表面有蓝绿色晕圈的阳性转化子;所述表面固定的方法为:将b2所得到的金电极置于edc/nhs试剂中,在4℃下静置6h;所述edc与nhs的重量比为2:1;
所述重组质粒pet28(+)-cota的构建
pet-28a(+)质粒用限制性内切酶bamhi进行酶切,鉴定其总长。酶切反应体系(20μl)如下:
反应条件为37℃酶切4h,在体系中加入10×loadingbuffer终止液后利用1.0%琼脂糖凝胶电泳分离,紫外快速切胶纯化并参照北京庄盟公司提供的胶回收试剂盒说明书回收目的片段。
将(1)中得到的pcr产物为cota基因全长,需要在pcr产物的两端加上质粒片段用于一步克隆与质粒连接,构建原理为图1。连接条件为:
所述重组菌株e.colibl21/pet28(+)-cota的构建
加入构建的重组质粒溶液至装有200ml感受态细胞的悬液,混合均匀后冰浴30min。取出后于42℃下水浴准确热激计时90s,冰浴2min。加入一定量的lb培养基,在37℃、150r/min条件下孵化培养1~2h。取适量孵化好的菌液涂布于含有200mg/labts、50mg/l卡那霉素和24mg/liptg的lb固体平板上,37℃培养12h,挑选有蓝色变色圈的阳性克隆子,经测序验证基因序列无误。
所述重组细菌漆酶cota的诱导表达及纯化:
平板培养:将菌液涂布到平板培养基上,放置于恒温培养箱中,37℃恒温培养12h。
菌种有氧活化培养:将保存于-80℃超低温冰箱的菌种解冻后,以1%的接种量接至含有5mllb液体培养基的试管中,在37℃,200r/min条件下培养12h。
有氧摇瓶培养:将经试管培养12h后的菌液按1%的接种量接种到含有50mllb液体培养基的500ml规格的三角瓶中,在37℃,200r/min条件下培养。
有氧诱导培养:同有氧摇瓶培养,在菌体od600达到0.6左右时,添加iptg(isopropyl-β-d-1-thiogalactopyranpside,异丙基-β-d-1-硫代半乳糖苷)至终浓度为0.1mmol/l,在20℃、170r/min,添加0.25mm浓度的cuso4,微好氧诱导24h。
发酵液经离心后使用50ml预冷的缓冲液(pbsph5.0)重悬,4℃,10000rpm,30min离心沉淀。运用超声细胞破碎法(220v,超声3s,间隔5s,30-50分钟)破碎细胞悬浊液直至浑浊变为清亮。收集上清液备用。
参照
1)将超声破碎后的样品用0.22μm的滤膜过滤上清。
2)开机,按操作使用说明安装调试纯化系,安装gehistrapff5ml组氨酸蛋白纯化柱。清洗后,使用2ml注射器从样品环进样,运行仪器,同时按要求更换缓冲液。
3)使用10ml离心管收集纯化蛋白,使用50kda分子量截留超滤管浓缩收集纯蛋白,将蛋白缓冲液置换成0.1mmph5.0pbs,存于4℃备用。
上述样品通过12%sds聚丙烯凝胶电泳(sds-page)检测cota的表达和纯化情况,并初步判断其分子量。
实施例3的第二方面提供了一种用于胆红素检测的细菌漆酶传感器,采用上述制备方法得到。
对比例1
对比例1提供了一种淡红色测试方法,所采用的为常规现有技术,真菌红素氧化酶传感电极。
性能测试评价
1)细菌漆酶传感电极在碱性条件下对胆红素的检测性能评测
首先,利用实施例1所制备得到的基于直接电化学的细菌漆酶传感器来研究cota修饰的直接电化学型电极在不同ph条件下的对胆红素的电化学响应性能,使用循环伏安法对电极响应一定浓度胆红素的性能进行表征。从图1可看出,ph对电极响应信号影响明显,其中,在ph偏中性为6、7时,电极对胆红素几乎无响应性能,这是由于胆红素只能溶于醇类等有机试剂或偏碱性溶液中,在中性或偏酸性条件下形成沉淀,电极上的cota酶蛋白不能对其进行氧化催化,导致几乎无响应电流形成,从而仅仅体现直接电化学对氧气的还原过程。而当ph为8时,胆红素溶解形成胆红素溶液,电极在电位为0.45v左右形成一个还原峰为大约3μa大小的电流,并且对氧气的还原峰电流相应减小。这是由于胆红素的氧化过程消耗了部分在电极表面的氧气。随着溶液ph的上升至8.5,电极展示了良好的对胆红素的响应能力并伴随着氧气还原峰电流的进一步下降。因此,可选择ph为8.5作为电极检测胆红素的电压值。而ph到达9.0时,电极对胆红素的氧化能力下降,并且对氧气的还原能力也明显降低,这可能是由于相较于ph8.5,cota蛋白在ph9.0时性能被抑制,无论是直接对氧气的还原还是对胆红素的氧化均受到影响,并且检测电位随着ph的改变也向中心偏移。
2)细菌漆酶传感电极的直接电化学表征
利用实施例1提供的方法所制备得到的基于直接电化学的细菌漆酶传感器对胆红素进行检测。从图2可知,在设定检测电压为0.45v的检测体系中加入10μmol的胆红素后,电极电流未有明显响应。直至加入浓度为40μmol时响应电流开始有显示,但响应电流较小。经测定,此电极的线性范围为80μmol至640μmol灵敏度为3.2μa/mmol,检出限为9.5μmol/l。
3)细菌漆酶传感电极与真菌胆红素氧化酶传感电极在钠盐存在下对胆红素的检测性能比较:
将实施例1所获得的细菌漆酶传感器与对比例1中的真菌胆红素氧化酶传感器进行胆红素检测性能比较。
在近人体环境中,氯离子普遍存在且浓度为100mmol左右,若要在此种环境依然能够发挥检测功能,生物电极表面的生物元件酶分子自身的稳定性尤其重要。上述研究中已比较了cota蛋白与胆红素氧化酶对氯离子的耐受性。在电极上,我们使用时间-电流扫描对电极在不同浓度氯离子存在环境下稳定性进行表征。从图3可以看出,随着不断添加氯化钠进入检测环境,cota修饰电极依然能在200mmol/l浓度下保持检测稳定,甚至在较高浓度(1mol/l)中电极依然能保留40%以上检测性能,这与之前有关cota的氯离子耐受性研究相符。而相对而言,真菌胆红素氧化酶修饰电极受影响较为严重,在氯离子浓度达到100mmol时电极性能就已经被干扰,已经不能发挥正常检测水平。
- 还没有人留言评论。精彩留言会获得点赞!