一种极端嗜盐、耐表面活性剂的非钙离子依赖型α-淀粉酶及其基因和应用的制作方法
本发明涉及基因工程领域,具体地,本发明涉及一种极端嗜盐、耐表面活性剂的非钙离子依赖型α-淀粉酶amysl3及其基因和应用。
背景技术:
淀粉由直链淀粉和支链组成,其中由α-1,4和α-1,6-葡糖键连接的葡萄糖单元分别构成主链和支链。通常内切淀粉酶,外淀粉酶,去分支酶,和转移酶参与淀粉的酶解转化。α-淀粉酶(ec3.2.1.1)是一种广为人知的内切淀粉酶,它随机催化淀粉和相关碳水化合物中α-1,4-葡糖键的水解,产生葡萄糖、低聚糖和糊精。根据催化结构域的序列相似性,α-淀粉酶分布在糖苷水解酶(gh)家族13、57、119和126(http://www.cazy.org/fam/acc_gh.html)。大多数α-淀粉酶属于gh家族13,该家族的α-淀粉酶包含tim桶催化结构域和4个保守区。
α-淀粉酶是最重要的工业酶之一,约占酶市场的四分之一(2016年)。虽然α-淀粉酶普遍分布在植物、动物和微生物中,但微生物α-淀粉酶由于在淀粉糖化、烘焙、酿造、洗衣、纺织以及制药工业中的广泛应用而引起了人们的特别关注。来自极端微生物的α-淀粉酶因为它们能够在恶劣的条件下保持活力引起了极大的兴趣。此外,它们为理解蛋白质结构与功能的关系提供了一个很好的原材料,同时也为其他酶的改造奠定理论基础。到目前为止,已报告了包括嗜热、嗜冷、嗜酸、嗜碱和嗜盐的α-淀粉酶。其中,来自嗜盐微生物的α-淀粉酶引起了越来越多的兴趣,因为它们在高盐浓度下具有内在的稳定性和活性,因此在食品加工、环境生物修复和制药领域有着重要的潜在生物技术应用价值。
尽管具有巨大的工业应用潜力,但对嗜盐α-淀粉酶的研究却非常有限。到目前为止,已经从嗜盐古菌、细菌和真菌中纯化和鉴定了不超过20种嗜盐或耐盐的α-淀粉酶。关于嗜盐或耐盐α-淀粉酶的基因克隆、过度表达和特性的研究更少。本发明从大布苏盐碱湖底泥中分离了一株能够产极端嗜盐、耐表面活性剂的非钙离子依赖型α-淀粉酶的嗜盐嗜碱菌alkalibacteriumsp.sl3,利用分子生物学和基因工程的方法获得了该极端嗜盐、耐表面活性剂的非钙离子依赖型α-淀粉酶的编码基因,并对该基因进行了重组表达,重组酶具有在高盐条件下高活性和高稳定性的特点。同时,该酶为非钙离子依赖型并具有很好的表面活性剂和有机溶剂耐受性。此外,该酶对不同植物来源的淀粉具有很高的降解活性并能生成麦芽寡糖。因此,该α-淀粉酶所具有的极端嗜盐、耐表面活性剂和非钙离子依赖的特点,在食品、洗涤剂和制药工业领域具有很大的应用潜力。
技术实现要素:
本发明针对现有技术中的不足,提供一种极端嗜盐、耐表面活性剂的非钙离子依赖型α-淀粉酶及其基因和应用。本发明首先获得一种极端嗜盐、耐表面活性剂的非钙离子依赖型α-淀粉酶amysl3,在高盐条件下具有很高的酶活性和稳定性。这些性质符合腌制食品和海产品处理过程中对淀粉酶耐盐的要求。该酶还具有耐受常见的表面活性剂的特性,因此可用于洗涤剂行业。最后,该酶具有的耐有机溶剂的特性,使得该酶可用于医药行业。
本发明的第一个目的是提供一种极端嗜盐、耐表面活性剂的非钙离子依赖型α-淀粉酶,其氨基酸序列如seqidno.1所示。
本发明的再一目的是提供编码上述极端嗜盐、耐表面活性剂的非钙离子依赖型α-淀粉酶的基因,其核苷酸序列如seqidno.2所示。
本发明的另一目的是提供包含上述基因的重组载体。
本发明的另一目的是提供包含上述基因的重组菌株。
所述重组菌株为大肠杆菌、酵母菌、芽孢杆菌或丝状真菌。
本发明的另一目的是提供一种极端嗜盐、耐表面活性剂的非钙离子依赖型α-淀粉酶的制备方法方法,包括以下步骤:
1)用amysl3的重组载体转化宿主细胞,得重组菌株;
2)培养重组菌株,诱导重组淀粉酶表达;
3)回收并纯化所表达的α-淀粉酶amysl3。
进一步地,将所述极端嗜盐、耐表面活性剂的非钙离子依赖型α-淀粉酶amysl3应用于制备腌制食品、海产品、洗涤剂或药物合成中。
附图说明
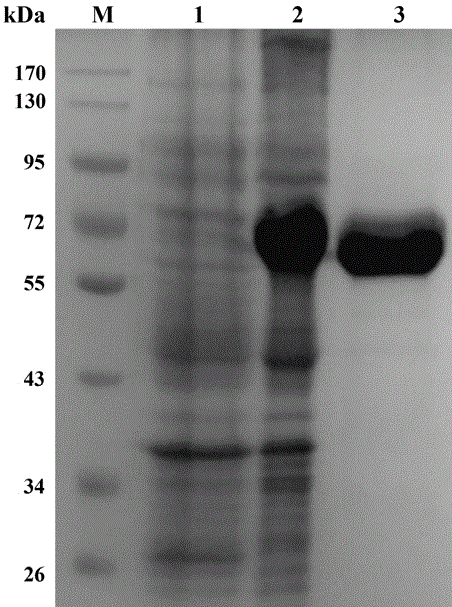
图1:在大肠杆菌中表达的重组α-淀粉酶amysl3的sds-page分析;其中,m:蛋白质marker;1:未诱导的含有α-淀粉酶基因载体pet28a-amysl3的大肠杆菌菌体破碎液;2:诱导的含有α-淀粉酶基因载体pet28a-amysl3的大肠杆菌菌体破碎液;3:通过镍柱纯化的达到电泳纯的amysl3蛋白。
图2:重组α-淀粉酶amysl3的最适ph。
图3:重组α-淀粉酶amysl3的ph稳定性。
图4:重组α-淀粉酶amysl3的最适温度。
图5:重组α-淀粉酶amysl3的热稳定性。
图6:钙离子对重组α-淀粉酶amysl3活性的影响。
图7:重组α-淀粉酶amysl3的盐耐受性。
图8:重组α-淀粉酶amysl3的盐稳定性。
图9:重组α-淀粉酶amysl3的对不同来源的淀粉的降解产物分析。
具体实施方式
试验材料和试剂
1、菌株及载体:大肠杆菌表达载体pet28a(+)及菌株escherichiacolibl21(de3)购自于novagen公司。
2、酶类及其它生化试剂:限制性内切酶、t4dna连接酶、dna聚合酶、dntps和pmd19-t载体购于日本takara公司。基因组提取试剂盒购于北京tiangen公司,纯化及质粒提取试剂盒购于美国omega公司。可溶性淀粉购于美国sigma公司,蛋白胨(tryptone)、酵母提取物(yeastextract)为英国oxoid公司产品,其余试剂为国产分析纯。
3、培养基:
(1)lb液体培养基(g/l):蛋白胨10.0,酵母粉5.0,nacl10.0,ph7.0。
(2)lb固体培养基(g/l):酵母粉5.0,蛋白胨10.0,nacl10.0,琼脂15.0,ph7.0。
说明:以下实施例中未作具体说明的分子生物学实验方法,均参照《分子克隆实验指南》(第三版)j.萨姆布鲁克一书中所列的具体方法进行,或者按照试剂盒和产品说明书进行。
实施例1:α-淀粉酶基因amysl3的克隆
嗜盐嗜碱菌alkalibacteriumsp.sl3基因组dna的提取:利用淀粉为唯一碳源的筛选培养基从吉林乾安大布苏盐碱湖的底泥中分离得到一株产α-淀粉酶的微生物,经16s鉴定为嗜盐嗜碱菌属,命名为alkalibacteriumsp.sl3。采用天根公司的细菌基因组提取试剂盒(dp302)提取该嗜盐嗜碱菌的基因组dna,具体操作完全按照该试剂盒的说明书进行。
根据alkalibacterium属来源的α-淀粉酶蛋白序列比对结果,找到两个的保守区序列设计合成了简并引物amy-f和amy-r(表1):
以上述的嗜盐嗜碱菌sl3基因组总dna为模板进行pcr扩增。采用降落pcr方法进行基因片段的扩增。反应参数为:94℃预变性4min;94℃变性30sec,60-54℃退火30sec,72℃延伸30sec,12个循环(每个循环降落0.5℃)。然后94℃变性30sec,54℃退火30sec,72℃延伸30sec,30个循环,72℃保温5min。得到一约500bp左右的片段,将该片段回收后与pmd19-t载体相连送到英俊公司测序。
测序结果表明保守区片段序列与alkalibacteriumpelagiumdsm19183(nz_fnzu01000004)来源的α-淀粉酶的序列一致性达到了94%。由于相似性非常高,因此本研究采用同源克隆的方法获得amysl3基因的全长。根据alkalibacteriumpelagiumdsm19183(nz_fnzu01000004)的α-淀粉酶基因序列设计了amysl3-f和amysl3-r扩增基因的全长(表1)。
表1α-淀粉酶amysl3保守区扩增、全长以及表达所需的引物
arestrictionsitesarebold.
将扩增得到的序列送去测序,结果表明该基因全序列共长1455bp,具有一个完整的开放阅读框(orf)。α-淀粉酶基因amysl3由1455个碱基组成,编码484个氨基酸和一个终止密码子。在genbank中的比对结果表明它与来源于alkalibacteriumpelagium(wp_091479515.1)的预测的α-淀粉酶最高一致性为98%。但是数据库中与它相似性大于50%以上的α-淀粉酶基因均未做过性质研究,表明amysl3是一个新的α-淀粉酶。amysl3编码的蛋白amysl3预计分子量为56.6kda,等电点为4.56。经预测,amysl3无信号肽序列,包含一个第13家族的淀粉酶催化结构域。核苷酸序列如下所示:
atgaatggaacgatgatgcagtactttgaatgggacttgccaaatgatggcaagcactggaaacgactgaaagaggatgctgaacacctgaacgagatcggtgtcacagcagtatggattcctccgtgctttaaatcagtcggtcaggatgatgtagggtatggcatctatgatttatatgacttaggagaatttgatcagaaaggaacagtccgtaccaagtacgggaccaaggacgaactgcttgaagcgatcgaggcactgcacgaacaggggattcatgtctatgccgatgtcgtccttaaccataaggcaggggctgacggcactgaacggttcgaagctacacctgtcgatccggaaaatcgtcacgaggccataggcgatacacgcgaaatcgagtcctggacgtttttcaactttcctggcagggaaggcaagcattctgactttgaatggcactggtaccatttttcaggcgtatcagaagacaccatttcagaagaacagggcatttaccggatcgaaggagaagacaagggatgggcaccggatgacaatgtctctactgagttcggtaattttgattacctgatgtttgcagatatcgactacagtcaccctgaagtcgttgaagaaactaaaaaatggatccactggttcatcgaagaaacaaatatcgatggcatcagactggatgcggtgaaacatatagacagccagttcatgagagaactgatcgaagatgtcagagaggtacatggcgaggagttcttcttcgtagcggaatactggcatcagcgctataaatacctggaagagtatctggaagaacatgactattccatctccatgatggatgtacggttccactatgcgcttcatgaagcatccaagcagcacaatgagttcgacttgagacgtcttctggatggtacgctttacaagacgaatgctgaacaggcggtcacttttgtggagaatcacgattctcagccgggacagtctctggaatcgtatgtcgagccgtggttcaaaccgctggcttacggcttcattctattaagctactacggttacccctgtgtattctatagtgattattatggatacaagggagacgtcgattacgacggatgtcgcagagaaatcgagatgcttctgaaagcgagaaaagactatgcgtacggcgaacagtacaattacttggatcatggcaactgtatcggctttacccgaacaggaaacgacgagcatcctgaagggtgtgcggtcatcatgtccaatggagatgaagggttcaaggaaatgtctgttggcgaactacatgcaaatgaggtctatgtcgacttgatgaacaacagagatgaagaaatagaaatcgacggtgaagggaaagccactttccctgtcaatgcagaatcgatttccgtatgggtcagaaaaacagaataa。
其氨基酸序列如下:
mngtmmqyfewdlpndgkhwkrlkedaehlneigvtavwippcfksvgqddvgygiydlydlgefdqkgtvrtkygtkdelleaiealheqgihvyadvvlnhkagadgterfeatpvdpenrheaigdtreieswtffnfpgregkhsdfewhwyhfsgvsedtiseeqgiyriegedkgwapddnvstefgnfdylmfadidyshpevveetkkwihwfieetnidgirldavkhidsqfmreliedvrevhgeefffvaeywhqrykyleeyleehdysismmdvrfhyalheaskqhnefdlrrlldgtlyktnaeqavtfvenhdsqpgqslesyvepwfkplaygfillsyygypcvfysdyygykgdvdydgcrreiemllkarkdyaygeqynyldhgncigftrtgndehpegcavimsngdegfkemsvgelhanevyvdlmnnrdeeieidgegkatfpvnaesisvwvrkte。
实施例2重组α-淀粉酶的制备。
以在基因5’和3’端分别引入了saci和xhoi酶切位点amysl3-m-f和amysl3-m-r为引物对(见表1),嗜盐嗜碱菌基因组dna为模板,进行pcr扩增。pcr反应参数为:94℃预变性5min;94℃变性30sec,50℃退火30sec,72℃延伸1.5min,30个循环,72℃保温5min。将表达载体pet28a(+)进行双酶切(saci+xhoi),同时将编码α-淀粉酶的基因amysl3双酶切(saci+xhoi),切好的编码α-淀粉酶的基因片段与表达载体pet28a(+)连接,获得含有α-淀粉酶基因amysl3的重组质粒pet28a-amysl3并转化大肠杆菌bl21(de3),获得重组大肠杆菌菌株bl21/amysl3。
取含有重组质粒pet28a-amysl3的bl21菌株,接种于5mllb(含100µg/ml的氨苄青霉素)培养液中,37℃培养过夜。将培养好的菌液按1%v/v接种于200mllb(加有100µg/ml的氨苄青霉素),37℃振荡培养约2~3h(od600达到0.5)后加入终浓度1mmol/l的诱导剂iptg,30℃180rpm震荡培养12h。12000rpm离心5min,收集菌体并超声波破碎。然后再12000rpm离心5min,收集上清。采用dns法测定α-淀粉酶的活力。sds-page结果(图1)表明,重组α-淀粉酶在大肠杆菌中得到了表达。所表达的α-淀粉酶经过纯化之后,其蛋白质的含量达到总蛋白的95%以上。
实施例3重组α-淀粉酶amysl3的性质测定
1、重组淀粉酶的活性分析
重组α-淀粉酶的活性测定采取3,5-二硝基水杨酸(dns)法:具体方法如下:在ph7.5,45℃条件下,1ml的反应体系包括100μl适当的稀释酶液,900μl底物(1wt%可溶性淀粉),4m的nacl,反应10min,加入1.5mldns终止反应,沸水煮5min。冷却后540nm测定od值。1个酶活单位(u)定义为在给定的条件下每分钟释放出1μmol还原糖的所需的酶量。
2、重组α-淀粉酶amysl3的最适ph和ph稳定性的测定
最适ph测定:将纯化好的重组α-淀粉酶amysl3在37℃下和0.1mph4.0–9.0的缓冲液中进行酶促反应。酶的ph稳定性测定:将酶液置于0.1mph6.0–10.0的缓冲液中,在37℃下处理1h,然后在ph7.5及45℃下进行酶促反应,以未处理的酶液作为对照。缓冲液为:0.1mmcilvainebuffer(ph4.0–8.0),0.1mtris-hclbuffer(ph8.0–9.0)和0.1mglycine-naoh(ph9.0–10.0)。以1wt%可溶性淀粉为底物,反应10min,测定amysl3的活力。结果表明:amysl3的最适ph为7.5,在ph6.5到8.0剩余50%以上的酶活(图2);此α-淀粉酶在ph7.0-9.0之间均很稳定,在此ph范围内处理60min后剩余酶活性在85%以上,这说明此酶具有较好的ph稳定性(图3)。
3、重组α-淀粉酶amysl3的最适温度及热稳定性测定
酶的最适温度的测定:在ph7.5的缓冲液中,于10–70℃下进行酶促反应。酶的热稳定性测定:将同样酶量的酶液置于35℃,40℃,45℃和50℃中,处理0–60min后,在ph7.5及45℃下进行酶促反应,以未处理的酶液作为对照。以1wt%可溶性淀粉为底物,反应10min。此外,为研究该酶在盐存在时的热稳定性,在45和50℃处理酶液的同时加入4m的nacl,其余条件不变。酶反应最适温度测定结果(图4)表明,其最适温度为45℃。酶的热稳定性性试验表明(图5),重组酶在40℃时稳定性较好。50℃下保温20min,酶活性完全丧失。然而,在4m的nacl存在的情况下,该酶的热稳定性得到极大的提高。50℃处理60min仍然剩余70%以上的酶活。
4、重组α-淀粉酶amysl3的vmax和km的测定
以不同浓度的可溶性淀粉(1,0.8,0.4,0.2,0.15和0.1wt%)为底物,在最适条件下测定酶活性,计算相应的反应速度,利用米氏方程双倒数法求得km值及vmax。结果表明:该酶的vmax为527.5±12.3μmolmin–1mg–1,km为3.6±0.2mgml–1。
5、不同浓度ca2+对重组α-淀粉酶amysl3的活性的影响
α-淀粉酶amysl3中含有ca2+结合位点,因此研究了不同浓度ca2+对该酶活性的影响:在酶促反应体系中加入不同浓度的ca2+,研究其对酶活性的影响。在45℃及ph7.5的条件下,以可溶性淀粉为底物测定酶活性。结果表明,低浓度的ca2+对该酶活性没有影响,其但是当浓度高于10mm的时候,该酶的活性受到明显的抑制(图6)。表明该酶是一个钙离子非依赖型的α-淀粉酶,使得该酶在应用中更加简便。
实施例4不同浓度nacl对重组α-淀粉酶amysl3的活性和稳定的影响
nacl对重组α-淀粉酶amysl3的活性影响:在酶促反应体系中加入不同浓度的nacl,研究其对酶活性的影响。在45℃及ph7.5的条件下,以可溶性淀粉为底物测定酶活性。nacl对重组α-淀粉酶amysl3的稳定性的影响:将酶液分别置于含有4m和5m的ph7.5的缓冲液中,在37℃下处理1h,然后在ph7.5及45℃下进行酶促反应,以未处理的酶液作为对照。结果表明:该酶是一个极端嗜盐α-淀粉酶,当nacl浓度为0的时候,该酶基本没有活性。随着nacl浓度的提高,该酶的活性也随着提高,当浓度为5m(接近饱和)的时候,酶活性达到最高(图7)。在4m和5mnacl的浓度下处理60min,剩余95%以上的酶活(图8)。
实施例5不同表面活性剂和有机溶剂对重组α-淀粉酶amysl3活性的影响
在酶促反应体系中分别加入2种不同的浓度(终体积浓度为5%和10%)的吐温20、吐温80、tritonx-100,以及0.1%和1%(v/v)的sds,以研究其对酶活性的影响。在最适ph(7.5)和最适温度(45℃)的条件下测定酶活性,以同样条件下未加任何试剂的酶促反应为对照组。在酶促反应体系中分别加入9种不同的两个浓度(终体积浓度为20%和50%)的有机溶剂,包括:甲醇、乙醇、丁醇、异丁醇、异戊醇、丙酮、正己烷、甘油、氯仿。以研究其对酶活性的影响。最适ph(7.5)和最适温度(45℃)的条件下测定酶活性,以同样条件下未加有机溶剂的酶促反应为对照组。
结果表明(表2),吐温20和吐温80对amysl3有促进作用,其中10%v/v的吐温20和吐温80促进作用最为明显,可达115%左右;而低浓度的tritonx-100对amysl3有促进作用,但是高浓度下有部分抑制作用。0.1%v/v的sds对该酶有较强的抑制作用;而高浓度下对该酶有强烈的抑制作用。
甲醇、乙醇和丙酮不论在低浓度还是高浓度的条件下对amysl3都具有强烈的抑制作用。低浓度的丁醇、异丁醇和异戊醇对该酶的活性影响不大,但是高浓度的条件下有强烈的抑制作用。甘油对该酶的活性影响不大。但是该酶对于水不溶性的正己烷和氯仿不论在低浓度还是高浓度的情况下都具有很好的耐性,剩余活性达到80%以上。表明该酶具有很好的有机溶剂的耐性,在药物合成中具有很大的应用潜力。
表2不同表面活性剂和有机溶剂对重组α-淀粉酶amysl3活性的影响
实施例6重组α-淀粉酶amysl3的用于不同来源的淀粉的水解及其产物分析
使用过量纯酶液分别与含有4mnacl的ph7.5buffer配置的1wt%的土豆淀粉、玉米淀粉、木薯淀粉、直链淀粉和支链淀粉混匀,放置在重组酶最稳定的温度中水浴反应8h后取样,沸水浴5min灭活酶液,冷却至室温后13000r/min离心5min,取相同体积的样品点样在硅胶板上。薄层层析实验表明,该酶对土豆淀粉、玉米淀粉、木薯淀粉的水解产物为麦芽糖、麦芽三糖和麦芽四糖,而对支链淀粉和直链淀粉的水解产物除以上三种之外还具有少量的葡萄糖(图9)。
本发明提供了一种性质优良的、适合于在食品、洗涤和制药工业中应用的新α-淀粉酶amysl3。本发明所提供的α-淀粉酶amysl3最适反应温度为45℃,该酶的最适ph为7.5,在20℃的时候剩余35%的酶活。该α-淀粉酶还具有很好的ph耐受性,在ph7.0~9.0非常稳定。该酶的活性对钙离子不具有依赖性,可以简化该酶的应用。该酶在5mnacl的浓度下具有最高的活性和非常好的稳定性。因此可在腌制食品、酱和海产品的加工处理。该酶对常见的表面活性剂具有非常好的耐受性,因此可用于洗涤剂酶的添加。最后,该酶对疏水有机溶剂也具有非常好的耐受性,因此可以用于制药工业中一些药物中间体的合成。总而言之,本发明的α-淀粉酶amysl3具有极端嗜盐耐盐、耐表面活性剂和非钙离子依赖的特点,在食品、洗涤剂和制药等工业中具有重要的应用。
应当理解的是,对本领域普通技术人员来说,可以根据上述说明加以改进或变换,而所有这些改进和变换都应属于本发明所附权利要求的保护范围。
sequencelisting
<110>福州大学
<120>一种极端嗜盐、耐表面活性剂的非钙离子依赖型α-淀粉酶及其基因和应用
<130>8
<160>8
<170>patentinversion3.3
<210>1
<211>484
<212>prt
<213>人工序列
<400>1
metasnglythrmetmetglntyrpheglutrpaspleuproasnasp
151015
glylyshistrplysargleulysgluaspalagluhisleuasnglu
202530
ileglyvalthralavaltrpileproprocysphelysservalgly
354045
glnaspaspvalglytyrglyiletyraspleutyraspleuglyglu
505560
pheaspglnlysglythrvalargthrlystyrglythrlysaspglu
65707580
leuleuglualaileglualaleuhisgluglnglyilehisvaltyr
859095
alaaspvalvalleuasnhislysalaglyalaaspglythrgluarg
100105110
pheglualathrprovalaspprogluasnarghisglualailegly
115120125
aspthrarggluileglusertrpthrphepheasnpheproglyarg
130135140
gluglylyshisserasppheglutrphistrptyrhisphesergly
145150155160
valsergluaspthrileserglugluglnglyiletyrargileglu
165170175
glygluasplysglytrpalaproaspaspasnvalserthrgluphe
180185190
glyasnpheasptyrleumetphealaaspileasptyrserhispro
195200205
gluvalvalglugluthrlyslystrpilehistrppheilegluglu
210215220
thrasnileaspglyileargleuaspalavallyshisileaspser
225230235240
glnphemetarggluleuilegluaspvalarggluvalhisglyglu
245250255
gluphephephevalalaglutyrtrphisglnargtyrlystyrleu
260265270
gluglutyrleuglugluhisasptyrserilesermetmetaspval
275280285
argphehistyralaleuhisglualaserlysglnhisasngluphe
290295300
aspleuargargleuleuaspglythrleutyrlysthrasnalaglu
305310315320
glnalavalthrphevalgluasnhisaspserglnproglyglnser
325330335
leuglusertyrvalgluprotrpphelysproleualatyrglyphe
340345350
ileleuleusertyrtyrglytyrprocysvalphetyrserasptyr
355360365
tyrglytyrlysglyaspvalasptyraspglycysargarggluile
370375380
glumetleuleulysalaarglysasptyralatyrglygluglntyr
385390395400
asntyrleuasphisglyasncysileglyphethrargthrglyasn
405410415
aspgluhisprogluglycysalavalilemetserasnglyaspglu
420425430
glyphelysglumetservalglygluleuhisalaasngluvaltyr
435440445
valaspleumetasnasnargaspglugluilegluileaspglyglu
450455460
glylysalathrpheprovalasnalagluserileservaltrpval
465470475480
arglysthrglu
<210>2
<211>1455
<212>dna
<213>人工序列
<400>2
atgaatggaacgatgatgcagtactttgaatgggacttgccaaatgatggcaagcactgg60
aaacgactgaaagaggatgctgaacacctgaacgagatcggtgtcacagcagtatggatt120
cctccgtgctttaaatcagtcggtcaggatgatgtagggtatggcatctatgatttatat180
gacttaggagaatttgatcagaaaggaacagtccgtaccaagtacgggaccaaggacgaa240
ctgcttgaagcgatcgaggcactgcacgaacaggggattcatgtctatgccgatgtcgtc300
cttaaccataaggcaggggctgacggcactgaacggttcgaagctacacctgtcgatccg360
gaaaatcgtcacgaggccataggcgatacacgcgaaatcgagtcctggacgtttttcaac420
tttcctggcagggaaggcaagcattctgactttgaatggcactggtaccatttttcaggc480
gtatcagaagacaccatttcagaagaacagggcatttaccggatcgaaggagaagacaag540
ggatgggcaccggatgacaatgtctctactgagttcggtaattttgattacctgatgttt600
gcagatatcgactacagtcaccctgaagtcgttgaagaaactaaaaaatggatccactgg660
ttcatcgaagaaacaaatatcgatggcatcagactggatgcggtgaaacatatagacagc720
cagttcatgagagaactgatcgaagatgtcagagaggtacatggcgaggagttcttcttc780
gtagcggaatactggcatcagcgctataaatacctggaagagtatctggaagaacatgac840
tattccatctccatgatggatgtacggttccactatgcgcttcatgaagcatccaagcag900
cacaatgagttcgacttgagacgtcttctggatggtacgctttacaagacgaatgctgaa960
caggcggtcacttttgtggagaatcacgattctcagccgggacagtctctggaatcgtat1020
gtcgagccgtggttcaaaccgctggcttacggcttcattctattaagctactacggttac1080
ccctgtgtattctatagtgattattatggatacaagggagacgtcgattacgacggatgt1140
cgcagagaaatcgagatgcttctgaaagcgagaaaagactatgcgtacggcgaacagtac1200
aattacttggatcatggcaactgtatcggctttacccgaacaggaaacgacgagcatcct1260
gaagggtgtgcggtcatcatgtccaatggagatgaagggttcaaggaaatgtctgttggc1320
gaactacatgcaaatgaggtctatgtcgacttgatgaacaacagagatgaagaaatagaa1380
atcgacggtgaagggaaagccactttccctgtcaatgcagaatcgatttccgtatgggtc1440
agaaaaacagaataa1455
<210>3
<211>27
<212>dna
<213>人工序列
<400>3
gaggagacgaagaartggathcaytgg27
<210>4
<211>27
<212>dna
<213>人工序列
<400>4
ctctacgaaagtnacngcytgytcngc27
<210>5
<211>28
<212>dna
<213>人工序列
<400>5
atgaatggaacaatgatgcagtactttg28
<210>6
<211>26
<212>dna
<213>人工序列
<400>6
ttattctgtttttctgacccatacgg26
<210>7
<211>33
<212>dna
<213>人工序列
<400>7
ttcgagctcatgaatggaacaatgatgcagtac33
<210>8
<211>35
<212>dna
<213>人工序列
<400>8
gtgctcgagtttattctgtttttctgacccatacg35
- 还没有人留言评论。精彩留言会获得点赞!