一种用于检测水貂阿留申病毒(AMDV)的荧光定量PCR试剂盒及其用途的制作方法
本发明涉及一种病毒检测试剂盒及其用途,特别涉及一种用于检测水貂阿留申病毒(amdv)的荧光定量pcr试剂盒及其用途。本发明属于生物
技术领域:
。
背景技术:
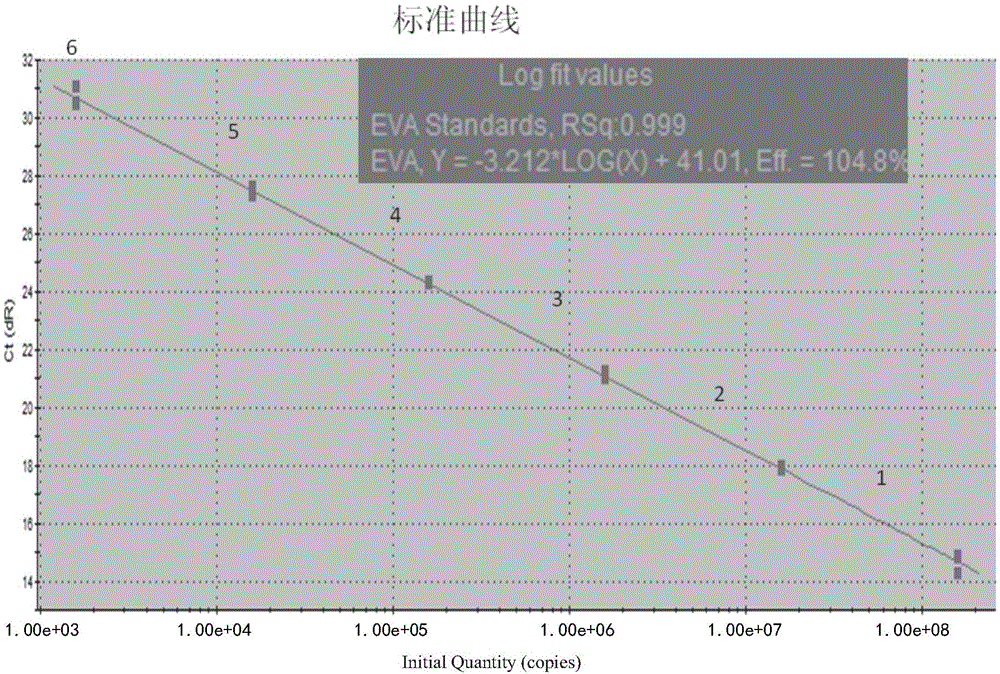
:水貂阿留申病(aleutiandiseaseofmink,amd)又称浆细胞增多症(plasmacytosis),是农业部动物疫病病种名录中三类动物疫病、中国-丹麦进境水貂议定书中的必检疫病项目,该病由水貂阿留申病毒(aleutianminkdiseasevirus,amdv)引起的,它可以感染任何年龄段的水貂,并且病症呈现出多样的表现形式。对患急性肺炎的新生仔貂而言,阿留申病毒几乎可以导致其100%的死亡率;而对成年水貂,该病通常引起水貂的持续感染,并表现为终生病毒血症、高蛋白血症、动脉血管炎和由病毒-抗体复合体诱导的肾小球肾炎和肝炎等。阿留申病毒为单股线状dna,在分类上属于细小病毒科(parvoviridae),细小病毒亚科(parvovirinae),阿留申病毒属(amdovirus)中排名第一的成员,即水貂阿留申病毒(carnivoreamdoparvovirus1)。水貂阿留申病毒的整个基因组全长约为4.8kb,由两个开放阅读框(orf)组成。左侧的l-orf编码非结构蛋白(ns),并参与核酸复制和对结构蛋白合成的调节;右侧的r-orf编码结构蛋白(vp),即衣壳蛋白,它同病毒的致病性和对宿主选择有关。流行病学研究表明,不同的amdv株在ns和vp基因中均呈现出较高水平的可变性。由于amd没有治疗的方法,也没有疫苗可以进行预防。对该病的控制主要采取“确诊-剔除”的方法。目前国内的水貂养殖企业基本采用“中丹协议”中提到的血清学检测方法——对流免疫电泳(ciep)对阿留申病进行检测,然而该方法仅能够对产生抗体的感染动物进行检测,却无法及时发现早期感染未产生足够抗体水平或携带病毒不发病的水貂。尽管这样的水貂在血清学检测上是阴性的,但仍可向外排毒并传染其他易感水貂,无法从根本上切断阿留申病毒病传播。而在这种情况下,如果运用病原体检测方法,amdv将更容易被鉴别出来。目前世界范围内应用的主要分子学检测方法为常规pcr。1996年,oie等人在研究amdv通过浣熊传播给水貂的过程中,根据vp2基因设计了一对引物。自此以后,在国内外很多amdv的检测研究中均使用了这对引物。jensen等人针对amdvns1基因上的一段374bp片段建立了pcr方法,并在2008~2010年间,同ciep方法对水貂组织样品进行了检测结果的差异性比较,结果证实了ciep方法存在“假阴性”的可能。国内学者许秋等人针对amdv-ns1基因建立的pcr方法最低能够检测到2.53ng/μl的病毒核酸含量。邵西群利用ciep和pcr方法对自然感染2年的貂场的amd的流行情况进行检测对比,发现在水貂感染早期及不产生抗体的amdv携带者中,ciep容易使结果产生假阴性,进而解释了利用ciep方法根除amdv计划失败的原因。此外,杨瑞梅等将胶体金颗粒加入到pcr体系中建立了amdv的纳米pcr检测方法,该方法可在含毒量低的粪尿样品中对amdv进行检测。然而目前为止,很少有研究关注amd的荧光定量pcr检测。截止目前,国外报道的关于用于检测的amdv荧光定量方法有两种。一种是2014年bowman等人在对安大略地区的水獭感染amdv的情况进行检测时,使用了基于sybrgreen染料的荧光定量pcr系统,但使用的引物是由oie在1996年设计一种基于sybrgreen染料的荧光定量pcr系统,且扩增的片段长度约为500bp。另一种是prieto等人在调查amdv在环境中的分布情况时,使用了基于ns基因的商业化taqman探针的荧光定量pcr,然而该荧光定量pcr扩增基因的引物和探针序列的信息没有给出。国内方面,我国学者张秀丽用sybrgreeni染料建立了染料法的荧光定量pcr方法;随后,贾赟根据用mgb探针,针对amd-vp2基因,建立了taqman荧光定量pcr。这两种荧光定量pcr方法的敏感性被检测均约为10拷贝/μl。荧光定量pcr和常规pcr相比具有很高的敏感性,并能够对pcr产物实时定量。evagreen染料(eg)除了价格相对经济,在敏感性和不受pcr抑制物影响方面远远优于sybrgreen,且同taqman探针荧光定量pcr相比,它可以减少样品dna序列在探针位置可能产生的错配,从而降低假阴性的产生。本发明是evagreen染料在amdv荧光定量pcr检测方法当中的首次应用。经证实本发明所建立的方法(egpcr)具有高度的敏感性和特异性,可作为快速检测水貂amdv和诊断水貂疾病的可靠方法。此外,目前国内外有关amdv荧光定量pcr的报道均用于当地amd流行情况的调查,并未提到因为不同地区amdv基因可能存在着差异,从而导致发生阳性水貂漏检的可能。而本发明通过对不同amdv毒株的实验数据对比,进一步证实了egpcr对amdv有着更广泛的适应性,不仅能够检测到美国株的amdv,对于我国大部分地区的amdv一样能够检测得到。因而egpcr更适用于世界范围内amdv的检测及防控。技术实现要素:本发明的目的是提供一种用于检测水貂阿留申病毒(aleutianminkdiseasevirus,amdv)的荧光定量pcr试剂盒及其用途。为了达到上述目的,本发明采用了以下技术手段:本发明为一种用于检测水貂阿留申病毒(aleutianminkdiseasevirus,amdv)的荧光定量pcr试剂盒,所述的试剂盒中含有荧光定量pcr反应试剂以及引物,其中,所述的荧光定量pcr反应试剂中含有evagreen染料,所述的引物由上游引物和下游引物组成,上游引物的核苷酸序列如seqidno.1所示,下游引物的核苷酸序列如seqidno.2所示。其中,优选的,所述的荧光定量pcr反应试剂为2×ssofasttmevagreensupermix。其中,优选的,荧光定量pcr的反应体系为20μl,其中包含dna模板1μl,2×ssofasttmevagreensupermix10μl,10μm上下游引物各0.5μl;反应程序为:95℃预变性3min;95℃变性25s,58℃退火30s,72℃延伸20s,40个循环;溶解曲线的分析为:95℃,15s;60℃,20s和95℃,15s。进一步的,本发明还提出了所述的荧光定量pcr试剂盒在制备检测水貂阿留申病毒中的用途。其中,优选的,所述的水貂阿留申病毒存在于血液及组织样品中。相较于现有技术,本发明的有益效果是:本发明建立了能够定量检测amdv的evagreen荧光定量pcr方法(egpcr)及其试剂盒。实验表明egpcr方法对amdv特异,有着良好的重复性,组内tm的cv值均为0%,组间tm的cv值均小于0.15%;dna检测限量为1拷贝或者3pg/μl。此外,无论是对中国毒株amdv-hlj以及美国株p-adv-g进行检测,均未发现egpcr存在有假阴性结果的产生。在用egpcr和现有的taqman试剂盒两种荧光定量pcr方法分别对中国毒株amdv-hlj以及美国株p-adv-g进行实验时发现,使用egpcr,其结果均获得了扩增产物;而使用现有的taqman试剂盒仅能检测出美国株的p-adv-g,而对amdv-hlj未能产生扩增结果。并且对于p-adv-g,egpcr的敏感性(检测限量=10拷贝/μl)要远远高于现有的taqman检测试剂盒的敏感性(检测限量=100拷贝/μl)。以上结论表明现有的taqmanpcr并不适用检测来自中国的病毒株,而相比之下,本发明建立的egpcr更适用于检测来自国内外的amdv。在应用taqmanpcr进行检测的结果中,除了阳性对照的ct值显示为26.56,其余检测样品结果均显示为阴性。为了获知这些taqmanpcr检测结果呈阴性而egpcr检测结果呈阳性的样品中是否存在amdv,一方面我们进行了egpcr扩增产物的测序;另一方面我们利用taqman试剂盒中的引物进行了一个新的evagreen染料法的荧光定量pcr试验,并命名为taqman/egpcr。egpcr阳性扩增产物测序结果经blast后证实确实是amdv;41个egpcr检测结果为阳性的样品经taqman/egpcr检测,结果显示,其中39个是阳性且均有特异性的熔解曲线产生,而另外两个样品的结果依然显示阴性。这表明此前的实验中,taqman试剂盒中的探针未能与这些中国病毒形成碱基配对,从而未能发生扩增反应。此外,通过对taqman/egpcr扩增产物序列比对发现,这些序列中存在着大量短间隔的碱基突变,这进一步证实了以上的推论。至于taqman/egpcr检测结果中两个样品为阴性的原因,很可能是由于taqmanpcr引物的扩增效率低导致的。相比之下,通过egpcr的阳性扩增产物序列同genbank中部分amdv参考序列的比对可以看出,其产物序列两端的引物部分仅存在着非常少的碱基突变,且在3’端关键位点的前三个碱基上没有突变发生,因而对amdv基因的扩增效率的影响较小。在临床样品检测过程中,我们发现45个样品的检测结果中,有41个样品为egpcr阳性;39个是常规pcr阳性。常规pcr的阳性结果少于egpcr阳性结果的原因,除了evagreen染料对pcr抑制物影响较小以外,还可能与pcr方法本身有着一定的局限性有关——当设计的引物和探针不具有普适性的,很有可能导致该方法的低敏感性和假阴性结果。本发明是evagreen染料在amdv荧光定量pcr检测方法当中的首次应用。egpcr经证实具有高度的敏感性和特异性,可作为快速检测水貂amdv和诊断水貂疾病的可靠方法。此外,当前国内外有关amdv荧光定量pcr的报道均用于当地amd流行情况的调查,并未提到因为不同地区amdv基因可能存在着差异,从而导致发生阳性水貂漏检的可能。而本发明通过对不同amdv毒株的实验数据对比,进一步证实了egpcr对amdv有着更广泛的适应性,不仅能够检测到美国株的amdv,对于我国大部分地区的amdv一样能够检测得到。因而egpcr更适用于世界范围内amd的检测及防控。附图说明图1a为使用egpcr扩增稀释10倍后的p-hjl-rt的标准曲线;其中:1:1×107拷贝/μl;2:1×106拷贝/μl;3:1×105拷贝/μl;4:1×104拷贝/μl;5:1×103拷贝/μl;6:1×102拷贝/μl;nc阴性对照;图1b为使用egpcr扩增稀释10倍后的p-hjl-rt的扩增曲线;其中:1:1×107拷贝/μl;2:1×106拷贝/μl;3:1×105拷贝/μl;4:1×104拷贝/μl;5:1×103拷贝/μl;6:1×102拷贝/μl;nc阴性对照;图1c为使用egpcr扩增稀释10倍后的p-hjl-rt的溶解曲线;其中:1:1×107拷贝/μl;2:1×106拷贝/μl;3:1×105拷贝/μl;4:1×104拷贝/μl;5:1×103拷贝/μl;6:1×102拷贝/μl;nc阴性对照;图2a为使用egpcr扩增稀释10倍后的p-adv-g的标准曲线;其中:1:1×107拷贝/μl;2:1×106拷贝/μl;3:1×105拷贝/μl;4:1×104拷贝/μl;5:1×103拷贝/μl;6:1×102拷贝/μl;nc阴性对照;图2b为使用egpcr扩增稀释10倍后的p-adv-g的扩增曲线;其中:1:1×107拷贝/μl;2:1×106拷贝/μl;3:1×105拷贝/μl;4:1×104拷贝/μl;5:1×103拷贝/μl;6:1×102拷贝/μl;nc阴性对照;图2c为使用egpcr扩增稀释10倍后的p-adv-g的溶解曲线;其中:1:1×107拷贝/μl;2:1×106拷贝/μl;3:1×105拷贝/μl;4:1×104拷贝/μl;5:1×103拷贝/μl;6:1×102拷贝/μl;nc阴性对照;图3a为使用taqmanpcr扩增稀释10倍后的p-adv-g的标准曲线;其中:1:1×107拷贝/μl;2:1×106拷贝/μl;3:1×105拷贝/μl;4:1×104拷贝/μl;5:1×103拷贝/μl;6:1×102拷贝/μl;nc阴性对照;图3b为使用taqmanpcr扩增稀释10倍后的p-adv-g的扩增曲线;其中:1:1×107拷贝/μl;2:1×106拷贝/μl;3:1×105拷贝/μl;4:1×104拷贝/μl;5:1×103拷贝/μl;6:1×102拷贝/μl;nc阴性对照;图4为egpcr方法的特异性;其中:a:扩增曲线;b:溶解曲线;其中,1:amdv;2:cdv;3:mev;4:阴性对照;图5为部分egpcr扩增产物的序列对比;其中:hlj-1~9:a水貂场的9个egpcr扩增产物序列;sd-1,sd-2:b水貂场的2个egpcr扩增产物序列;图6为部分taqman/egpcr扩增产物的序列比对。其中:hlj-1~9:a水貂场的9个egpcr扩增产物序列;sd-1,sd-2:b水貂场的2个egpcr扩增产物序列。具体实施方式下面结合具体实例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。实施例1检测水貂阿留申病毒(aleutianminkdiseasevirus,amdv)的荧光定量pcr方法的建立一、材料和方法1、病毒分离、质粒的获得、样品采集本发明人从黑龙江地区某水貂厂的一只死亡水貂中分离得到脾脏组织,该水貂在死前经ciep检测为血清学阳性水貂。提取脾脏dna,并通过常规pcr(jensenetal.,2011)进一步验证为amdv阳性。将该脾脏中提取的病毒dna命名为amdv-hlj,并将其作为用于建立evagreen荧光定量pcr的阳性对照。adv-g(genbankm20036)是美国分离株的原型毒株。p-adv-g为根据adv-g全基因序列合成的质粒。该质粒的浓度用nanodrop1000机器进行测定,并按照公式(whelanetal.2003)计算出相应的拷贝数临床血液样品的采集是通过“剪趾甲取血法”进行的,样品对象是来自中国黑龙江省(a场、b场)和山东省(c场)的45只水貂。其中,a场为无amd水貂场。这45只水貂的外观均没有amd临床症状。2、dna的提取水貂脾脏和血液样本的dna,均使用qiaampdnamini试剂盒(qiagen,hilden,germany)进行提取。脾的dna(amdv-hlj)样品浓度使用nanodrop1000机器进行测定(wilmington,de,usa),并采用分光光度法进行计算。3、引物设计通过对ncbi参考序列数据库中的amdv全基因核苷酸序列进行比对。我们在amdv-ns的保守区设计了三对引物。引物序列见表1。表1用于建立egpcr的三对引物a位置:引物位置代表了amdv内核苷酸的起始位置和结束位置(参照genebank中ku513987的序列位置)。4、evagreen荧光定量pcr(egpcr)荧光定量pcr的反应体系为20μl,其中包含dna模板1μl,2×ssofasttmevagreensupermix(bio-rad,hercules,ca,usa)10μl,上下游引物各0.5μl(10μm)。进行荧光定量pcr反应的仪器是strantagenemx3005p机器(fostercity,ca,usa)。反应程序为95℃预变性3min;95℃变性25s,58℃退火30s,72℃延伸20s,40个循环。溶解曲线的分析为:95℃,15s;60℃,20s和95℃,15s。amdv-hlj的egpcr产物经琼脂糖电泳分析后,选取目的片段(seqidno.7所示)进行切胶纯化。纯化后的产物克隆到pmd18-t载体中(takarabioinc.,dalian,china),将获得的重组质粒命名为p-hlj-rt。该质粒的浓度和拷贝数随即被计算出来。5、egpcr的特异性、敏感性和重复性选取水貂犬瘟热病毒(minkdistempervirus,mdv)和貂肠炎病毒(minkenteritisvirus,mev)进行特异性实验,病貂脾组织中提取的amdvdna(amdv-hlj)作为阳性对照。为进一步验证结果的正确性,我们对扩增产物进行琼脂糖凝胶电泳鉴定,目的片段送到生物公司进行测序,测序结果同ncbi上的amdv参考序列进行比对鉴定。分别将p-hlj-rt和p-adv-g连续10倍稀释(1:104-1:1011拷贝/μl),以及amdv-hlj连续5倍(1:1-1:56)稀释,进行egpcr的敏感性实验,同时建立标准曲线。分别将p-hlj-rt和p-adv-g稀释为1×109,1×106和1×104拷贝/μl的稀释度,每个稀释度一式三份,然后进行egpcr的组内和组间的重复性实验。然后将实验结果中tm值的变化系数记录下来以计算重复性。6、taqman荧光定量pcrtaqmanpcr的试剂盒(genesigadvancedreal-timepcrdetectionkit)购自于primerdesigntmltd.,southampton,uk.。该方法扩增的目的片段位于ns基因上。taqman荧光定量pcr(taqmanpcr)用于进行对egpcr的实验性能比较。用p-adv-g和/或amdv-hlj作为模版分别进行taqmanpcr的标准曲线的建立和敏感性实验的分析。操作过程参照试剂盒附带的说明书。7、常规pcr使用jensenetal.2011年发表文章中提到的引物:amdv-f-7-h-pn1(5′catattcactgttgcttaggtta3′)和amdv-r-7-hpn2(5′cgttctttgttagttaggttgtc3′)。反应程序为预变性94℃,5min;扩增反应为94℃,30s、55℃,30s、72℃,30s,共40个循环;72℃延伸7min。扩增产物在琼脂糖凝胶电泳上检测到有约为374bp大小的条带,可认定为阳性结果。8、临床样品的检测为了评估egpcr对amdv的检测性能,对45个临床样品同时使用egpcr,常规pcr和taqmanpcr进行检测。稀释后的p-hlj-rt作为egpcr的阳性对照,无菌depc水作为阴性对照。扩增产物经琼脂糖凝胶电泳、胶回纯化后,克隆到pmd18-t载体中进行测序,测序结果与genbank中的amdv参考序列进行比对分析,用以评价egpcr对不同地区amdv检测的通用性,参考病毒株见表2。表2本发明中用于对荧光定量pcr扩增产物序列分析的amdv参考病毒株病毒名时间国家及地区genbank登录号adv-g1970美国m20036adv-k1994丹麦x77084utah-i1994美国x77083m1952014加拿大kt878959adv-ln12009中国、大连gu108231adv-ln22009中国、大连gu108232adv-ln32009中国、大连gu269892beijing2015中国、北京kt329428hlj12013中国、黑龙江ku295517hlj-lm2014中国、黑龙江ky680280jilin2013中国、吉林ku295525hebei2013中国、河北ku295513二、结果1、最优引物的选择对设计的三对引物进行的egpcr测定结果分析,我们最终选择上游引物1(seqidno.1)和下游引物1(seqidno.2)这对引物作为最优引物。因为和其他两对引物相比,其同一反应结果产生的ct值最低,而且熔解曲线上没有非特异性峰产生。而其他两对引物,一个荧光信号弱;一个有非特异的熔融曲线峰产生。2、标准曲线的生成p-hlj-rt以及p-adv-g经10倍稀释(1×107至1×102拷贝/μl)进行egpcr敏感性实验的同时建立标准曲线,如图1a-c以及图2a-c所示。这两个质粒对应的egpcr的标准曲线的扩增效率分别为104.8%、94.4%,相关系数(rsq)分别为0.999和0.998。经稀释后的p-adv-g建立的taqmanpcr标准曲线,其扩增效率为85.3%,相关系数(rsq)为0.998,见图3a-b。3、egpcr的特异性通过对熔融曲线数据的分析可以鉴别egpcr对amdv的特异性。egpcr鉴别amdv的平均tm值为82.8℃。而在特异性实验中,我们没有发现犬瘟热病毒、水貂肠炎病毒及空白对照产生扩增曲线和tm值,如图4a-b所示。amdv的产物的测序结果经ncbi的blast分析,确认其是amdv的目的基因。4、两种荧光定量pcr的敏感性为了确定egpcr检测的敏感性,对p-hlj-rt进行10倍稀释,amdv-hlj进行5倍稀释,经结果分析,显示egpcr的最低检测限量为1拷贝,3pg/μl的dna浓度。对p-adv-g进行10倍稀释后检测,其最低检测限量为10拷贝,见表3。用10倍稀释后的p-adv-g对taqmanpcr进行检测分析,其结果显示该方法的最低限量为100拷贝,该结果与试剂盒说明书中的限值范围一致。而对于amdv-hlj,taqmanpcr并未产生扩增结果。表3不同dna模版的两种荧光定量pcr的敏感性模版evagreenpcrtaqmanpcrp-hlj-rt(质粒)1拷贝/μl未检测到amdv-hlj(病毒dna)3pg/μl未检测到p-adv-g(质粒)10拷贝/μl100拷贝/μl5、egpcr的重复性分别将稀释后的p-hlj-rt以及p-adv-g一式三份进行重复性实验,分析tm值并计算出其组内和组间变异系数(cv),如表4所示,amdv的组内变异系数为0%,组间的变异系数均小于0.15%。结果表明egpcr检测amdv的重复性好。表4不同dna模板的egpcr的重复性6、临床试验用egpcr、常规pcr和taqmanpcr方法对45个血液样本进行amdv的检测。其中egpcr方法检测结果中,41个样品为阳性;常规pcr方法检测结果中,39个样品检测为阳性。然而,使用taqmanpcr方法,没有样品被检测出是阳性。结果见表5。表5egpcr同其他检测方法的临床样品检测结果经对egpcr产物的测序对比,进一步验证了egpcr阳性扩增产物均为amdv。部分egpcr产物的测序结果与genbank中的参考序列的比对结果见图5。如图所示,引物部分的序列仅存在少量的碱基错配。为了验证taqmanpcr产生的结果可能是错误的,我们使用primerdesigntm试剂盒(taqmanpcr试剂盒)中的aldv-specificprimer/probemix和evagreenpcr中的2×ssofasttmevagreensupermix进行染料法的荧光定量pcr反应,该反应被命名为taqman/egpcr。反应程序和egpcr的反应程序相同。结果显示,41个egpcr结果为阳性的样品中,39个样品结果显示为阳性,2个结果显示为阴性。所有的阳性产物克隆到pmd18-t载体后,进行测序,最终获得了大小为140bp的一组序列,经blast分析,扩增序列确认为amdv。部分产物(与图5中用于序列比对的扩增产物来自相同的检测样品)的测序比对结果见图6,序列中存在着大量的突变点。实施例2用于检测水貂阿留申病毒(amd)的荧光定量pcr试剂盒的组装及使用方法1、试剂盒的组装所述的试剂盒含有以下成分:1)引物上游引物1:atggctcaggctcaaattgatga(seqidno.1)下游引物1:gtgttgctttggttggtttgttg(seqidno.2)2)2×ssofasttmevagreensupermix(bio-rad,hercules,ca,usa)。2、使用方法荧光定量pcr的反应体系为20μl,其中包含dna模板1μl,2×ssofasttmevagreensupermix(bio-rad,hercules,ca,usa)10μl,上下游引物各0.5μl(10μm)。反应程序为95℃预变性3min;95℃变性25s,58℃退火30s,72℃延伸20s,40个循环。溶解曲线的分析为:95℃,15s;60℃,20s和95℃,15s。序列表<110>中国农业科学院哈尔滨兽医研究所(中国动物卫生与流行病学中心哈尔滨分中心)哈尔滨维科生物技术有限公司中华人民共和国哈尔滨海关<120>一种用于检测水貂阿留申病毒(amdv)的荧光定量pcr试剂盒及其用途<130>klpi180981<160>7<170>patentinversion3.3<210>1<211>23<212>dna<213>artificialsequence<400>1atggctcaggctcaaattgatga23<210>2<211>23<212>dna<213>artificialsequence<400>2gtgttgctttggttggtttgttg23<210>3<211>23<212>dna<213>artificialsequence<400>3atggctcaggctcaaattgatga23<210>4<211>25<212>dna<213>artificialsequence<400>4gtttgttgtccttgtcggtgtaggt25<210>5<211>26<212>dna<213>artificialsequence<400>5actgactgtggcaatagaaacatcat26<210>6<211>27<212>dna<213>artificialsequence<400>6gcctttaatagattgaggttgcttgtt27<210>7<211>148<212>dna<213>amdv-hlj<400>7atggctcaggctcaacttgatgaacagaggagactgcaagacctgtataagcagttgaag60aaagacgttgctgaaggtgaaggacttgcttggctgttccaacaaaagacctacaccgac120aaggacaacaaaccaaccaaagcaacac148当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1