一种鲟源停乳链球菌及应用的制作方法
本发明属于兽医生物制品技术领域,具体地说,涉及一种鲟源停乳链球菌及应用。
背景技术:
中国鲟鱼养殖的主要种类有西伯利亚鲟(acipenserbaerii)、史氏鲟(acipenserschrencki)等。其中,西伯利亚鲟因易驯养、生长快、体形大、肉质好,成为目前国内鲟鱼养殖的主导品种。随着中国鲟鱼养殖的发展,传染性疾病日趋严重。已有较多关于嗜水气单胞菌(aeromonashydrophila)感染各种鲟鱼致病的报道,还有关于豚鼠气单胞菌(aeromonascarvia)和类志贺邻单胞菌(plesimonasshigelloides)感染鲟鱼致病的报道。以上报道的致病菌均为革兰氏阴性菌,只有roy和ruth等(roype,yanong,ruth.francis-floyd.streptococcalinfectionsoffish[j].circular,2006,57:1-6.)认为革兰氏阳性菌—链球菌(streptococcusspp.)亦可能是鲟鱼细菌性疾病的病原。
鱼类链球菌病是由链球菌属细菌感染引起的传染病,引起鱼类链球菌病的种类主要有海豚链球菌(s.iniae)主要感染虹鳟、罗非鱼、杂交鲈、鲆等鱼类,无乳链球菌(s.agalactiae)主要感染罗非鱼、海鲷等鱼类和停乳链球菌(s.dysgalactiae)等,其中停乳链球菌(s.dysgalactiae)引起的鱼类疾病最早见于nomoto等(nomotor,munasingheli,jindh,etal.lancefieldgroupcstreptococcusdysgalactiaeinfectionresponsibleforfishmortalitiesinjapan[j].jfishdis,2004,27(12):679-686.)日本的报道,停乳链球菌毒性较强,引起杜氏鰤(serioladumerili)和五条鰤(seriolaquinqueradiata)死亡。国内2009年从西伯利亚鲟中分离到致病性停乳链球菌(s.dysgalactiae),出现腹部出血、肌肉坏死等症状。申请者从鲟鱼上分离的停乳链球菌具强的致病性,引起鲟鱼“红嘴病”,该病的发病死亡率在30%,导致鲟鱼养殖者重大的经济损失。
由于临床中常大量不合理使用抗生素来控制细菌性疾病,致使养殖场的细菌在抗生素的压力下进化出耐药菌群。因此,用药物防控鲟链球菌的难度越来越大,而且随着人们对食品安全问题的重视,抗生素在水生动物疫病防控中的应用会越来越少,疫病的防控更多的会依赖疫苗,特别是鲟鱼主要生产鱼子酱,产品出口,更注重安全。海豚链球菌、无乳链球菌有2种血清型,且不同血清型之间的毒力和致病力差异较大,而停乳链球菌目前还没有发现有不同的血清型。且海豚链球菌、无乳链球菌疫苗研发相当成功,因此,很有必要研发鲟源链球菌疫苗,以预防鲟鱼细菌性疾病的发生。
技术实现要素:
有鉴于此,本发明提供了一种鲟源停乳链球菌及应用。
为了解决上述技术问题,本发明公开了一种鲟源停乳链球菌,于2018年11月29日保藏于武汉大学中国典型培养物保藏中心进行保藏(湖北省武汉市武昌区八一路299号武汉大学校内),保藏号为:cctccm2018843,菌株的分类命名为streptococcusdysgalactiaesds。
本发明还公开了一种上述的鲟源停乳链球菌在防控鲟链球菌病的药物中的应用。
可选地,所述的药物为疫苗。
本发明还公开了一种疫苗,是用上述的鲟源停乳链球菌作为抗原制备得到的。
可选地,所述的疫苗为灭活疫苗。
可选地,所述的疫苗为单价疫苗。
可选地,所述的鲟源停乳链球菌的含量为1×107~1×108cfu/ml。
与现有技术相比,本发明可以获得包括以下技术效果:
1)本发明筛选出一株鲟源停乳链球菌,记名为鲟源停乳链球菌sds株,其毒力较强,108cfu/ml即可引起全部试验鲟死亡;免疫原性强,疫苗抗原含量仅需2×108cfu/ml即可对试验鲟产生100%的免疫保护,目前市面上的无同类产品。
2)利用本发明筛选出的鲟源停乳链球菌sds制备鲟源停乳链球菌疫苗,工艺简单,仅需单独培养鲟源停乳链球菌sds,经常规处理即可制备得到鲟源停乳链球菌疫苗。本发明技术工艺简单,成本低廉,可以补充市场上鲟源停乳链球菌疫苗的缺乏。
3)本发明提供了预防鲟链球菌病的单价疫苗,可以弥补市场的空白。所述单价疫苗具有较好的免疫保护力,利用其对鲟进行免疫接种,可以抵御国内主要鲟鱼养殖品种的链球菌的侵害,市场前景广阔。
当然,实施本发明的任一产品并不一定需要同时达到以上所述的所有技术效果。
附图说明
此处所说明的附图用来提供对本发明的进一步理解,构成本发明的一部分,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
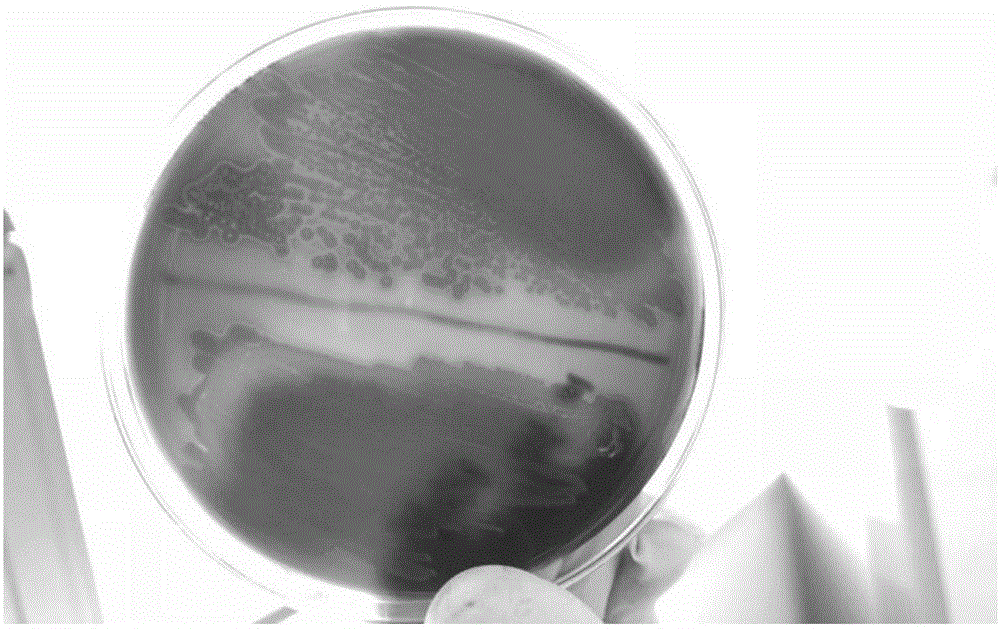
图1是本发明停乳链球菌溶血试验结果;
图2是本发明停乳链球菌革兰氏染色结果;
图3是本发明停乳链球菌sds16srrna基因扩增产物,其中,1代表marker,2代表停乳链球菌sds,3代表停乳链球菌sds。
具体实施方式
以下将配合实施例来详细说明本发明的实施方式,藉此对本发明如何应用技术手段来解决技术问题并达成技术功效的实现过程能充分理解并据以实施。
实施例1鲟源停乳链球菌sds株的分离、鉴定和毒力试验
1、鲟源停乳链球菌菌株的分离:
2017年于浙江衢州某鲟链球菌发病鱼场采集病料,无菌取发病鲟的肾、脑组织,接种到tha琼脂培养基上,置28-30℃培养24~36h后挑选典型的单个菌落进行纯化培养。挑选纯化好的单菌落接种于thb液体培养液中,30℃摇床(220r/min)培养过夜。纯培养物接种含绵羊血的琼脂平板,30℃培养24h后,可见形成直径1~2mm透明,圆润的菌落,在血平板中呈α溶血(图1)。挑取上述单菌落进行革兰氏染色,显微镜下观察,可见蓝紫色,卵圆形或圆形,成双或成链状的菌落分布于视野中(图2),初步判断为链球菌。
2、鲟源停乳链球菌菌株的筛选:
对初步证实是鲟源停乳链球菌菌株的多株菌株进行筛选。经毒力、生长特性等的比对验证,最终筛选出易于培养、毒力较强的鲟源停乳链球菌1株,进行如下研究。
二、鲟源停乳链球菌菌株的16srrna鉴定
对毒力最强的鲟源停乳链球菌菌株进行16srrnapcr鉴定,引物序列如下:
p1:5'-agagtttgatcctggctcag-3';
p2:5'-ggttaccttgttacgactt-3';
经pcr检测可疑菌落扩增出大小约为1492bp的条带(图3),pcr产物送上海生工生物公司进行序列测定,测序结果与ncbigenbank中已有序列比对,比对结果显示,分离到的菌株与停乳链球菌同源性最高,为100%。将菌株命名为sds株,于2018年11月29日保藏于武汉大学中国典型培养物保藏中心进行保藏(湖北省武汉市武昌区八一路299号武汉大学校内),保藏号为:cctccm2018843,菌株的分类命名为streptococcusdysgalactiaesds。保藏中心于2018年11月29日鉴定菌株是存活的。
三、鲟源停乳链球菌sds株的致病力研究
取20尾健康的试验鲟鱼,体重为5-8公斤(平均6.5公斤)的四年龄鲟随机分成5组,即对照组(注射生理盐水)和4个浓度梯度组(分别腹腔注射106/ml、107/ml、108/ml和109/ml)。每组5尾,每尾0.5ml,试验期间水温在25℃左右,并每日观察鱼类活动情况,并记录鱼体死亡情况。试验结果如表1。
表1鲟源停乳链球菌sds株攻毒结果
试验结果显示,108/ml和109/ml组试验鱼于攻毒后48h均开始表现出症状,106/ml和107/ml组的鱼于攻毒后4天出现上述症状,对照组鱼正常。试验证实,鲟源停乳链球菌sds株对鲟有较强的致病力。
实施例2鲟源停乳链球菌疫苗的制备以及免疫效力检测
一、鲟源停乳链球菌疫苗的制备
通过以下步骤制备疫苗:
1)一级种子液制备:取冻干保存的鲟源停乳链球菌sds株接种于tha固体平板,在温度为30℃的条件下培养18h;然后挑取单菌落于thb培养基(含5%新生牛血清)中,在温度为30℃的条件下,以转速120rpm振荡培养18h,进行纯粹检验合格后,作为一级种子液,置2~8℃保存备用,保存时间均不超过3天。
2)二级种子液制备:取步骤1)得到的一级种子液,按种子液与培养基的体积比1:20接种于thb培养基中,在温度为30℃的条件下,以转速120rpm振荡培养16h,进行纯粹检验合格后,作为二级种子液,置2~8℃保存备用,保存时间均不超过3天。
3)原菌液制备:取步骤2)得到的二级种子培养液,按种子液与培养基的体积比1:100接种于thb培养基中,在温度为30℃的条件下,以转速120rpm振荡培养24h后,得到原菌液。
4)活菌计数:将步骤3)中获得的菌液进行活菌计数,步骤如下:
取鲟源停乳链球菌sds株菌液1ml,用ph7.4pbs做10倍系列稀释,每个稀释度换1支吸管。具体方法是:准确吸取菌液100μl,放入盛有稀释液900μl的第一支1.5ml离心管中(不接触液面),另取1支1ml枪头将第一管液体混合均匀后,吸取100μl放入盛有稀释液900μl的第2支1.5ml离心管中,依次稀释至最后1管。根据对样品含菌数的估计,选择适宜稀释度,吸取最终稀释度的菌液接种适宜的培养基平板3个,每个滴100μl,使菌液散开,置30℃凉干后,翻转平板,培养48~72h,按照下列方法数出每个平皿中的菌落个数,计算每ml菌液中的活菌数(cfu/ml)。
5)灭活:在上述步骤3)制备的菌液中加入终浓度为0.2~0.4%的甲醛溶液,30℃振荡灭活24h。
6)配制:在步骤5)得到的灭活菌液中取样,按照《中华人民共和国兽药典》附录进行纯粹检验;将原菌液按一定比例用无菌生理盐水稀释成浓度为2×108cfu/ml的菌苗,得到预防鲟链球菌病的疫苗,2~8℃保存备用。
二、鲟源停乳链球菌疫苗的免疫效力检测
1.最小免疫效力试验
取600尾四年龄的鲟鱼,随机分成a、b、c共3组,每组200尾,其中a组胸鳍基部腹腔注射鲟源停乳链球菌灭活疫苗,0.5ml/尾;b组胸鳍基部腹腔注射用灭菌生理盐水稀释10倍的鲟源停乳链球菌灭活疫苗,0.5ml/尾;c组注射生理盐水,0.5ml/尾。所有组在3个月后分别取10尾用鲟源停乳链球菌sds株进行攻毒,7.2×107cfu/尾,连续观察10天,观察记录鲟的发病和死亡情况,按下面公式计算每组免疫保护率,如表2所示。
表2鲟链球菌sds株灭活疫苗对鲟的免疫保护结果
表2结果显示,鲟源停乳链球菌sds株灭活疫苗对四龄大小的鲟鱼能产生较好的免疫保护效力,免疫a组的保护率为100%,即疫苗的抗原含量为2×108cfu/ml可对鲟形成较好的免疫保护,b组疫苗的抗原含量2×107cfu/ml有40%鱼发病,攻毒对照组80%发病,免疫保护率为50%。
上述说明示出并描述了发明的若干优选实施例,但如前所述,应当理解发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述发明构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离发明的精神和范围,则都应在发明所附权利要求的保护范围内。
序列表
<110>浙江省淡水水产研究所
<120>一种鲟源停乳链球菌及应用
<130>2018
<160>2
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>1
agagtttgatcctggctcag20
<210>2
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>2
ggttaccttgttacgactt19
- 还没有人留言评论。精彩留言会获得点赞!