菌株及其应用,以及疫苗及其制备方法与流程
本发明涉及生物技术领域,特别涉及菌株及其应用,以及疫苗及其制备方法。
背景技术:
毛皮动物主要指产品为制裘原料的动物。随着经济的发展、人们生活水平的提高和需求的不断增长,中国毛皮业呈现出强劲的发展趋势。我国毛皮动物养殖业主要集中在山东、河北、辽宁和黑龙江等地,养殖的品种主要有水貂、貉、狐、獭兔,年产水貂皮600万张、狐狸皮200万张,其中狐狸皮占世界总产量的35%,水貂皮占世界总产量的12%。经过多年的发展和积累,毛皮动物养殖已成为一项优势产业,我国已成为世界上最大的毛皮产品生产国和出口国,它的发展不仅为国家赚取了大量外汇,还直接带动了农业结构的调整,促进了农民增收,局部地区甚至已成为区域经济的支柱性产业,对推动“三农”经济发展起到了重要的作用。
水貂出血性肺炎是由铜绿假单胞菌引起水貂的一种急性传染病,多发生于秋季温暖潮湿,以咳嗽、呼吸困难、吐血、鼻出血为临床特症、以肺大面积出血、肺肝样变、肺水肿为主要病变特征,发病率为20%-50%,死亡率为100%。病貂发病急,死亡快,常呈地方性暴发性流行。近年来由于水貂养殖规模和集约化程度明显提高,水貂出血性肺炎的发病率显著上升,该病危害程度逐年加深,已成为危害我国水貂养殖的主要传染病之一。
鉴于该病的发病特点及该菌易产生耐药性问题,用药物治疗该病往往很困难,灭活疫苗是预防该病的最有效方法,将水貂中流行的血清型的菌株灭活后制备成多价灭活疫苗,可有效预防同类血清型菌株引起的该病,“水貂铜绿假单胞菌分离株的生物学特性比较分析和血清型调查”(白雪,柴秀丽,闫喜军,高晗,张海玲,赵建军,张蕾,邵西群,罗国良,王长凤),“水貂出血性肺炎二价灭活疫苗及其制备方法”(专利号:zl201010203879.1,闫喜军、白雪、柴秀丽、罗国良、赵建军、张海玲、邵西群、张蕾、高晗,)公开了我国引起水貂出血性肺炎的铜绿假单胞菌的主要血清型为g型和b型,并利用这2种血清型菌株dl15(国家菌种保藏号cgmccno.3811)和jl08(国家菌种保藏号cgmccno.3812)研制出了可用于预防水貂出血性肺炎的二价灭活疫苗,2011年该产品获得了农业部的临床试验批件,并同时进行了临床推广应用。2016年获得了国家新兽药证书(三类)。
水貂病毒性肠炎是水貂肠炎细小病毒(minkenteritisparvovirus,mev)引起的以剧烈腹泻为主要临床特症的急性烈性、高度接触性传染病,其死亡率高达80%以上,该病在世界范围内广泛流行,在自然条件下,不同品种和不同年龄的貂均有感染性,但幼貂的感染性极强,随着特种养殖业的发展,病毒性肠炎已经成为危害水貂养殖的三大疫病之一,给养貂业带来巨大的经济损失,1947年由加拿大学者schofield最早发现并报道了mev引起的疾病。1981年姜廷秀等首先报道了我国发生水貂病毒性肠炎,此后该病逐渐蔓延全国,给养貂业带来巨大的经济损失。我单位吴威等用单克隆抗体对我国分离的水貂肠炎细小病毒进行系统分型,确定我国水貂肠炎细小病毒主要由b型细小病毒引起,在此基础上选育出毒力稳定、免疫原性良好的病毒株mevb株,并研制出水貂细小病毒灭活疫苗,2010年获得了国家新兽药证书(三类),并迅速在市场上应用。使该病得到较好的控制。
目前国内还未有水貂细小病毒性肠炎、水貂出血性肺炎的二联疫苗,市场上也无该种二联苗使用。而使用单苗需要对水貂进行多次免疫,免疫剂量大,免疫程序繁琐,增加了人力、物力和财力成本,同时还易引起水貂的应激反应。
本项目在研究成功水貂细小病毒性肠炎和水貂出血性肺炎的基础上开发“一针防两病”的水貂细小病毒性肠炎和出血性肺炎二联灭活疫苗,技术上攻克了联苗中的两种成分细小病毒和铜绿假单胞菌的抗原成分互相干扰、疫苗含量配比及生产工艺的问题。本研究在水貂出血性肺炎二价灭活疫苗研制的基础上,在疫苗株中新加入了近几年出现的流行株i型、c型和f型,制备为水貂出血性肺炎五价灭活疫苗(g型、b型、i型、c型和f型),能够对水貂出血性肺炎新的血清型菌株的流行起到很好的预防作用,可解决国内原有疫苗的对该病只能提供部分保护的问题,更为有效预防水貂出血性肺炎的发生。通过对二联疫苗的研制及关键技术创新,研制出一种高效、副作用小、市场推广可行的二联苗,解决了单苗免疫程序上的复杂问题,满足行业和养殖户的迫切需求,具有广阔的市场应用前景。
现有技术是用转瓶通气的培养技术将这两株铜绿假单胞菌用pyg培养基增菌培养,37℃180r/m摇床培养12h后收菌,用细菌平板计数法测定两株菌的菌量分别达到40×108cfu/ml,将g型菌株和b型菌株按2:1的比例混合;(1)用终浓度为0.15%的甲醛溶液对铜绿假单胞菌进行灭活,于37℃灭活24h,期间振摇2~3次;(2)将灭活后的菌液加20%比例的氢氧化铝胶,混匀后即可得到水貂铜绿假单胞菌多价灭活疫苗。原有的培养基:pyg培养基成份:蛋白胨2%,葡萄糖1%,氯化钠0.5%,酵母粉0.3%,用去离子水配制,配完调ph值7.2~7.4,116℃30min。但是使用转瓶通气培养菌体,接种比例为3%~4%,通气培养12~15h,由于疫苗的转瓶生产工艺落后,转瓶数目较多接菌时易于污染,培养时间长,生产菌数少,在20~40亿cfu/ml之间,只适用于疫苗研制前期的小批量生产。
选用铜绿假单胞菌的当前主要流行血清型g、b型和肺炎克雷伯菌k1型3种菌株制备成灭活疫苗。免疫了以10%灭活肺炎克雷伯菌为佐剂的疫苗,保护率为83%;免疫了以10%al(oh)3佐剂的疫苗,保护率为71%;而作为空白对照组,仅注射了生理盐水的第6组小鼠的存活率为33%。相对于传统的al(oh)3佐剂,肺炎克雷伯菌本身可以作为疫苗成分,保护机体免于该病原菌的感染,同时又兼有良好的免疫调节活性,加强了机体对铜绿假单胞菌的免疫应答,产生了更高的抗体水平和提供了更好的免疫保护,兽医临床具有一定的应用价值。
以上几种研制的水貂出血性肺炎中使用的疫苗株血清型主要包含2种或3种,即g型,b型,或g型、c型、i型,根据本单位进行的水貂出血性肺炎流行病学调查,2010年至2015年的流行血清型新出现了f型、i型和c型,而由于各种流行血清型之间的交叉保护率低,大约为20%-30%。所以有必要加入所有可能的流行血清型。
技术实现要素:
有鉴于此,本发明提供了菌株及其应用,以及疫苗及其制备方法。该疫苗免疫期为6个月,免疫保护率80%以上,可同时用于预防水貂细小病毒性肠炎和水貂出血性肺炎的,减少了养殖户的免疫工作量和水貂应激反应,市场应用前景较好。
为了实现上述发明目的,本发明提供以下技术方案:
本发明还提供了一种铜绿假单胞菌株,其保藏编号为cgmccno.11990。
本发明还提供了保藏编号为cgmccno.11988、cgmccno.11990和cgmccno.11989的铜绿假单胞菌株在制备水貂出血性肺炎疫苗中的应用。
本发明还提供了保藏编号为cgmccno.11988、cgmccno.11990和cgmccno.11989的铜绿假单胞菌株在制备水貂细小病毒性肠炎、出血性肺炎二联灭活疫苗中的应用。
本发明提供了一种水貂出血性肺炎疫苗,由本发明保藏编号为cgmccno.11988、cgmccno.11990和cgmccno.11989的铜绿假单胞菌株以及水貂铜绿假单胞菌g型dl15株、b型jl08株制得。
本发明还提供了一种水貂细小病毒性肠炎、出血性肺炎的二联灭活疫苗,由本发明保藏编号为cgmccno.11988、cgmccno.11990和cgmccno.11989的铜绿假单胞菌株以及水貂铜绿假单胞菌g型dl15株、b型jl08株和水貂细小病毒毒株mevb株制得。
在本发明的一些具体实施方案中,二联灭活疫苗的制备方法包括如下步骤:
步骤1:取本发明保藏编号为cgmccno.11988、cgmccno.11990和cgmccno.11989的铜绿假单胞菌株以及水貂铜绿假单胞菌g型dl15株、b型jl08株分别接种于培养基培养后混合、灭活后制得灭活后铜绿假单胞菌五价苗半成品菌液;
步骤2:取水貂细小病毒毒株mevb株接种细胞,收获、灭活制得细小病毒半成品;
步骤3:取步骤1制得的灭活后铜绿假单胞菌五价苗半成品菌液与步骤2制得的细小病毒半成品混合制得混合液;
步骤4:取步骤3制得的混合液与佐剂混合。
在本发明的一些具体实施方案中,二联灭活疫苗的制备方法步骤1中本发明保藏编号为cgmccno.11988、cgmccno.11990和cgmccno.11989的铜绿假单胞菌株以及水貂铜绿假单胞菌g型dl15株、b型jl08株分别经培养基培养后,所述混合的比例为1:1:1:1:1(v/v),混合后每株菌的菌数至少为40亿cfu/ml。
在本发明的一些具体实施方案中,二联灭活疫苗的制备方法步骤2细小病毒半成品中细小病毒的含量为106.00tcid50。
在本发明的一些具体实施方案中,二联灭活疫苗的制备方法步骤3所述步骤1制得的灭活后铜绿假单胞菌五价苗半成品菌液与步骤2制得的细小病毒半成品混合的比例为2:1。
在本发明的一些具体实施方案中,二联灭活疫苗的制备方法步骤1所述的培养基为pyg培养基,优选在pyg培养基中添加mgso4、尿素、枸橼酸钠、维生素、na2hpo4缓冲盐或kh2po4缓冲盐中的一种或多种;
作为优选,培养基配方:蛋白胨3%,葡萄糖2%,酵母粉0.3%,氯化钠0.5%,na2hpo42.5g/l,kh2po40.83g/l,mgso40.3g/l,枸橼酸钠0.3g/l,尿素2g/l,维生素液10ml/l;
步骤1中所述接种为按照pyg培养基体积的3%接种菌株;步骤2所述接种为按照crfk细胞悬液体积的2%接种病毒。
在本发明的一些具体实施方案中,二联灭活疫苗的制备方法步骤1或步骤2所述灭活采用甲醛灭活;所述甲醛的用量为菌液总量的0.2%。
作为优选,步骤1或步骤2所述灭活为按菌液总量的0.2%缓慢加入甲醛溶液,边加边搅拌,36~37℃搅拌灭活24小时。
在本发明的一些具体实施方案中,二联灭活疫苗的制备方法步骤4所述佐剂为40%(w/v,以g/ml计)氢氧化铝胶,步骤3制得的混合液与所述佐剂的混合比例为6:1。
在本发明的一些具体实施方案中,二联灭活疫苗的制备方法步骤1中培养具体包括如下步骤:
步骤1:一级种子繁殖:取dl15株、jl08株、wd01株、wf05株、dl03株菌株冻干菌种各1支启封,用灭菌生理盐水稀释,分别接种pyg琼脂培养基(所述的培养基配方:蛋白胨3%,葡萄糖2%,酵母粉0.3%,氯化钠0.5%,na2hpo42.5g/l,kh2po40.83g/l,mgso40.3g/l,枸橼酸钠0.3g/l,尿素2g/l,维生素液10ml/l,琼脂粉2g/l),36~37℃培养18~24小时,分别挑选5个以上典型菌落混合于少量pyg液体培养基中,再分别接种pyg琼脂斜面培养基(所述的培养基配方:蛋白胨3%,葡萄糖2%,酵母粉0.3%,氯化钠0.5%,na2hpo42.5g/l,kh2po40.83g/l,mgso40.3g/l,枸橼酸钠0.3g/l,尿素2g/l,维生素液10ml/l,琼脂粉2g/l)若干,36~37℃培养18~24小时,作为一级种子。2~8℃保存,使用期不超过15日,传代不超过5代;
步骤2:二级种子繁殖:取一级种子分别接种若干支5mlpyg液体培养基(所述的培养基配方:蛋白胨3%,葡萄糖2%,酵母粉0.3%,氯化钠0.5%,na2hpo42.5g/l,kh2po40.83g/l,mgso40.3g/l,枸橼酸钠0.3g/l,尿素2g/l,维生素液10ml/l)中,36~37℃振摇12小时,再按3%比例分别接种较大量的pyg液体培养基中,36~37℃振摇12小时,经纯粹检验合格后,作为二级种子,置2~8℃保存,应不超过4日;
步骤3:发酵种子液制备:将所述二级种子接种于发酵培养基,在温度37~37.5℃、搅拌速度100~120r/min、进气流量70~90l/min、压力30~70kpa条件下发酵培养7h,获得发酵种子液;
步骤4:一级发酵:将发酵种子液按3%比例接种于装有250~300lpyg培养基(所述的培养基配方:蛋白胨3%,葡萄糖2%,酵母粉0.3%,氯化钠0.5%,na2hpo42.5g/l,kh2po40.83g/l,mgso40.3g/l,枸橼酸钠0.3g/l,尿素2g/l,维生素液10ml/l)的500l发酵罐,加入消泡剂泡敌,培养6~7h后分别加入葡萄糖至终浓度为1%和尿素至终浓度2g/l作为补充碳源,发酵期间主要控制参数如下::罐温37~37.5℃,搅拌速度80~110r/min,进气流量80~120l/min,罐压30~70kpa,12h收获,经纯粹检验合格后,即为半成品菌液,菌数稳定在250亿cfu/ml;
步骤5:二级发酵:将发酵种子液按4%比例接种于装有500l~600lpyg培养基(所述的培养基配方:蛋白胨3%,葡萄糖2%,酵母粉0.3%,氯化钠0.5%,na2hpo42.5g/l,kh2po40.83g/l,mgso40.3g/l,枸橼酸钠0.3g/l,尿素2g/l,维生素液10ml/l)的1000l发酵罐,培养6~7h后分别加入葡萄糖至终浓度为1%和尿素至终浓度2g/l作为补充碳源,加入消泡剂泡敌,发酵期间主要控制参数如下::罐温37~37.5℃,搅拌速度80~100r/min,进气流量90~136l/min,罐压30~70kpa,12h收获,经纯粹检验合格后,即为半成品菌液,菌数可稳定在250亿cfu/ml。
在本发明的一些具体实施方案中,二联灭活疫苗的制备方法步骤2中培养具体为:将基础毒种用细胞维持液进行稀释,按2%的比例同步接种于crfk细胞悬液中,置37℃培养3~4日,80%以上细胞出现典型cpe时,即可收获,-20℃保存。
在本发明的一些具体实施方案中,本发明提供的铜绿假单胞菌的培养基及发酵罐培养工艺原有pyg培养基(葡萄糖-蛋白胨-酵母粉)的基础上对培养基进行改良,通过添加菌体代谢所需要的mgso4、枸橼酸钠、维生素液满足高速发酵的营养需求,并通过添加na2hpo4,kh2po4缓冲盐类维持ph值及菌体渗透压的稳定,另外,在发酵培养6~7h补充葡萄糖和尿素,通过100l、500l、1000l发酵罐逐级发酵方法的建立,确定了种子液的菌数、接种比例,种子液保存时间,传代次数,发酵收获时间,使菌数可稳定达到250亿cfu,比原有方法菌数提高了5~10倍。
本发明在水貂出血性肺炎二价灭活疫苗研制的基础上,在疫苗株中新加入了近几年出现的流行株i型、c型和f型,制备为水貂出血性肺炎五价灭活疫苗,能够对水貂出血性肺炎新的血清型菌株的流行起到很好的预防作用,可解决国内原有疫苗的对该病只能提供部分保护的问题,从而可有效预防水貂出血性肺炎的发生。该疫苗免疫期为6个月,免疫保护率80%以上,可同时用于预防水貂细小病毒性肠炎和水貂出血性肺炎的,减少了养殖户的免疫工作量和水貂应激反应,市场应用前景较好。
生物保藏说明
菌株wd01,分类命名:铜绿假单胞菌pseudomonasaeruginosa.于2016年01月11日保藏在中国微生物菌种保藏管理委员会普通微生物中心,地址为北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,保藏编号为cgmccno.11988;
菌株wf05,分类命名:铜绿假单胞菌pseudomonasaeruginosa.于2016年01月11日保藏在中国微生物菌种保藏管理委员会普通微生物中心,地址为北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,保藏编号为cgmccno.11990;
菌株dl03,分类命名:铜绿假单胞菌pseudomonasaeruginosa.于2016年01月11日保藏在中国微生物菌种保藏管理委员会普通微生物中心,地址为北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,保藏编号为cgmccno.11989。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
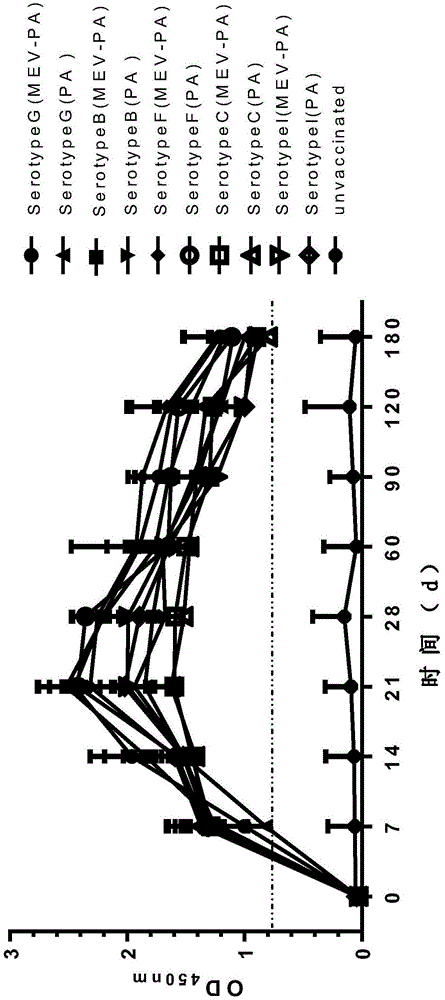
图1示水貂免疫二联苗后铜绿假单胞菌抗体酶联免疫吸附试验测定结果;
图2示水貂免疫二联苗后细小病毒血凝抑制抗体测定结果;
图3示水貂免疫二联苗后细小病毒中和抗体测定结果。
具体实施方式
本发明公开了菌株及其应用,以及疫苗及其制备方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本发明提供的菌株及其应用,以及疫苗及其制备方法中所用菌株、原料及试剂均可由市场购得。其中,菌株dl15的保藏编号为cgmccno.3811;菌株jl08的保藏编号为cgmccno.3812;病毒株mevb株筛选方法请见《我国水貂肠炎细小病毒主要流行型的研究》吴威;聂金珍;王克坚;程世鹏;中国兽医学报,1996年04期。
本发明具体实施方案中的培养基配方为:蛋白胨3%,葡萄糖2%,酵母粉0.3%,氯化钠0.5%,na2hpo42.5g/l,kh2po40.83g/l,mgso40.3g/l,枸橼酸钠0.3g/l,尿素2g/l,维生素液10ml/l。
下面结合实施例,进一步阐述本发明:
实施例1水貂细小病毒性肠炎、出血性肺炎二联灭活疫苗的制备
1.疫苗菌毒种标准:
1.1铜绿假单胞菌菌种标准
1.1.1形态和生化特性本菌为革兰氏阴性杆菌。生化特性应符合细菌分类学中本菌的特性。
1.1.2培养特性接种在pyg琼脂平板上,在36~37℃培养18~24小时,肉眼观察,菌落扁平湿润,边缘不整齐,产生弥漫于培养基中的绿色素或褐色色素;接种pyg液体培养基中,36~37℃培养18~24小时,液体均匀混浊,产生绿色或褐色色素。
1.1.3血清学特性用铜绿假单胞菌分型血清定型,dl15株应为g型,jl08株应为b型,wd01株应为c型、wf05株应为i型、dl03株应为f型。
1.1.4毒力菌种dl15株、jl08株、wd01株、wf05株、dl03株分别接种pyg液体培养基中37℃振荡培养12小时,菌液培养物毒力应符合以下要求。
1.1.4.1dl15株、wd01株和wf05株用16~18g小鼠10只,每只小鼠皮下接种活菌0.2ml(含活菌7000万cfu/0.2ml),48小时内小鼠应全部死亡;用2~10月龄健康易感水貂5只,每只气管内滴入活菌1ml(含活菌2亿cfu/ml)。72小时内水貂应全部死亡。
1.1.4.2jl08株和dl03株用16~18g小鼠10只,每只皮下接种活菌0.2ml(含活菌1.2亿cfu/0.2ml),48小时内小鼠应全部死亡;用2~10月龄健康易感水貂5只,每只气管内滴入活菌1ml(含活菌4亿cfu/ml)。72小时内水貂应全部死亡。
1.1.5免疫原性
1.1.5.1小鼠用体重16~18g小鼠50只,分为5组,每组10只,分别皮下注射单菌型疫苗0.2ml,21日后连同对照小鼠50只,分5组,每组10只,各皮下注射7000万cfu/0.2ml的dl15株、wd01株或wf05株的强毒液,或1.2亿cfu/0.2ml的jl08株或dl03株的强毒液,连续观察7日。对照小鼠应全部死亡,免疫小鼠应至少保护8只。
1.1.5.2水貂用2~10月龄健康易感水貂25只,分5组,每组5只,分别肌肉注射单菌型疫苗1ml,21日后连同对照水貂25只,分5组,每组5只,分别气管内滴入2亿cfu/ml的dl15株、wd01株或wf05株,或4亿cfu/ml的jl08株或dl03株强毒液,连续观察7日。对照水貂应全部死亡,免疫水貂应至少保护4只。
1.1.6纯粹用pyg培养基(附注2)检查,应纯粹。
1.1.7基础种子代数5~10代。
1.1.8强毒标准
1.1.8.1形态和生化特性、培养特性、血清学特性和毒力同1.1.1、1.1.2、1.1.3、1.1.4。
1.1.8.1纯粹用pyg培养基检查,应纯粹。
1.1.8.1种子代数5~10代。
1.1.9菌种保存-20℃冻干菌种,保存期暂定为36个月。
1.2水貂细小病毒mevb株应符合下列标准
1.2.1病毒含量将毒种用细胞维持液作10倍系列稀释,取10-4、10-5、10-6、10-7四个稀释度,每个稀释度接种4孔,每孔0.1ml,补充crfk细胞悬液0.9ml,置37℃培养并观察3~4日,计算tcid50,每ml病毒含量应≥106.50tcid50。。
1.2.2红细胞凝集价按照附注3.1进行,毒种对猪红细胞凝集价应≥1:64。
1.2.3毒力毒种口服2~10月龄健康水貂5只,每只15ml,观察10日,4只以上水貂出现典型症状(见附注1)。
1.2.4免疫原性按照本规程制成疫苗(灭活前病毒含量≥106.00tcid50)后,肌肉接种2~10月龄健康水貂5只,每只1ml,21日后连同条件相同的对照组水貂5只,口服攻毒水貂细小病毒smpv-11株(肠道毒)10ml(含100个id50),观察10日,免疫水貂应全部获得保护,对照水貂全部发病,出现典型症状。
1.2.5特异性1∶100稀释的毒种与1∶10倍稀释的水貂细小病毒特异性血清等量混合,37℃中和1小时后,接种crfk细胞4孔,同时设病毒对照组4孔,培养观察4日,试验组应不出现cpe,对照组应全部出现cpe。
1.2.6纯净按现行《中国兽药典》附录进行检验,毒种应无细菌、霉菌、支原体污染;毒种应无外源病毒污染。
1.2.7基础种子代数6~14代。
1.2.8基础毒种保存细胞培养湿毒种-70℃保存期为3年;真空冷冻干燥后置于-70℃中,保存期为5年。
1.2.9检验用强毒标准
1.2.9.1对水貂的半数感染量(id50)取水貂细小病毒smpv-11株脏器毒,用生理盐水制成10%的乳剂,反复冻融两次并过滤,滤液每毫升加入青霉素2000单位,硫酸链霉素2000μg,置于4℃作用过夜,作为检验用强毒原液;原液用生理盐水进行10倍系列稀释,取原液、10-1、10-2、10-3四个稀释度,每个稀释度灌服3~10月龄健康水貂4只,每只10ml,观察10日,计算id50,smpv-11株病毒对水貂半数感染量标准为每10ml原液应≥100个id50。
1.2.9.2检验用强毒毒力标准用100个id50水貂细小病毒smpv-11株脏器毒灌服3~10月龄健康水貂4只,攻毒后3~5d水貂全部发病,出现典型症状,水貂粪便中病毒对猪红血球ha效价应≥1∶256。
1.2.10外源病毒检验按附注2.2进行,毒种应无外源病毒污染。
1.2.11检验用强毒使用代次4~6代。
1.2.12检验用强毒毒种保存脏器毒种在-70℃保存期为4年。
2疫苗制备及半成品检验
2.1水貂出血性肺炎灭活疫苗
2.1.1生产用种子制备
2.1.1.1一级种子繁殖与鉴定取dl15株、jl08株、wd01株、wf05株、dl03株菌株冻干菌种各1支启封,用灭菌生理盐水稀释,分别接种pyg琼脂培养基,36~37℃培养18~24小时,分别挑选5个以上典型菌落混合于少量pyg液体培养基中,再分别接种pyg琼脂斜面培养基若干,36~37℃培养18~24小时,作为一级种子。2~8℃保存,使用期不超过15日,传代不超过5代。
2.1.1.2二级种子繁殖取一级种子分别接种若干支5mlpyg液体培养基中,36~37℃振摇12小时,再按3%比例分别接种较大量的pyg液体培养基中,36~37℃振摇12小时,经纯粹检验合格后,作为二级种子,置2~8℃保存,应不超过4日。
2.1.2制苗用培养基pyg改良培养基。
2.1.2.1制苗用菌液制备
发酵种子液制备:将所述2.1.1.2二级种子接种于发酵培养基,在温度37~37.5℃、搅拌速度100~120r/min、进气流量70~90l/min、压力30~70kpa条件下发酵培养7h,获得发酵种子液;
一级发酵:将发酵种子液按3%比例接种于装有250~300l培养基的500l发酵罐,加入消泡剂泡敌,培养6~7h后加入葡萄糖至终浓度为1%和尿素至终浓度为2g/l作为补充碳源,发酵期间主要控制参数如下::罐温37~37.5℃,搅拌速度80~110r/min,进气流量80~120l/min,罐压30~70kpa,12h收获,经纯粹检验合格后,即为半成品菌液,菌数稳定在250亿cfu/ml。
二级发酵:将发酵种子液按4%比例接种于装有500l~600l培养基的1000l发酵罐,培养6~7h加入葡萄糖至终浓度为1%和尿素至终浓度为2g/l作为补充碳源,加入消泡剂泡敌,发酵期间主要控制参数如下::罐温37~37.5℃,搅拌速度80~100r/min,进气流量90~136l/min,罐压30~70kpa,12h收获,经纯粹检验合格后,即为半成品菌液,菌数可稳定在250亿cfu/ml。
2.1.3纯粹检验按现行《中国兽药典》附录进行检验,应纯粹。
2.1.4活菌计数用pyg琼脂平板按现行《中国兽药典》附录进行活菌计数;每毫升菌数不低于2×1010cfu。
2.1.5灭活按菌液总量的0.2%缓慢加入甲醛溶液,边加边搅拌,36~37℃搅拌灭活24小时。
2.1.3半成品检验
2.1.3.1无菌检验按现行《中国兽药典》附录进行检验,应无菌生长。
2.1.3.2灭活检验按现行《中国兽药典》附录进行检验,应无菌生长。
2.1.4配苗将无菌检验和灭活检验合格后的g型、b型、c型、i型、f型菌液按照1:1:1:1:1(v/v)混合,充分混匀后即为水貂出血性肺炎疫苗五价苗半成品菌液,混合后每株菌的菌数至少为40亿cfu/ml。
水貂细小病毒性肠炎灭活疫苗:
2.2水貂细小病毒性肠炎灭活疫苗
2.2.1生产用毒种的制备
2.2.1.1毒种繁殖将基础毒种用细胞维持液进行适当稀释,按2%的比例同步接种于crfk细胞悬液中,置37℃培养3~4日,80%以上细胞出现典型cpe时,即可收获,-20℃保存,注明收获日期、毒种代数、装量等。
2.2.1.2毒种鉴定按1.2.1~1.2.6项进行,应符合规定。
2.2.1.3毒种保存-20℃不超过12个月。
2.2.1.4毒种继代不超过4代。
2.2.2制苗用病毒液的制备
2.2.2.1猫肾传代细胞(crfk株)的制备按常规方法制备crfk细胞。crfk细胞应符合以下标准:细胞应无细菌、霉菌及支原体污染;细胞在mem营养液中37℃条件下转动培养,36小时内应形成致密单层;细胞基础代数为43~48代,使用代次不超过10代。供疫苗生产用。
2.2.2.2接种将生产毒种按1~2%的比例接种于制备好的猫肾传代细胞悬液转瓶中。
2.2.2.3培养与观察将细胞悬液与毒种混合均匀后置37℃条件下旋转培养,连续观察4日,废弃污染或生长异常的细胞。
2.2.2.4收获当70%以上的细胞出现cpe时即可收获,置-20℃冻结,再融化后收获细胞培养物于灭菌容器内,若干瓶为1组,在-20℃以下冻存备用。
2.2.2.5制苗用病毒液的检验按1.2.1.1、1.2.1.6项方法进行病毒液病毒含量测定和无菌检验,每毫升病毒含量应≥106.00tcid50,病毒液应无细菌、霉菌污染;若病毒液病毒含量在105.50~106.00tcid50之间,通过超滤进行5倍浓缩,直至符合规定。
2.3灭活将检验合格的病毒液融化后,过滤后按病毒液总量的0.2%加入甲醛溶液,边加边搅拌,充分混匀,置37℃下灭活24小时,灭活期间应不断搅拌。
2.4半成品检验
2.4.1无菌检验将收获的病毒液以组为单位分别取样,按现行《中国兽药典》附录进行,应无细菌、霉菌生长。
2.4.2灭活检验取灭活液作1∶5稀释后分别接种5mlcrfk细胞悬液4瓶,每瓶0.4ml,置37℃下培养,24小时换液,继续培养3日后再传1代,细胞应不出现病变,收获培养液血凝试验呈现阴性,判定灭活合格。
3二联苗的配制与分装
将检验合格的灭活后铜绿假单胞菌五价苗半成品菌液与细小病毒半成品菌液按2:1(v/v)的比例混合,再将混合液与40%(w/v,以g/ml计)氢氧化铝胶按6:1比例均匀混合,充分混匀后,定量分装,密封瓶口。
表1二联苗配置组分比例摸索
选取pa疫苗g型进行疫苗配制比例摸索,根据疫苗生产含量标准,设定二联苗的含量:pag型为40亿cfu/ml,细小病毒的含量为106.00tcid50,在此浓度基础上对疫苗进行4组不同比例(v/v)的混合,之后肌肉注射免疫水貂,5只/组,测定不同组免疫水貂28日后的paelisa值和mevhi值,结果表明,c组pa:mev=2:1时抗体均相对较高,为最佳配比,因此确定二联苗的pa:mev配制比例为2:1。
4成品检验
4.1性状静置后,上层为淡黄褐色澄明液体,下层为灰白色沉淀,振摇后呈均匀混悬液。
4.2无菌检验按现行《中国兽药典》附录进行检验,均无菌生长。
4.3安全检验用2~10月龄健康易感水貂5只,各后肢内侧肌肉接种疫苗3ml(分3点注射,每点1.0ml),连续观察15日。
4.4效力检验
4.4.1水貂出血性肺炎效力检验
4.4.1.1小鼠用体重16~18g小鼠50只,分为5组,每组10只,分别皮下注射二联疫苗0.2ml,21日后连同对照小鼠50只,分5组,每组10只,每组分别皮下注射7000万cfu/0.2ml的dl15株、wd01株或wf05株的强毒液,或1.2亿cfu/0.2ml的jl08株或dl03株的强毒液,连续观察7日。对照小鼠应全部死亡,免疫小鼠应至少保护8只。
4.4.1.2水貂用2~10月龄健康易感水貂25只,分5组,每组5只,分别肌肉注射二联疫苗1ml,21日后连同对照水貂25只,分5组,每组5只,每组分别气管内滴入2亿cfu/ml的dl15株、wd01株或wf05株强毒液,或4亿cfu/ml的jl08株或dl03株强毒液,连续观察7日。对照水貂应全部死亡,免疫水貂应至少保护4只。
4.4.1.3elisa
建立了针对水貂出血性肺炎的elisa方法,抗体阴阳性临界值用od450表示,g型dl15株、b型jl08株、c型wd01株、i型wf05株、f型dl03株的临界值均设定为0.3100,od值大于临界值则判为阳性;反之,则判定为阴性。用elisa方法监测二联苗免疫后铜绿假单胞菌g、b、c、i、f型抗体的变化,免疫后各组分别用elisa方法测定接种后0,7,14,21,28,60,90,120,180血清中铜绿假单胞菌抗体水平。
4.4.2细小病毒性肠炎效力检验
4.4.2.1血清抗体测定用2~10月龄健康易感水貂(水貂细小病毒hi抗体效价≤1∶4)5只,各肌肉接种疫苗1ml,21日后,连同对照水貂5只,分别采血,测定hi及sn抗体效价,免疫组水貂抗体效价均应≥1∶32,对照组水貂抗体效价均应≤1∶4。
4.4.2.2免疫攻毒用2~10月龄健康易感水貂(水貂细小病毒hi抗体效价≤1∶4)5只,各肌肉接种疫苗1ml,21日后,连同对照水貂5只,各口服100个id50水貂细小病毒smpv-11株脏器毒,观察9日,对照组水貂应全部发病,免疫水貂应全部健活。
4.4.3甲醛残留量测定分别按现行《中国兽药典》附录进行测定,应符合规定。
5作用与用途用于预防水貂细小病毒性肠炎和由g型、b型、c型、f型、i型铜绿假单胞菌引起的水貂出血性肺炎。免疫期为5个月。
6用法与用量后肢内侧肌肉注射。水貂每只接种1ml。肌肉注射,出生后50~70日龄的仔貂与母貂同时接种,种貂配种前30~60日接种,每只1ml。
实施例2安全性试验
表2安全性试验检查内容
1.1安全性试验
201501、201502、201503三批疫苗一次单剂量接种、单剂量重复接种、超剂量接种不同日龄水貂进行安全性评价,一次单剂量接种60~70日龄幼貂,1ml/只;单剂量重复接种60~70日龄幼貂,2次接种中间间隔15日,每次接种1ml/只;超剂量接种60~70日龄幼貂和3-6月龄育成貂,3ml/只,分3点注射。每组均接种水貂5只,后肢内侧肌肉接种,并设立未免疫对照组。接种后连续观察15日,观察全身临床症状和接种局部变化,并在接种后前10日,每日上午记录体温变化。
1.2安全性试验结果:
201501、201502、201503三批疫苗免疫后水貂均未出现局部和全身不良反应,精神、食欲、体温与粪便无异常变化。接种后水貂体温与基础体温相同,均维持在38.6~41.5℃之间,所有接种水貂接种后注射部位均无肿大,无溃烂,幼貂生长状况良好。说明该疫苗对水貂较为安全。
表3水貂细小病毒性肠炎、出血性肺炎二联灭活疫苗水貂安全性试验结果
实施例3mev-pa二联灭活疫苗的效力评价
一、mev-pa二联灭活疫苗的效力试验
1免疫分组
1.1水貂
取3月龄健康易感水貂120只(健康易感水貂标准:水貂细小病毒血清hi抗体效价≤1∶4,铜绿假单胞菌g、b、c、i、f水貂血清玻片凝集反应为阴性)随机分为4组,每组40只,分为mev-pa组,mev组,pa组及对照组,分别后肢内侧肌肉注射疫苗1ml/只,对照组同样方式注射等体积生理盐水。
1.2小鼠
用体重16~18g小鼠50只,分为5组,每组10只,分别皮下注射疫苗0.2ml。
2水貂出血性肺炎免疫效果评价
2.1水貂
2.1.1攻毒保护
取30只免疫后21日,连同对照水貂30只,分6组,每组5只免疫及对照组水貂分别在免疫后21、90、180日攻毒padl15株、jl08株、wd01株、wf05株、dl03株菌株及mevsmpv-11株,每个毒株攻5只水貂,观察7日,记录死亡数,测定攻毒保护效果。
2.1.2抗体测定
免疫后第0,7,14,21,28,60,90,120,180日每组采集5只水貂血液样本检测pa的抗g、b、c、i、f型elisa抗体。
2.2小鼠
50只小鼠免疫后21日,连同对照小鼠50只,分5组,每组10只,每组分别皮下注射7000万cfu/0.2ml的dl15株、wd01株或wf05株的强毒液,或1.2亿cfu/0.2ml的jl08株或dl03株的强毒液,连续观察7日,记录死亡数。
3水貂细小病毒性肠炎免疫效果评价
3,1抗体测定
疫苗免疫后第0,7,14,21,28,60,90,120,180日每组采集5只水貂血液样本检测mev的sn及hi抗体。
3.2攻毒保护
上述免疫及对照组水貂分别在免疫后21、90、180日攻毒1个mldpadl15株、jl08株、wd01株、wf05株、dl03株菌株及100个id50水貂细小病毒smpv-11株脏器毒,每个毒株攻5只水貂,观察7日,记录死亡数,测定攻毒保护效果。
二、mev-pa二联疫苗的效力评价结果:
1水貂出血性肺炎效力试验结果
1.1测定结果表明,各血清型抗体均从7天抗体转阳,21日最高,持续至180d。与单苗对照相比,联苗中各个血清型的抗体水平差异不显著(p>0.005)。
1.1攻毒保护
1.1.1水貂mev-pa二联苗及pa单苗分别免疫水貂后30、90、180日,连同对照组,分别攻毒pag型dl15株,b型jl08株,c型wd01株、i型wf05株、f型dl03株,每种血清型及对照攻毒组随机选择5只/组。攻毒结果表明至180日,各组保护数在4/5以上,对照组均100%死亡,疫苗保护效果较好,免疫期可达180日。与pa单苗相比,疫苗的保护效果无显著差异(p>0.005)。
1.1.2小鼠mev-pa二联苗及pa单苗分别免疫小鼠后21日攻毒结果表明pamev-pa二联苗及pa单苗免疫小鼠对g型dl15株,b型jl08株,c型wd01株、i型wf05株、f型dl03株的攻毒保护率均为100%(10/10)。
2水貂细小病毒性肠炎效力检验
2.1血清抗体测定
血凝抑制抗体(hi)分别用hi方法检测二联苗及mev苗免疫水貂后第0,7,14,21,28,60,90,120,180日水貂血清中的mevhi抗体水平,二联苗和mev苗免疫后的抗mev抗体第7日抗体平均值≥25.9,28~60日持续了较高抗体水平,为29.5~210.4,至180日抗体均较高,为28~28.6。从图形趋势上看,与mev单苗免疫后水平相比,二联苗免疫后mev抗体整体偏低,但差异性不显著(p>0.05)。
2.2中和抗体(sn)用终点滴定法分别检测二联苗及mev苗免疫水貂后第0,7,14,21,28,60,90,120,180日水貂血清中抗mevsn抗体水平,二联苗和mev苗免疫后的抗mev抗体第7日抗体平均值≥100.8,28~60日持续了较高抗体水平,为101~101.29,至180日抗体均较高,为100.9。与mev单苗免疫后水平相比,二联苗免疫后mev抗体整体偏低,但差异性不显著(p>0.05)。
2.3攻毒mev-pa二联苗及mev单苗分别免疫水貂后30、90、180日,每组随机选择5只,连同对照5只,各口服100个id50水貂细小病毒smpv-11株脏器毒。攻毒结果表明至180日,各组保护数均为5/5,对照组均5/5发病,证明疫苗保护效果较好,免疫期可达180日。与mev单苗相比,二联苗的保护效果差异不显著(p>0.05)。
表4二联苗免疫水貂攻毒保护结果
表5二联苗免疫小鼠21日攻毒保护结果
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!