一种pH敏感和活性氧增敏的普兰尼克聚合物及其制备方法和应用与流程
本发明属于普兰尼克聚合物载体制备技术领域,具体涉及的是一种ph敏感和活性氧增敏的普兰尼克聚合物及其制备方法和应用。
背景技术:
药物化疗一直是临床治疗癌症的主要手段之一。然而,传统的小分子抗癌药物在体内往往代谢快、半衰期短、最终导致肿瘤部位较低的药物富集,治疗效果低下。为了取得较好的抗肿瘤疗效,临床上常常需要多次重复给药。这不仅会加重病患的花费,药物的副作用也会给患者带来严重的负面影响,如脱发、食欲不振、体重减轻等。此外,长期给予单一的药物化疗,还会引起肿瘤细胞的药物抗性,导致药物化疗低效或无作用。
随着纳米科技的发展,近年来多种纳米药物载体被设计并开发为了克服上述缺陷。相对于传统的小分子药物,纳米控释载体不仅能够提高药物的稳定性,延长药物体内代谢时间,提高肿瘤部位的药物富集。它还能通过载体材料的可选择性、配体的功能化修饰达到在时间和空间上可控药物释放,大大提高了抗肿瘤疗效。此外,一些精心设计的的载体还能够克服肿瘤细胞的耐药性,进一步提高疗效。
普郎尼克(pluronic),作为一种非离子式三嵌段共聚物,被广泛设计用来开发多药耐药的空白胶束。然而,它的逆转性能与其亲疏水比(hlb)相关,亲水性强则逆转效果低(如pluronic127基本无逆转性能),同时也容易导致组装的空白胶束不耐稀释;疏水性强则逆转性能高,但同时毒性也较大。为了获取能有效逆转肿瘤多药耐药同时能稳定组装载体的普郎尼克,有必要对其进一步修饰。通过在其两端引入原酸酯键,然后进一步键合疏水的维生素e琥珀酸酯,能够提高普兰尼克载体的稳定性,同时逆转肿瘤多药耐药性。此外,引入的原酸酯键能够在酸性条件下触发药物释放,维生素e琥珀酸酯能够进一步刺激细胞内ros产生,达到一个协同抗癌效果。
技术实现要素:
本发明所要解决的技术问题在于提供了一种ph敏感和活性氧增敏的普兰尼克聚合物及其制备方法和应用。
本发明是通过以下技术方案解决上述技术问题的:
一种ph敏感和活性氧增敏的普兰尼克聚合物,聚合物的结构如式ⅵ所示:
上述ph敏感和活性氧增敏的普兰尼克聚合物的合成路线如下:
上述ph敏感和活性氧增敏的普兰尼克聚合物的制备方法,包括以下步骤:
s1、式ⅲ所示化合物的制备:
将式ⅰ所示普兰尼克p123、式ⅱ所示2,2,2-三氟-n-(2-甲氧基-[1,3]-二氧戊烷-4-甲基)乙酰胺、对甲苯磺酸吡啶盐加入至反应器中,减压条件下,升温至120℃,反应6h后,经后处理操作后,得到式ⅲ所示化合物;
s2、式ⅳ所示化合物的制备:
将步骤s1制备得到的式ⅲ所示化合物以thf溶解后,加入naoh,室温条件下高速搅拌6h后,减压除去thf后,采用透析袋透析,透析液为乙醇溶液透析24h后,经旋蒸冷冻干燥,得到式ⅳ所示化合物;
s3、式ⅵ所示ph敏感和活性氧增敏的普兰尼克聚合物的制备:
将ⅳ所示化合物、式ⅴ所示的维生素e琥珀酸酯、edci、nhs、三乙胺,加入至反应器中,以dmso作为溶剂,通氮气保护条件下,室温搅拌反应48h后,采用透析袋透析,透析液为乙醇溶液透析72h后,除去催化剂及多余的维生素e琥珀酸酯,之后旋蒸冷冻干燥,得到ph敏感和活性氧增敏的普兰尼克聚合物。
优选地,所述步骤s1中式ⅰ所示普兰尼克p123、式ⅱ所示2,2,2-三氟-n-(2-甲氧基-[1,3]-二氧戊烷-4-甲基)乙酰胺、对甲苯磺酸吡啶盐添加量的摩尔比为1:6:0.02。
优选地,所述步骤s1中后处理操作如下:
反应结束后,反应液静置至室温后,用二氯甲烷溶解反应物,以0.5%nahco3溶液和饱和食盐水萃取反应液,收集下层有机相,有机相旋蒸浓缩后,得到得到式ⅲ所示化合物。
优选地,所述步骤s3中式ⅳ所示化合物、式ⅴ所示的维生素e琥珀酸酯、edci、nhs、三乙胺添加量的摩尔比为1:2.5:3:3:1。
优选地,所述步骤s2和步骤s3中透析袋为截留分子量3500da的透析袋。
优选地,所述步骤s2和步骤s3中乙醇溶液为质量分数为80%的乙醇水溶液。
本发明同时公开上述ph敏感和活性氧增敏的普兰尼克聚合物在药物传递系统中的应用,所述药物传递系统包括ph敏感和活性氧增敏的普兰尼克聚合物、抗肿瘤药物以及药物制剂上能够接受的辅料。
优选地,所述抗肿瘤药物选自阿霉素、紫杉醇以及喜树碱。
优选地,所述抗肿瘤药物为阿霉素。
本发明相比现有技术具有以下优点:
本发明公开一种ph敏感和活性氧增敏的普兰尼克聚合物,该聚合物的合成以普兰尼克p123为底物,按照药物骈合原理设计,以普兰尼克p123为母核,在普兰尼克p123的两侧的链端部依次骈合上原酸酯和维生素e琥珀酸酯基团,采用上述药物骈合理论设计所具有的优点在于:
1、普兰尼克p123能够逆转肿瘤细胞多药耐药性;
2、引入原酸酯能够控制药物释放;
3、引入疏水链段能够提高粒子稳定性;
4、α-tos能够进一步刺激ros产生,达到协同抗肿瘤效果。
附图说明
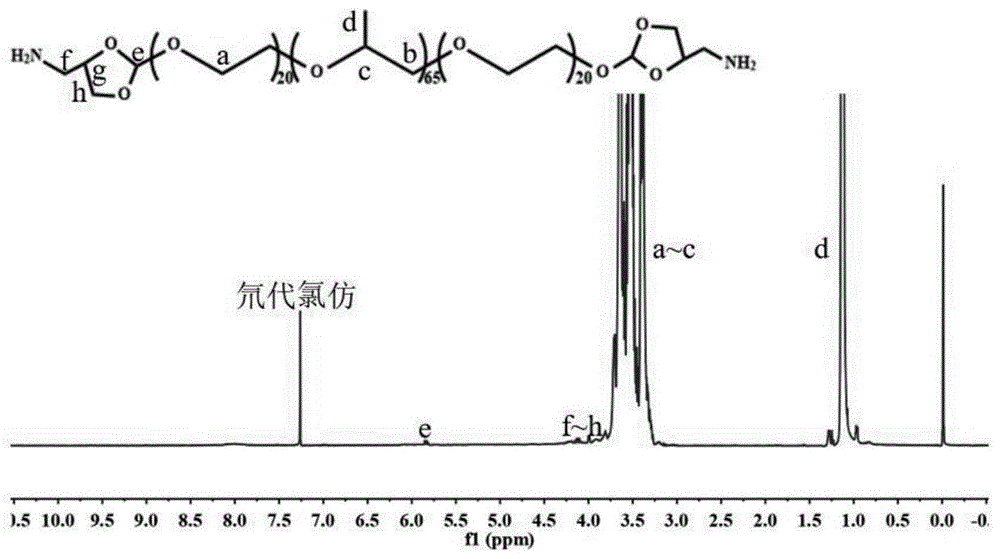
图1是本发明实施例2中式ⅳ所示化合物的1hnmr图。
图2是本发明实施例2中ph敏感和活性氧增敏的普兰尼克聚合物的的1hnmr图。
图3a是本发明实施例3中普兰尼克p123空白胶束的粒径分布图;
图3b是本发明实施例3中ph敏感和活性氧增敏的普兰尼克聚合物空白胶束的粒径分布图;
图3c是本发明实施例3中普兰尼克p123空白胶束透射电镜下的形貌特征图;
图3d是本发明实施例3中ph敏感和活性氧增敏的普兰尼克聚合物空白胶束透射电镜下的形貌特征图;
图4是本发明实施例5中普兰尼克p123载药胶束以及ph敏感和活性氧增敏的普兰尼克聚合物载药胶束中阿霉素的体外释放结果量;
图5a是本发明实施例6中人乳腺癌细胞定性摄取结果图;
图5b是本发明实施例6中人乳腺癌耐阿霉素细胞定性摄取结果图;
图6a是本发明实施例7中人乳腺癌细胞检测结果图;
图6b是本发明实施例7中人乳腺癌耐阿霉素细胞检测结果图;
图7a是本发明实施例8中人乳腺癌细胞线粒体去极化图;
图7b是本发明实施例8中人乳腺癌耐阿霉素细胞线粒体去极化图;
图7c是本发明实施例8中荧光强度比值图;
图8是本发明实施例9中空白胶束作用细胞后,细胞内atp含量变化结果图;
图9a是本发明实施例10中维生素e琥珀酸酯及空白胶束对人乳腺癌细胞毒性图;
图9b是本发明实施例10中维生素e琥珀酸酯及空白胶束对人乳腺癌耐阿霉素细胞毒性图;
图9c是本发明实施例10中阿霉素及载药胶束对人乳腺癌细胞毒性图;
图9d是本发明实施例10中阿霉素及载药胶束对人乳腺癌耐阿霉素细胞毒性图。
图中,p123胶束即为普兰尼克p123空白胶束,pot胶束即为ph敏感和活性氧增敏的普兰尼克聚合物空白胶束;
p123载药胶束即为普兰尼克p123载药胶束,pot载药胶束即为ph敏感和活性氧增敏的普兰尼克聚合物载药胶束。
具体实施方式
下面对本发明的实施例作详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
实施例1
一种ph敏感和活性氧增敏的普兰尼克聚合物,聚合物的结构如式ⅵ所示:
实施例2
ph敏感和活性氧增敏的普兰尼克聚合物的制备方法:
ph敏感和活性氧增敏的普兰尼克聚合物的合成路线如下:
ph敏感和活性氧增敏的普兰尼克聚合物的制备方法包括以下步骤:
s1、式ⅲ所示化合物的制备:
向100ml的圆底反应瓶中依次加入式ⅰ所示普兰尼克p123(10g,1.7mmol),式ⅱ所示2,2,2-三氟-n-(2-甲氧基-[1,3]-二氧戊烷-4-甲基)乙酰胺(2.35g,10.25mmol),对甲苯磺酸吡啶盐(py-ptsa)(8.54mg,0.034mmol),用油泵抽真空,120℃油浴条件下反应8h。反应结束后,静置,直至恢复室温。用二氯甲烷溶解反应物,以0.5%nahco3溶液和饱和食盐水萃取,收集下层有机相,旋蒸,得到式ⅲ所示化合物;
s2、式ⅳ所示化合物的制备:
往步骤s1制备得到的式ⅲ所示化合物中,以50mlthf溶解,加入naoh(0.1m),高速搅拌6h,旋蒸除去thf。之后用截留分子量3500da的透析袋透析24h,透析液为80%乙醇水溶液,旋蒸冷冻干燥,得到式ⅳ所示化合物8.5g,产率83%。
式ⅳ所示化合物的结构表征如图1。
s3、式ⅵ所示ph敏感和活性氧增敏的普兰尼克聚合物的制备:
向100ml的圆底反应瓶中依次加入式ⅳ所示化合物(3g,0.5mmol),式ⅴ所示维生素e琥珀酸酯(α-tos)(0.67g,1.25mmol),1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edct)(0.29g,1.5mmol),n-羟基琥珀酰亚胺(nhs)(0.17g,1.5mmol),再加入20ml无水二甲基亚砜作溶剂,同时滴加0.2ml的三乙胺,通氮气常温搅拌反应48h后,用截留分子量3500da的透析袋透析,透析液为80%的乙醇水溶液,透析72h除去催化剂及多余维生素e琥珀酸酯(α-tos),之后旋蒸冷冻干燥,得到ph敏感和活性氧增敏的普兰尼克聚合物2.56g,产率73.1%。
ph敏感和活性氧增敏的普兰尼克聚合物的结构表征如图2所示。
由图2可知:原酸酯特征峰(式ⅳ所示化合物)与维生素e琥珀酸酯苯环取代甲基的特征峰积分比为1:9,表明普兰尼克p123两端均被维生素e琥珀酸酯接枝,说明制备的聚合物是成功的。
实施例3
空白胶束的制备及其粒径与形貌:
一、普兰尼克p123空白胶束的制备:
称取30mg的普兰尼克p123置于25ml圆底瓶中,加入1ml的无水二氯甲烷,50℃旋蒸30min,再放入60℃烘箱干燥过夜;之后将圆底瓶放入50℃水浴锅中水化加热15min,向瓶中加入10ml、50℃的去离子水(ph7.4),快速搅拌涡旋,将溶液用0.22μm的滤头过滤,得到乳白色或透明胶束乳液,即为普兰尼克p123空白胶束。
通过dls和透射电镜检测纳米胶束的粒径分布及形貌,粒径分布图如图3a所示,形貌特征图如图3c。
由图3a、图3c可知:普兰尼克p123空白胶束粒径约在50nm,呈球形形貌。
二、ph敏感和活性氧增敏的普兰尼克聚合物空白胶束的制备:
称取30mg的ph敏感和活性氧增敏的普兰尼克聚合物置于25ml圆底瓶中,加入1ml的无水二氯甲烷,50℃旋蒸30min,再放入60℃烘箱干燥过夜;之后将圆底瓶放入50℃水浴锅中水化加热15min,向瓶中加入10ml50℃的去离子水(ph7.4),快速搅拌涡旋,将溶液用0.22μm的滤头过滤,得到乳白色或透明胶束乳液,即为ph敏感和活性氧增敏的普兰尼克聚合物空白胶束。通过dls和透射电镜检测纳米胶束的粒径分布及形貌,粒径分布图如图3b所示,形貌特征图如图3d。
由图3c、图3d可知:ph敏感和活性氧增敏的普兰尼克聚合物空白胶束尺寸约在80nm,分散性较好,整体呈球形轮廓。
实施例4
包载阿霉素的纳米载药胶束的制备:
一、ph敏感和活性氧增敏的普兰尼克聚合物载药胶束的制备:
称取5mg的阿霉素与30mg的ph敏感和活性氧增敏的普兰尼克聚合物共溶在1ml无水二氯甲烷,后续操作与实施例3相同,得到的载药粒子即为ph敏感和活性氧增敏的普兰尼克聚合物载药胶束。
二、普兰尼克p123载药胶束的制备:
按照ph敏感和活性氧增敏的普兰尼克聚合物包载阿霉素药物载体的制备方法,称取30mg普兰尼克p123和5mg的阿霉素,制备得到载药粒子为普兰尼克p123载药胶束。
采用酶标仪在481nm波长处测定上述ph敏感和活性氧增敏的普兰尼克聚合物载药胶束以及普兰尼克p123载药胶束的载药量及包封率,
其中,载药量(%)=胶束中阿霉素的量/载药胶束的总量×100%;包封率(%)=胶束中阿霉素的量/加入的总共阿霉素的量×100%;结果如表1所示:
表1
由表1可知:ph敏感和活性氧增敏的普兰尼克聚合物空白胶束由于具有更强的疏水性,因而具备更高的载药率和包封率。
实施例5
载药胶束的体外释放检测
分别取阿霉素浓度为450μg/ml的普兰尼克p123载药胶束以及ph敏感和活性氧增敏的普兰尼克聚合物载药胶束1ml于截留分子量为8kd-14kd的透析袋中,用棉线扎紧透析袋,放入到50ml的ep管中,再在ep管中加入5ml0.05m的缓冲液,缓冲液ph为5.0和7.4,设3个重复。放入摇床,在37℃,100rpm条件下振荡,分别在0.5、1、2、4........12、24、36、48h取出旧缓冲液,并加入5ml新的缓冲液,然后检测缓冲液中的阿霉素浓度,然后计算阿霉素的释放量,释放结果如图4。
由图4可知:普兰尼克p123载药胶束稳定性较差,在中性环境中,药物被大量释放。ph敏感和活性氧增敏的普兰尼克聚合物载药胶束在ph7.4时呈现相对好的稳定性,48h累积释放不足40%,而在ph5.5时,48h累积释放超过80%,表明ph敏感和活性氧增敏的普兰尼克聚合物载药胶束具有明显的ph响应性能力。
实施例6
载药胶束的细胞定性摄取:
将人乳腺癌细胞(mcf-7)或人乳腺癌耐阿霉素细胞(mcf-7/adr)加入到细胞培养皿中,培养24h,允许细胞贴壁。然后,吸去旧培养基,加入1.8ml新鲜培养基,以及0.2ml游离阿霉素、ph敏感和活性氧增敏的普兰尼克聚合物载药胶束和普兰尼克p123载药胶束(阿霉素终浓度为4μg/ml)。共培养两小时后,吸去旧培养基,加入2ml新鲜培养基继续培养4h。最后,吸去培养基,用pbs清洗两次,4%多聚甲醛液固定细胞(5min),pbs清洗两次,dapi染核试剂染细胞核(5min),pbs再次清洗两次,然后用激光共聚焦显微镜观察,结果如图5a和图5b。其中,图5a为人乳腺癌细胞定性摄取结果图,图5b为人乳腺癌耐阿霉素细胞定性摄取结果图。
由图5a、图5b可知:游离阿霉素、普兰尼克p123载药胶束及ph敏感和活性氧增敏的普兰尼克聚合物载药胶束均能很好地被乳腺癌细胞摄取;
然而,在耐药细胞中,由于药物外排泵的作用,游离阿霉素的胞内富集被抑制,普兰尼克p123空白胶束及ph敏感和活性氧增敏的普兰尼克聚合物空白胶束能改变这种抑制状态,提高胞内药物的富集。
实施例7
空白胶束刺激细胞内ros产生:
将人乳腺癌细胞(mcf-7)或人乳腺癌耐阿霉素细胞(mcf-7/adr)加入到六孔板中,培养24h,允许细胞贴壁。然后,吸去旧培养基,加入1.8ml新鲜培养基,0.2ml的游离维生素e琥珀酸酯(α-tos)、普兰尼克p123空白胶束以及ph敏感和活性氧增敏的普兰尼克聚合物空白胶束(浓度为0.1mg/ml),共培养4h之后,吸去旧培养基,加入2ml新培养基以及0.1ml稀释的ros探针dcfh-da,孵育30min。然后,pbs清洗细胞两次,4%多聚甲醛液固定细胞5min,再次清洗细胞两次,荧光显微镜观察绿色ros的产生。人乳腺癌细胞检测结果如如图6a所示,人乳腺癌耐阿霉素细胞检测结果如图6b所示。
由图6a和图6b可知:在两种细胞中,几种样品均能刺激细胞产生ros,其中以ph敏感和活性氧增敏的普兰尼克聚合物空白胶束作用效果最强,其次是游离α-tos(维生素e琥珀酸酯),普兰尼克123空白胶束效果最差。
实施例8
空白胶束作用细胞后线粒体去极化:
细胞培养及样品孵育同实施例7,再共培养4h后,吸去旧培养基,加入2ml新培养基以及0.1ml稀释的线粒体探针jc-1工作液,培养箱中孵育15min。再用pbs清洗两遍,荧光显微镜观察健康线粒体红光与去极化线粒体绿光强度,统计红绿光比值。结果如图7a、图7b、图7c所示,其中图7a为人乳腺癌细胞线粒体去极化图,图7b为人乳腺癌耐阿霉素细胞线粒体去极化图,图7c为荧光强度比值图。
由图7a、图7b、图7c可知:在两种细胞中,两种胶束制剂均能诱导线粒体去极化,同时可以发现,ph敏感和活性氧增敏的普兰尼克聚合物空白胶束的作用效果明显强于普兰尼克p123空白胶束。
实施例9
空白胶束作用细胞后atp含量变化:
细胞培养及样品孵育同实施例7,共培养4h后,吸除培养液,每孔加入0.2ml裂解液,裂解细胞。裂解后于4℃,12000g离心5min,取上清,用于后续的测定。加0.1mlatp检测工作液到检测孔,再在检测孔内加上20μl样品或标准品,迅速用枪(微量移液器)混匀,至少间隔2s后,用酶标仪的化学发光luminometer测定rlu值,结果如图8所示。
由图8可知:在两种细胞中,游离α-tos(维生素e琥珀酸酯)及两种胶束都可以下调胞内atp含量,其中以ph敏感和活性氧增敏的普兰尼克聚合物的联合作用效果最强。
实施例10
细胞毒性检测:
将人乳腺癌细胞(mcf-7)或人乳腺癌耐阿霉素细胞(mcf-7/adr)加入到96孔板中,每孔细胞约在5,000个,培养24h后,去除培养基,加入180μl的新鲜培养基,20μl的游离维生素e琥珀酸酯(α-tos)、普兰尼克p123空白胶束以及ph敏感和活性氧增敏的普兰尼克聚合物ph敏感和活性氧增敏的普兰尼克聚合物空白胶束,以及自由阿霉素、普兰尼克p123载药胶束或者ph敏感和活性氧增敏的普兰尼克聚合物载药胶束(阿霉素浓度从0.5-10μg/ml)。共培养两小时后,吸去旧培养基,加入200μl新鲜培养基,继续培养24h。之后,去除培养基,加入180μl的新鲜培养基和20μlmtt(5mg/ml)共培养4h后。最后,去除培养基,加入150μl的dmso,震荡10min后,在570nm波长下检测活细胞产生的结晶紫吸光度,计算细胞存活率,结果如图9a、图9b、图9c、图9d所示。
其中,图9a为维生素e琥珀酸酯及空白胶束对人乳腺癌细胞毒性图;图9b为维生素e琥珀酸酯及空白胶束对人乳腺癌耐阿霉素细胞毒性图;图9c为阿霉素及载药胶束对人乳腺癌细胞毒性图;图9d为阿霉素及载药胶束对人乳腺癌耐阿霉素细胞毒性图。
由图9a、图9b、图9c、图9d可知:由于空白胶束可以刺激细胞产生杀伤性的活性氧,因此在高浓度时呈现一定的细胞毒性。
此外,在乳腺癌细胞中,几种药物样品在两种细胞中均呈现浓度依赖性的细胞毒性,其中以ph敏感和活性氧增敏的普兰尼克聚合物载药胶束杀伤细胞能力最强。然而,在耐药细胞中,由于药物外排泵的高表达,游离阿霉素的细胞毒性被明显抑制;但普兰尼克p123载药胶束及ph敏感和活性氧增敏的普兰尼克聚合物载药胶束能明显的逆转肿瘤细胞的耐药性,特别是ph敏感和活性氧增敏的普兰尼克聚合物载药胶束的联合作用导致最强的抗肿瘤效果。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!